Содержание
- 2. Часть 1. Трансляция у прокариот
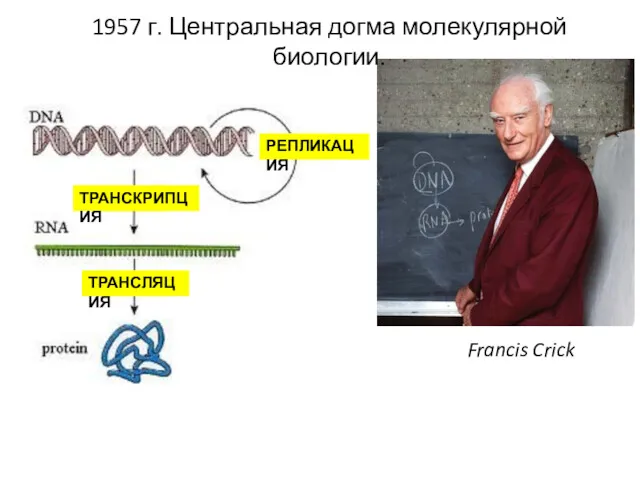
- 3. 1957 г. Центральная догма молекулярной биологии. Francis Crick РЕПЛИКАЦИЯ ТРАНСКРИПЦИЯ ТРАНСЛЯЦИЯ
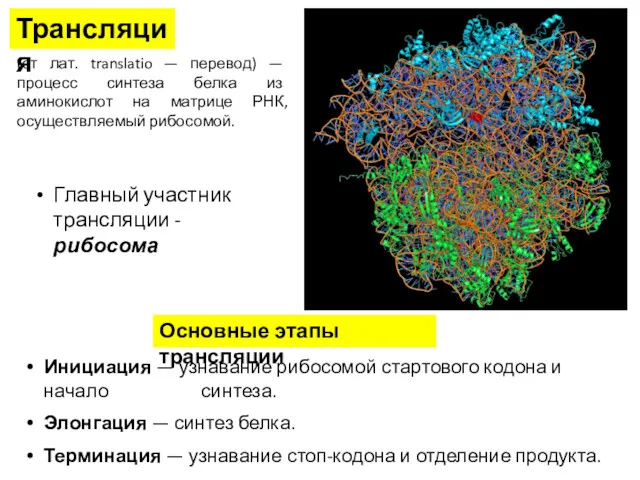
- 4. (от лат. translatio — перевод) — процесс синтеза белка из аминокислот на матрице РНК, осуществляемый рибосомой.
- 5. Трансляция
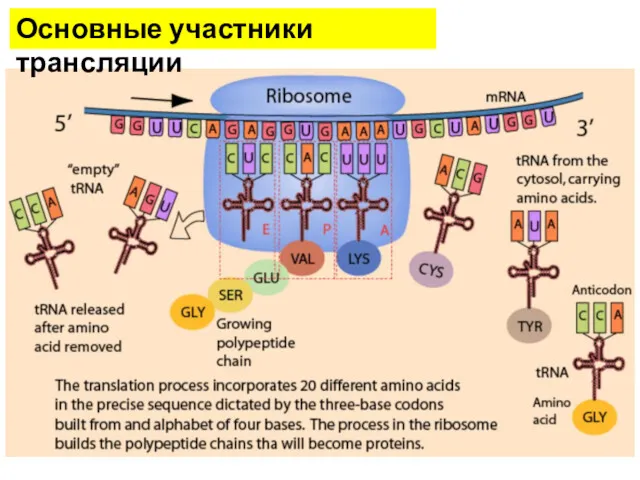
- 6. Основные участники трансляции
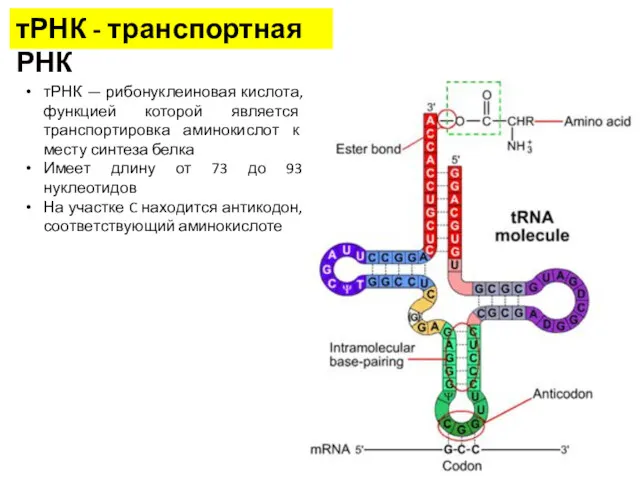
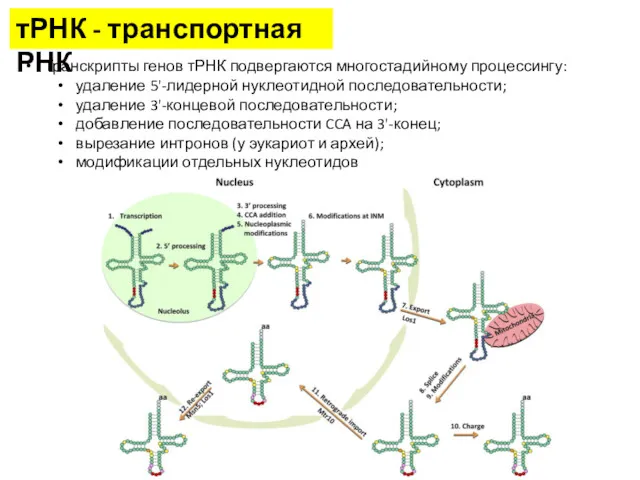
- 7. тРНК - транспортная РНК тРНК — рибонуклеиновая кислота, функцией которой является транспортировка аминокислот к месту синтеза
- 8. тРНК - транспортная РНК Транскрипты генов тРНК подвергаются многостадийному процессингу: удаление 5'-лидерной нуклеотидной последовательности; удаление 3'-концевой
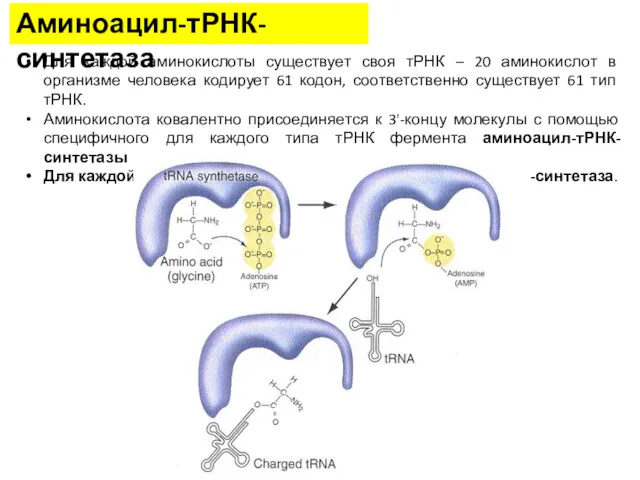
- 9. Аминоацил-тРНК-синтетаза Для каждой аминокислоты существует своя тРНК – 20 аминокислот в организме человека кодирует 61 кодон,
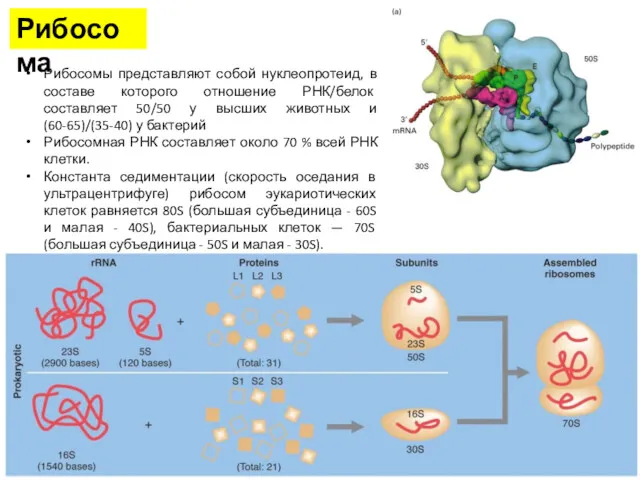
- 10. Рибосома Рибосомы представляют собой нуклеопротеид, в составе которого отношение РНК/белок составляет 50/50 у высших животных и
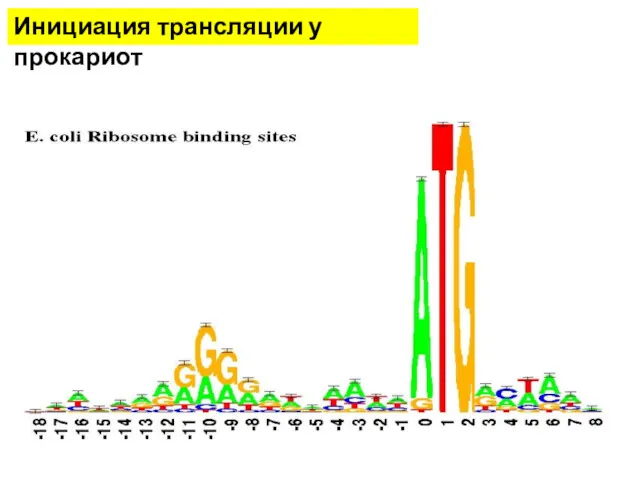
- 11. Инициация трансляции у прокариот Последовательность Шайна — Дальгарно — сайт связывания рибосом на молекуле мРНК прокариот,
- 12. Инициация трансляции у прокариот
- 13. В момент образования комплекса последовательности Шайна — Дальгарно и анти-Шайна — Дальгарно, с 30S-рибосомной субъединицей связываются
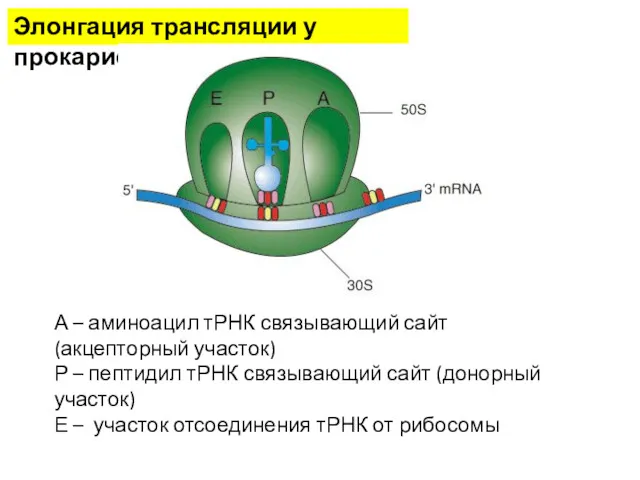
- 14. Элонгация трансляции у прокариот А – аминоацил тРНК связывающий сайт (акцепторный участок) Р – пептидил тРНК
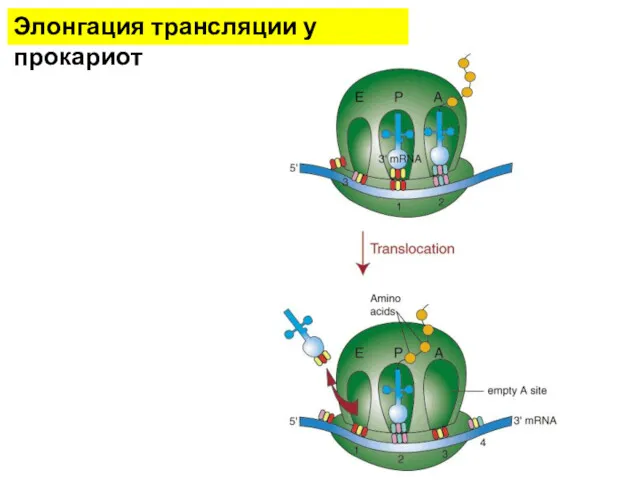
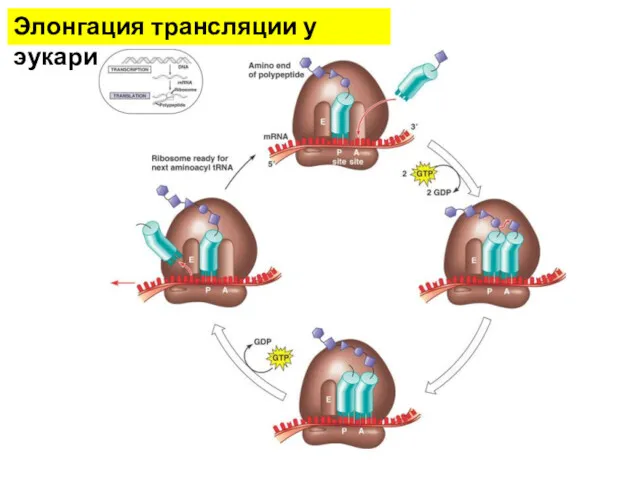
- 15. Элонгация трансляции у прокариот
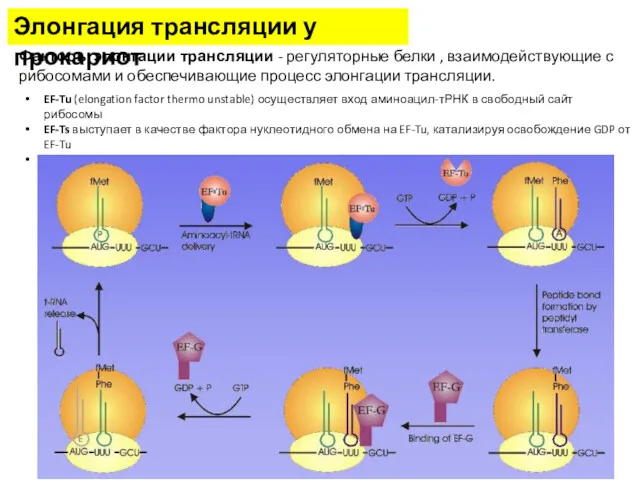
- 16. Элонгация трансляции у прокариот Факторы элонгации трансляции - регуляторные белки , взаимодействующие с рибосомами и обеспечивающие
- 17. Терминация трансляции у прокариот Факторы терминации: RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA и
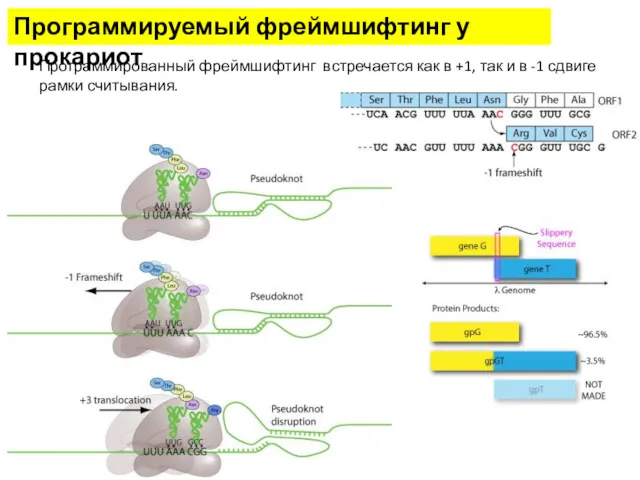
- 18. Программируемый фреймшифтинг у прокариот Программированный фреймшифтинг встречается как в +1, так и в -1 сдвиге рамки
- 19. Часть 2. Трансляция у эукариот
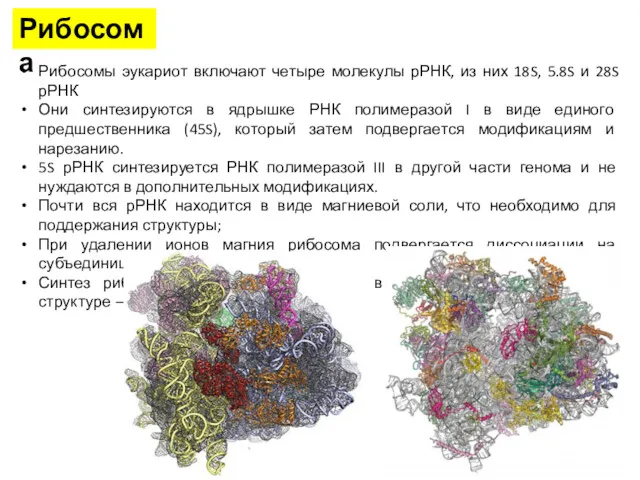
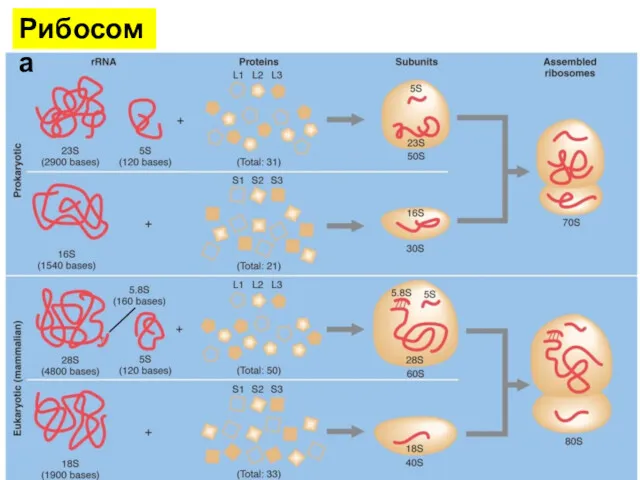
- 20. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5.8S и 28S рРНК Они синтезируются в
- 21. Рибосома
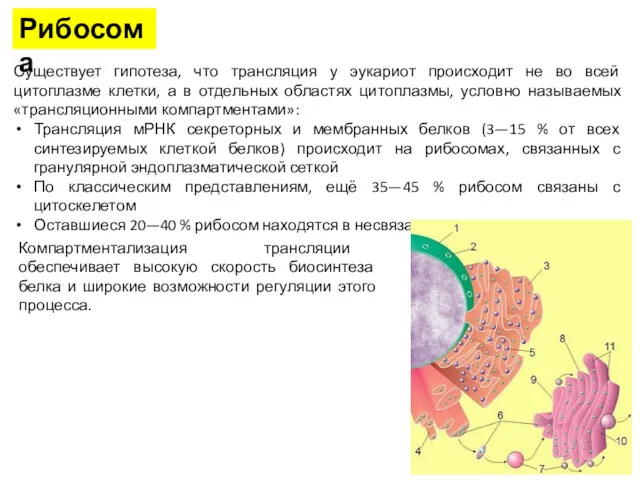
- 22. Рибосома Существует гипотеза, что трансляция у эукариот происходит не во всей цитоплазме клетки, а в отдельных
- 23. Инициация трансляции у эукариот У эукариот старт-сайтом трансляции обычно, но не всегда, является первый AUG кодон,
- 24. Инициация трансляции у эукариот У эукариот существуют два основных механизма нахождения рибосомой стартового AUG: Кэп-зависимый (сканирующий)
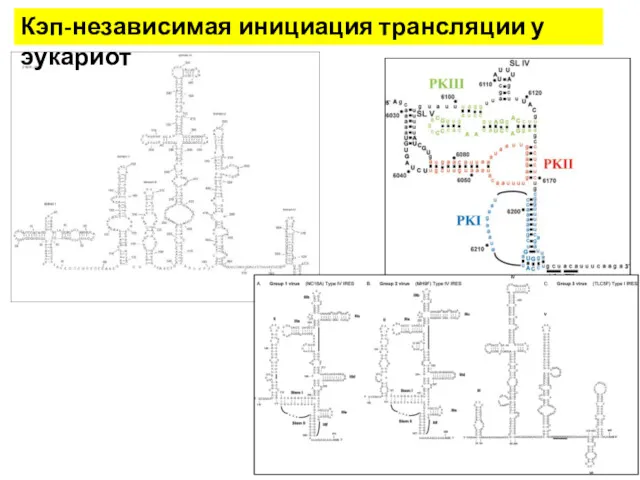
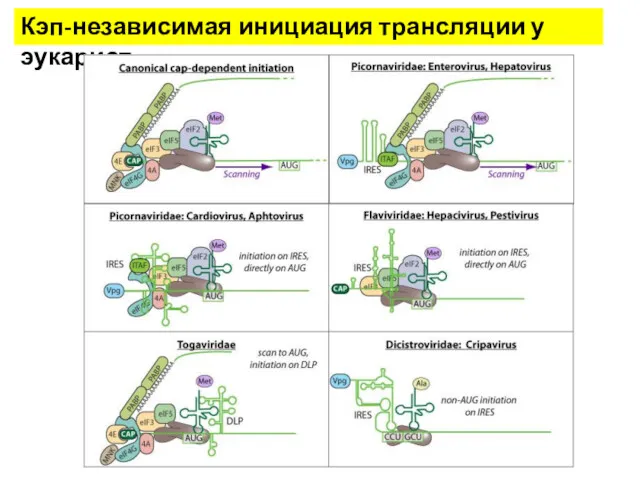
- 25. Кэп-независимая инициация трансляции у эукариот
- 26. Кэп-независимая инициация трансляции у эукариот
- 27. За 20 лет обнаружено множество IRES в самых разных мРНК представителей всех царств эукариот, НО: Не
- 28. IRES : механизм трансляции при клеточном стрессе Клеточный стресс вызывает изменения в белковом составе клетки и
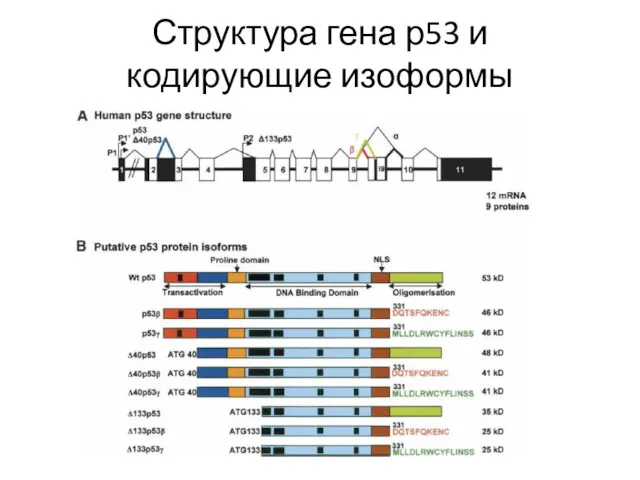
- 29. Структура гена р53 и кодирующие изоформы
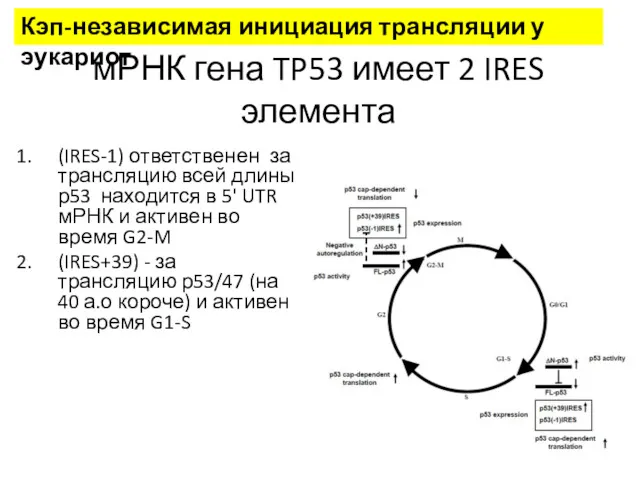
- 30. мРНК гена TP53 имеет 2 IRES элемента (IRES-1) ответственен за трансляцию всей длины р53 находится в
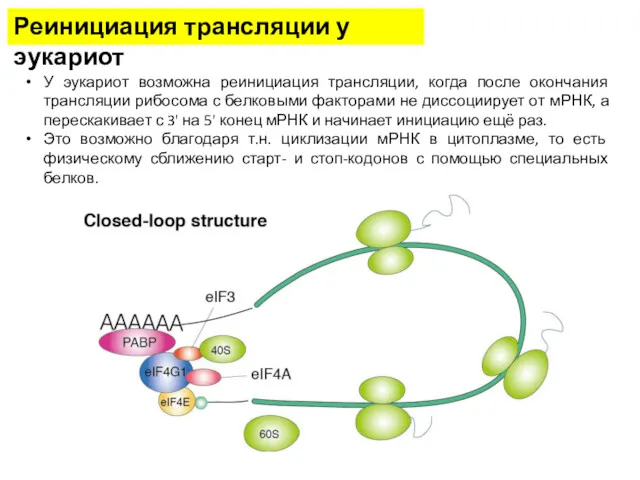
- 31. Реинициация трансляции у эукариот У эукариот возможна реинициация трансляции, когда после окончания трансляции рибосома с белковыми
- 32. Инициация трансляции у эукариот Трансляция большинства мРНК эукариот, имеющих КЭП и поли(А)-хвост, требует участия, по крайней
- 33. Элонгация трансляции у эукариот
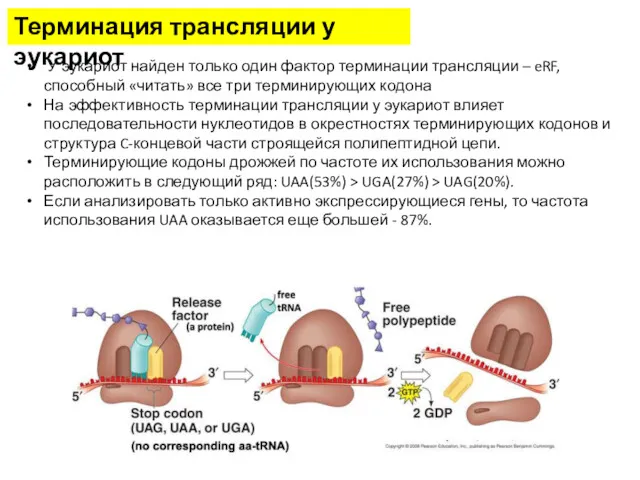
- 34. Терминация трансляции у эукариот У эукариот найден только один фактор терминации трансляции – eRF, способный «читать»
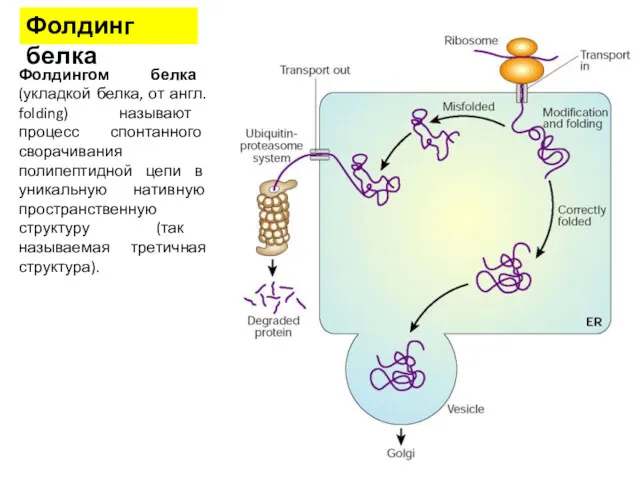
- 35. Фолдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную
- 36. Фолдинг белка В фолдинге участвуют белки-шапероны. Большинство только что синтезированных белков может сворачиваться при отсутствии шаперонов
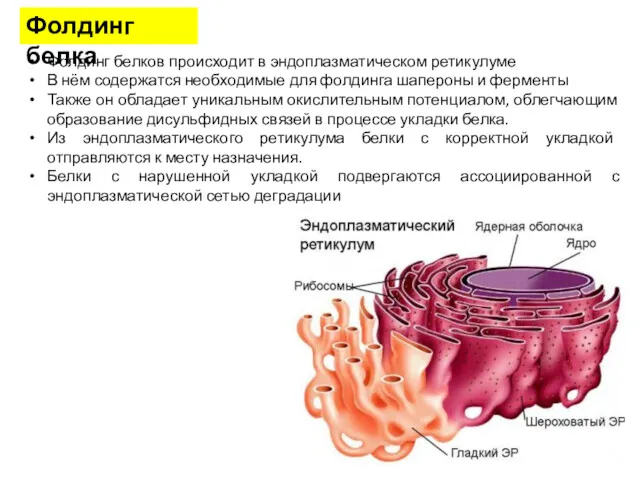
- 37. Фолдинг белка Фолдинг белков происходит в эндоплазматическом ретикулуме В нём содержатся необходимые для фолдинга шапероны и
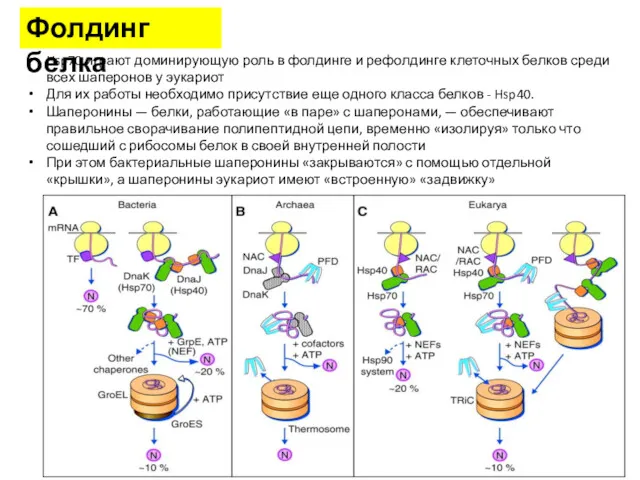
- 38. Фолдинг белка Hsp70 играют доминирующую роль в фолдинге и рефолдинге клеточных белков среди всех шаперонов у
- 39. Деградация белка Деградация белков проходит по убиквитин-протеасомному пасвею
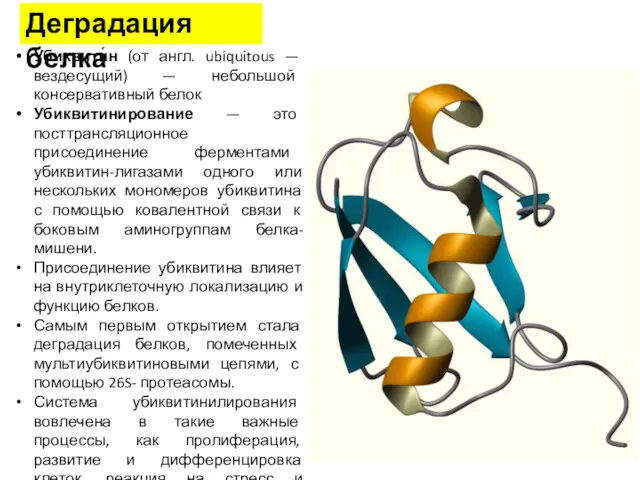
- 40. Деградация белка Убиквити́н (от англ. ubiquitous — вездесущий) — небольшой консервативный белок Убиквитинирование — это посттрансляционное
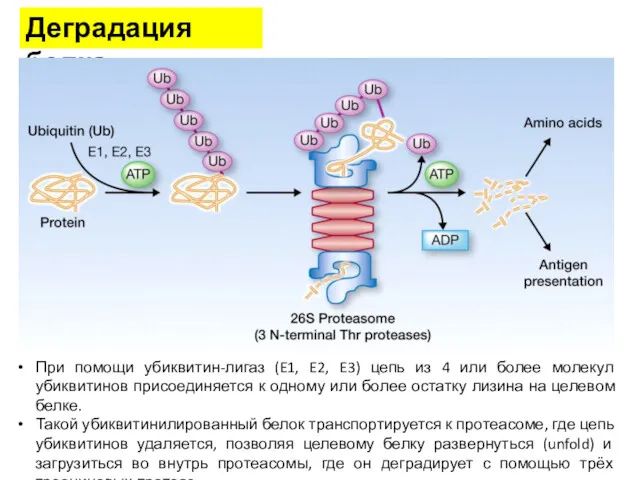
- 41. Деградация белка При помощи убиквитин-лигаз (E1, E2, E3) цепь из 4 или более молекул убиквитинов присоединяется
- 42. Деградация белка Протеасома (от англ. protease — протеиназа и лат. soma — тело) — мультисубъединичная протеаза,
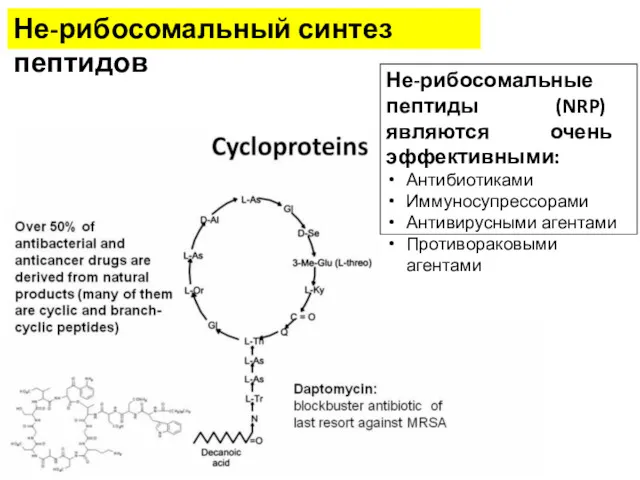
- 43. Не-рибосомальный синтез пептидов Не-рибосомальные пептиды (NRP) являются очень эффективными: Антибиотиками Иммуносупрессорами Антивирусными агентами Противораковыми агентами
- 45. Скачать презентацию













 Модификационная изменчивость
Модификационная изменчивость Методы исследования микроорганизмов и использование бактерий в биоиндикации
Методы исследования микроорганизмов и использование бактерий в биоиндикации Динамика содержания подвижного фосфора в серых лесных почвах Тюменской области
Динамика содержания подвижного фосфора в серых лесных почвах Тюменской области Митохондрия. Митохондрияның биологиялық рөлі
Митохондрия. Митохондрияның биологиялық рөлі Скелет. Строение, состав и соединение костей скелета человека
Скелет. Строение, состав и соединение костей скелета человека Вид. Популяция
Вид. Популяция Строение и функции кожи
Строение и функции кожи Ноосфера
Ноосфера Зелёная аптека. Экологическая игра
Зелёная аптека. Экологическая игра Анимированный кроссворд Строение клетки
Анимированный кроссворд Строение клетки Технологическое значение анатомических особенностей зерна
Технологическое значение анатомических особенностей зерна 20231016_prezentatsiya_2
20231016_prezentatsiya_2 Вирусы. Сходства вируса с живыми организмами. Размножение вирусов
Вирусы. Сходства вируса с живыми организмами. Размножение вирусов Биохимия печени. (Лекция 31)
Биохимия печени. (Лекция 31) Роль соли для организма человека
Роль соли для организма человека Моллюски
Моллюски Предмет и задачи микробиологии
Предмет и задачи микробиологии Неорганические вещества клетки (10 класс)
Неорганические вещества клетки (10 класс) Разнообразие животных. Урок 19
Разнообразие животных. Урок 19 Устный журнал: Зеленый наряд нашей планеты
Устный журнал: Зеленый наряд нашей планеты Уровни организации жизни
Уровни организации жизни Птицы из Красной книги Югры
Птицы из Красной книги Югры Өсімдіктер әлемі
Өсімдіктер әлемі Вопросы к викторине по охране природы
Вопросы к викторине по охране природы Личностно-ориентированная технология на уроках биологии
Личностно-ориентированная технология на уроках биологии Интегрированный урок биологии и химии с применением информационных технологий
Интегрированный урок биологии и химии с применением информационных технологий Забота о потомстве
Забота о потомстве Corynebacterium Erysipelothrix & Listeria
Corynebacterium Erysipelothrix & Listeria