Содержание
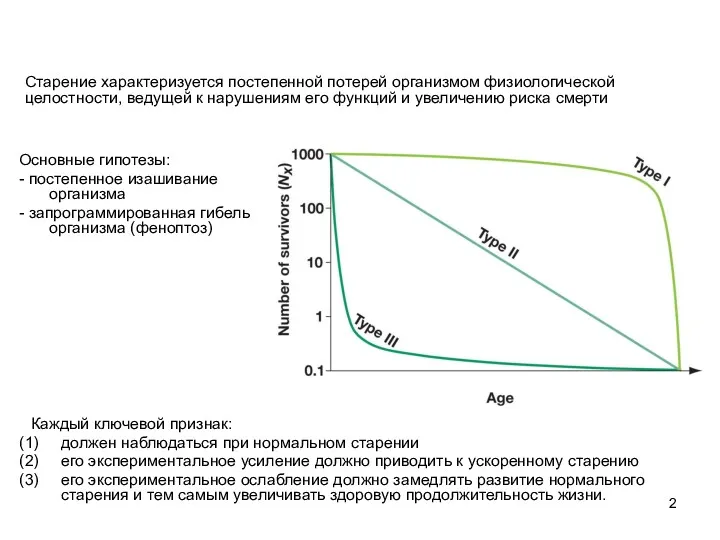
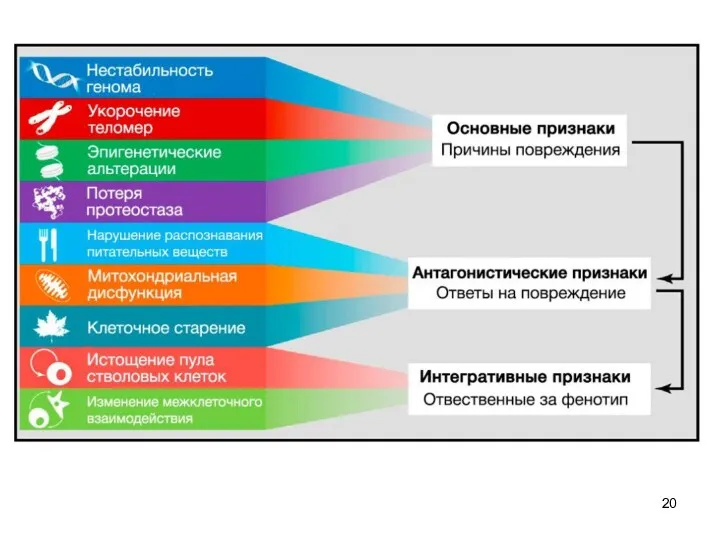
- 2. Каждый ключевой признак: должен наблюдаться при нормальном старении его экспериментальное усиление должно приводить к ускоренному старению
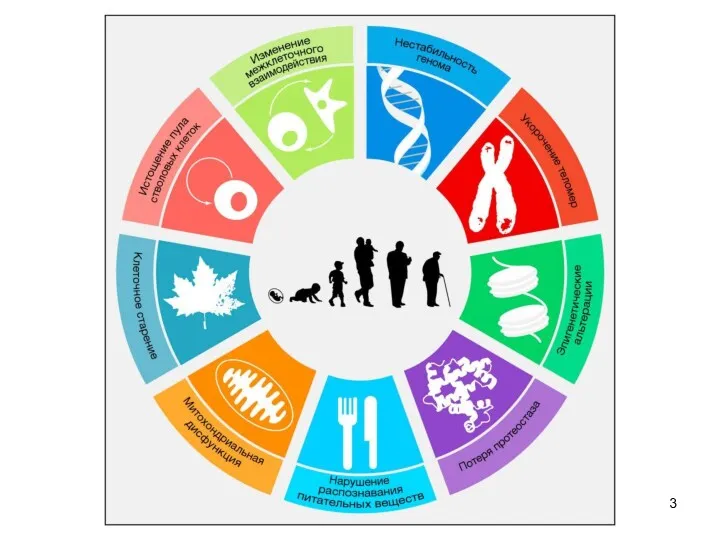
- 3. 11 11
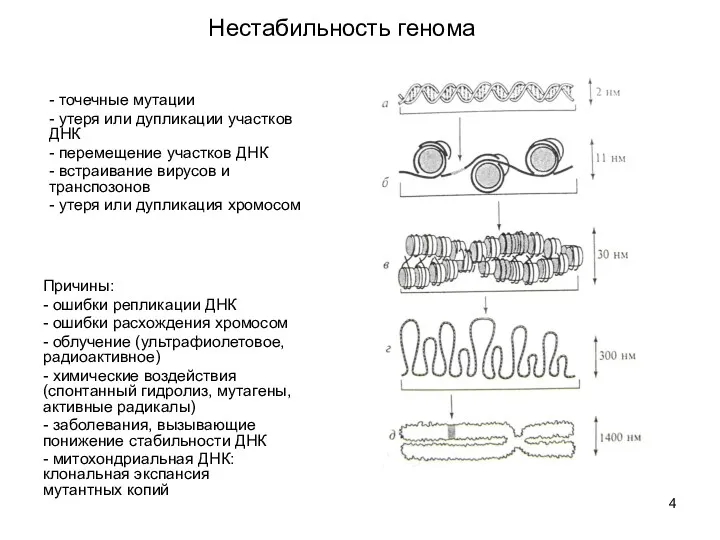
- 4. Нестабильность генома - точечные мутации - утеря или дупликации участков ДНК - перемещение участков ДНК -
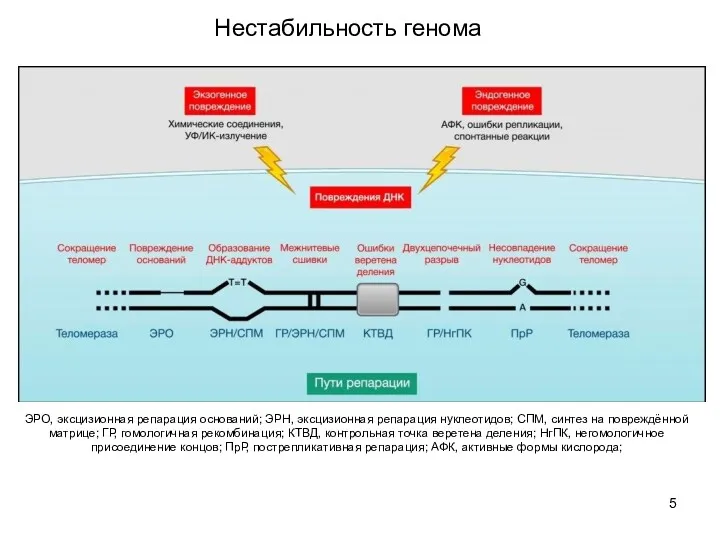
- 5. ЭРО, эксцизионная репарация оснований; ЭРН, эксцизионная репарация нуклеотидов; СПМ, синтез на повреждённой матрице; ГР, гомологичная рекомбинация;
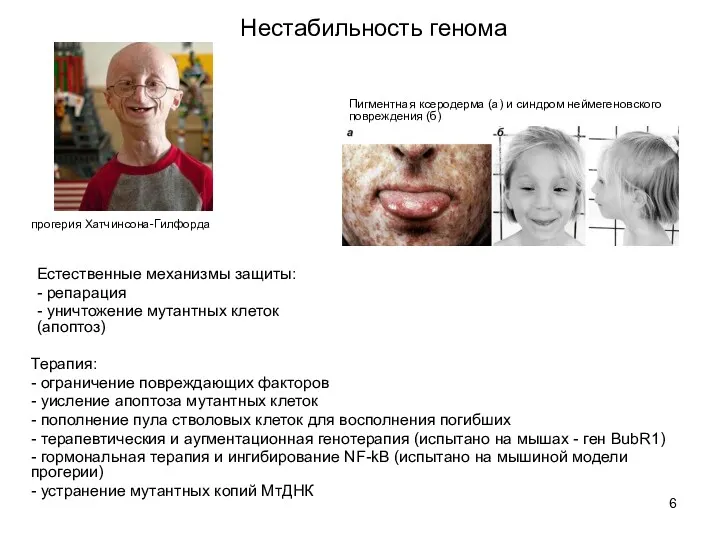
- 6. Пигментная ксеродерма (а) и синдром неймегеновского повреждения (б) Естественные механизмы защиты: - репарация - уничтожение мутантных
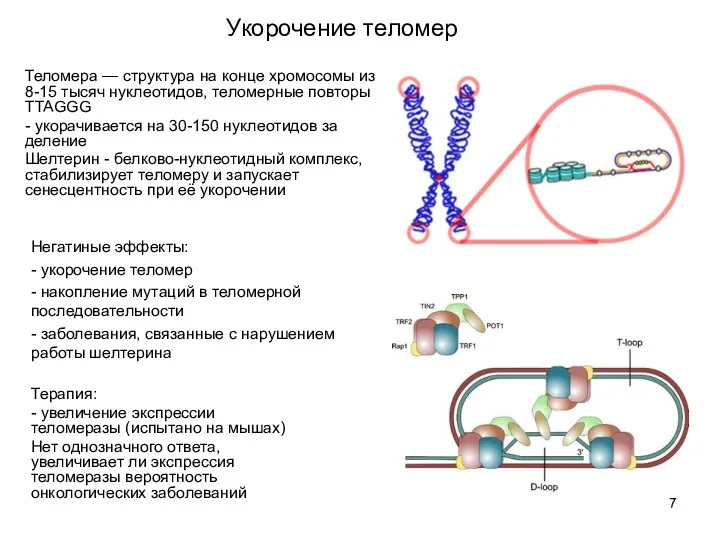
- 7. Укорочение теломер Теломера — структура на конце хромосомы из 8-15 тысяч нуклеотидов, теломерные повторы TTAGGG -
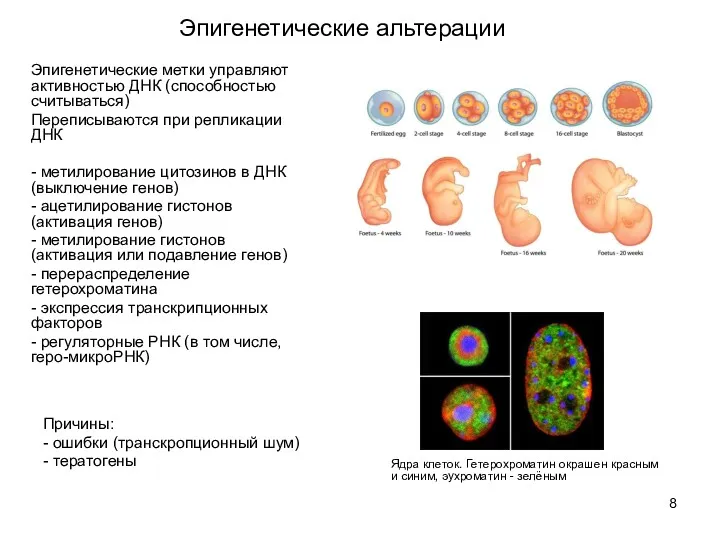
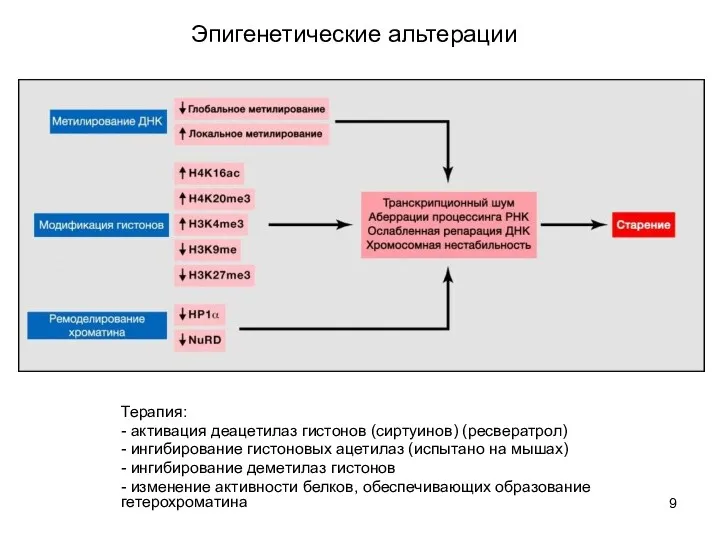
- 8. Эпигенетические альтерации Эпигенетические метки управляют активностью ДНК (способностью считываться) Переписываются при репликации ДНК - метилирование цитозинов
- 9. Эпигенетические альтерации Терапия: - активация деацетилаз гистонов (сиртуинов) (ресвератрол) - ингибирование гистоновых ацетилаз (испытано на мышах)
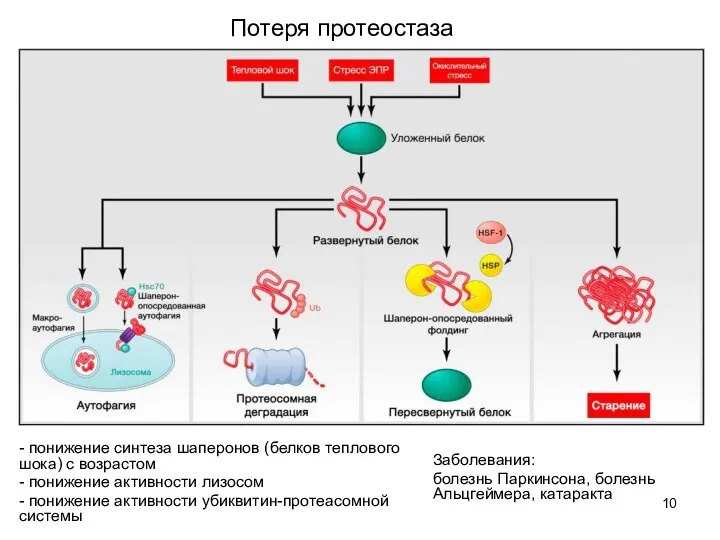
- 10. Потеря протеостаза - понижение синтеза шаперонов (белков теплового шока) с возрастом - понижение активности лизосом -
- 11. Терапия: индукция аутофагии (генетическая активация рецептора LAMP2a и рапамицин, сперимдин, омега-6 жирные кислоты, ингибиторы деубиквитинилазы, протеасомные
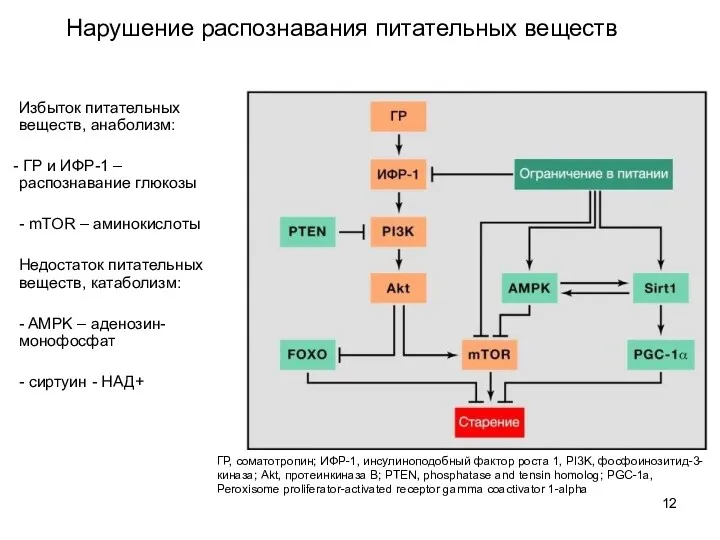
- 12. Нарушение распознавания питательных веществ ГР, соматотропин; ИФР-1, инсулиноподобный фактор роста 1, PI3K, фосфоинозитид-3-киназа; Akt, протеинкиназа В;
- 13. Нарушение распознавания питательных веществ снижение ГР и ИФР-1 может иметь компенсаторный характер при старении Терапия: умеренное
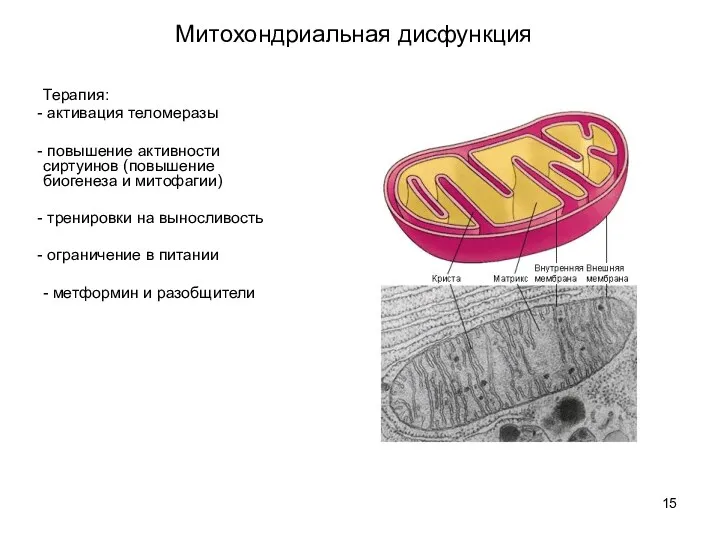
- 14. Митохондриальная дисфункция - ускорение старения активными формами кислорода (к настоящему времени считается опровергнутым. кроме того, до
- 15. Митохондриальная дисфункция Терапия: активация теломеразы повышение активности сиртуинов (повышение биогенеза и митофагии) тренировки на выносливость ограничение
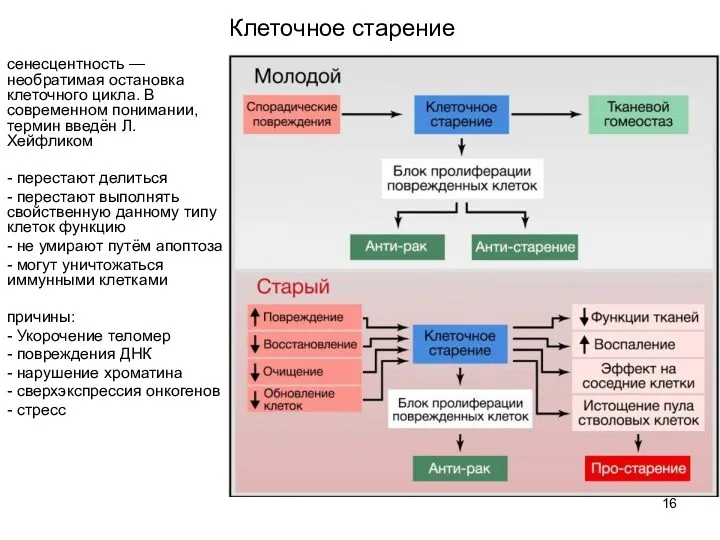
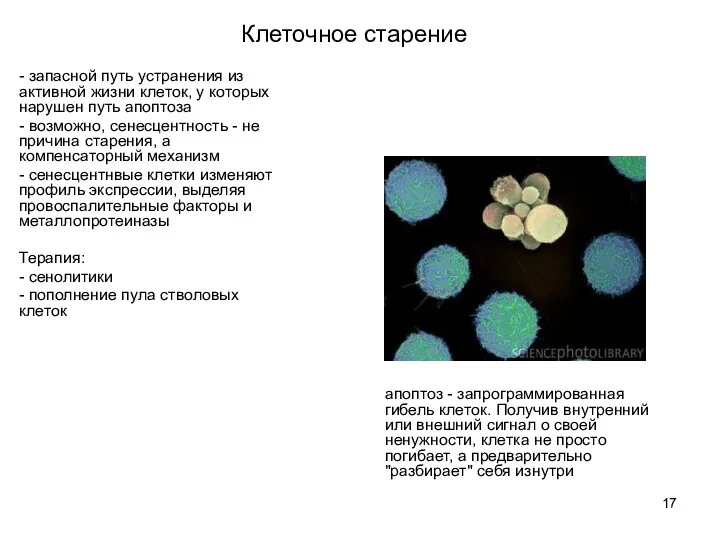
- 16. Клеточное старение сенесцентность — необратимая остановка клеточного цикла. В современном понимании, термин введён Л. Хейфликом -
- 17. - запасной путь устранения из активной жизни клеток, у которых нарушен путь апоптоза - возможно, сенесцентность
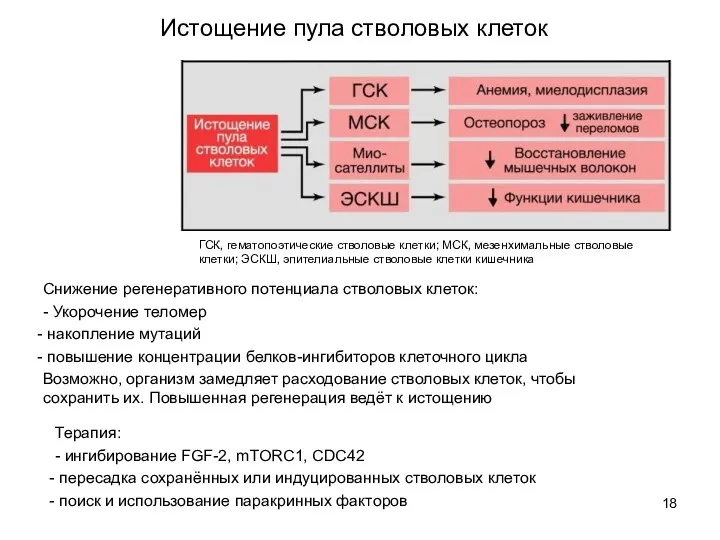
- 18. Снижение регенеративного потенциала стволовых клеток: - Укорочение теломер накопление мутаций повышение концентрации белков-ингибиторов клеточного цикла Возможно,
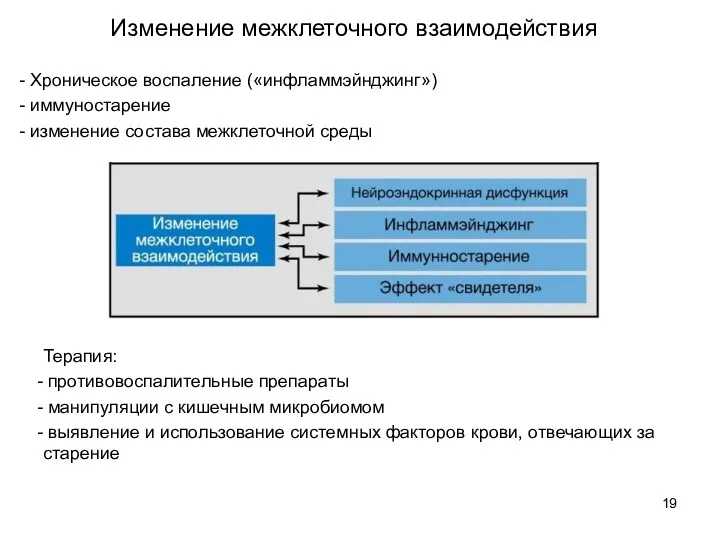
- 19. - Хроническое воспаление («инфламмэйнджинг») - иммуностарение - изменение состава межклеточной среды Изменение межклеточного взаимодействия Терапия: противовоспалительные
- 22. Скачать презентацию



 Основы гистологии. Ткани, виды тканей, соединительная ткань
Основы гистологии. Ткани, виды тканей, соединительная ткань Физиология пищеварения
Физиология пищеварения Иммунитет. Имунная система (биология, 8 класс)
Иммунитет. Имунная система (биология, 8 класс) урок биологии в 7 классе Инфузория
урок биологии в 7 классе Инфузория Атлас млекопитающих Москвы и Подмосковья
Атлас млекопитающих Москвы и Подмосковья African animals in danger. The world around us
African animals in danger. The world around us Анатомия зрительного пути
Анатомия зрительного пути Карл Линней (23 мая 1707 10 января 1778)
Карл Линней (23 мая 1707 10 января 1778) Практическая работа: Асимметрия головного мозга
Практическая работа: Асимметрия головного мозга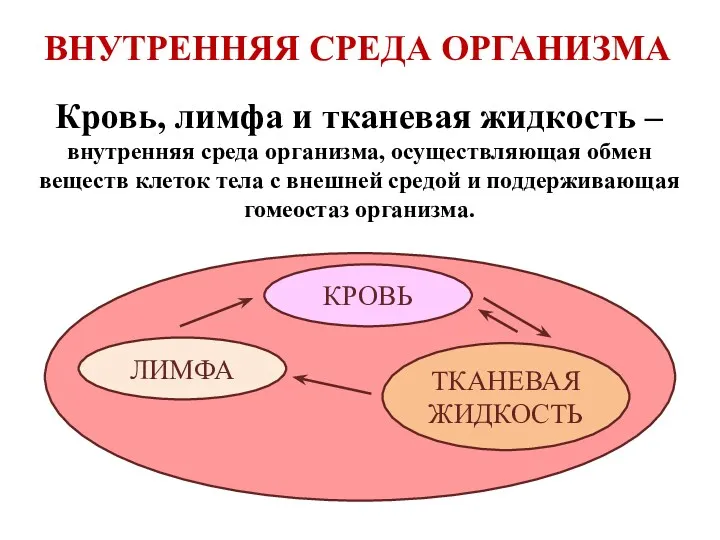 Внутренняя среда организма: кровь, лимфа и тканевая жидкость
Внутренняя среда организма: кровь, лимфа и тканевая жидкость Урок 1. Биология наука о живой природе. Классификация растений
Урок 1. Биология наука о живой природе. Классификация растений Органы цветковых растений
Органы цветковых растений Строение почек, расположение их на стебле растений
Строение почек, расположение их на стебле растений Лекция №4 Содержание и уход за собаками
Лекция №4 Содержание и уход за собаками Антропологиия. Раздел антропогенеза
Антропологиия. Раздел антропогенеза Слова і символи, як подразники
Слова і символи, як подразники Репаративная регенерация костной ткани
Репаративная регенерация костной ткани Структура и функции надорганизменных генетических систем. (Тема 4)
Структура и функции надорганизменных генетических систем. (Тема 4) Функциональная анатомия опорно-двигательного аппарата
Функциональная анатомия опорно-двигательного аппарата Микрофлора лекарственных средств
Микрофлора лекарственных средств Растения экваториальных лесов Африки
Растения экваториальных лесов Африки Типы взаимосвязей организмов
Типы взаимосвязей организмов Мозжечок. Общий план строения
Мозжечок. Общий план строения Интегрированное открытое мероприятие биология-математика Математика в мире животных
Интегрированное открытое мероприятие биология-математика Математика в мире животных презентация Гигиена питания
презентация Гигиена питания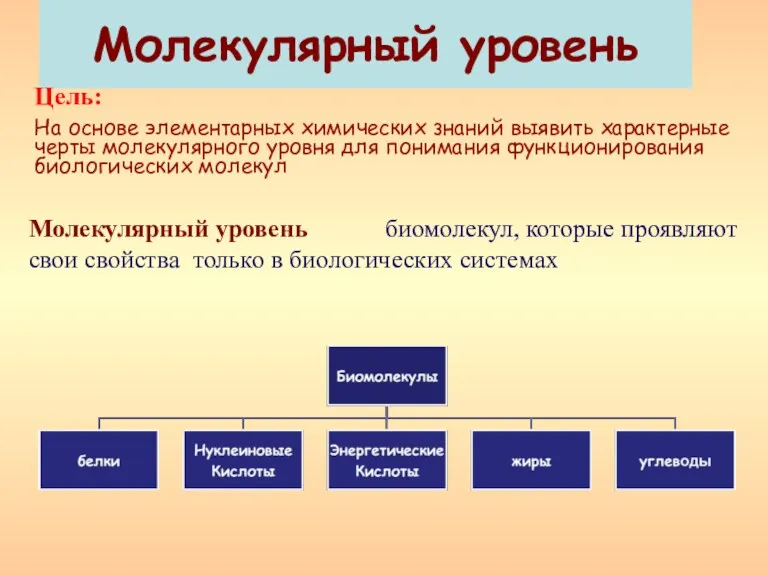 Молекулярный уровень
Молекулярный уровень Семейство крестоцветные
Семейство крестоцветные Бактерії
Бактерії