Содержание
- 2. Надклеточная организация растений. 1.Система дальнего транспорта
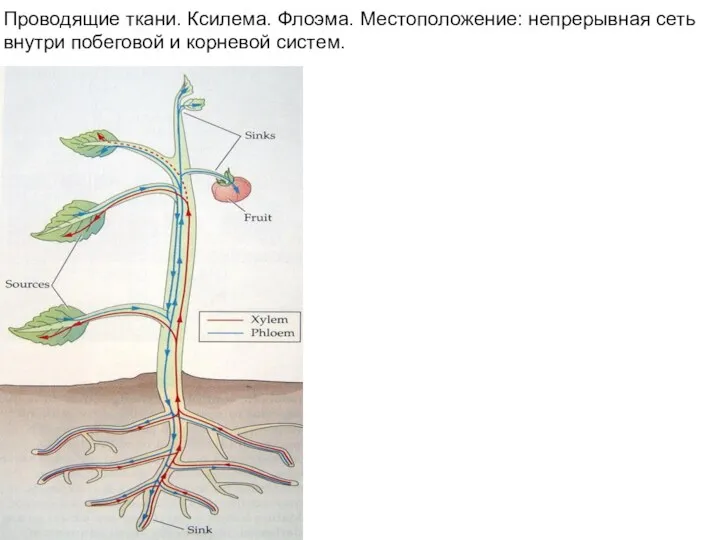
- 3. Проводящие ткани. Ксилема. Флоэма. Местоположение: непрерывная сеть внутри побеговой и корневой систем.
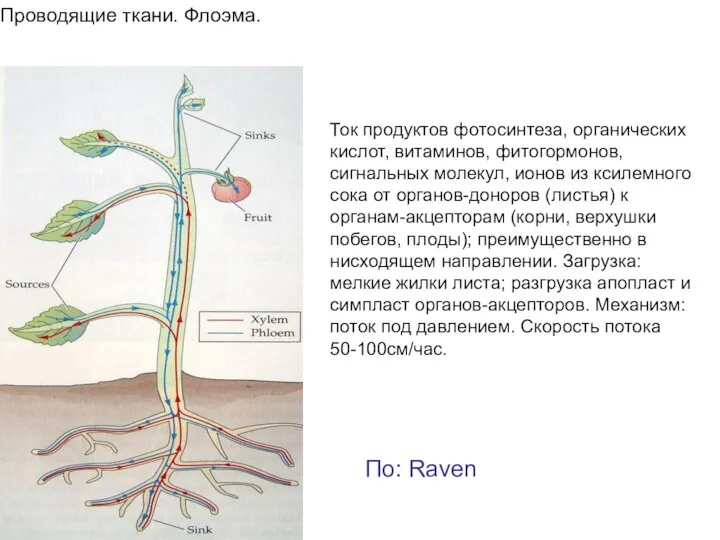
- 4. Проводящие ткани. Флоэма. Ток продуктов фотосинтеза, органических кислот, витаминов, фитогормонов, сигнальных молекул, ионов из ксилемного сока
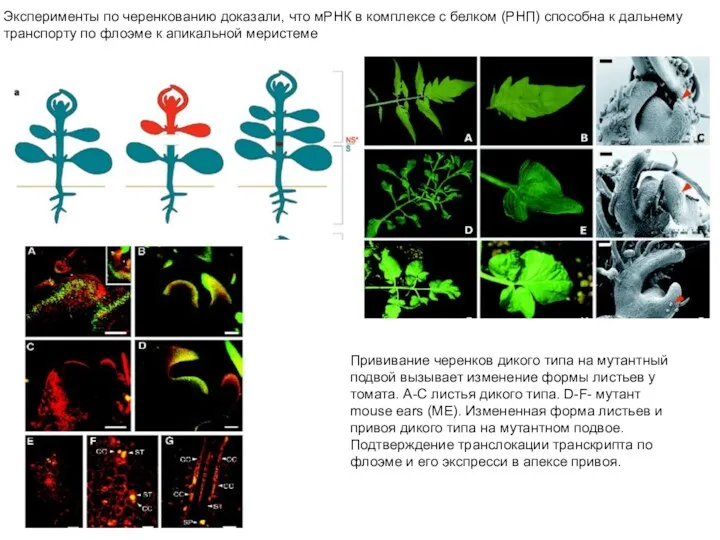
- 5. Растения табака, экспрессировавшие дополнительные копии гена нитратредуктаза (Nia) разделили на “замалчиваемые” (silenced, S) и “не замалчиваемые”
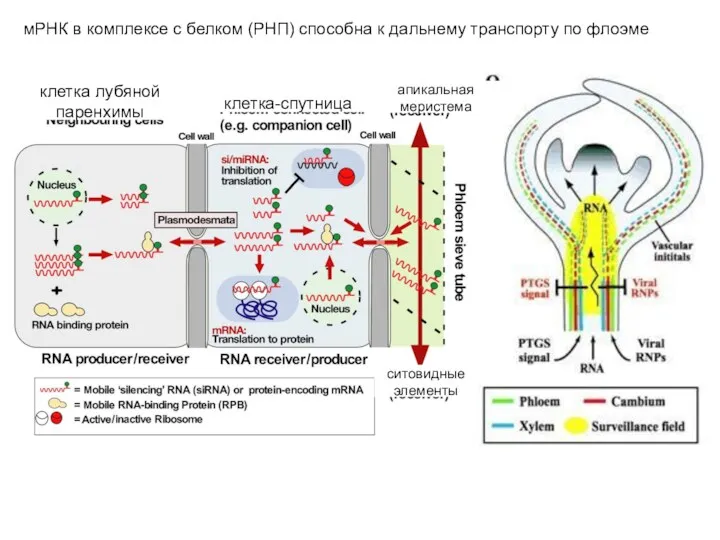
- 6. мРНК в комплексе с белком (РНП) способна к дальнему транспорту по флоэме клетка лубяной паренхимы клетка-спутница
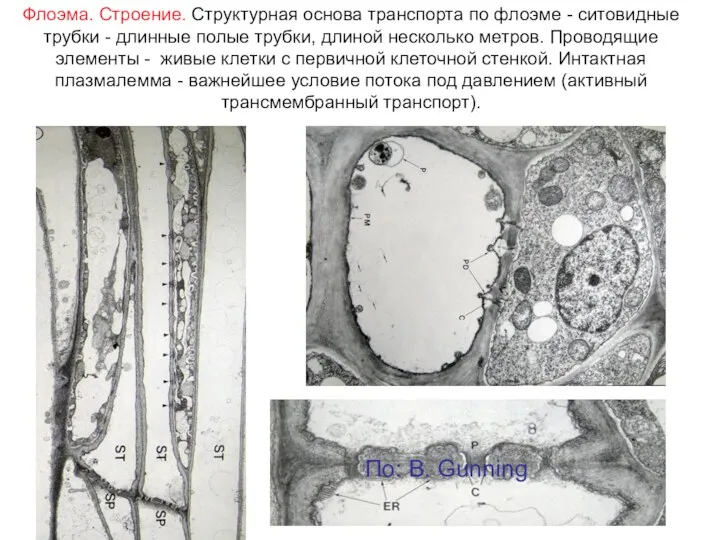
- 7. Флоэма. Строение. Структурная основа транспорта по флоэме - ситовидные трубки - длинные полые трубки, длиной несколько
- 8. Надклеточная организация растений. 2. Апопласт
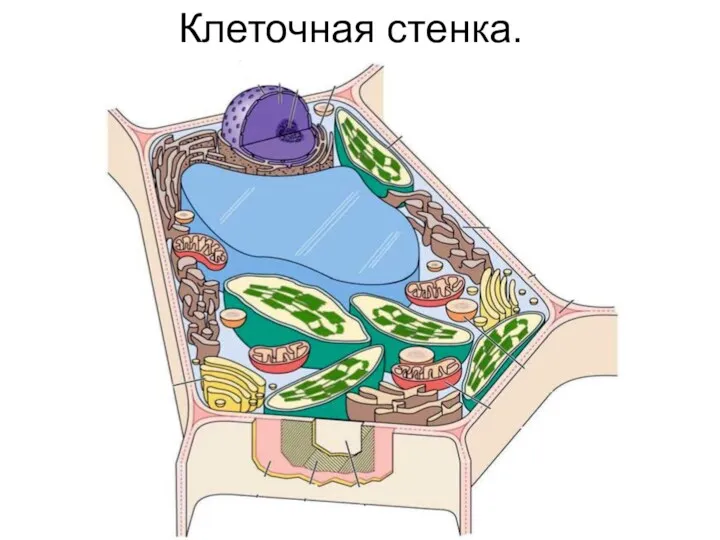
- 9. Клеточная стенка.
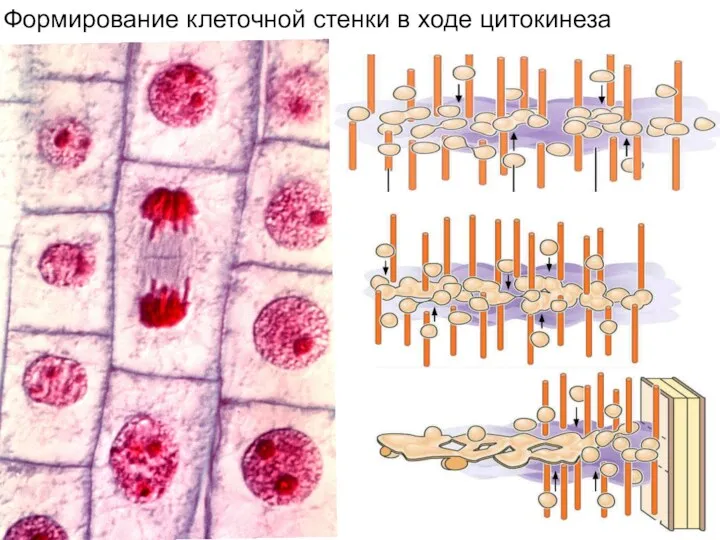
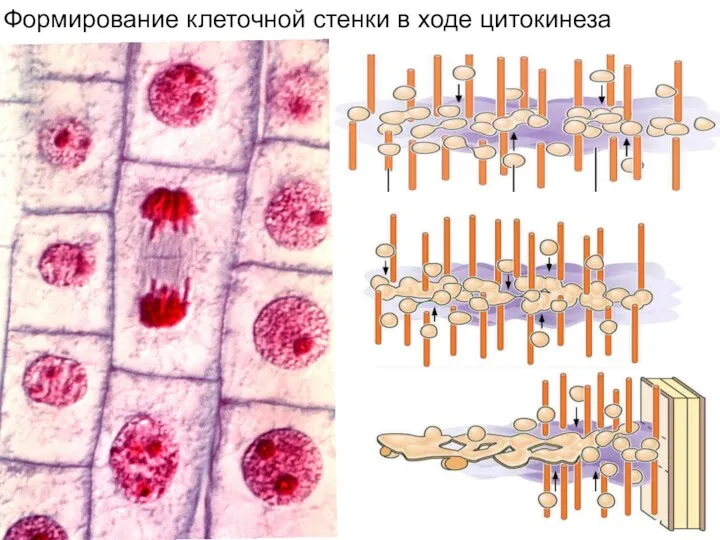
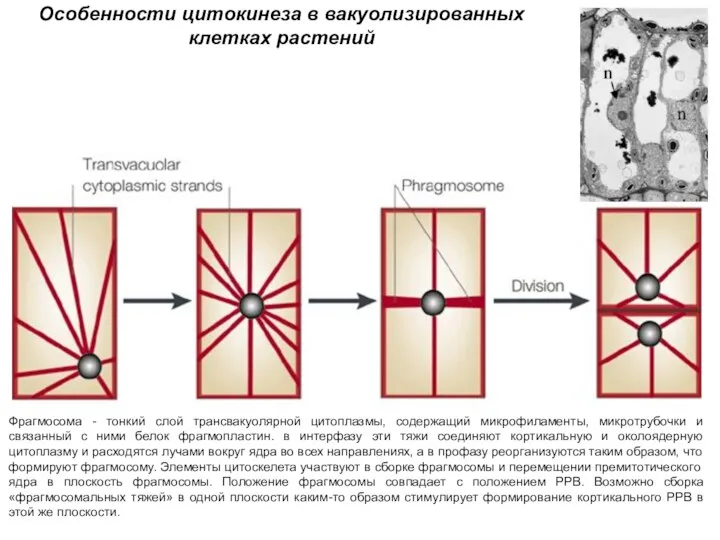
- 10. Формирование клеточной стенки в ходе цитокинеза
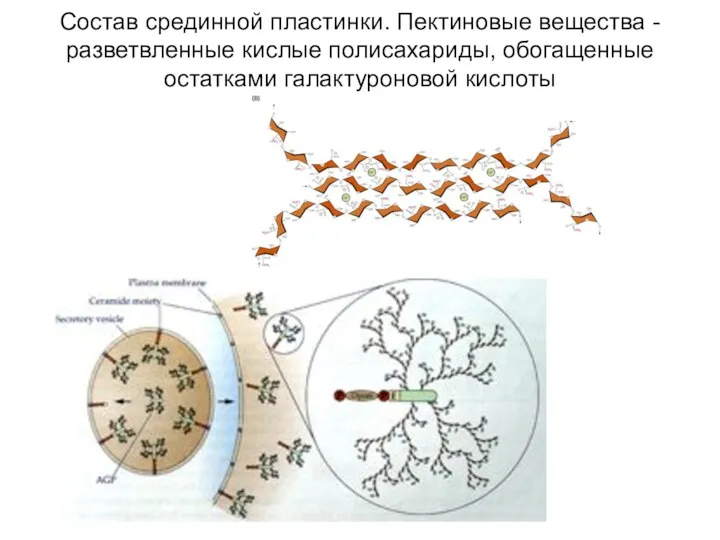
- 11. Состав срединной пластинки. Пектиновые вещества - разветвленные кислые полисахариды, обогащенные остатками галактуроновой кислоты
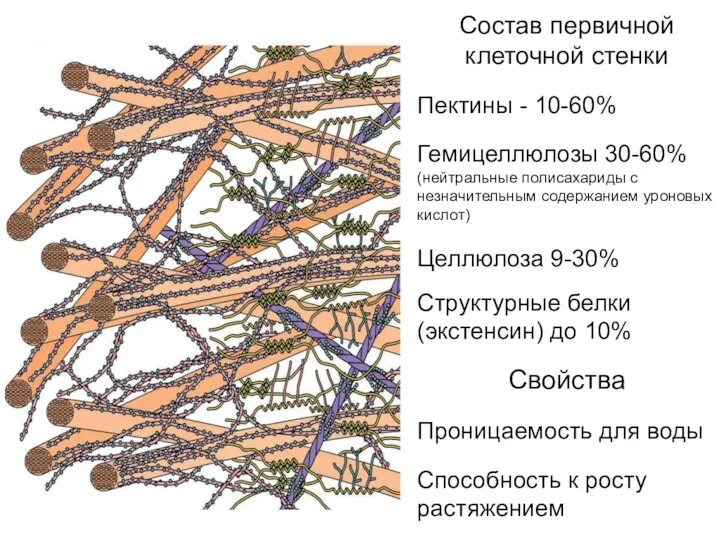
- 12. Состав первичной клеточной стенки Пектины - 10-60% Гемицеллюлозы 30-60% (нейтральные полисахариды с незначительным содержанием уроновых кислот)
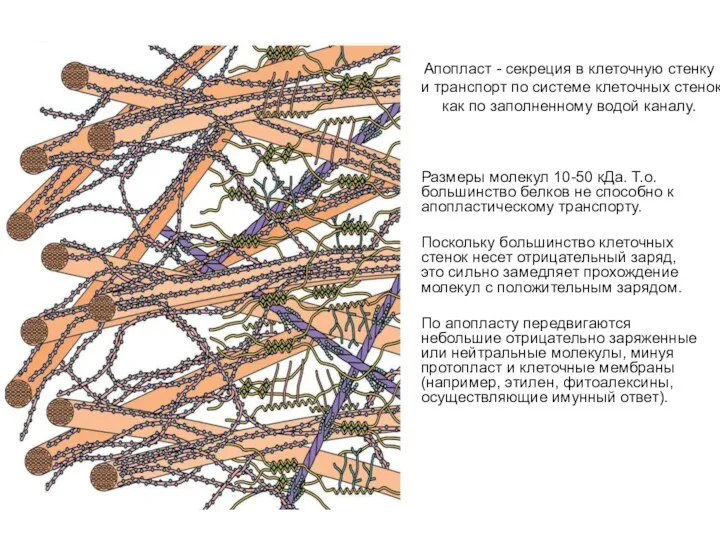
- 13. Апопласт - секреция в клеточную стенку и транспорт по системе клеточных стенок как по заполненному водой
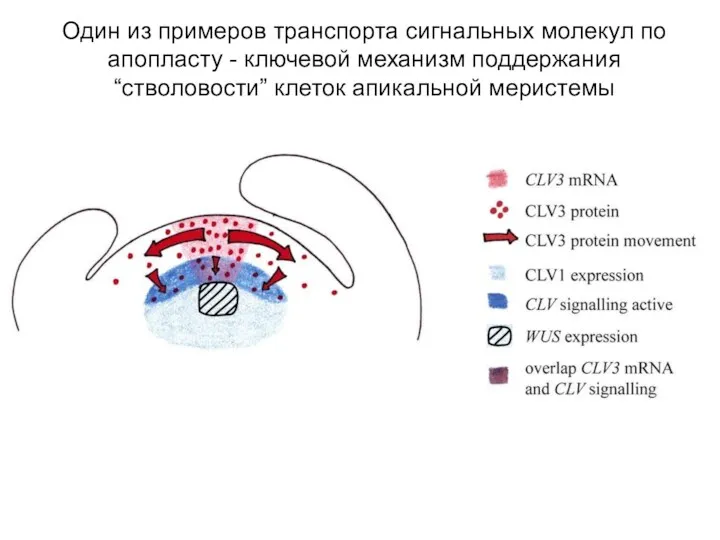
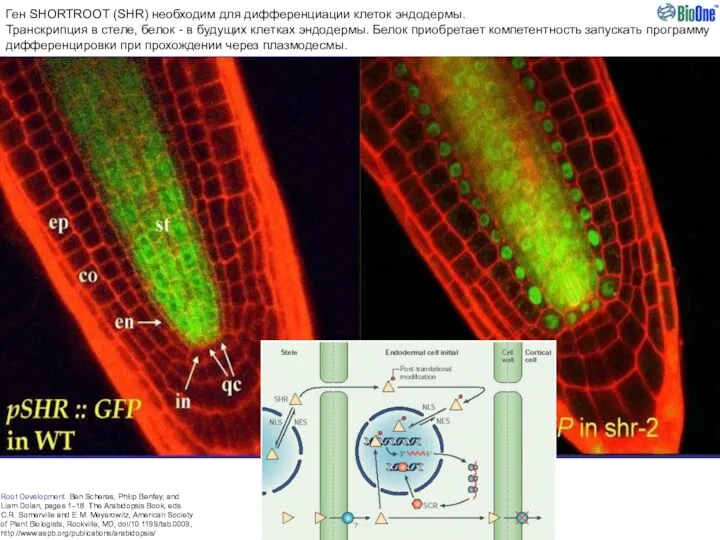
- 14. Один из примеров транспорта сигнальных молекул по апопласту - ключевой механизм поддержания “стволовости” клеток апикальной меристемы
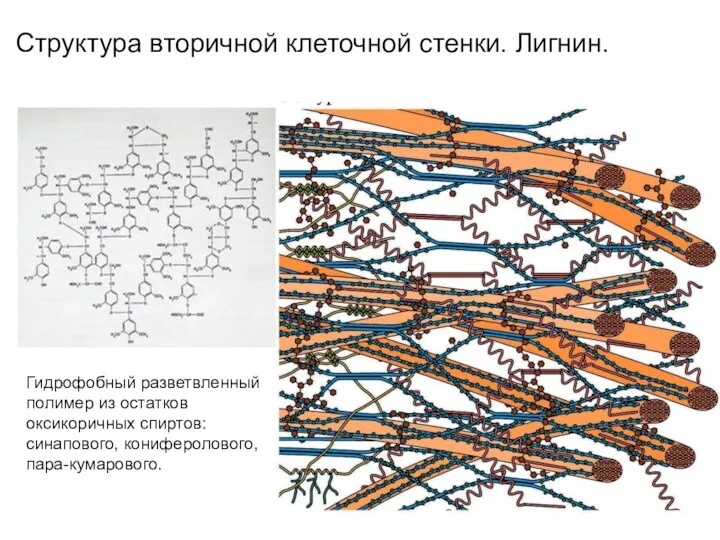
- 15. Структура вторичной клеточной стенки. Лигнин. Гидрофобный разветвленный полимер из остатков оксикоричных спиртов: синапового, кониферолового, пара-кумарового.
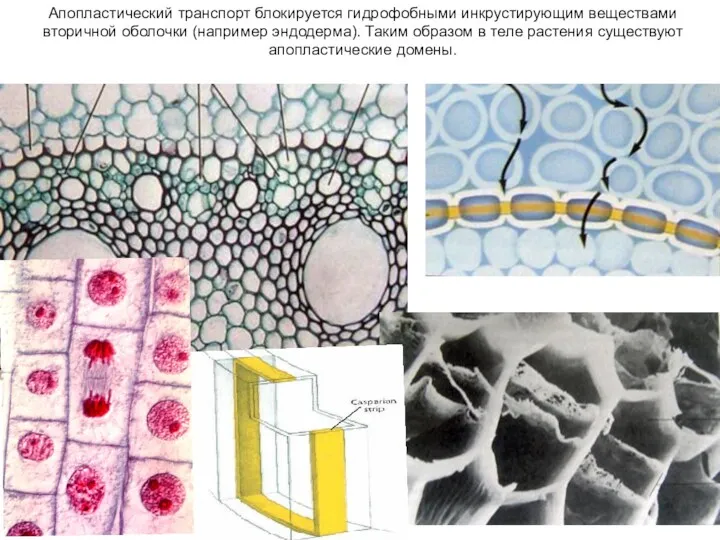
- 16. Апопластический транспорт блокируется гидрофобными инкрустирующим веществами вторичной оболочки (например эндодерма). Таким образом в теле растения существуют
- 17. Надклеточная организация растений. 3. Симпласт
- 18. Формирование клеточной стенки в ходе цитокинеза
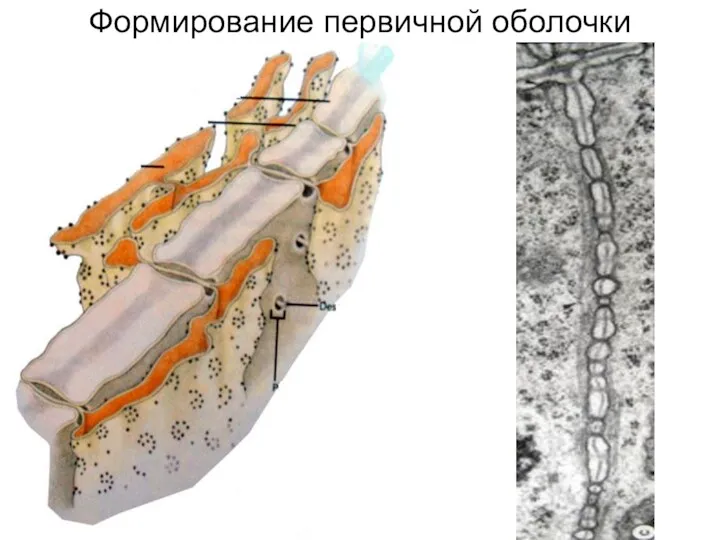
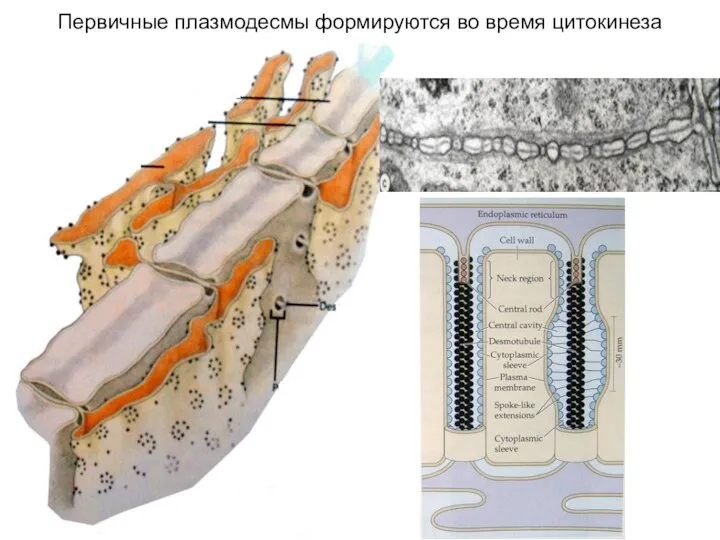
- 19. Формирование первичной оболочки
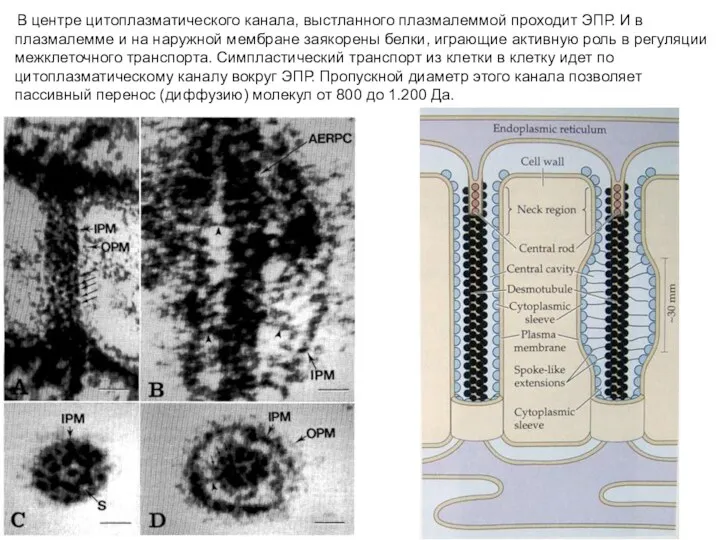
- 20. В центре цитоплазматического канала, выстланного плазмалеммой проходит ЭПР. И в плазмалемме и на наружной мембране заякорены
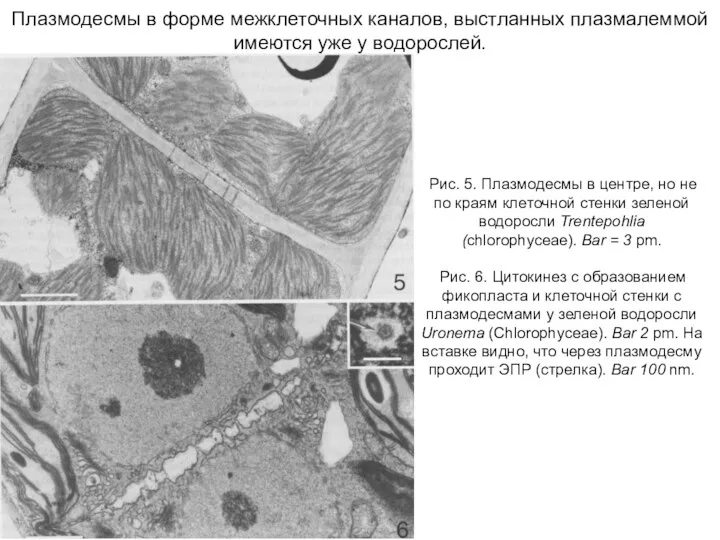
- 21. Плазмодесмы в форме межклеточных каналов, выстланных плазмалеммой имеются уже у водорослей. Рис. 5. Плазмодесмы в центре,
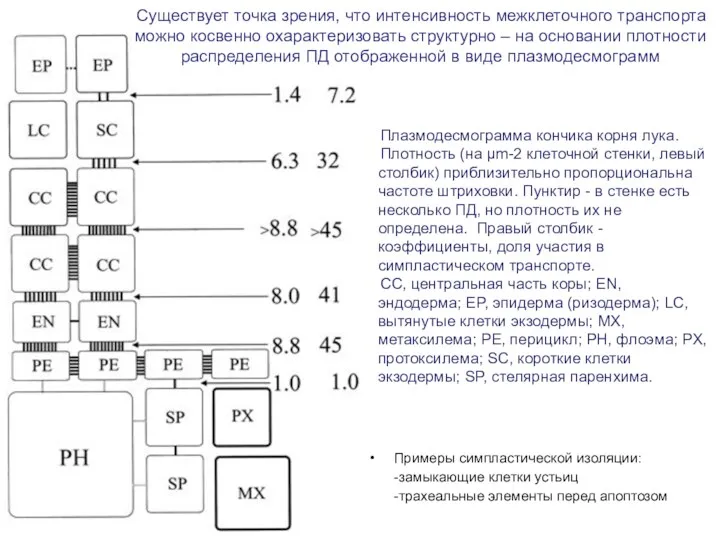
- 22. Плазмодесмограмма кончика корня лука. Плотность (на µm-2 клеточной стенки, левый столбик) приблизительно пропорциональна частоте штриховки. Пунктир
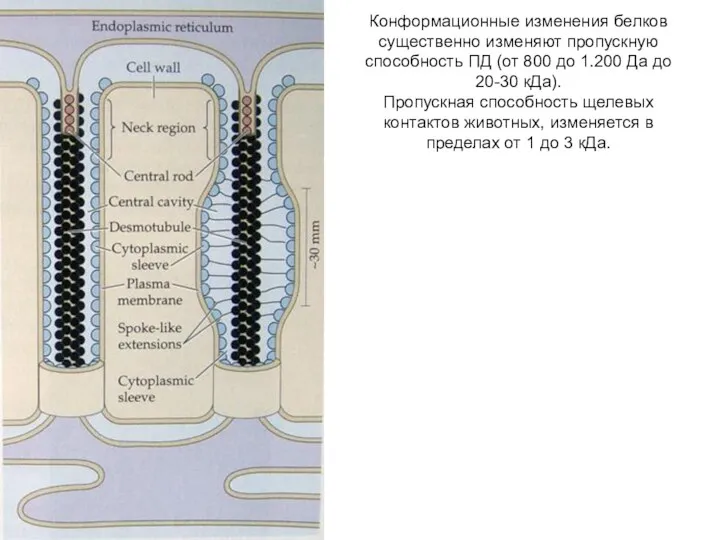
- 23. Конформационные изменения белков существенно изменяют пропускную способность ПД (от 800 до 1.200 Да до 20-30 кДа).
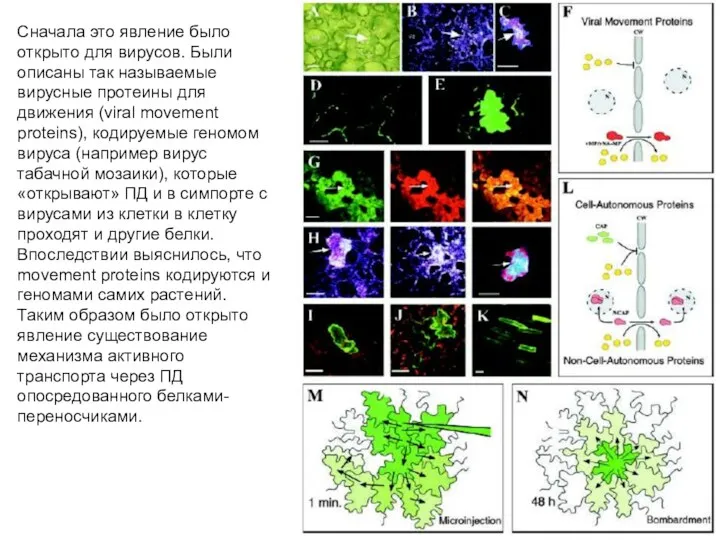
- 24. Сначала это явление было открыто для вирусов. Были описаны так называемые вирусные протеины для движения (viral
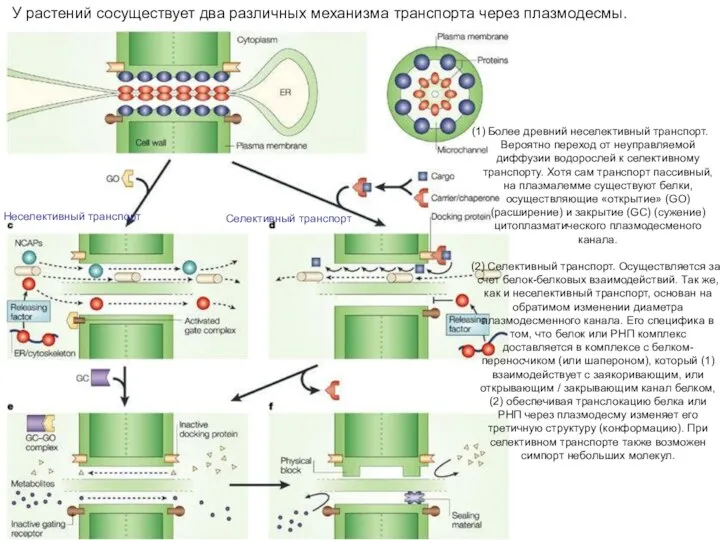
- 25. Селективный транспорт Более древний неселективный транспорт. Вероятно переход от неуправляемой диффузии водорослей к селективному транспорту. Хотя
- 26. Примеры изменения свойств белков при прохождении через плазмодесмы
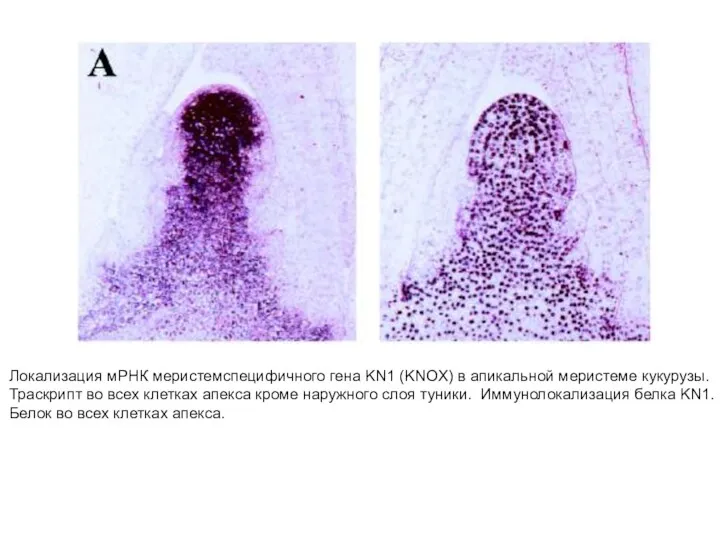
- 27. Локализация мРНК меристемспецифичного гена KN1 (KNOX) в апикальной меристеме кукурузы. Траскрипт во всех клетках апекса кроме
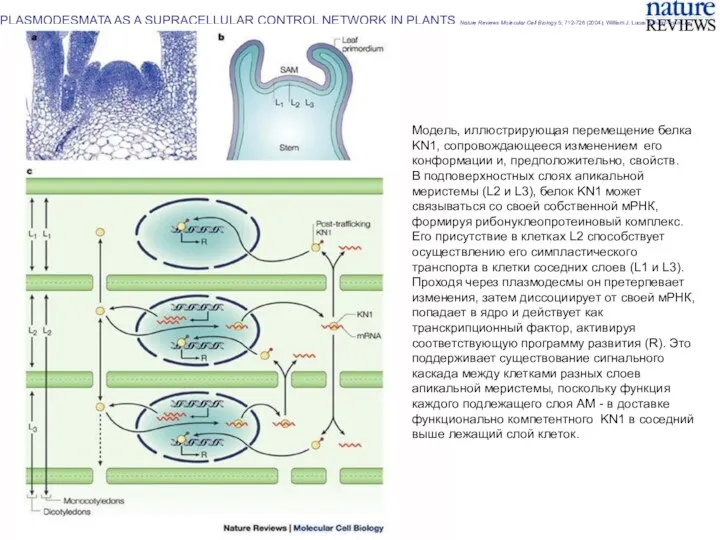
- 28. PLASMODESMATA AS A SUPRACELLULAR CONTROL NETWORK IN PLANTS Nature Reviews Molecular Cell Biology 5; 712-726 (2004);
- 29. Root Development. Ben Scheres, Philip Benfey, and Liam Dolan, pages 1–18. The Arabidopsis Book, eds. C.R.
- 30. Симпластическая организация: эволюционный аспект. Понятие о первичных и вторичных плазмодесмах
- 31. Первичные плазмодесмы формируются во время цитокинеза
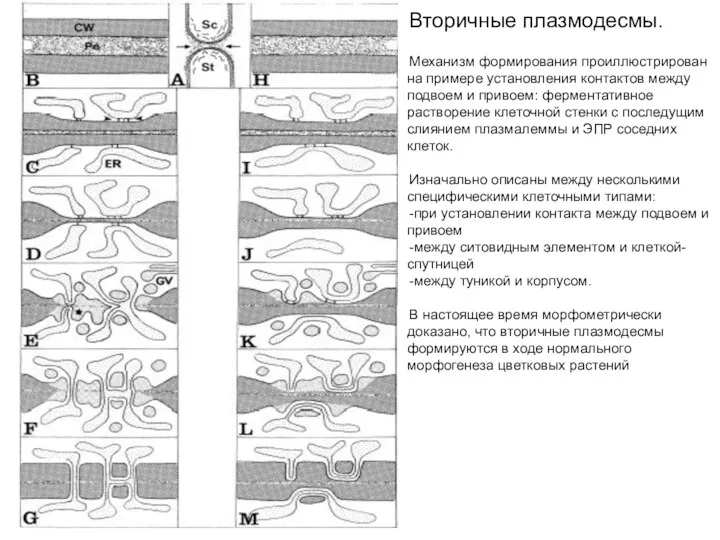
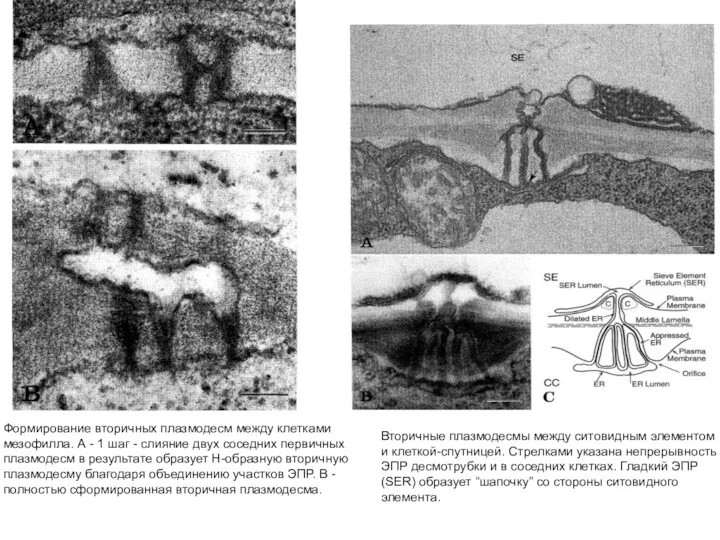
- 32. Вторичные плазмодесмы. Механизм формирования проиллюстрирован на примере установления контактов между подвоем и привоем: ферментативное растворение клеточной
- 33. Вторичные плазмодесмы между ситовидным элементом и клеткой-спутницей. Стрелками указана непрерывность ЭПР десмотрубки и в соседних клетках.
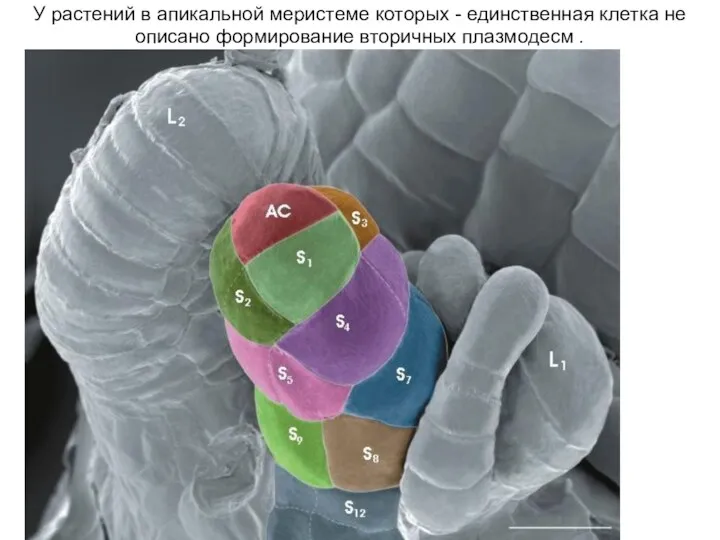
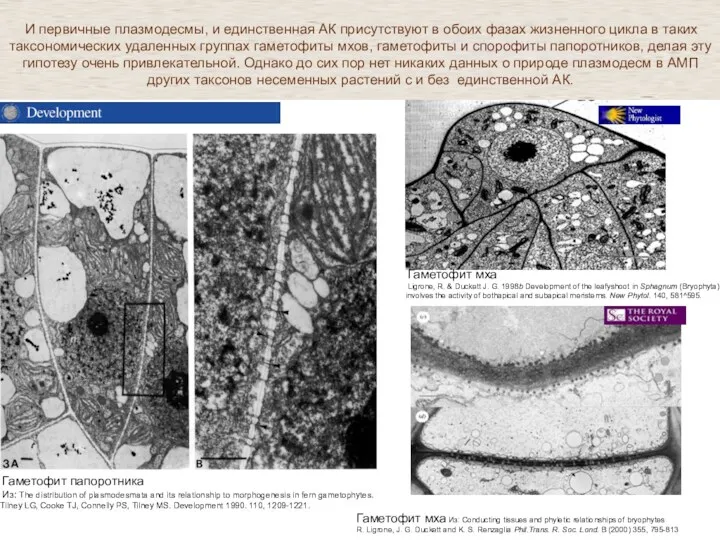
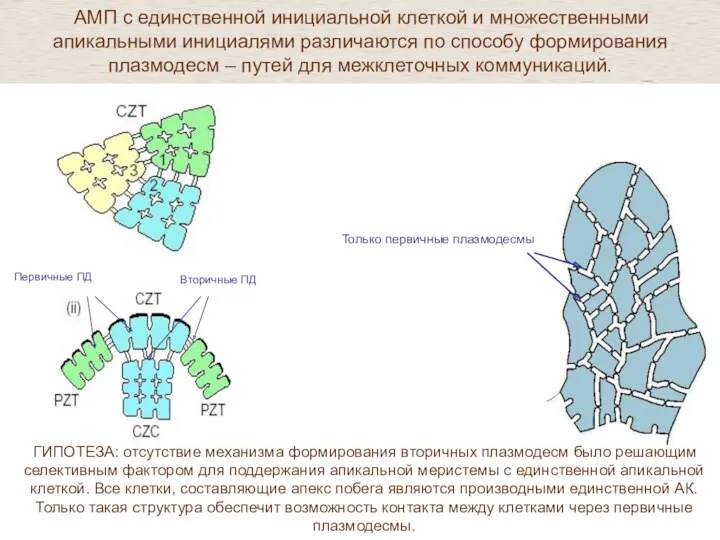
- 34. У растений в апикальной меристеме которых - единственная клетка не описано формирование вторичных плазмодесм .
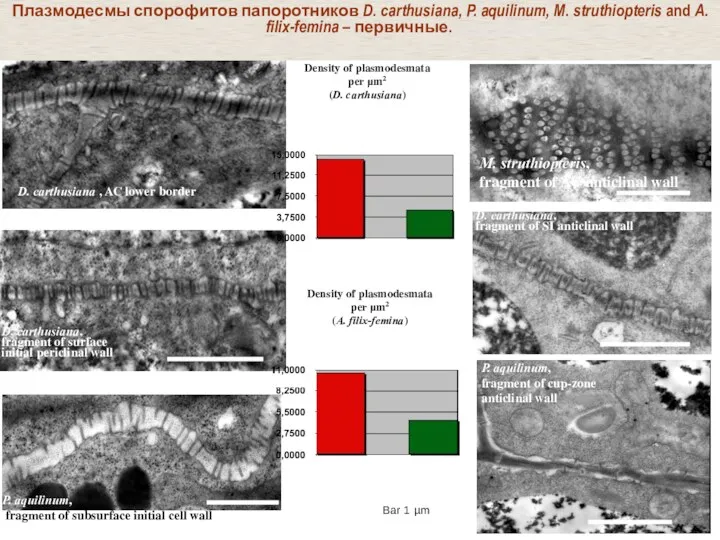
- 35. Плазмодесмы спорофитов папоротников D. carthusiana, P. aquilinum, M. struthiopteris and A. filix-femina – первичные. D. carthusiana
- 36. Гаметофит мха Из: Conducting tissues and phyletic relationships of bryophytes R. Ligrone, J. G. Duckett and
- 37. ГИПОТЕЗА: отсутствие механизма формирования вторичных плазмодесм было решающим селективным фактором для поддержания апикальной меристемы с единственной
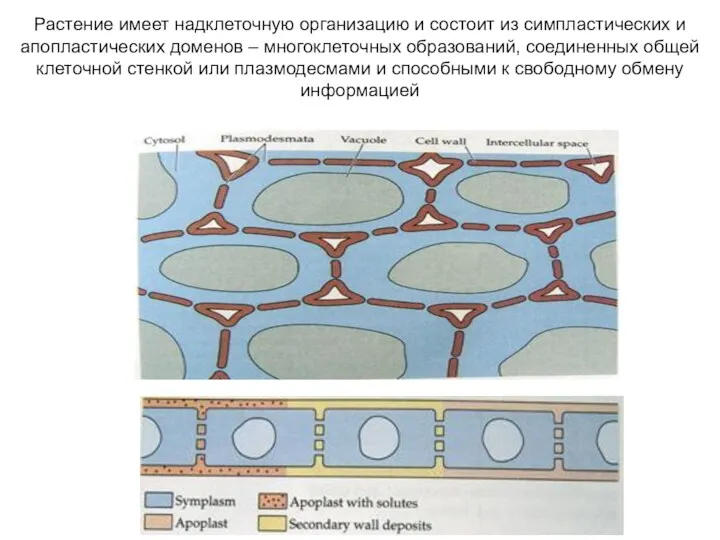
- 38. Растение имеет надклеточную организацию и состоит из симпластических и апопластических доменов – многоклеточных образований, соединенных общей
- 39. Еще одна функция клеточной стенки в морфогенезе По: Raven
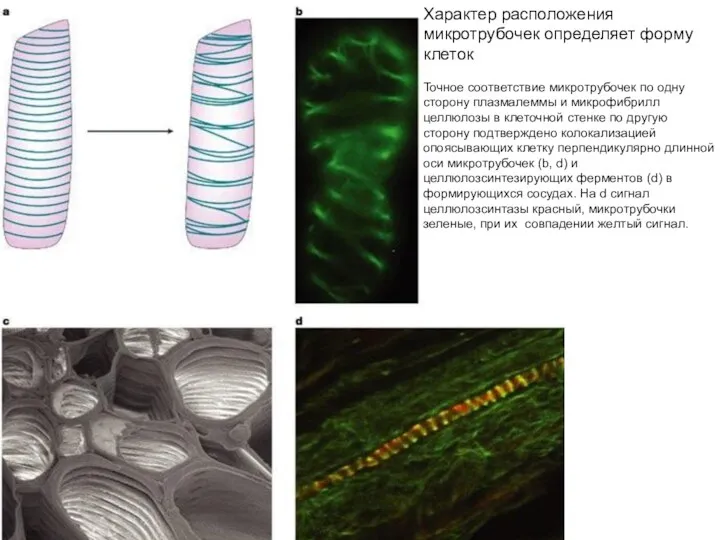
- 40. Точное соответствие микротрубочек по одну сторону плазмалеммы и микрофибрилл целлюлозы в клеточной стенке по другую сторону.
- 41. MICROTUBULES AND THE SHAPE OF PLANTS TO COME Nature Reviews Molecular Cell Biology 5; 13-23 (2004);
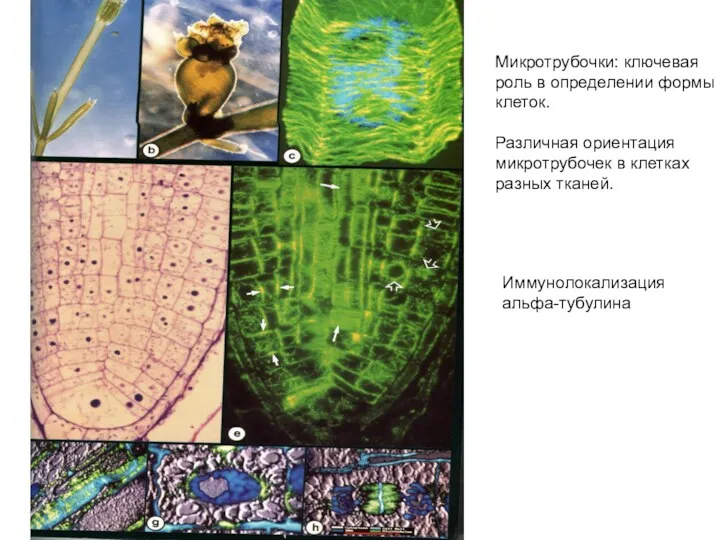
- 42. Иммунолокализация альфа-тубулина Микротрубочки: ключевая роль в определении формы клеток. Различная ориентация микротрубочек в клетках разных тканей.
- 43. Nature Reviews Molecular Cell Biology 2; 33-39 (2001); Laurie G. Smith PLANT CELL DIVISION: BUILDING WALLS
- 45. Скачать презентацию







 Типы питания живых организмов
Типы питания живых организмов Система двигательных действий и организация управления ими
Система двигательных действий и организация управления ими Развитие пищеварительной системы, оболочки пищеварительной трубки. Слизистая оболочка полости рта
Развитие пищеварительной системы, оболочки пищеварительной трубки. Слизистая оболочка полости рта Центральная догма молекулярной биологии. Синтез РНК по матрице ДНК
Центральная догма молекулярной биологии. Синтез РНК по матрице ДНК Общий обзор строения и функций организма человека
Общий обзор строения и функций организма человека Головач гигантский
Головач гигантский Семейства класса Двудольные
Семейства класса Двудольные Фотосинтез и хемосинтез 10 класс
Фотосинтез и хемосинтез 10 класс Теорія Мальтуса та сучасність
Теорія Мальтуса та сучасність Что мы знаем о наркотиках, или правда, или вымысел …
Что мы знаем о наркотиках, или правда, или вымысел … Презентация к уроку биологии в 6 классе
Презентация к уроку биологии в 6 классе Взаимодействие генов
Взаимодействие генов Розы кордес. Сорта
Розы кордес. Сорта Анатомия среднего уха
Анатомия среднего уха Совы. Интересные факты о совах
Совы. Интересные факты о совах Эволюция. Теория Дарвина
Эволюция. Теория Дарвина VITAMINS. History of the discovery of vitamins
VITAMINS. History of the discovery of vitamins Классификация и характеристика рыб
Классификация и характеристика рыб Состав и строение клеток
Состав и строение клеток Аутентификация личности по изображению отпечатка пальца
Аутентификация личности по изображению отпечатка пальца Кто хочет стать отличником
Кто хочет стать отличником Харчова поведінка тварин
Харчова поведінка тварин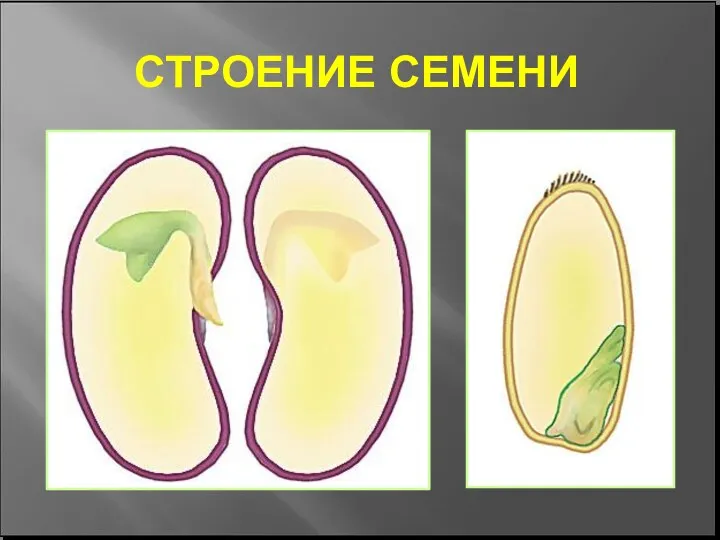 Открытый урок по биологии СТРОЕНИЕ СЕМЕНИ 6 класс
Открытый урок по биологии СТРОЕНИЕ СЕМЕНИ 6 класс Элементы физиологии клетки
Элементы физиологии клетки Многолетние цветковые растения
Многолетние цветковые растения Волевые качества и самоконтроль спортсменов гребли на байдарке.
Волевые качества и самоконтроль спортсменов гребли на байдарке. Рослинний матеріал у озелененні населених місць
Рослинний матеріал у озелененні населених місць Передвижение веществ в организме растения
Передвижение веществ в организме растения