Содержание
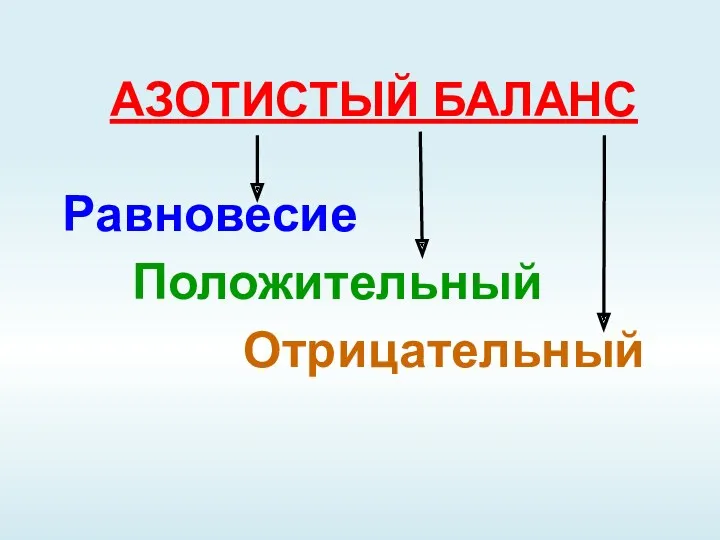
- 2. АЗОТИСТЫЙ БАЛАНС Равновесие Положительный Отрицательный
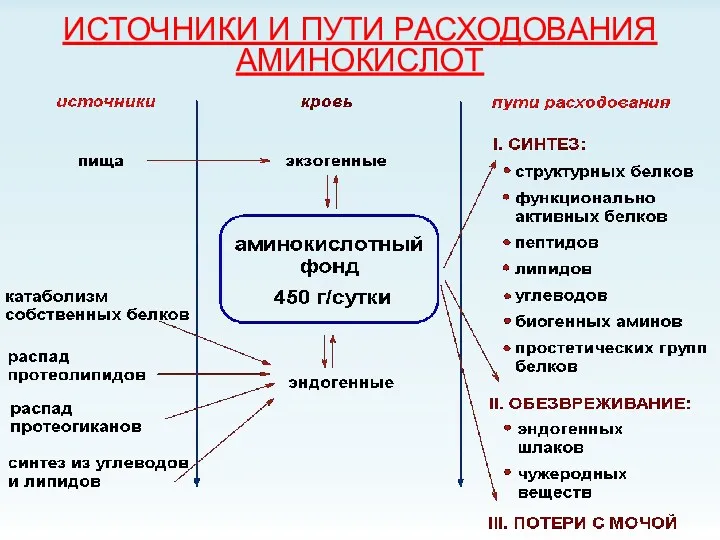
- 3. ИСТОЧНИКИ И ПУТИ РАСХОДОВАНИЯ АМИНОКИСЛОТ
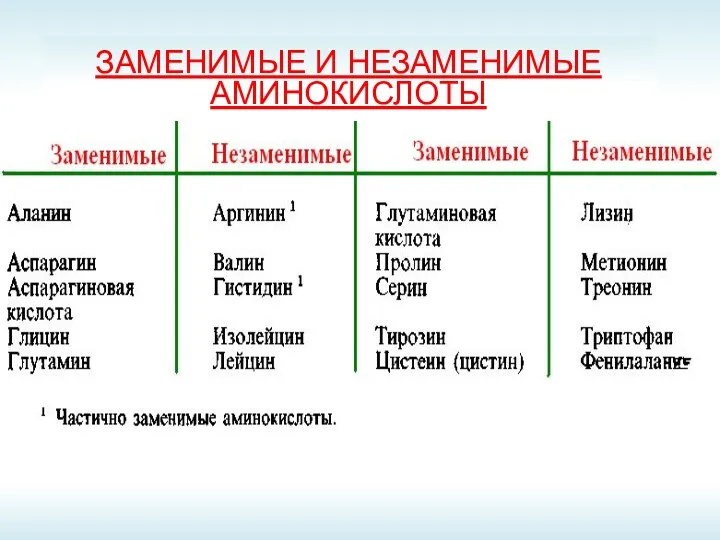
- 4. ЗАМЕНИМЫЕ И НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ
- 5. КОЛИЧЕСТВО БЕЛКА В НЕКОТОРЫХ ПИЩЕВЫХ ПРОДУКТАХ
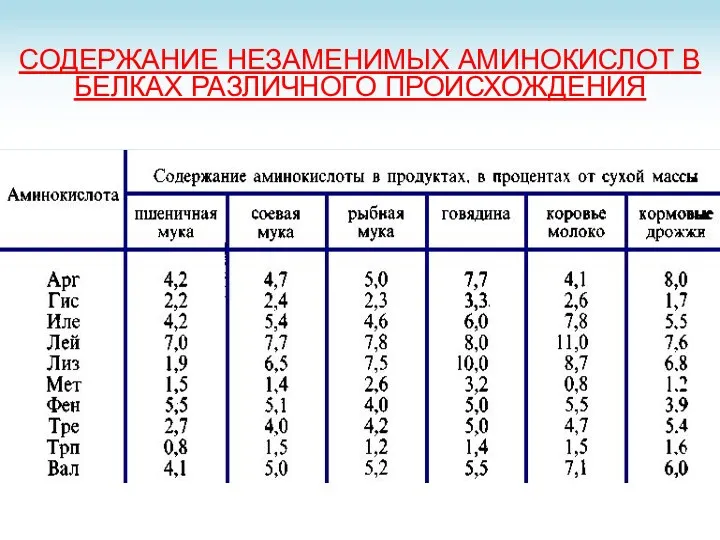
- 6. СОДЕРЖАНИЕ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ В БЕЛКАХ РАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ
- 7. ПРОТЕИНАЗЫ ЖКТ Эндопептидазы Пепсин; Реннин; Гастриксин; Трипсин; Химотрипсин; Эластаза. Экзопептидазы Карбоксипептидазы А и В; Аминопептидазы; Дипептидазы;
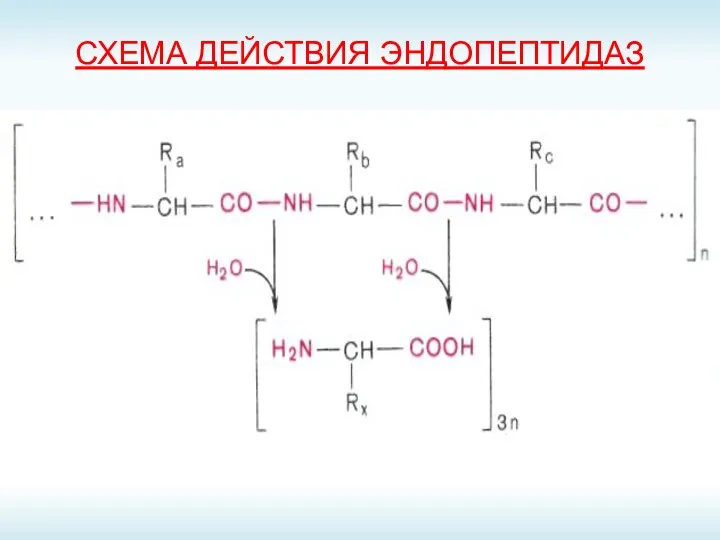
- 8. СХЕМА ДЕЙСТВИЯ ЭНДОПЕПТИДАЗ
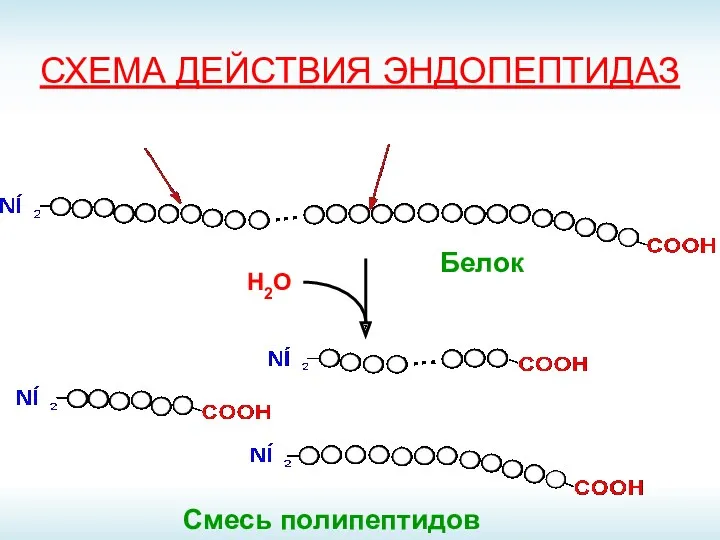
- 9. СХЕМА ДЕЙСТВИЯ ЭНДОПЕПТИДАЗ Смесь полипептидов Н2О Белок
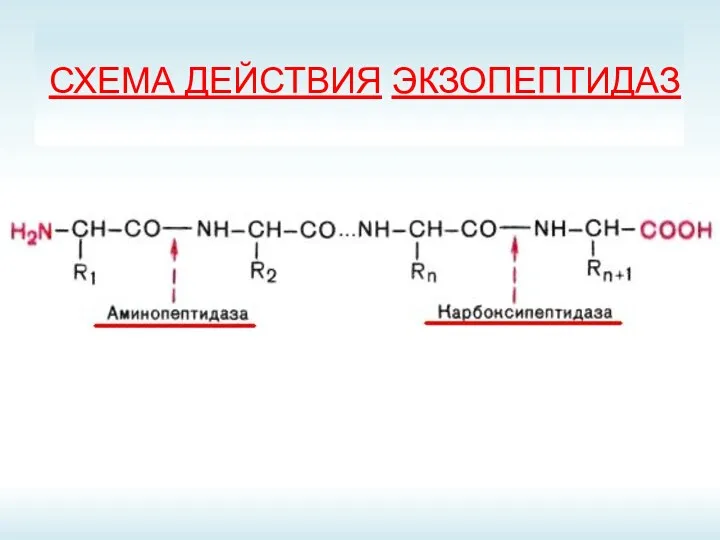
- 10. СХЕМА ДЕЙСТВИЯ ЭКЗОПЕПТИДАЗ
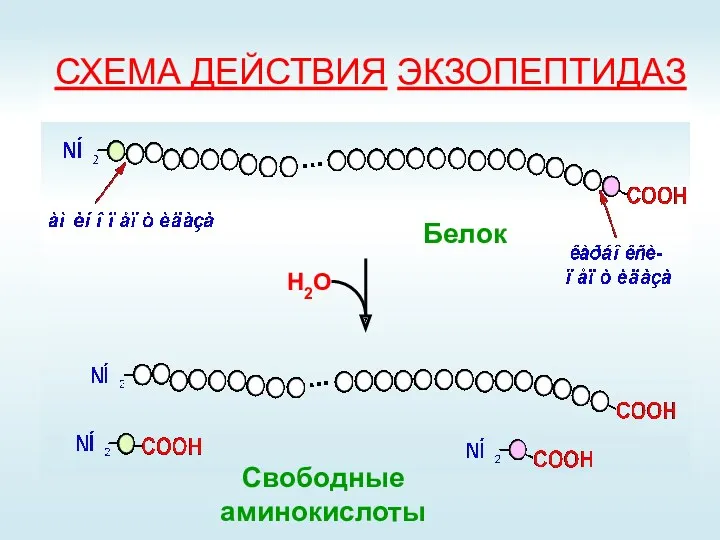
- 11. СХЕМА ДЕЙСТВИЯ ЭКЗОПЕПТИДАЗ Н2О Свободные аминокислоты Белок
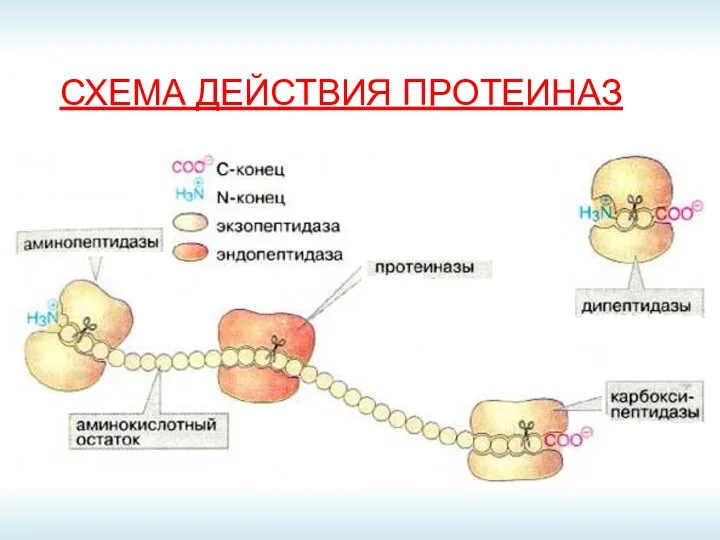
- 12. СХЕМА ДЕЙСТВИЯ ПРОТЕИНАЗ
- 14. ПРОТЕИНАЗЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
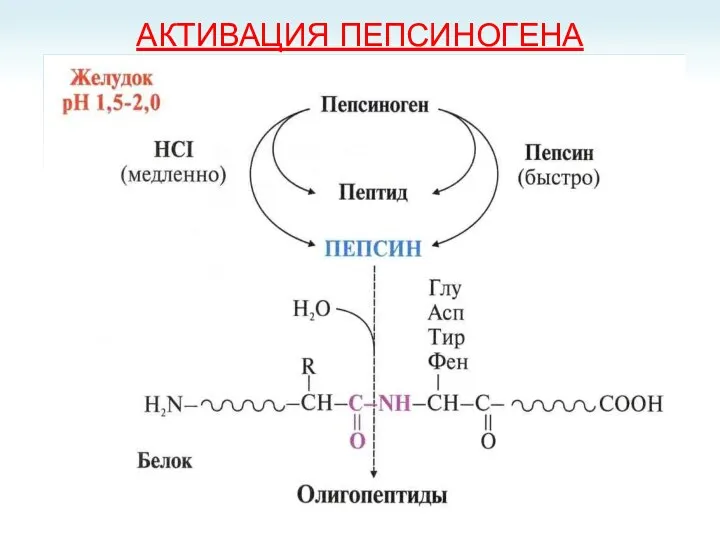
- 15. АКТИВАЦИЯ ПЕПСИНОГЕНА
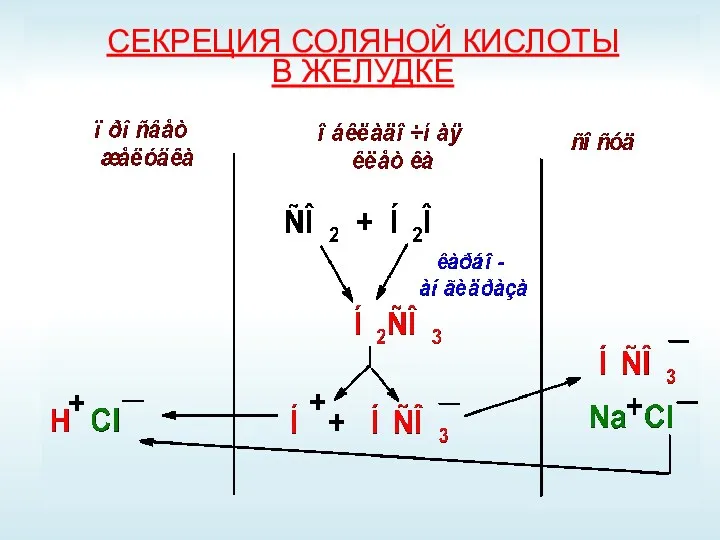
- 16. СЕКРЕЦИЯ СОЛЯНОЙ КИСЛОТЫ В ЖЕЛУДКЕ
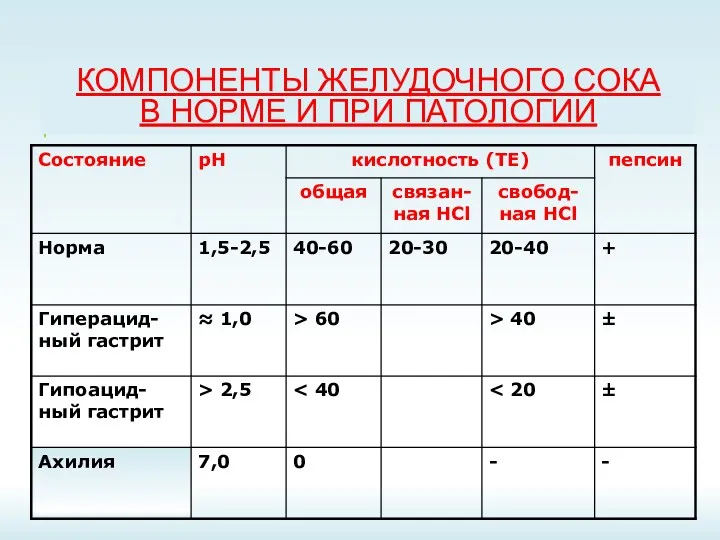
- 17. КОМПОНЕНТЫ ЖЕЛУДОЧНОГО СОКА В НОРМЕ И ПРИ ПАТОЛОГИИ
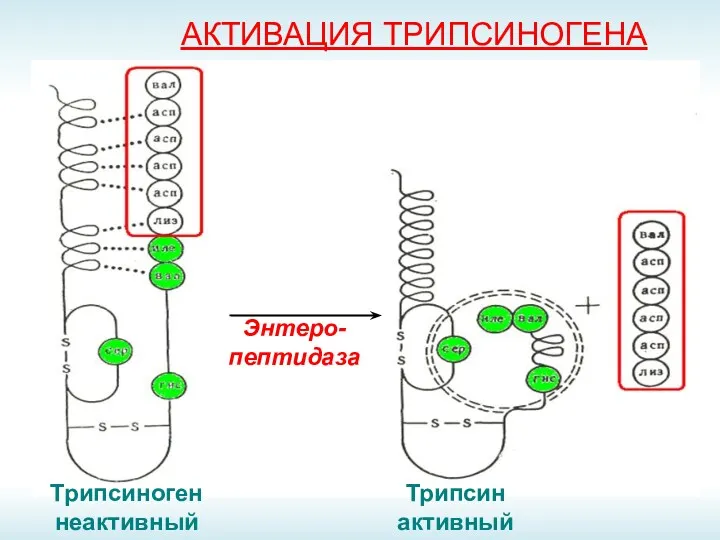
- 18. АКТИВАЦИЯ ТРИПСИНОГЕНА Энтеро-пептидаза Трипсиноген неактивный Трипсин активный
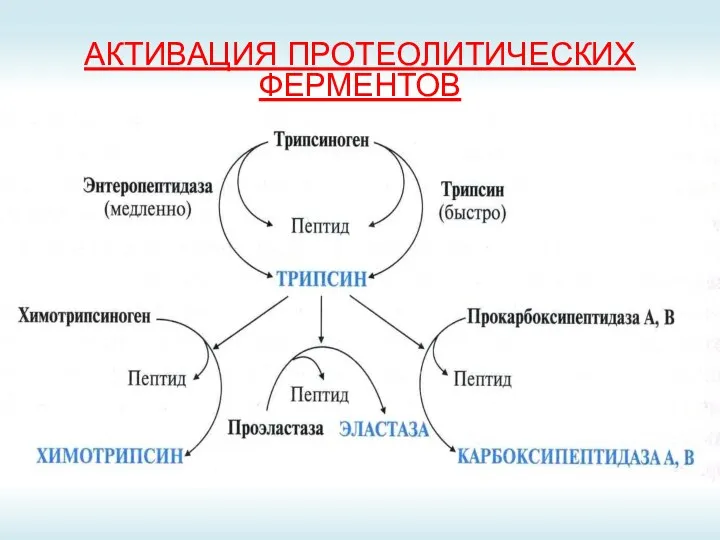
- 19. АКТИВАЦИЯ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ
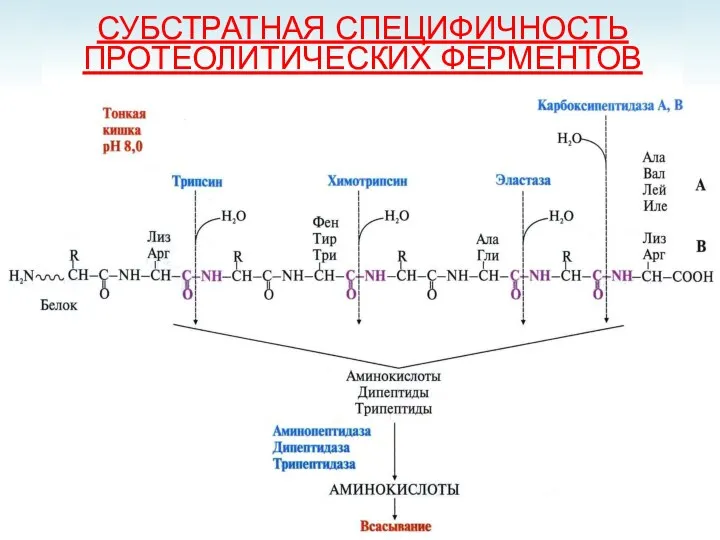
- 20. СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ
- 22. Советский учёный, специалист в области физиологии, вегетативных функций и их регуляции. Академик АН СССР по отделению
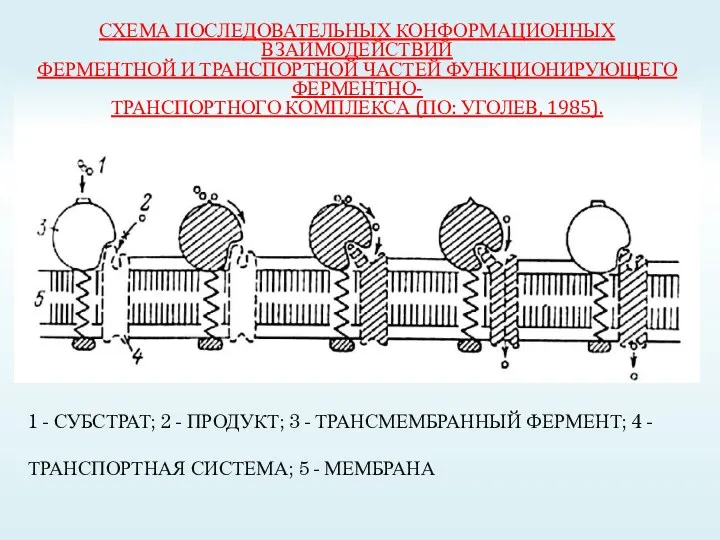
- 23. СХЕМА ПОСЛЕДОВАТЕЛЬНЫХ КОНФОРМАЦИОННЫХ ВЗАИМОДЕЙСТВИЙ ФЕРМЕНТНОЙ И ТРАНСПОРТНОЙ ЧАСТЕЙ ФУНКЦИОНИРУЮЩЕГО ФЕРМЕНТНО- ТРАНСПОРТНОГО КОМПЛЕКСА (ПО: УГОЛЕВ, 1985). 1
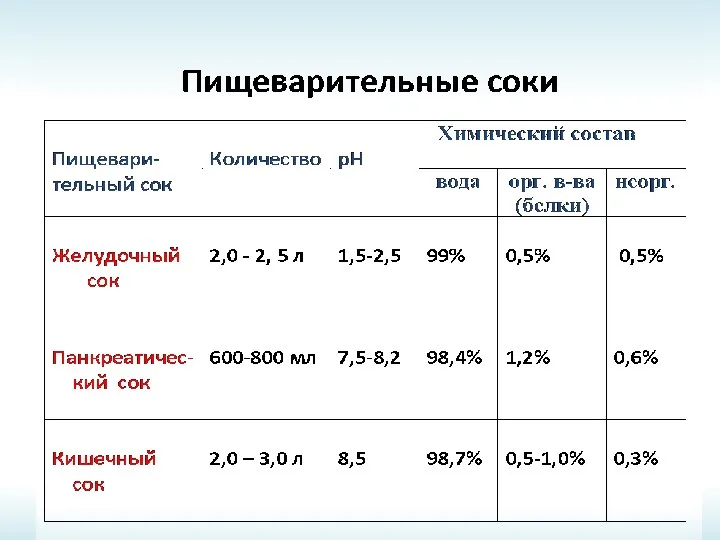
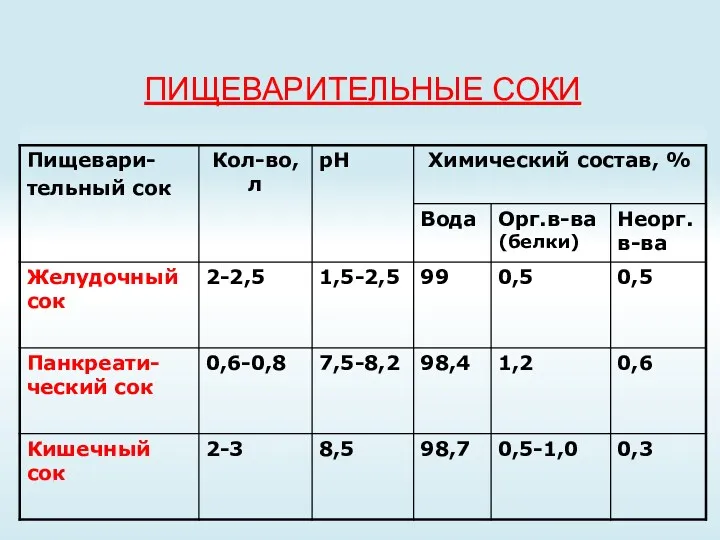
- 24. ПИЩЕВАРИТЕЛЬНЫЕ СОКИ
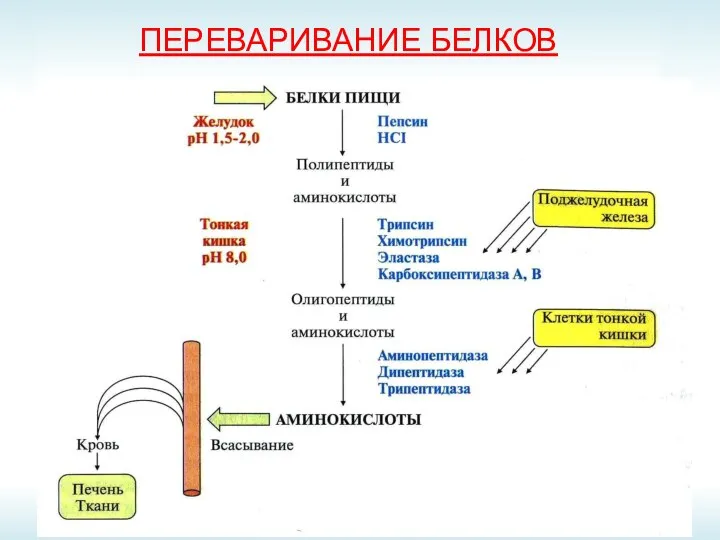
- 25. ПЕРЕВАРИВАНИЕ БЕЛКОВ
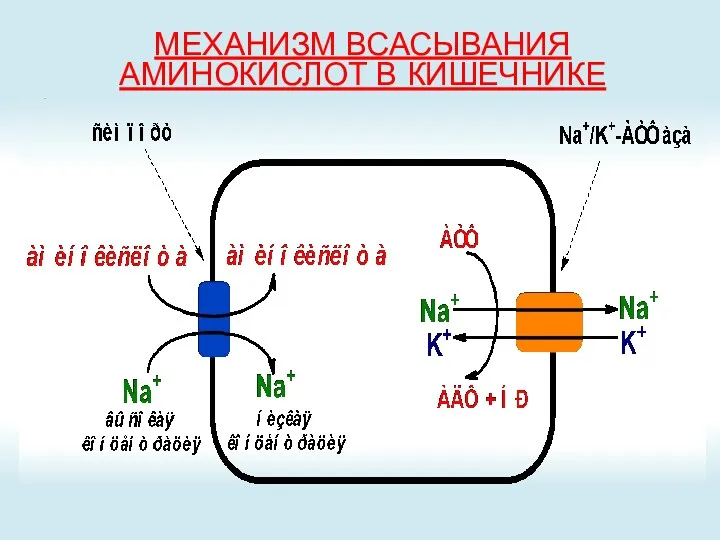
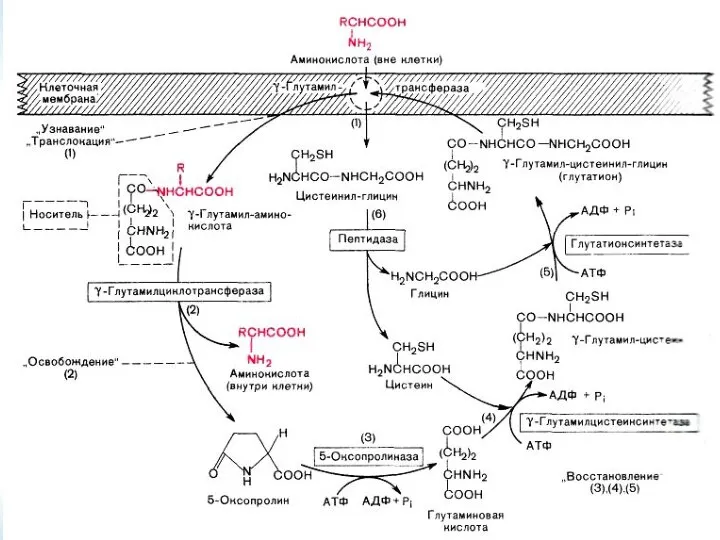
- 27. МЕХАНИЗМ ВСАСЫВАНИЯ АМИНОКИСЛОТ В КИШЕЧНИКЕ
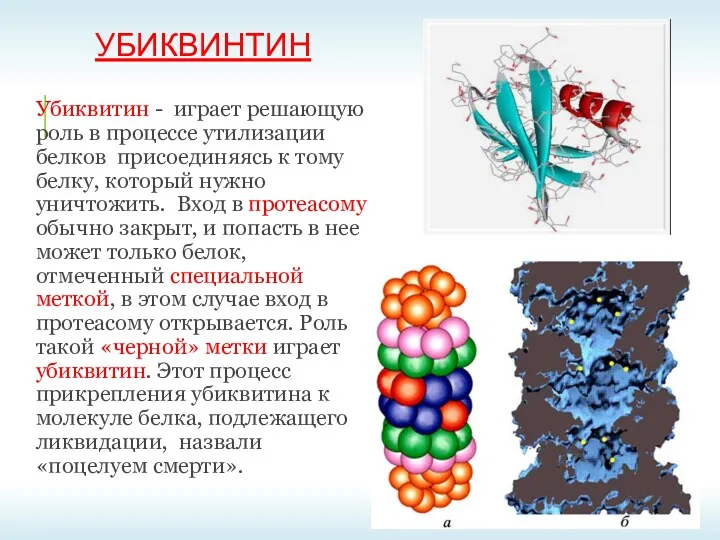
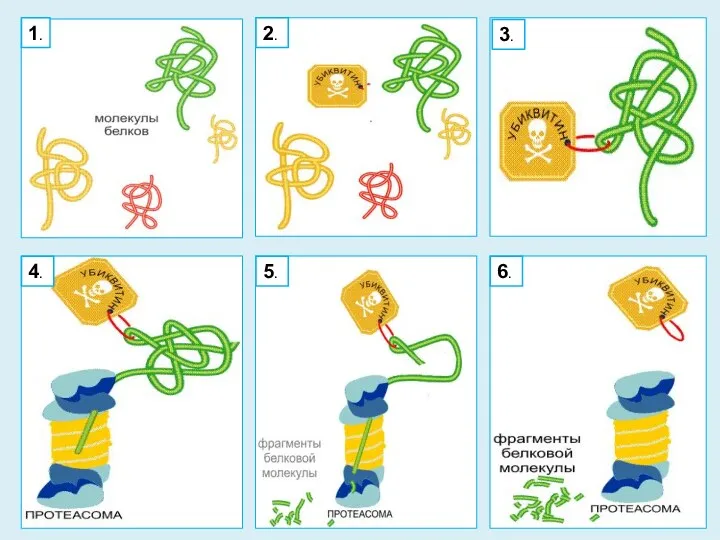
- 29. УБИКВИНТИН Убиквитин - играет решающую роль в процессе утилизации белков присоединяясь к тому белку, который нужно
- 30. 2. 1. 3. 4. 5. 6.
- 31. УБИКВИНТИН Убиквити́н (от англ. ubiquitous — вездесущий) консервативный белок эукариот, участвующий в регуляции процессов внутриклеточной деградации
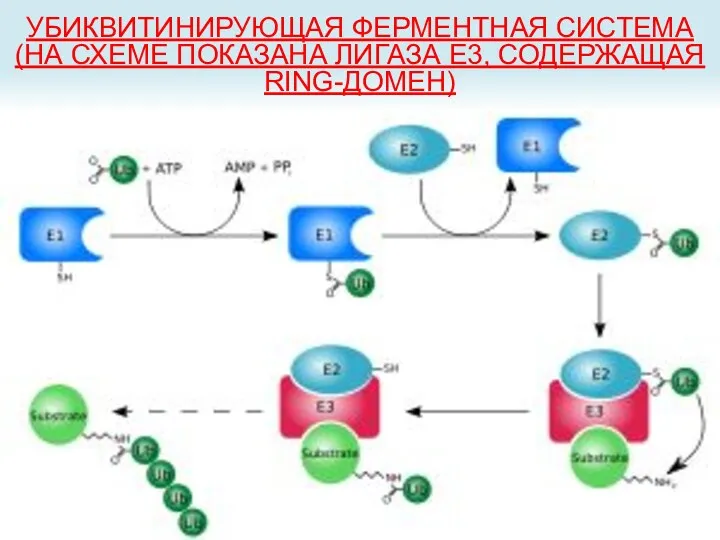
- 32. УБИКВИТИНИРУЮЩАЯ ФЕРМЕНТНАЯ СИСТЕМА (НА СХЕМЕ ПОКАЗАНА ЛИГАЗА E3, СОДЕРЖАЩАЯ RING-ДОМЕН)
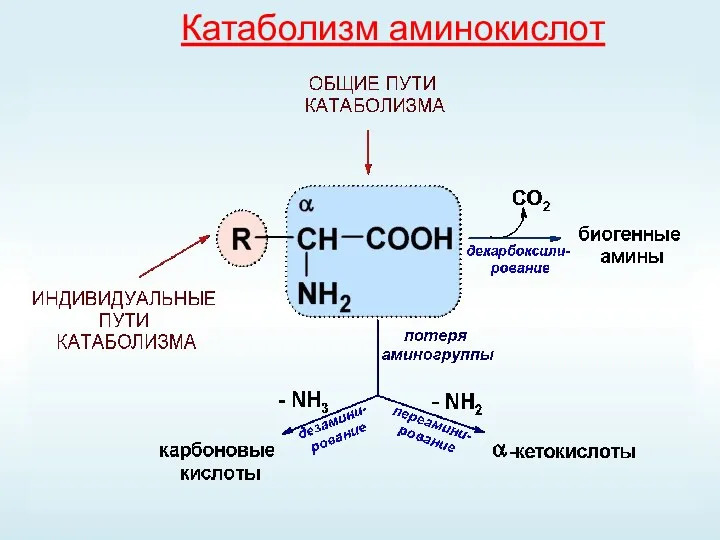
- 34. Катаболизм аминокислот
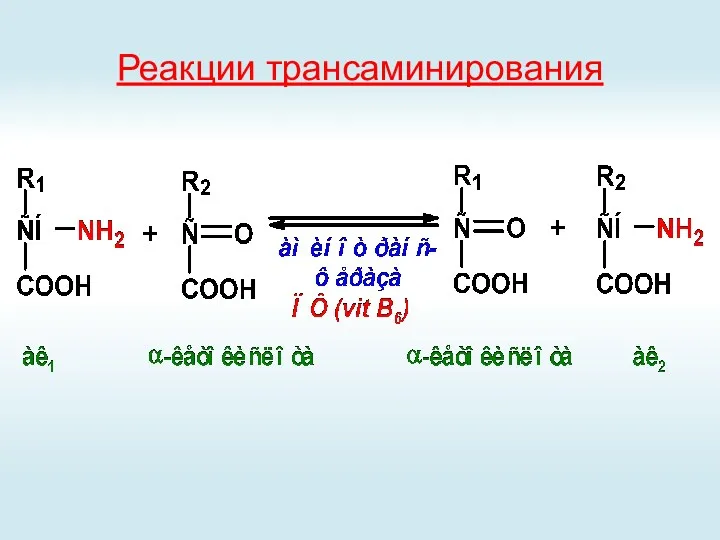
- 35. Реакции трансаминирования
- 36. Реакции трансаминирования
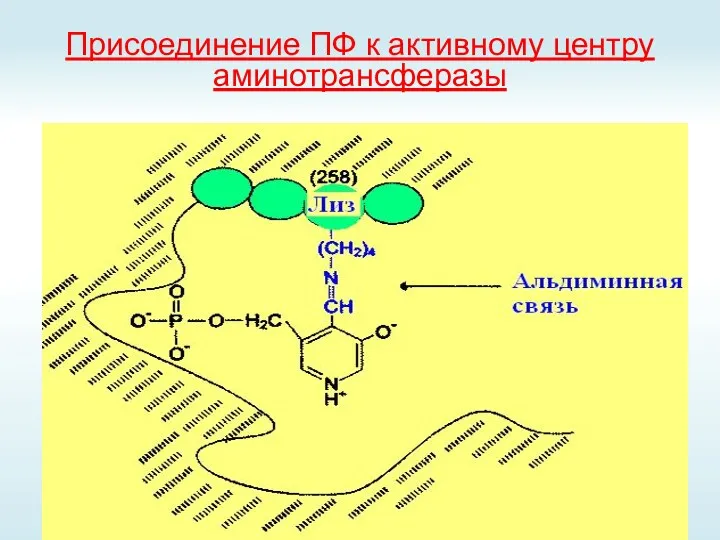
- 37. Присоединение ПФ к активному центру аминотрансферазы
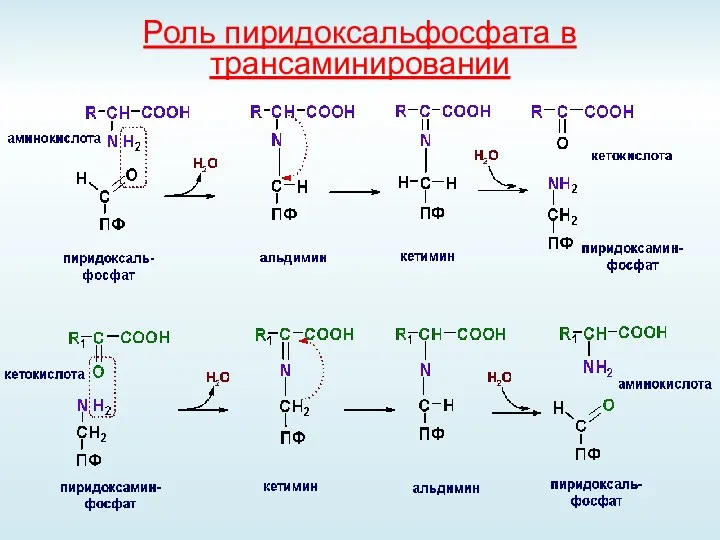
- 38. Роль пиридоксальфосфата в трансаминировании
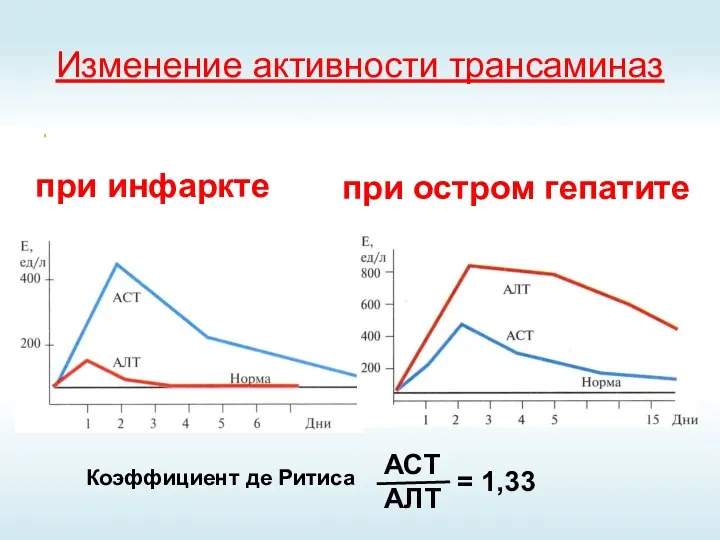
- 39. Изменение активности трансаминаз при инфаркте при остром гепатите Коэффициент де Ритиса АСТ АЛТ = 1,33
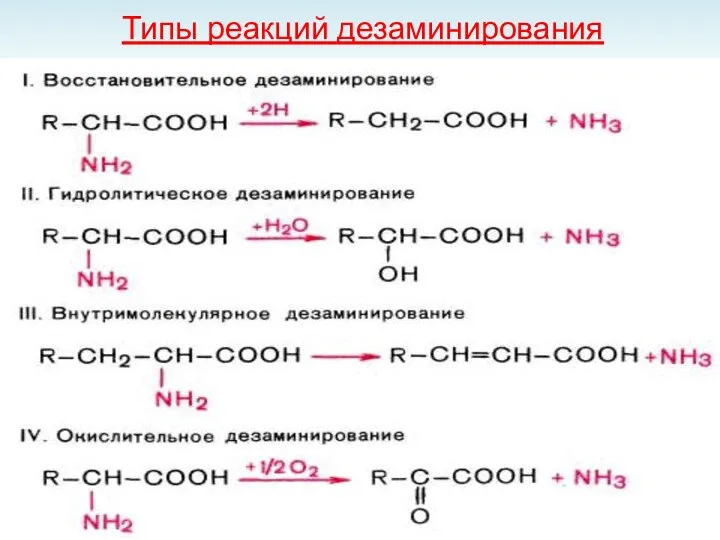
- 40. Типы реакций дезаминирования
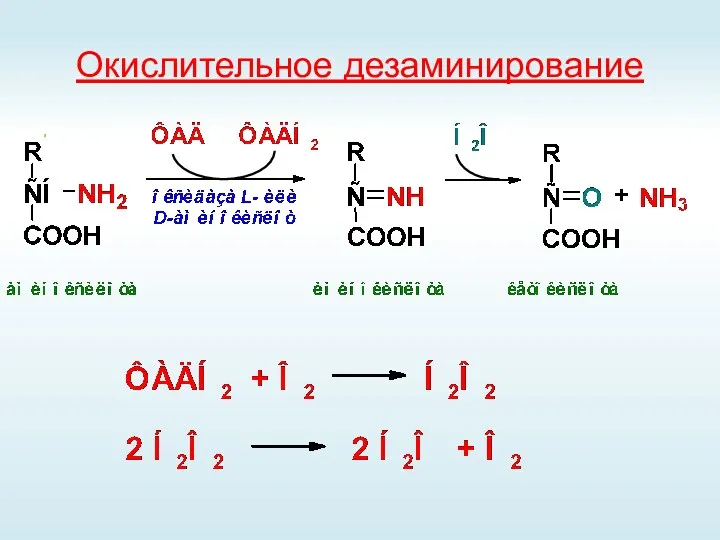
- 41. Окислительное дезаминирование
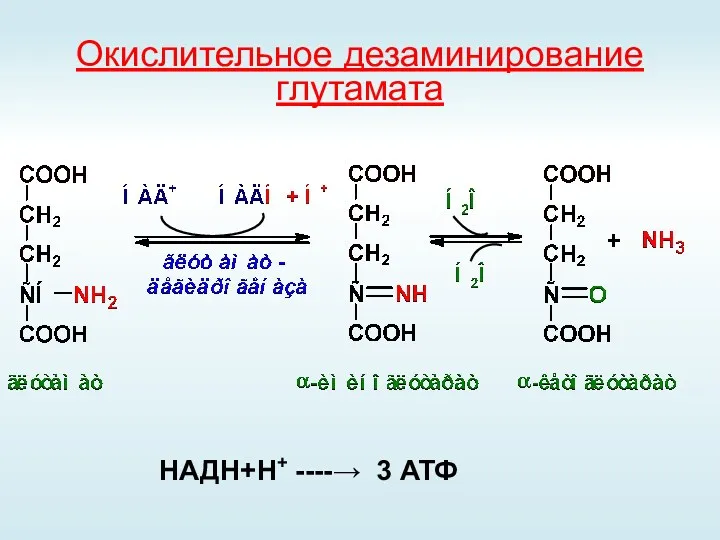
- 42. Окислительное дезаминирование глутамата НАДН+Н+ ----→ 3 АТФ
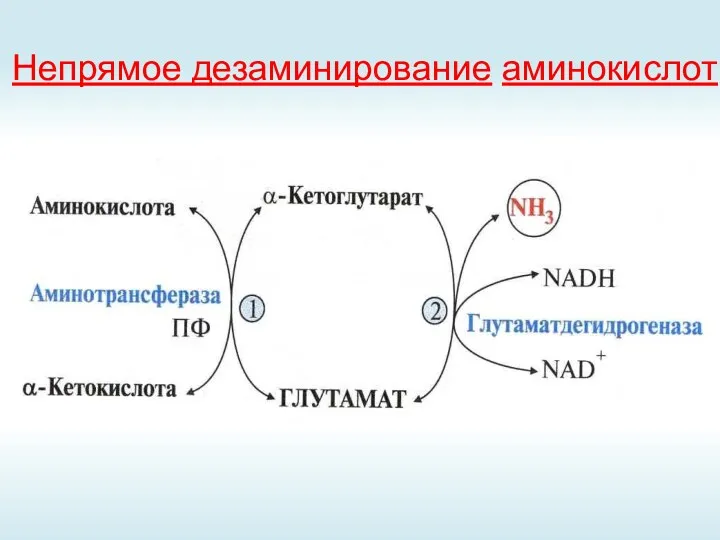
- 43. Непрямое дезаминирование аминокислот
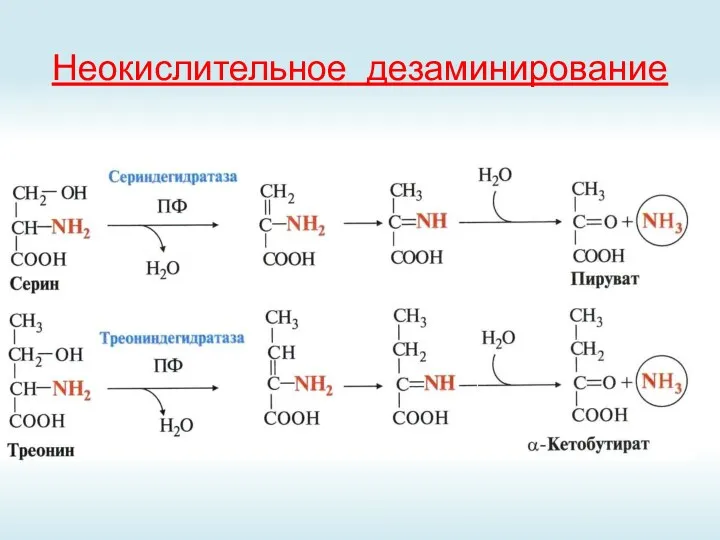
- 44. Неокислительное дезаминирование
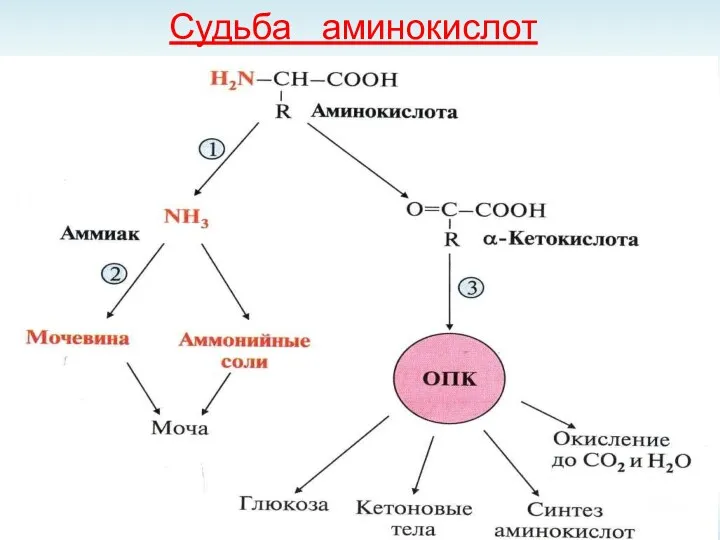
- 45. Судьба аминокислот
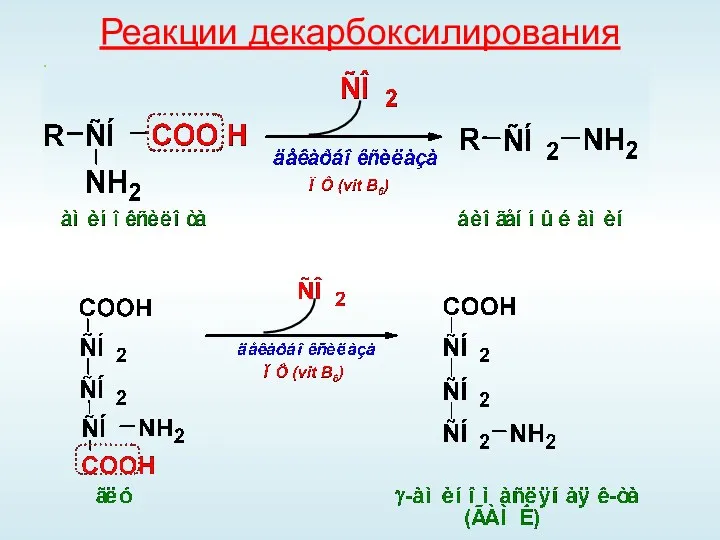
- 46. Реакции декарбоксилирования
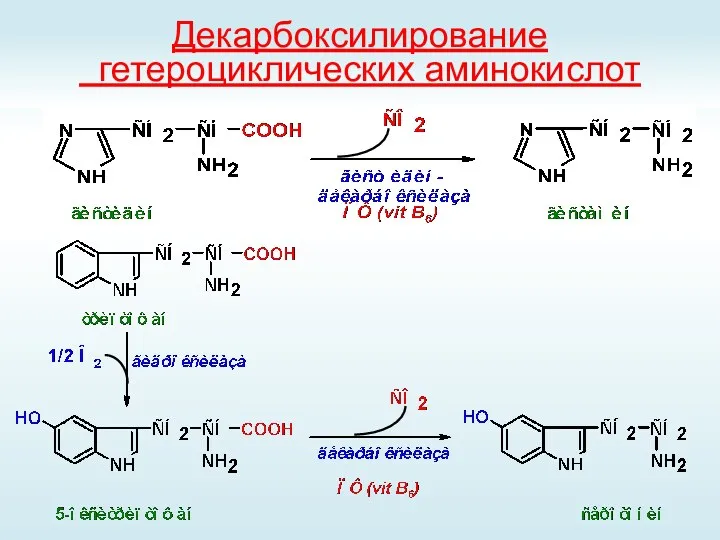
- 47. Декарбоксилирование гетероциклических аминокислот
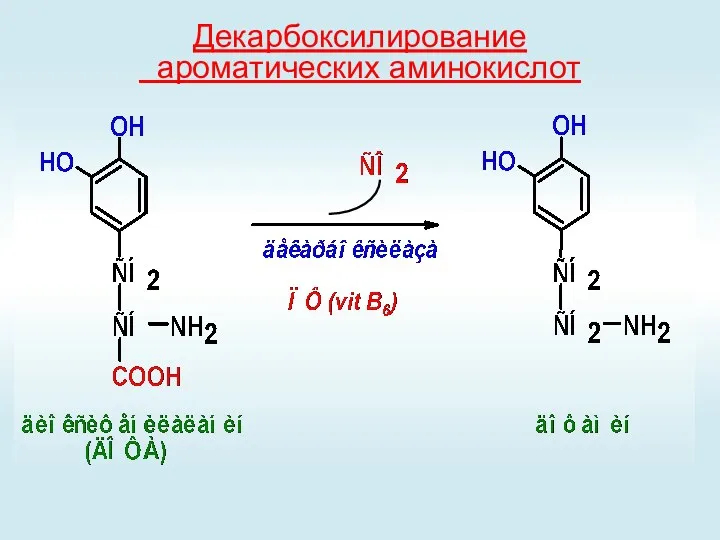
- 48. Декарбоксилирование ароматических аминокислот
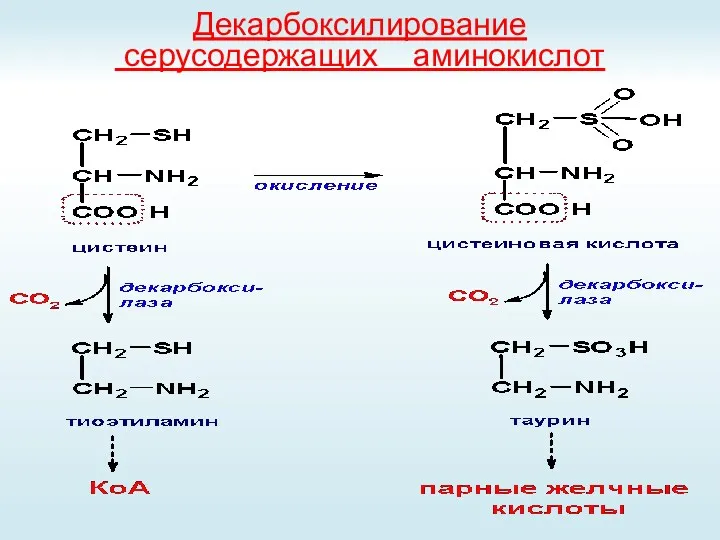
- 49. Декарбоксилирование серусодержащих аминокислот
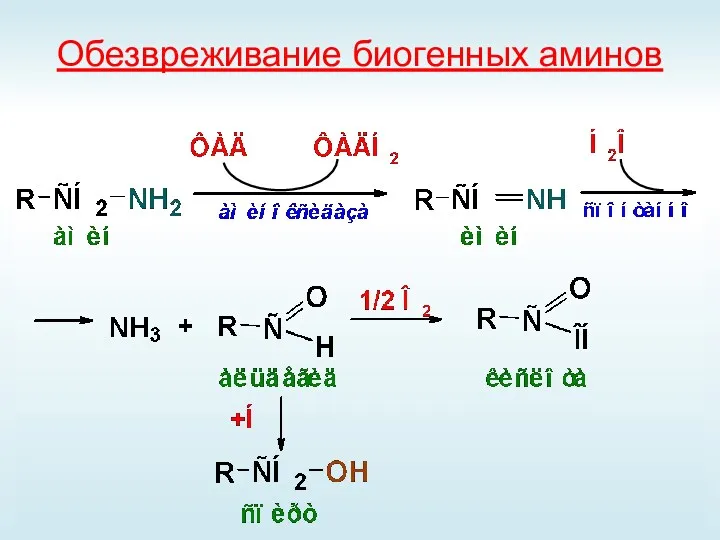
- 50. Обезвреживание биогенных аминов
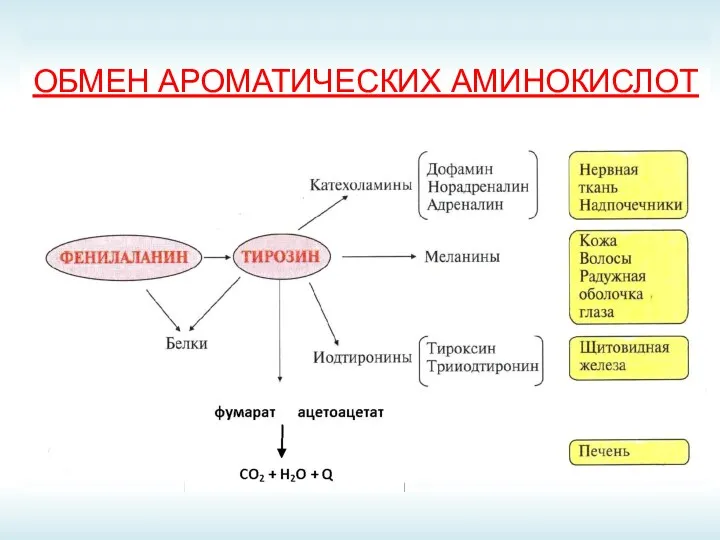
- 51. ОБМЕН АРОМАТИЧЕСКИХ АМИНОКИСЛОТ
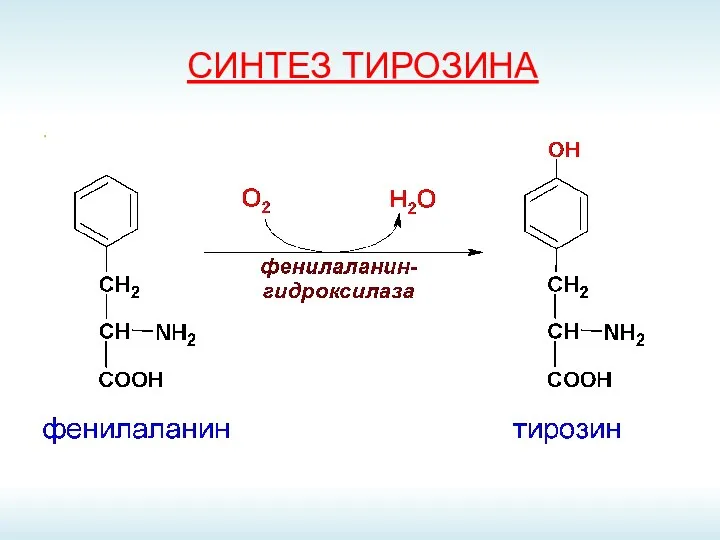
- 52. СИНТЕЗ ТИРОЗИНА
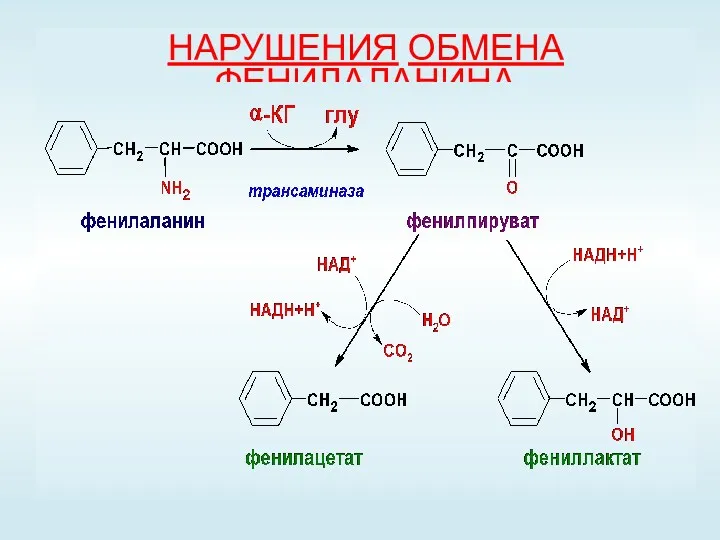
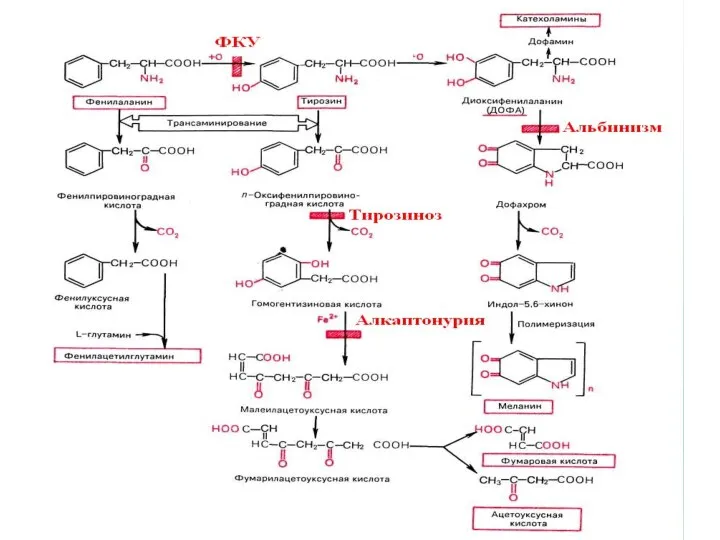
- 53. НАРУШЕНИЯ ОБМЕНА ФЕНИЛАЛАНИНА
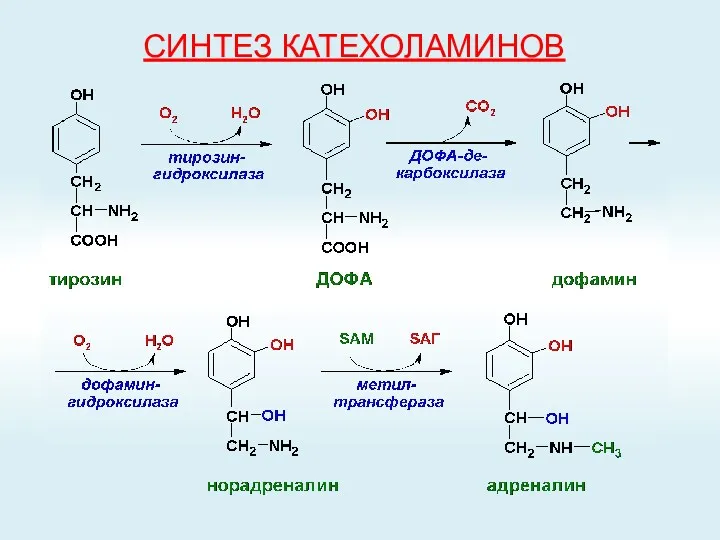
- 54. СИНТЕЗ КАТЕХОЛАМИНОВ
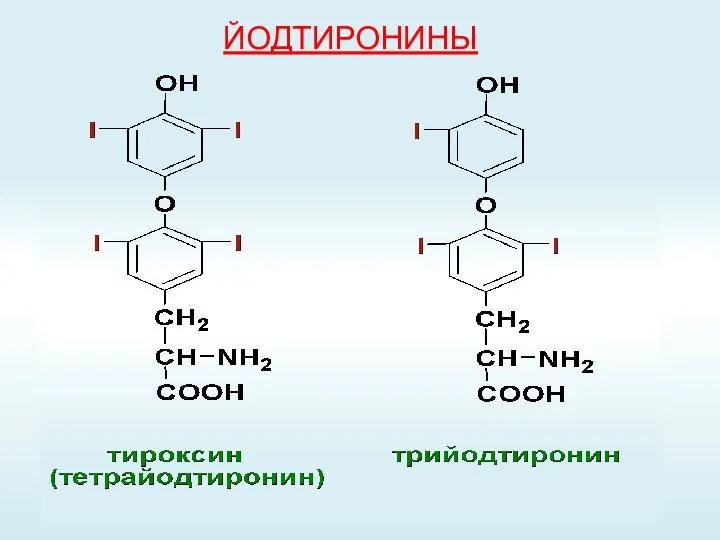
- 55. ЙОДТИРОНИНЫ
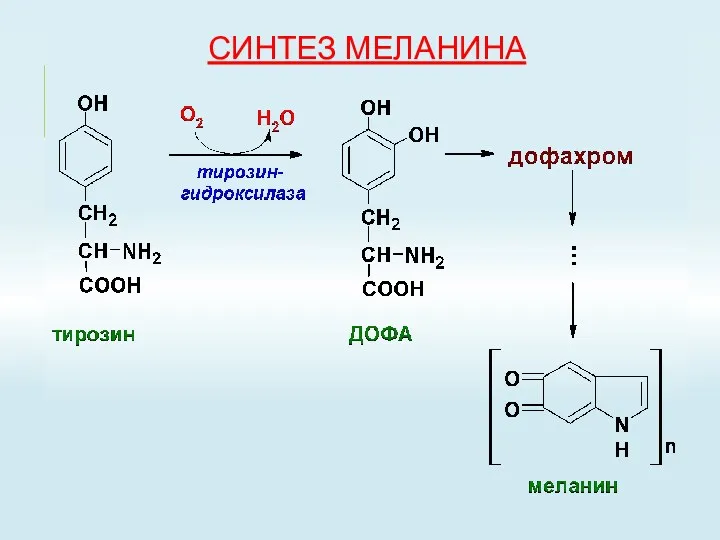
- 56. СИНТЕЗ МЕЛАНИНА
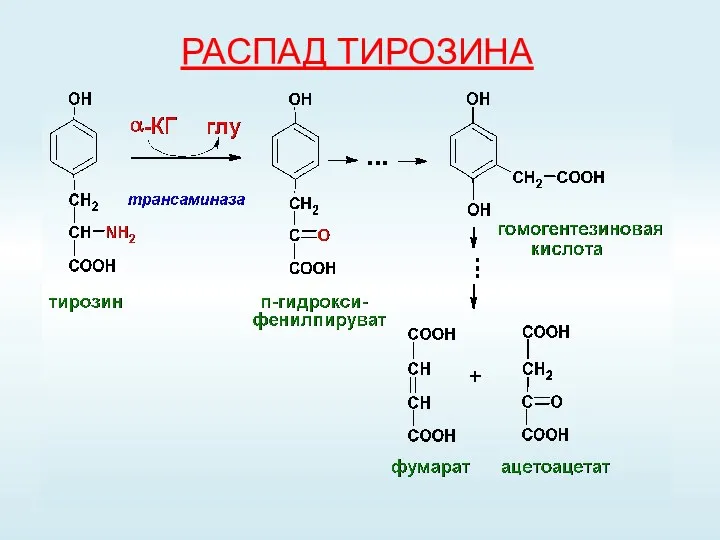
- 57. РАСПАД ТИРОЗИНА
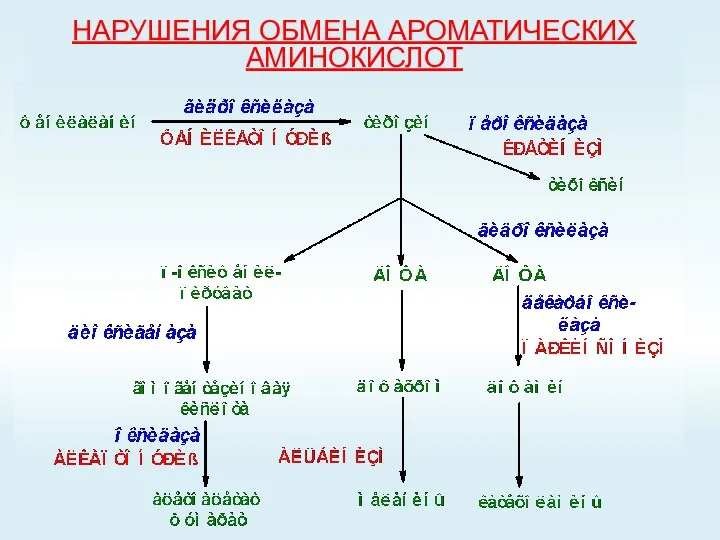
- 58. НАРУШЕНИЯ ОБМЕНА АРОМАТИЧЕСКИХ АМИНОКИСЛОТ
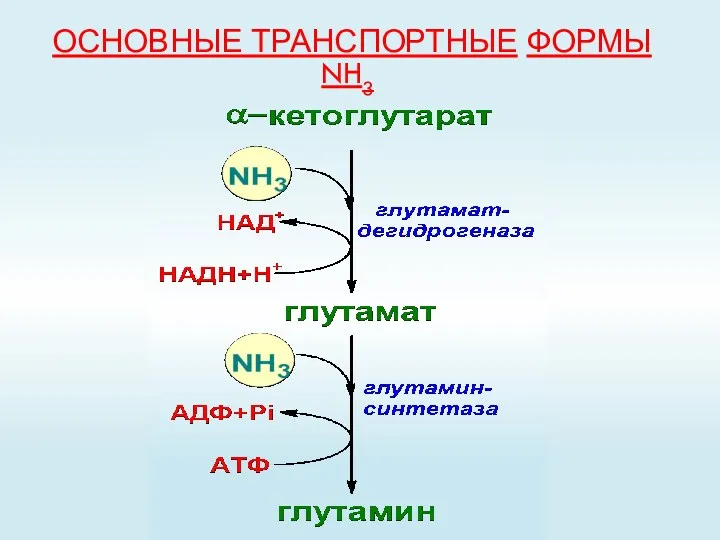
- 60. ОСНОВНЫЕ ТРАНСПОРТНЫЕ ФОРМЫ NH3
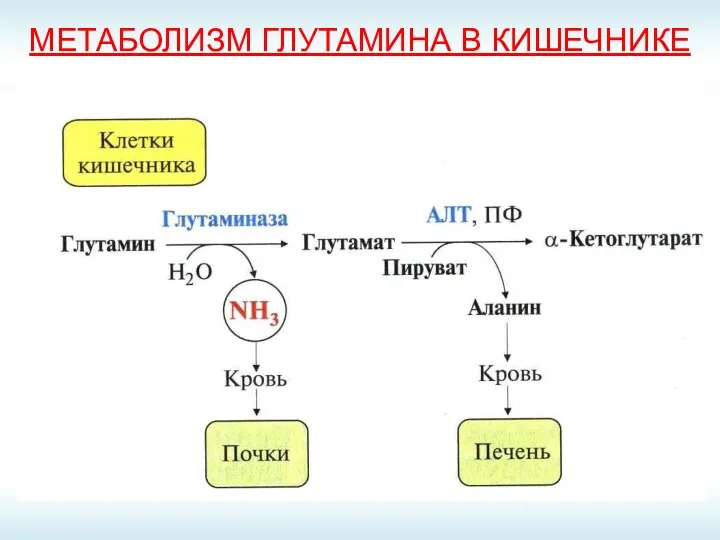
- 61. МЕТАБОЛИЗМ ГЛУТАМИНА В КИШЕЧНИКЕ
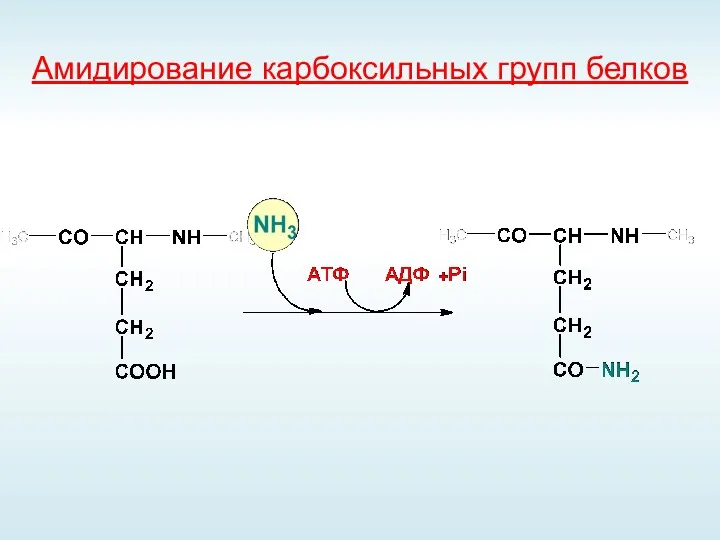
- 62. Амидирование карбоксильных групп белков
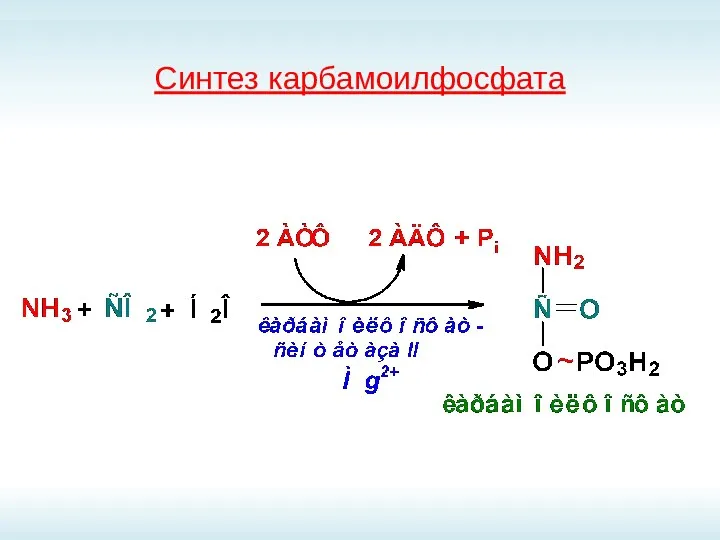
- 63. Синтез карбамоилфосфата
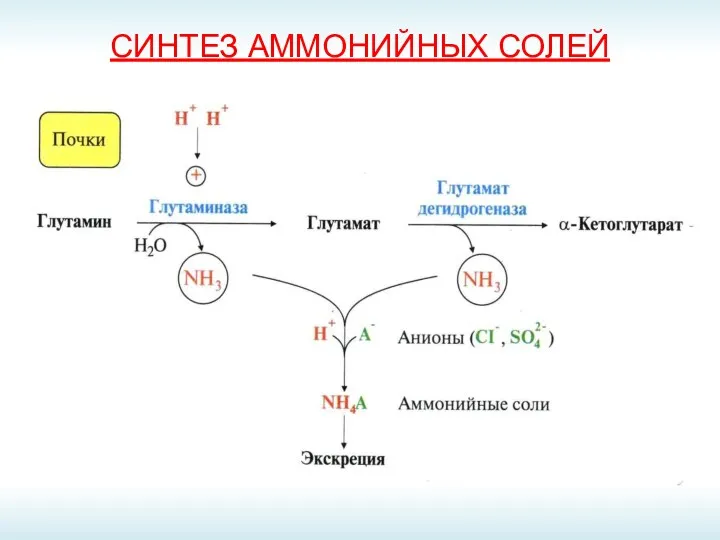
- 64. СИНТЕЗ АММОНИЙНЫХ СОЛЕЙ
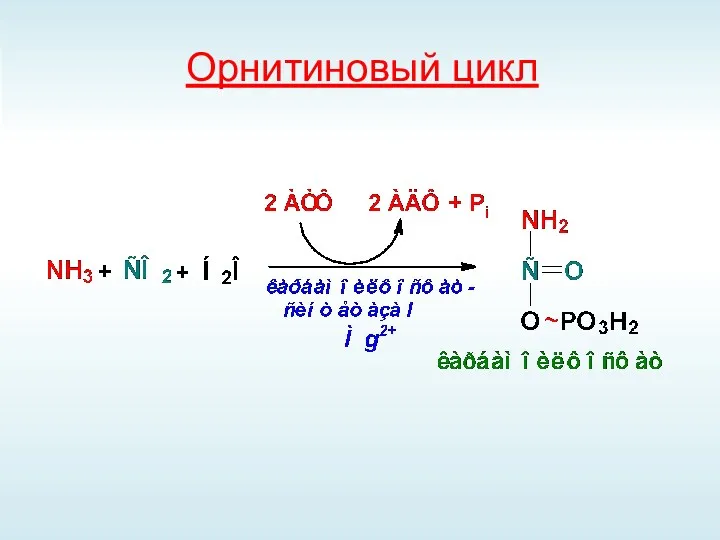
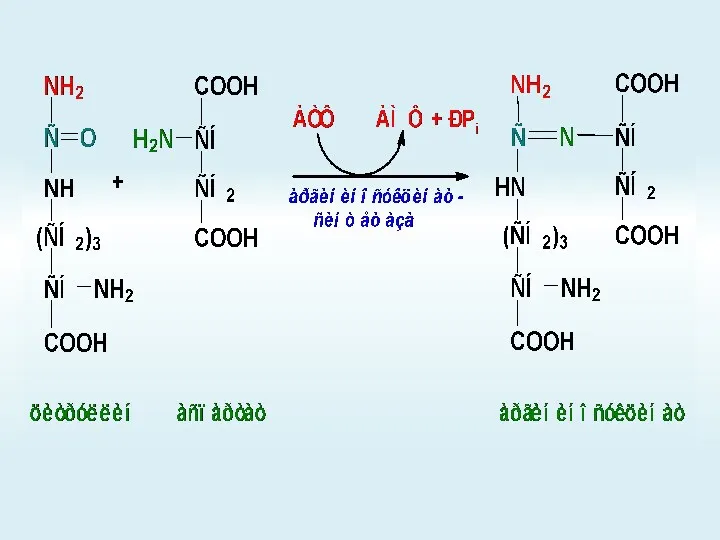
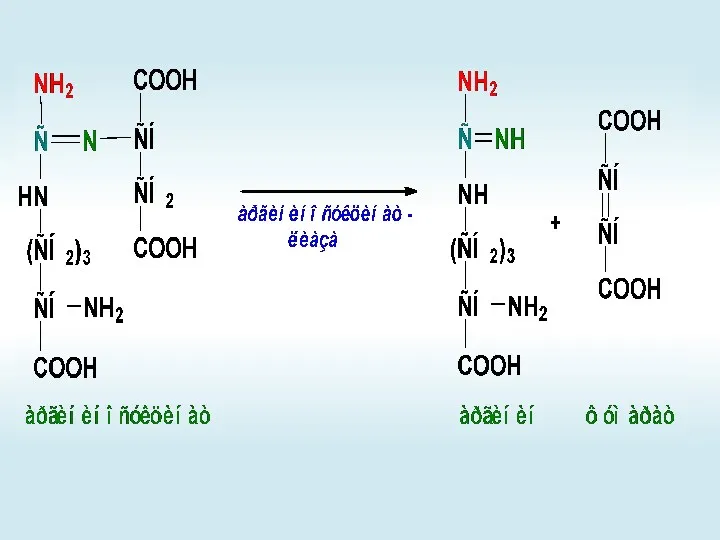
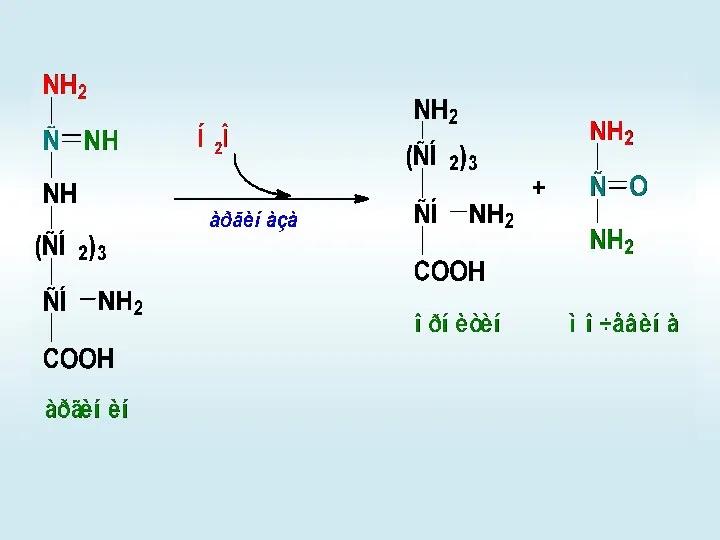
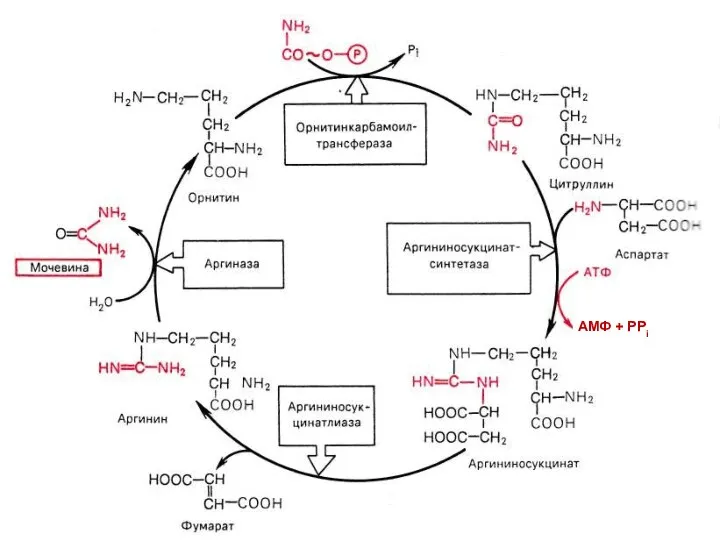
- 65. Орнитиновый цикл
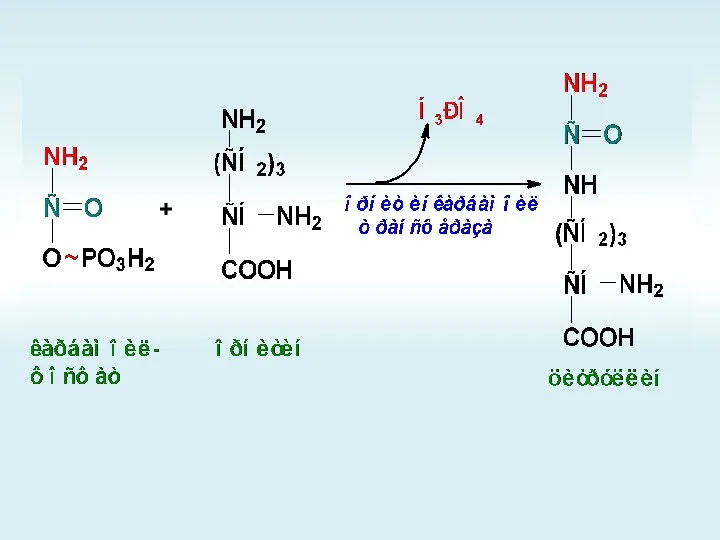
- 66. +
- 70. АМФ + РРi
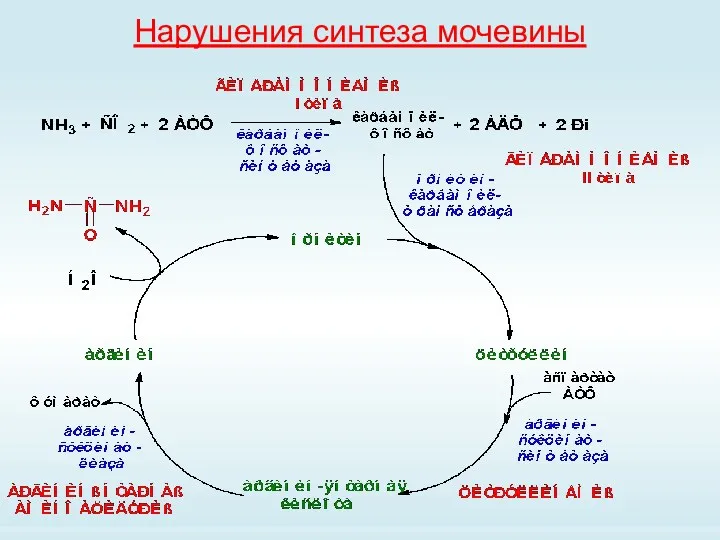
- 71. Нарушения синтеза мочевины
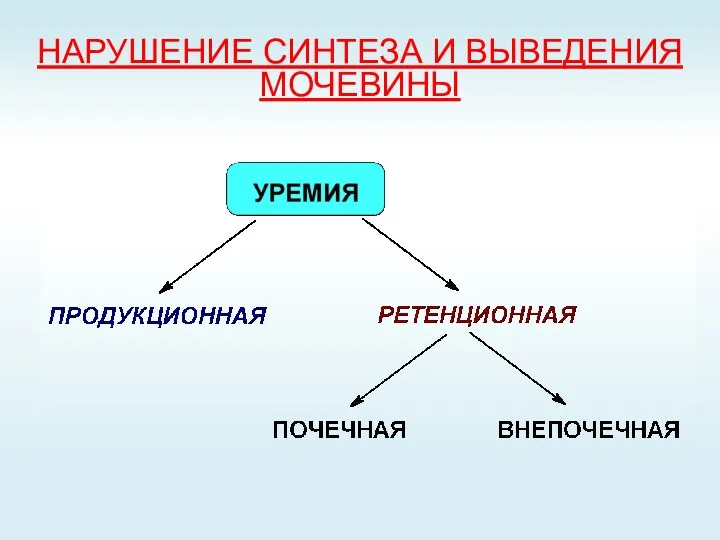
- 72. НАРУШЕНИЕ СИНТЕЗА И ВЫВЕДЕНИЯ МОЧЕВИНЫ
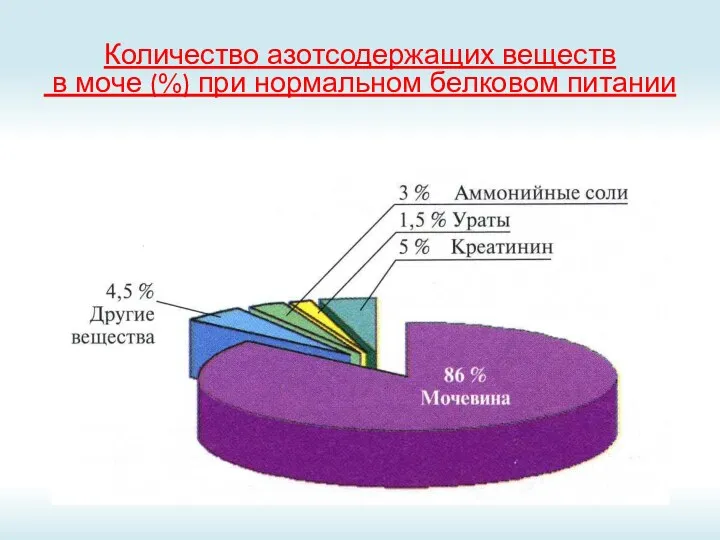
- 73. Количество азотсодержащих веществ в моче (%) при нормальном белковом питании
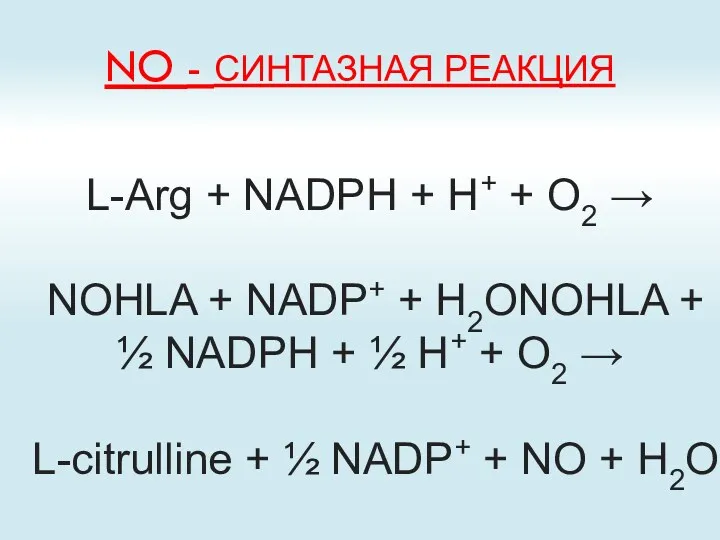
- 74. NO - СИНТАЗНАЯ РЕАКЦИЯ L-Arg + NADPH + H+ + O2 → NOHLA + NADP+ +
- 75. СИНТАЗЫ ОКСИДА АЗОТА NO-синтазы — группа ферментов, катализирующих образование оксида азота и цитруллина из аргинина, кислорода
- 77. Скачать презентацию









 Липиды. Биосинтез
Липиды. Биосинтез Реши кроссворд
Реши кроссворд Мінеральні речовини в організмі тварин
Мінеральні речовини в організмі тварин Вкусы и запахи
Вкусы и запахи Газообмен в лёгких и тканях
Газообмен в лёгких и тканях Люпин белый. Особенности биологии и технологии возделывания
Люпин белый. Особенности биологии и технологии возделывания Лесная фитопатология. Ржавчина хвои. Болезни листьев. Занятие 6
Лесная фитопатология. Ржавчина хвои. Болезни листьев. Занятие 6 ДНҚ-ның метилденуі
ДНҚ-ның метилденуі Макроэволюция. Механизмы возникновения биоразнообразия
Макроэволюция. Механизмы возникновения биоразнообразия Половое размножение.
Половое размножение. Біоінформатика. Банки данних. (Тема 2)
Біоінформатика. Банки данних. (Тема 2) Популяция. Основные характеристики популяций
Популяция. Основные характеристики популяций Биологическое оружие
Биологическое оружие Введение в спланхнологию. Системы внутренних органов
Введение в спланхнологию. Системы внутренних органов Человек и говорящие обезьяны: возможность диалога
Человек и говорящие обезьяны: возможность диалога Тип молюски. Клас головоногі
Тип молюски. Клас головоногі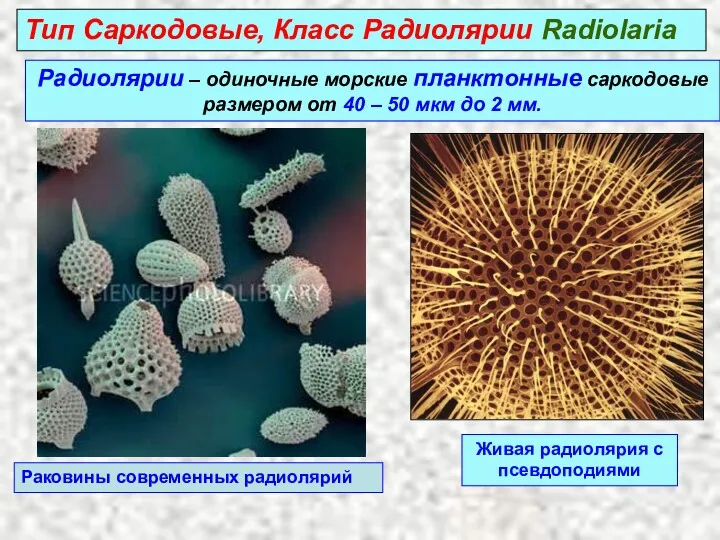 Радиолярии – одиночные морские планктонные саркодовые размером от 40 – 50 мкм до 2 мм
Радиолярии – одиночные морские планктонные саркодовые размером от 40 – 50 мкм до 2 мм Бактерії
Бактерії Лист. Типы листьев. Сложные листья. Жилкование
Лист. Типы листьев. Сложные листья. Жилкование Видоизменение побегов. Клубень
Видоизменение побегов. Клубень Энергетический обмен - катаболизм
Энергетический обмен - катаболизм Общие признаки для всех живых организмов
Общие признаки для всех живых организмов Цитология. Клетка как биологическая система
Цитология. Клетка как биологическая система Развитие человека
Развитие человека Растительные ткани
Растительные ткани Всемирный день защиты животных
Всемирный день защиты животных Происхождение человека и становление общества
Происхождение человека и становление общества Отдел покрытосеменные (Мagnoliophyta)
Отдел покрытосеменные (Мagnoliophyta)