Онкогены. Активирующие мутации в онкогенах. Вирусный канцерогенез (HPV, вирус Эпштейн-Барр). Гены-супрессоры презентация
Содержание
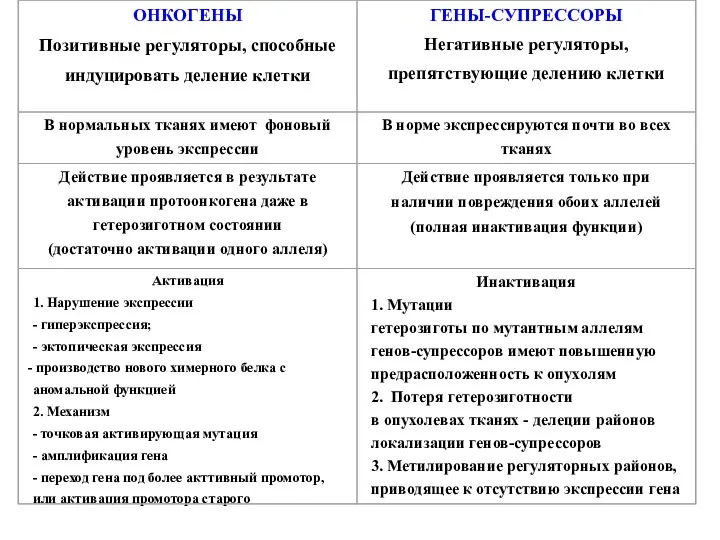
- 2. Нестабильность генома является отличительной характеристикой опухолевой клетки Генетическая нестабильность Наличие изменений в хромосомах, как числа хромосом
- 3. Одна опухоль – множество мутаций Секвенирование кодирующих частей 13000 генов в 11 образцах рака груди, 11
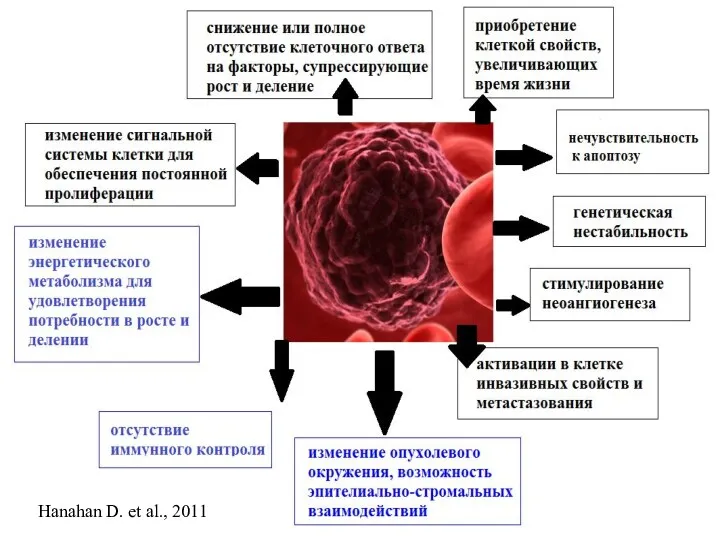
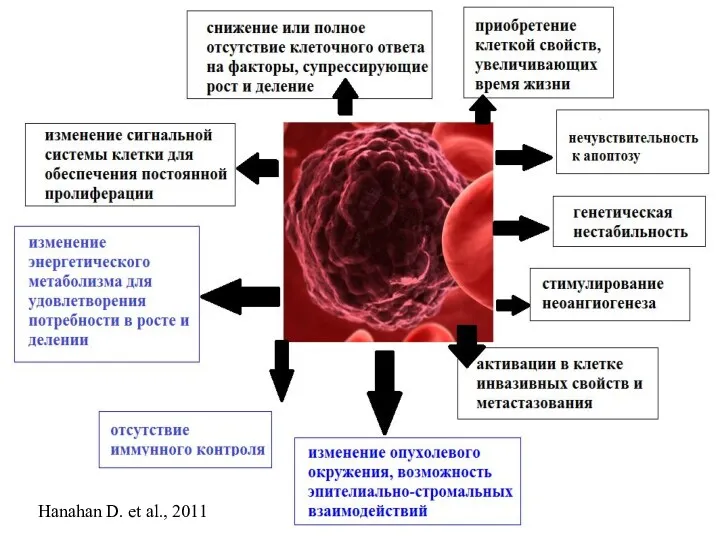
- 4. Hanahan D. et al., 2011
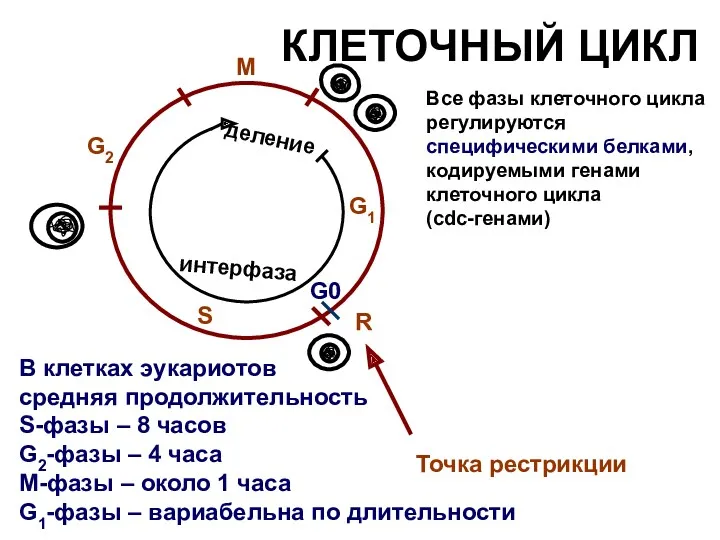
- 5. КЛЕТОЧНЫЙ ЦИКЛ В клетках эукариотов средняя продолжительность S-фазы – 8 часов G2-фазы – 4 часа М-фазы
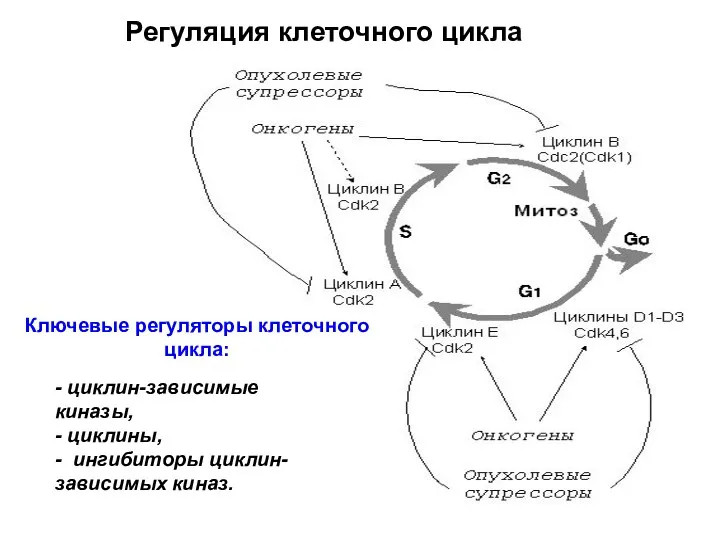
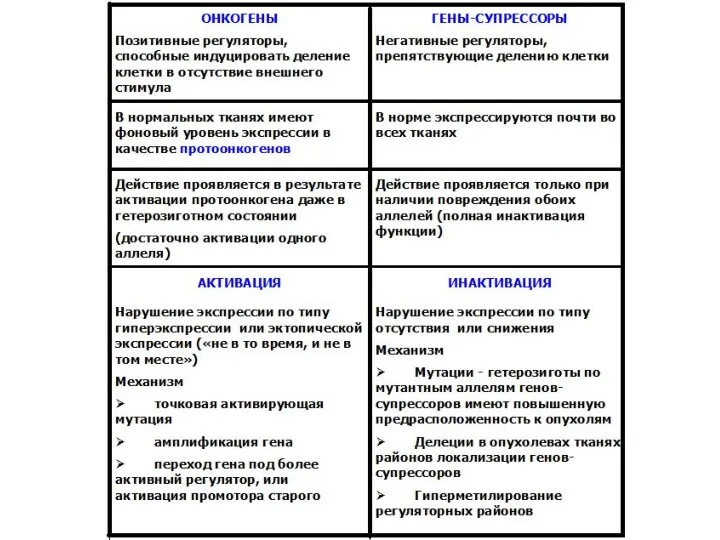
- 6. Регуляция клеточного цикла Ключевые регуляторы клеточного цикла: - циклин-зависимые киназы, - циклины, - ингибиторы циклин-зависимых киназ.
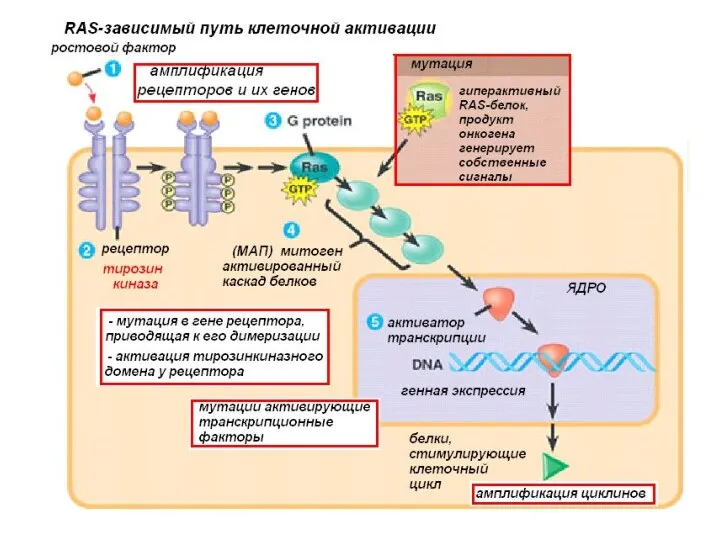
- 8. Онкогены вирусные онкогены - Вирус папилломы – рак шейки матки - Вирус Эпштейн -Барр – рак
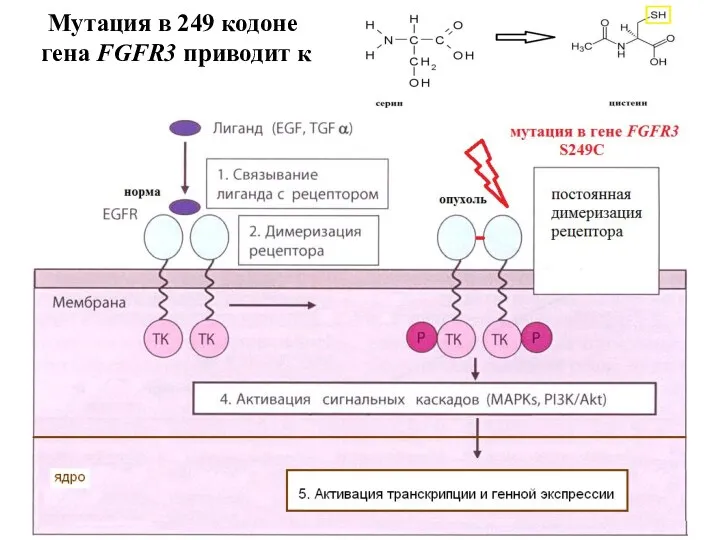
- 11. Мутация в 249 кодоне гена FGFR3 приводит к
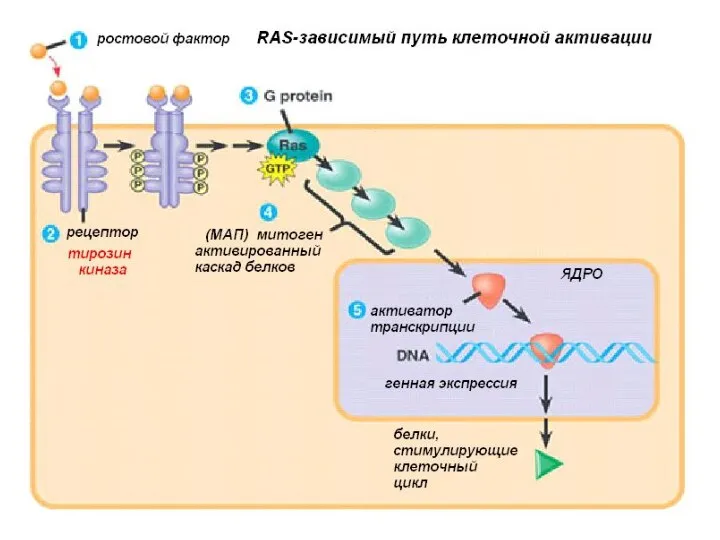
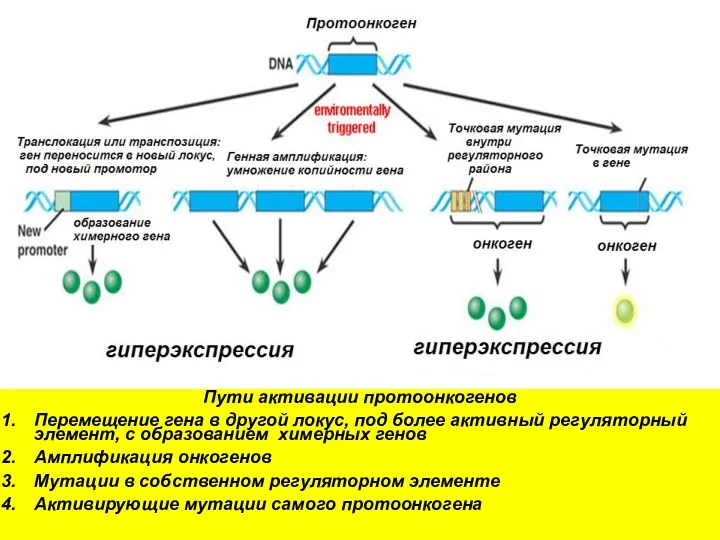
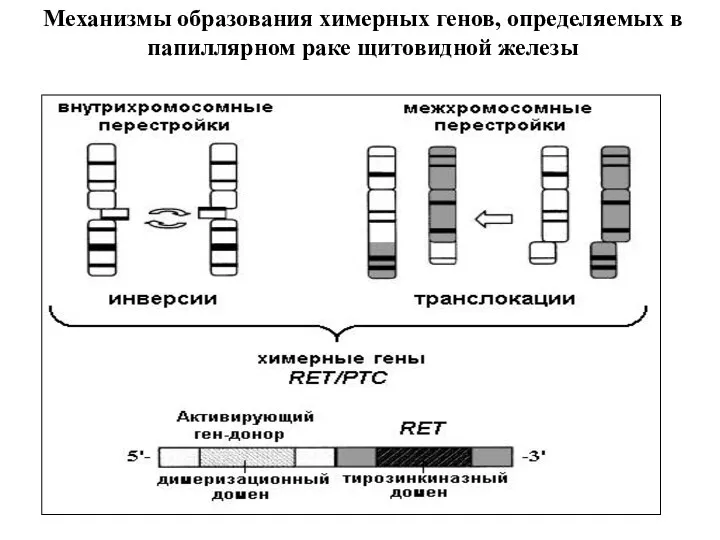
- 12. Пути активации протоонкогенов Перемещение гена в другой локус, под более активный регуляторный элемент, с образованием химерных
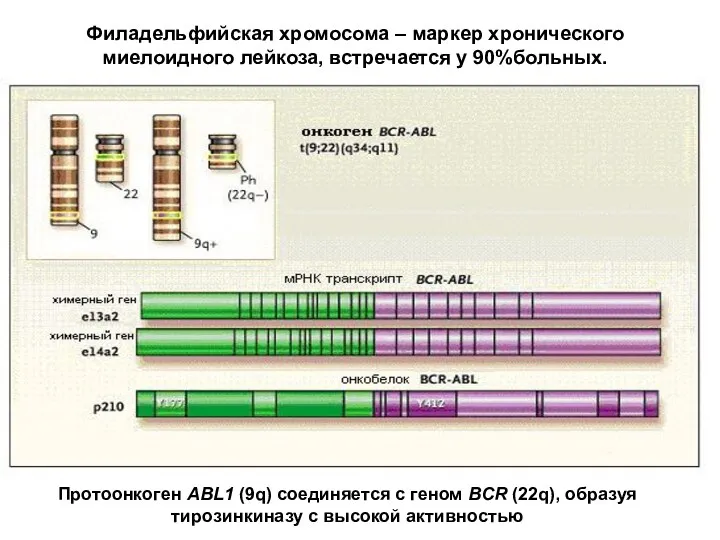
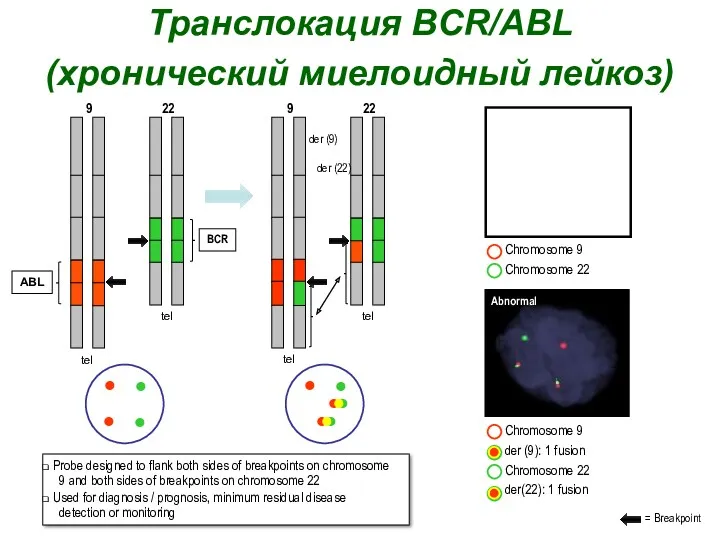
- 13. Филадельфийская хромосома – маркер хронического миелоидного лейкоза, встречается у 90%больных. Протоонкоген ABL1 (9q) соединяется с геном
- 14. Транслокация BCR/ABL (хронический миелоидный лейкоз) ABL 9 22 BCR tel tel 9 22 tel tel der
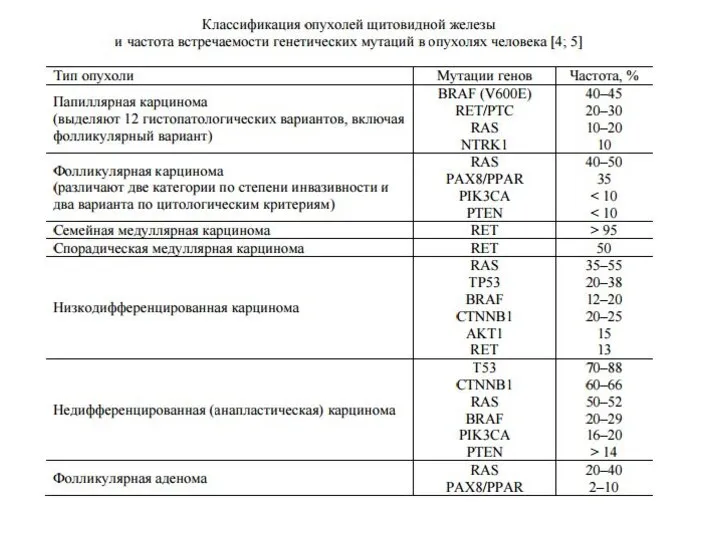
- 15. Злокачественные опухоли ЩЖ Папиллярная тиреокарцинома ~ 70-80% - относительно благоприятная форма рака - возникает в результате
- 16. МЭН 2А (Синдром Сиппла) Синдром характеризуется наличием медуллярной карциномы щитовидной железы, феохромоцитомы (единичной, билатеральной или множественной)
- 17. При синдроме МЭН - 2Б, наряду с медуллярной карциномой щитовидной железы и феохромоцитомой наблюдаются множественные ганлионейромы
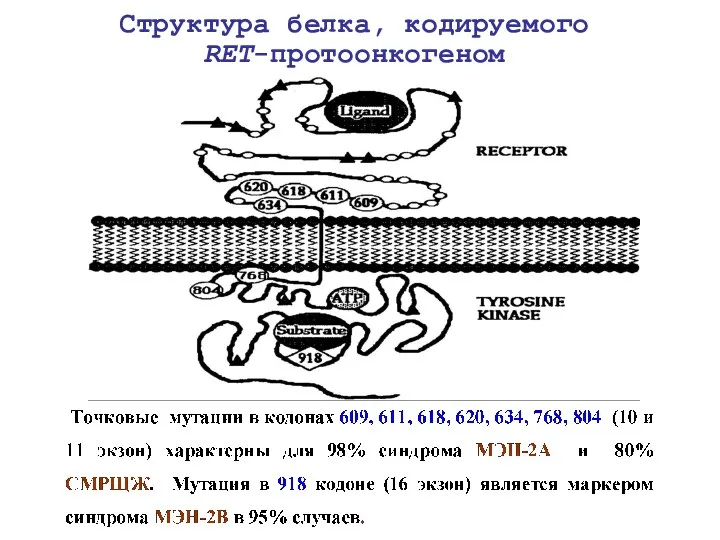
- 19. Структура белка, кодируемого RET-протоонкогеном
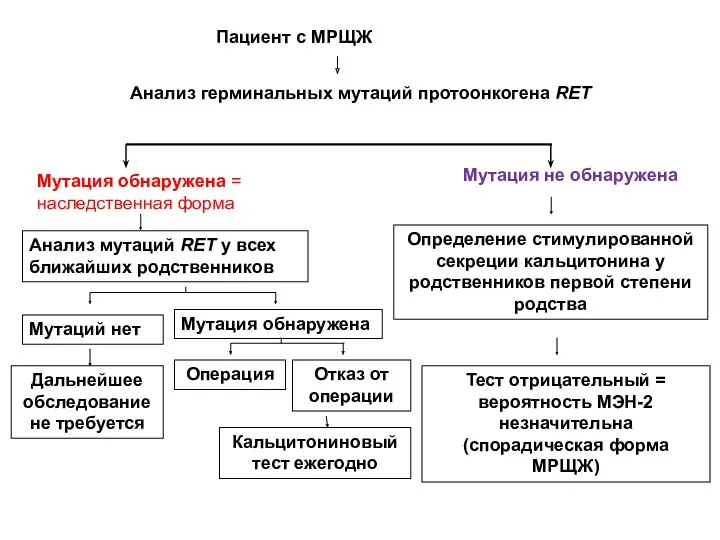
- 20. Пациент с МРЩЖ Анализ герминальных мутаций протоонкогена RET Мутация обнаружена = наследственная форма Мутация не обнаружена
- 21. Механизмы образования химерных генов, определяемых в папиллярном раке щитовидной железы
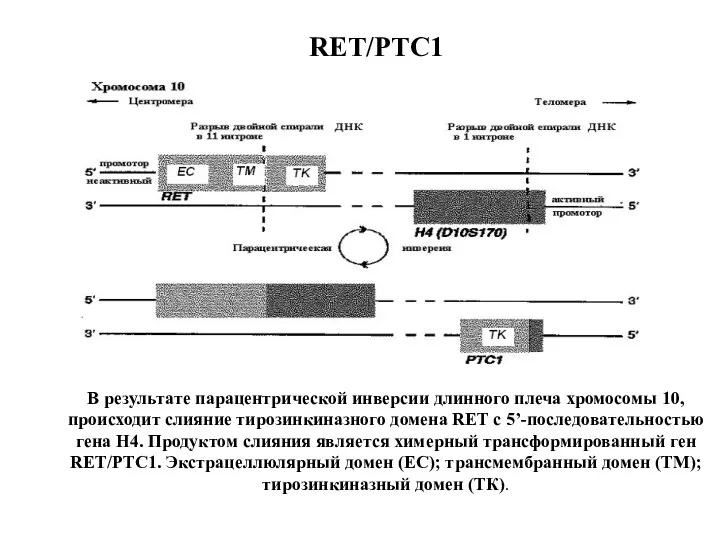
- 22. RET/PTC1 В результате парацентрической инверсии длинного плеча хромосомы 10, происходит слияние тирозинкиназного домена RET с 5’-последовательностью
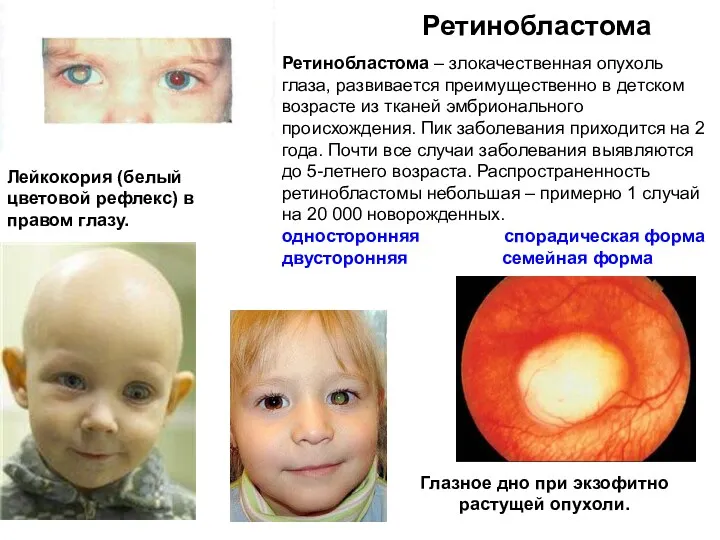
- 24. Ретинобластома Глазное дно при экзофитно растущей опухоли. Лейкокория (белый цветовой рефлекс) в правом глазу. Ретинобластома –
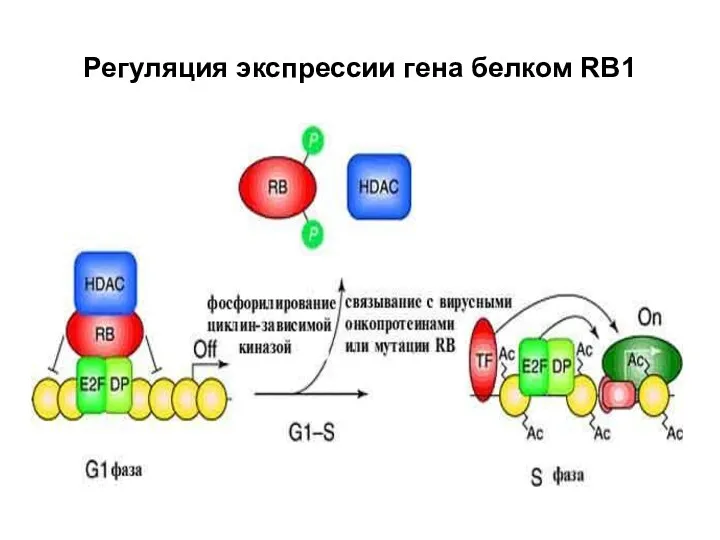
- 25. Регуляция экспрессии гена белком RB1
- 26. Ген RB1 расположен в проксимальном отделе длинного плеча хромосомы 13q14.1, и, занимает 180 т.п.н. геномной ДНК.
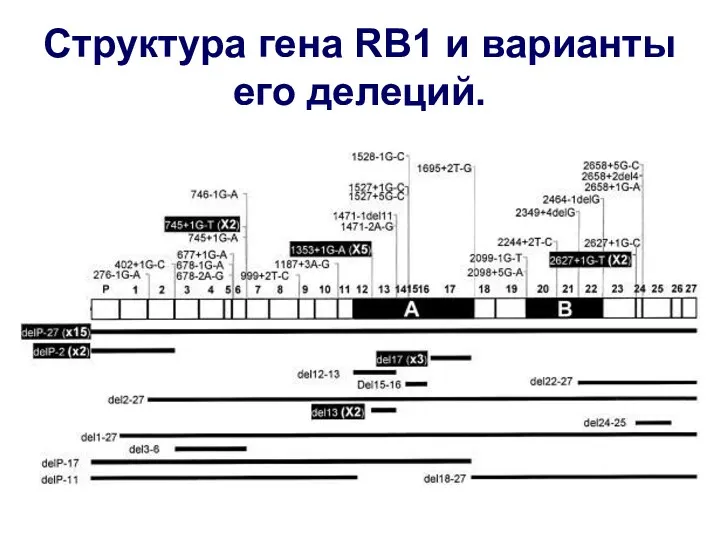
- 27. Структура гена RB1 и варианты его делеций.
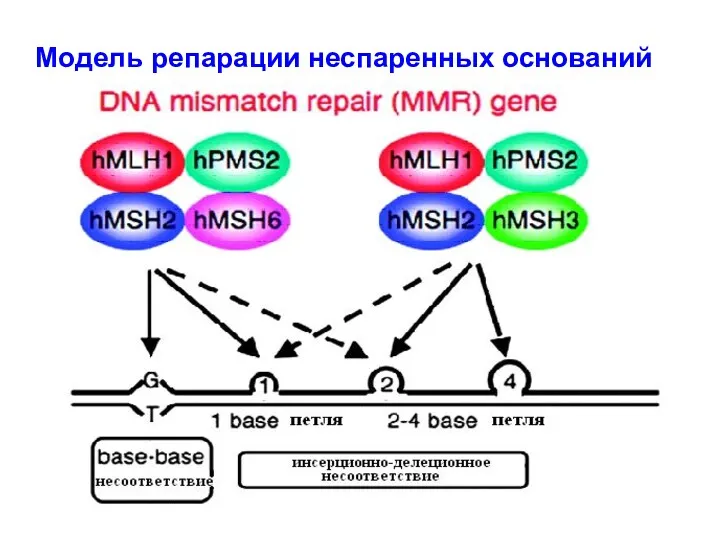
- 29. Модель репарации неспаренных оснований
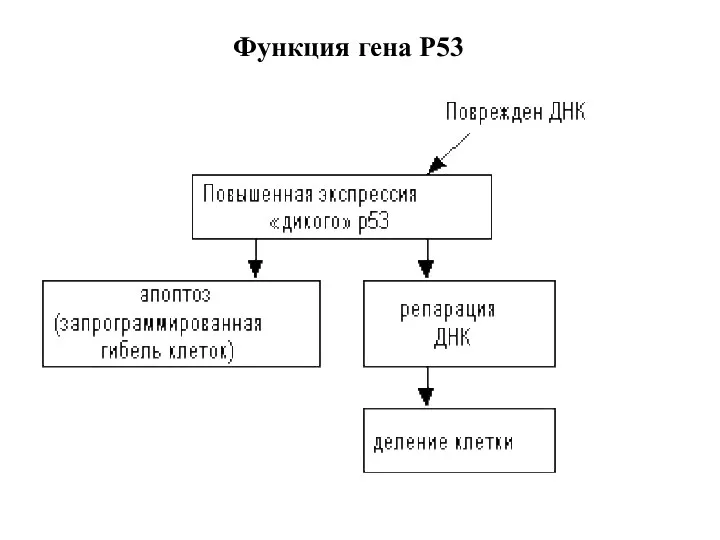
- 30. Функция гена Р53
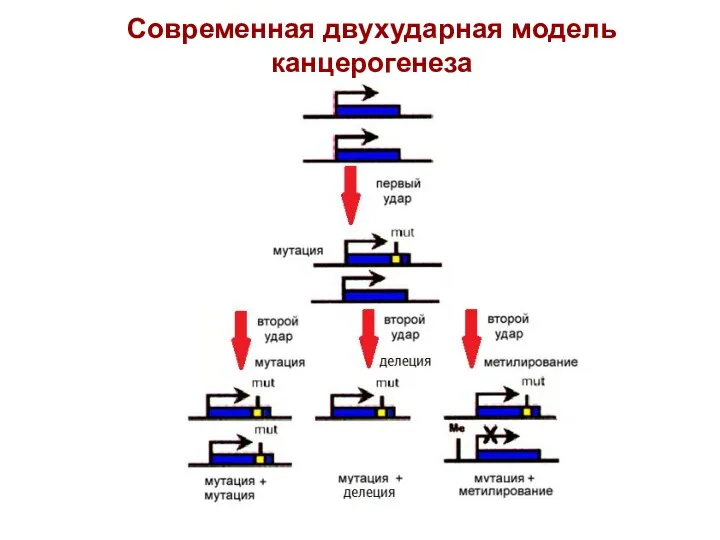
- 31. Современная двухударная модель канцерогенеза
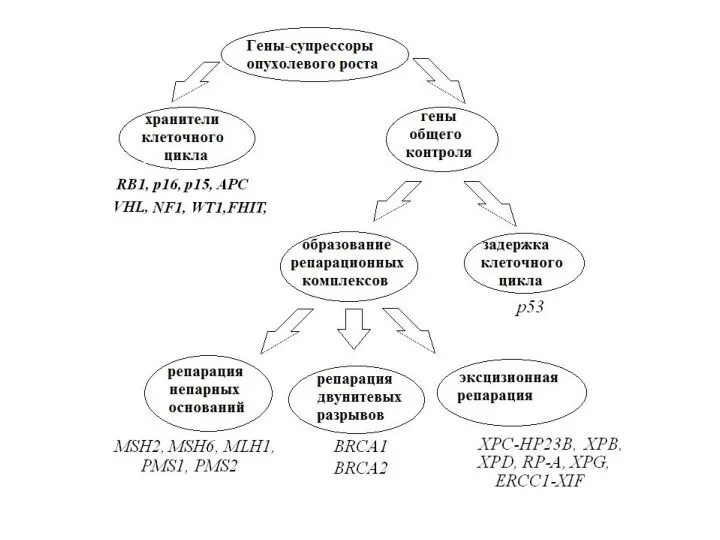
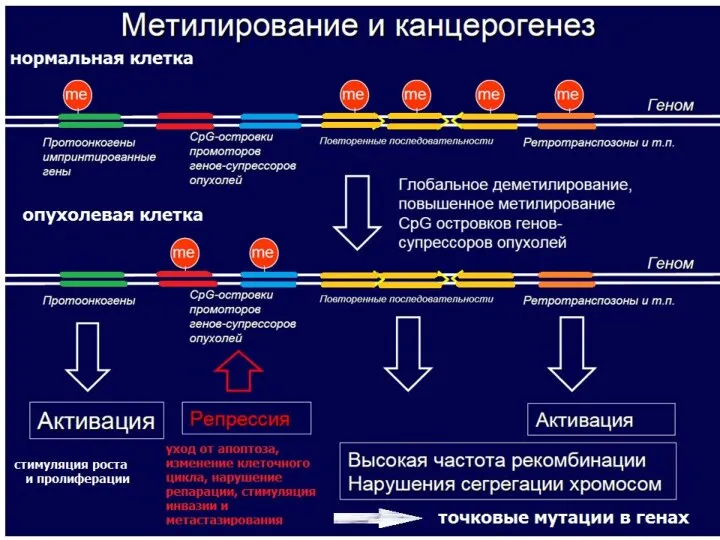
- 32. Пути инактивации генов- супрессоров опухолевого роста 1) аллельные делеции районов локализации генов-супресоров 2) аномальное метилирование промоторных
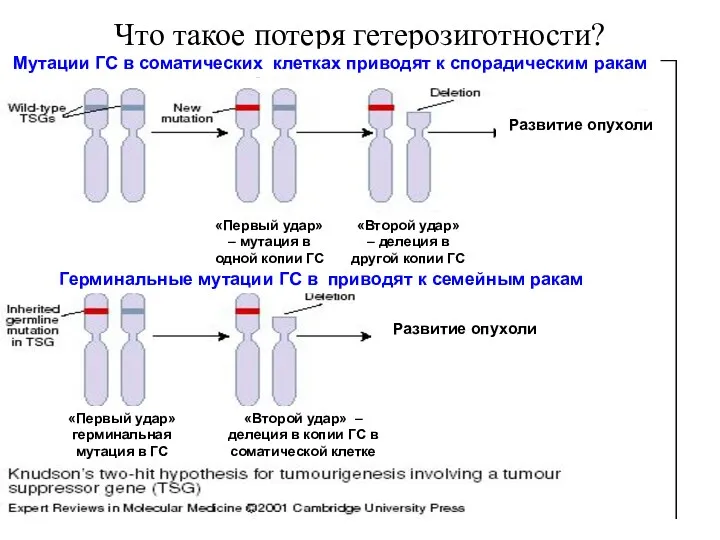
- 33. Что такое потеря гетерозиготности? Развитие опухоли Развитие опухоли Мутации ГС в соматических клетках приводят к спорадическим
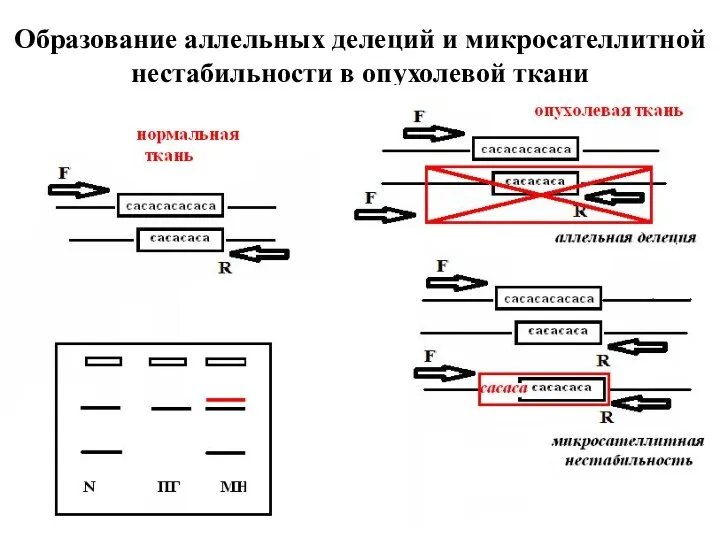
- 34. Образование аллельных делеций и микросателлитной нестабильности в опухолевой ткани
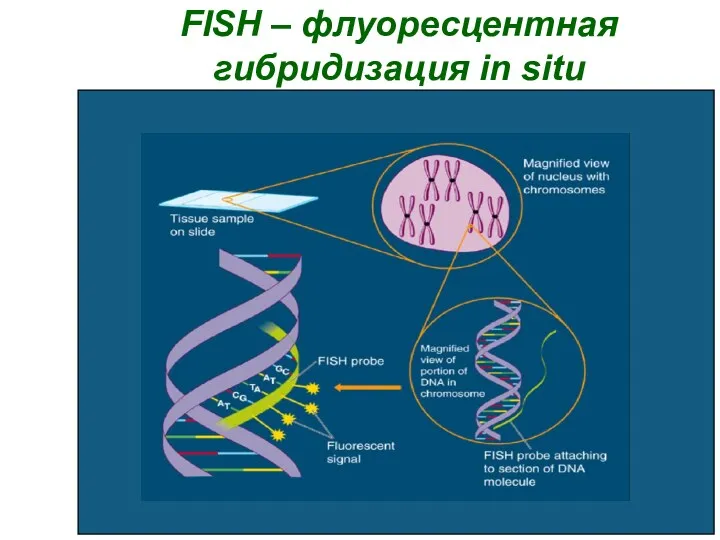
- 35. FISH – флуоресцентная гибридизация in situ
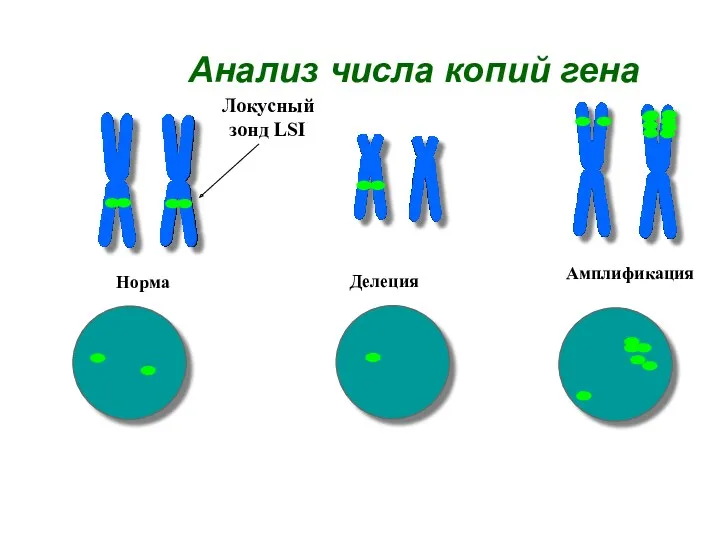
- 36. Анализ числа копий гена Норма Делеция Амплификация Локусный зонд LSI
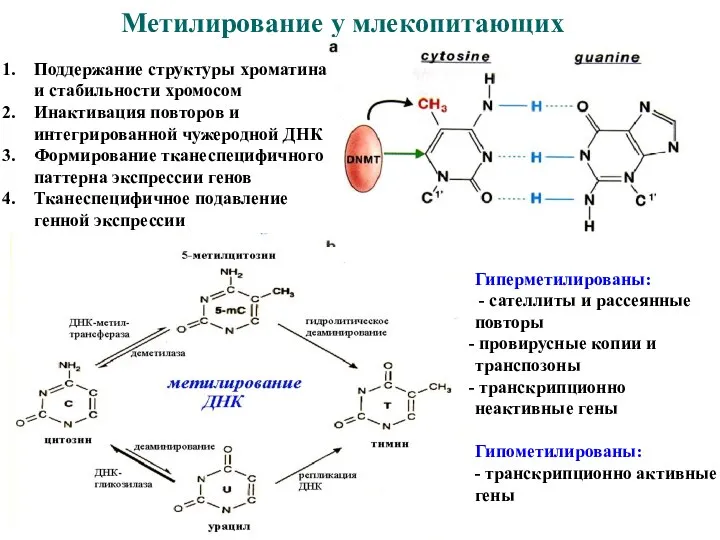
- 37. Метилирование у млекопитающих Поддержание структуры хроматина и стабильности хромосом Инактивация повторов и интегрированной чужеродной ДНК Формирование
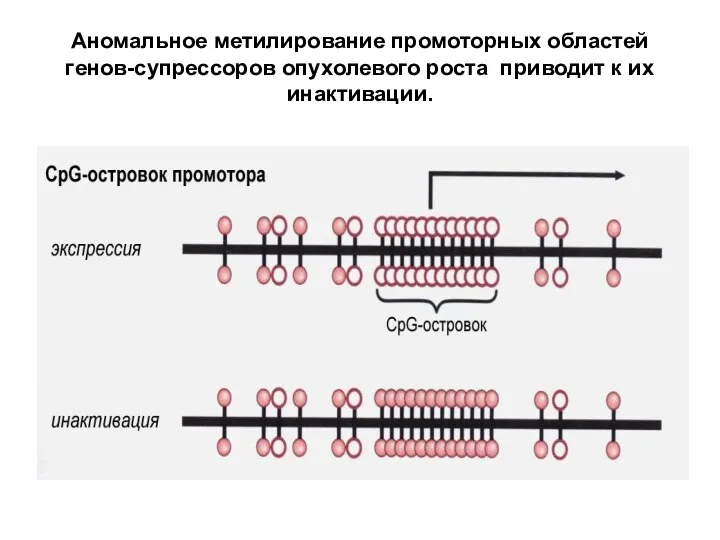
- 38. Аномальное метилирование промоторных областей генов-супрессоров опухолевого роста приводит к их инактивации.
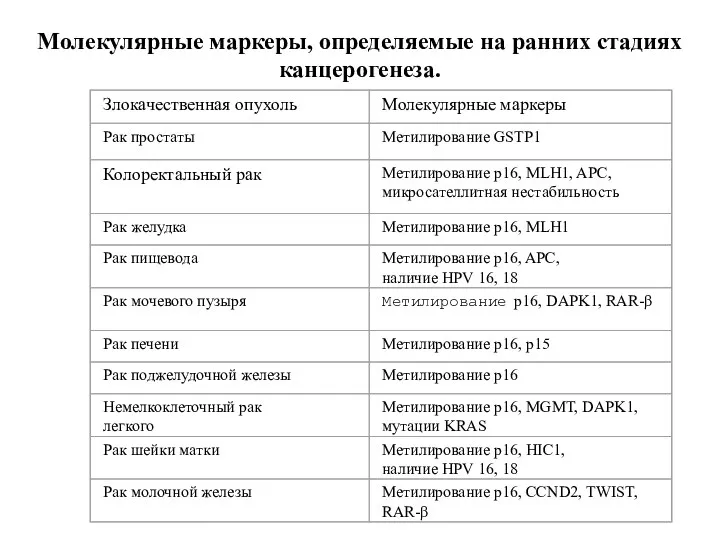
- 40. Молекулярные маркеры, определяемые на ранних стадиях канцерогенеза.
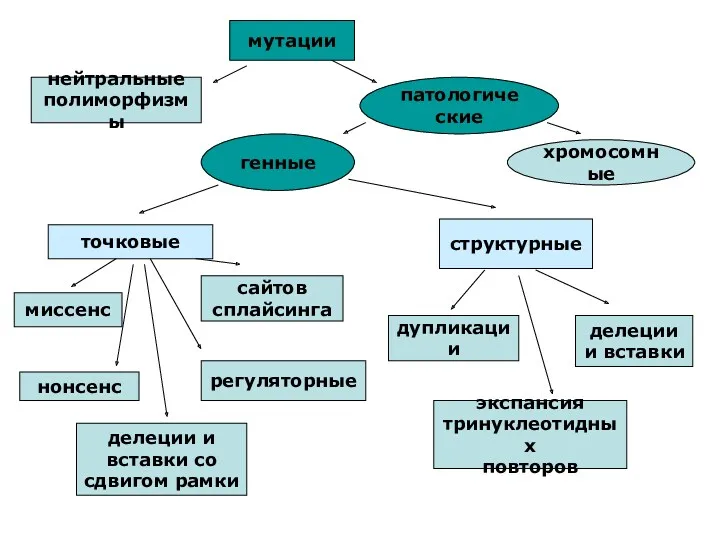
- 41. Под мутацией понимают все изменения в нуклеотидной последовательности ДНК, независимо от их локализации и влияния на
- 42. мутации нейтральные полиморфизмы патологические генные хромосомные точковые миссенс сайтов сплайсинга нонсенс регуляторные делеции и вставки со
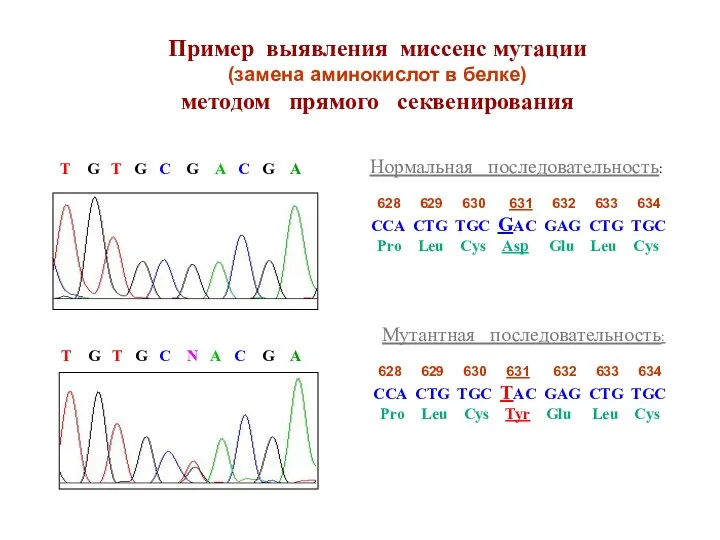
- 43. Пример выявления миссенс мутации (замена аминокислот в белке) методом прямого секвенирования
- 45. Hanahan D. et al., 2011
- 46. В норме активные процессы ангиогенеза (формирования новых кровеносных сосудов) отмечаются только в период формирования эмбриона, а
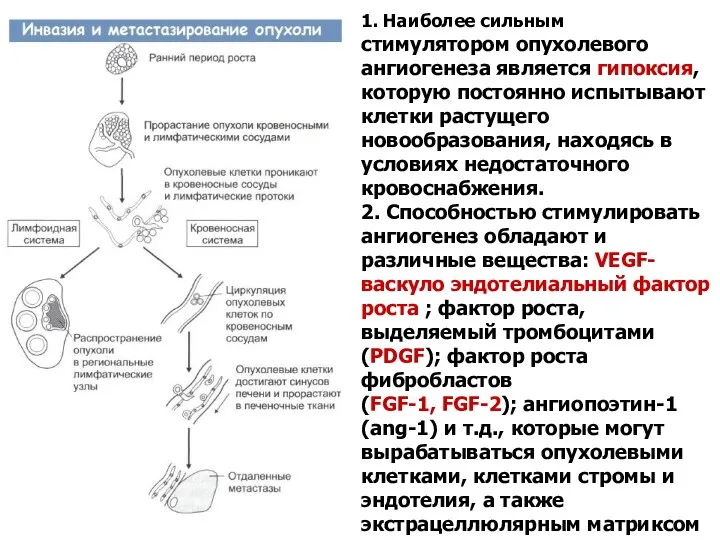
- 47. 1. Наиболее сильным стимулятором опухолевого ангиогенеза является гипоксия, которую постоянно испытывают клетки растущего новообразования, находясь в
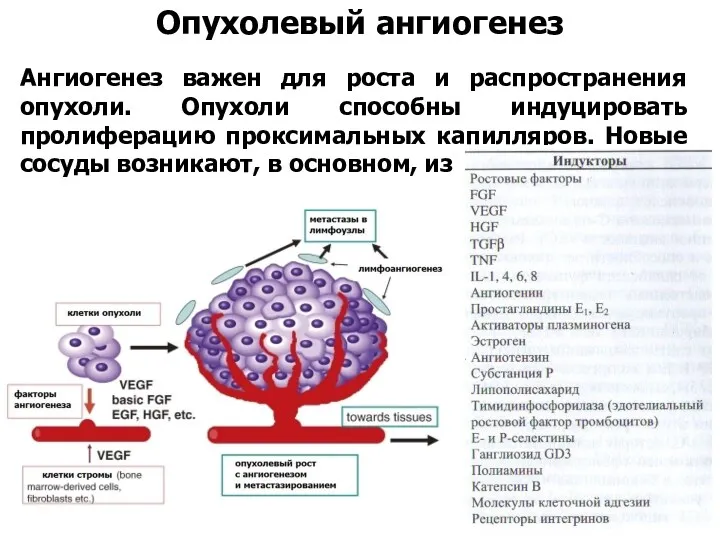
- 48. Опухолевый ангиогенез Ангиогенез важен для роста и распространения опухоли. Опухоли способны индуцировать пролиферацию проксимальных капилляров. Новые
- 49. В маленькие опухоли питательные вещества и кислород поступают путем диффузии или через соседние капилляры. Клетки опухолей
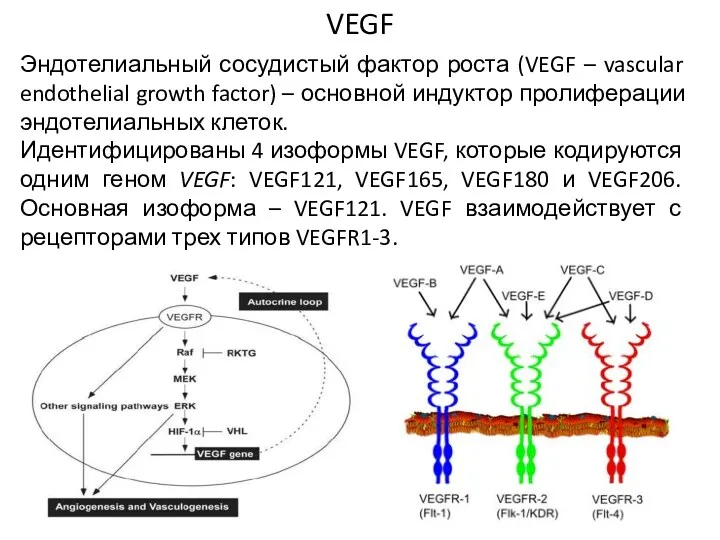
- 50. VEGF Эндотелиальный сосудистый фактор роста (VEGF – vascular endothelial growth factor) – основной индуктор пролиферации эндотелиальных
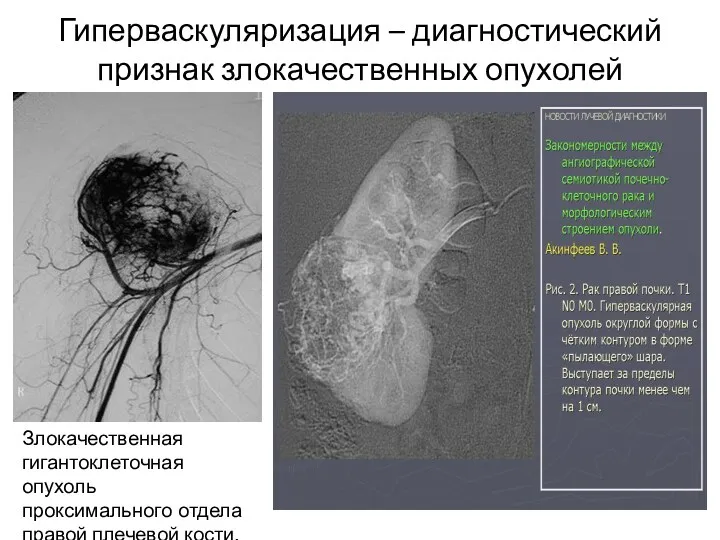
- 51. Гиперваскуляризация – диагностический признак злокачественных опухолей Злокачественная гигантоклеточная опухоль проксимального отдела правой плечевой кости.
- 53. Скачать презентацию












 Кәдімгі цикорий-Сichorium intybus l
Кәдімгі цикорий-Сichorium intybus l семейство розоцветные
семейство розоцветные Классификация животных и основные систематические группы
Классификация животных и основные систематические группы Көбею. Өсу және даму
Көбею. Өсу және даму Презентация по биологии для учащихся 8 класса на тему: Обмен веществ
Презентация по биологии для учащихся 8 класса на тему: Обмен веществ Кабинет биологии, фото
Кабинет биологии, фото Вегетативное размножение растений
Вегетативное размножение растений Екіншілік метаболиттер алу биотехнологиясы
Екіншілік метаболиттер алу биотехнологиясы Природний добір
Природний добір Мышцы конечностей
Мышцы конечностей Отдел Плауновидные Lycopodiophyta
Отдел Плауновидные Lycopodiophyta Технология возделывания яровой пшеницы
Технология возделывания яровой пшеницы Занятие элективного курса Основы биологии для 11профильного класса.
Занятие элективного курса Основы биологии для 11профильного класса. Животные степей
Животные степей Субтропические плоды
Субтропические плоды Экспрессия генов. Транскрипция, трансляция
Экспрессия генов. Транскрипция, трансляция Вода - источник жизни комнатных растений
Вода - источник жизни комнатных растений Анатомия и физиология женских половых органов
Анатомия и физиология женских половых органов Земледелие. Введение
Земледелие. Введение Пищеварение в кишечнике
Пищеварение в кишечнике Молодежный инновационный форум Воронежской области
Молодежный инновационный форум Воронежской области Вселенная микробов
Вселенная микробов Николай Иванович Вавилов
Николай Иванович Вавилов Биологическое и свободное окисление
Биологическое и свободное окисление Байгабилов Д., 2 курс
Байгабилов Д., 2 курс Природоохранные территории России. Баргузинский государственный биосферный заповедник
Природоохранные территории России. Баргузинский государственный биосферный заповедник Преддверно-улитковый нерв п. vestibulocochlearis (VIII пара)
Преддверно-улитковый нерв п. vestibulocochlearis (VIII пара) Ткани растений и их виды
Ткани растений и их виды