Содержание
- 2. Триада Генле-Коха: Ф.Генле разработал, а выдающийся немецкий микробиолог Р.Кох затем четко сформулировал получившую название триаду Генле—Коха,
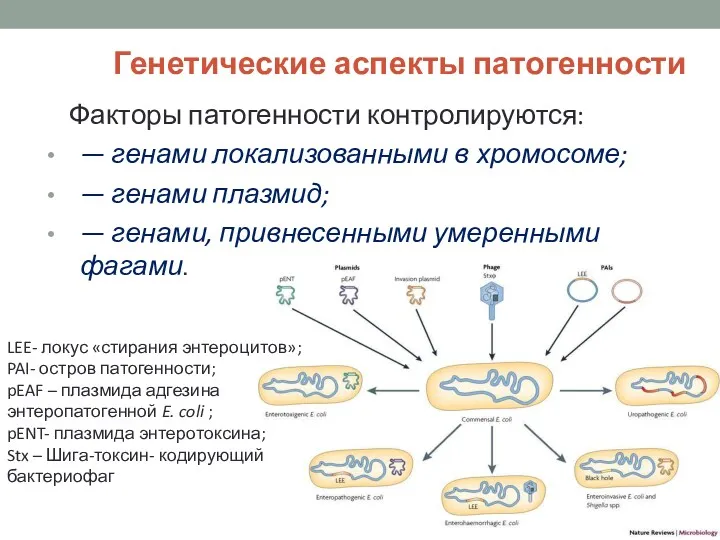
- 3. Генетические аспекты патогенности Факторы патогенности контролируются: — генами локализованными в хромосоме; — генами плазмид; — генами,
- 4. Патогенность – генетически закрепленная способность Гены «патогенности» организованные в островки патогенности, способные к горизонтальному переносу Это
- 5. Механизм превращения непатогенных в патогенные связан по меньшей мере с двумя процессами: 1. с получением дополнительных
- 6. Патогенность – потенциальная способность микроорганизма вызывать инфекционный процесс. Полифункциональное свойство, детерминировано геномом, передается по наследству. Вирулентность
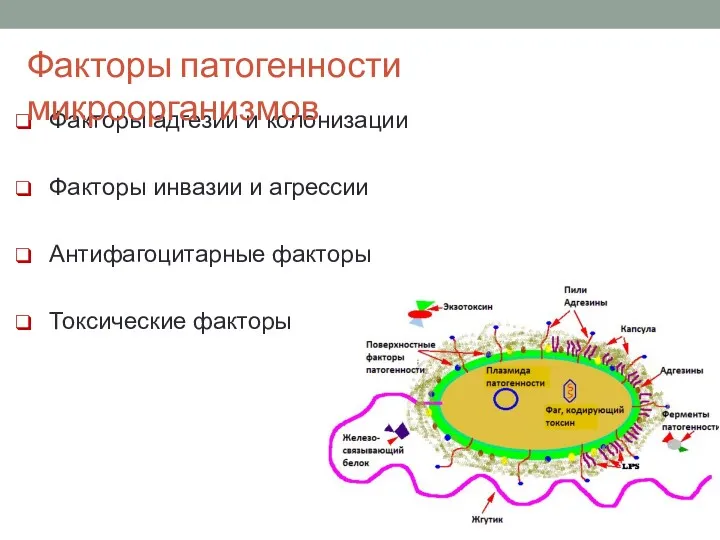
- 7. Факторы адгезии и колонизации Факторы инвазии и агрессии Антифагоцитарные факторы Токсические факторы Факторы патогенности микроорганизмов
- 8. Факторы адгезии Адгезия происходит на поверхности слизистых оболочек различных органов и систем. Адгезия протекает в две
- 9. Факторы адгезии - Адгезины Грамположительные и грамотрицательные бактерии – используют различные стратегии специфической адгезии. У грамотрицательных
- 10. Факторы инвазии и агрессии Инвазия –проникновение возбудителя через слизистые и соединительнотканные барьеры Агрессия – подавление естественной
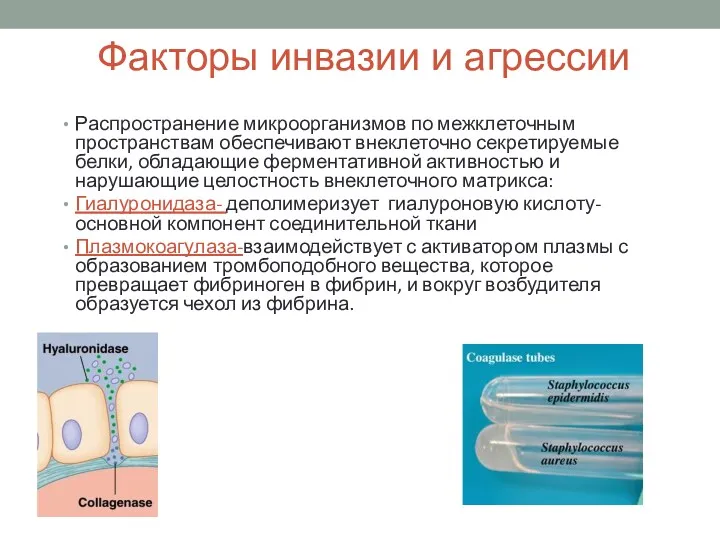
- 11. Факторы инвазии и агрессии Распространение микроорганизмов по межклеточным пространствам обеспечивают внеклеточно секретируемые белки, обладающие ферментативной активностью
- 12. Нейраминидаза Сиаловые кислоты экспрессированы на поверхности клеток и входят в состав секретируемых гликопротеинов. А поверхности маскируют
- 13. Факторы инвазии и агрессии Лецитиназа (фосфолипаза) – гидролизует лецитин (фосфоглицерид фосфатидилхолин) основной компонент мембран млекопитающих, разрушает
- 14. Факторы инвазии и агрессии Протеолитические ферменты: Основной мишенью протеолитических ферментов, образуемых бактериями, являются белки, включая сигнальные
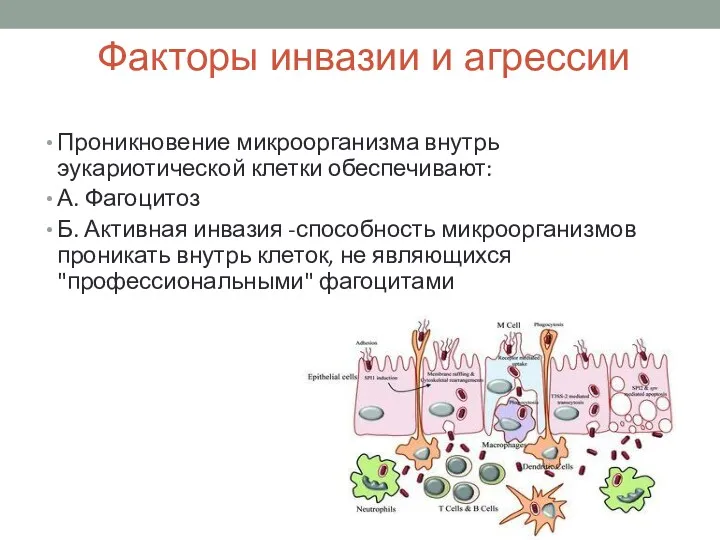
- 15. Факторы инвазии и агрессии Проникновение микроорганизма внутрь эукариотической клетки обеспечивают: А. Фагоцитоз Б. Активная инвазия -способность
- 16. Антифагоцитарные факторы Имеют поверхностную локализацию – капсулы, капсулоподобные структуры Не являются жизненно важными для бактериальной клетки
- 17. Антифагоцитарные факторы 1. Факторы, действующие на стадии распознавания и прикрепления: Полисахаридные капсулы S. pneumoniae, S. aureus,
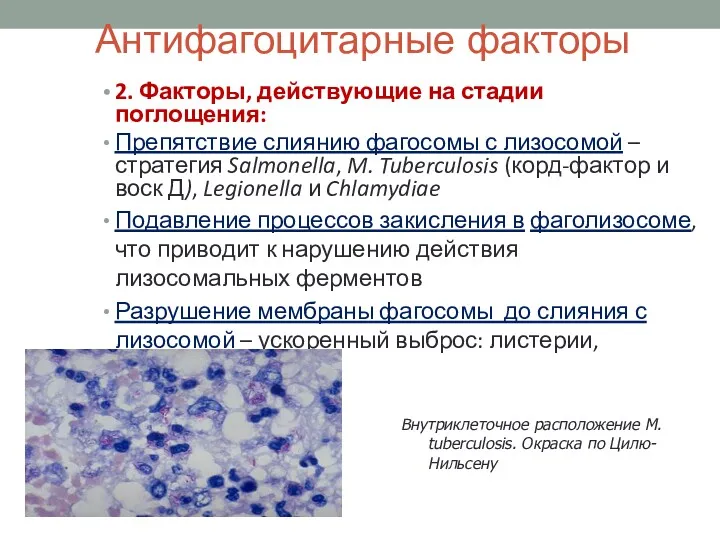
- 18. Антифагоцитарные факторы 2. Факторы, действующие на стадии поглощения: Препятствие слиянию фагосомы с лизосомой – стратегия Salmonella,
- 19. Антифагоцитарные факторы 3. Секреция микроорганизмами биологически активных веществ, способствующих гибели фагоцитов: Гемолизины S. Pyogenes, S.aureus Лейкоцидин
- 20. Антифагоцитарные факторы 4. Уклонение от иммунологического надзора Экранирование (маскировка) антигенных детерминант с помощью капсул и капсулоподобных
- 21. Бактериальные токсины
- 22. Бактериальные токсины. Экзотоксины Простые – полипептидная цепь Сложные – несколько связанных полипептидных цепей, соединенных между собой.
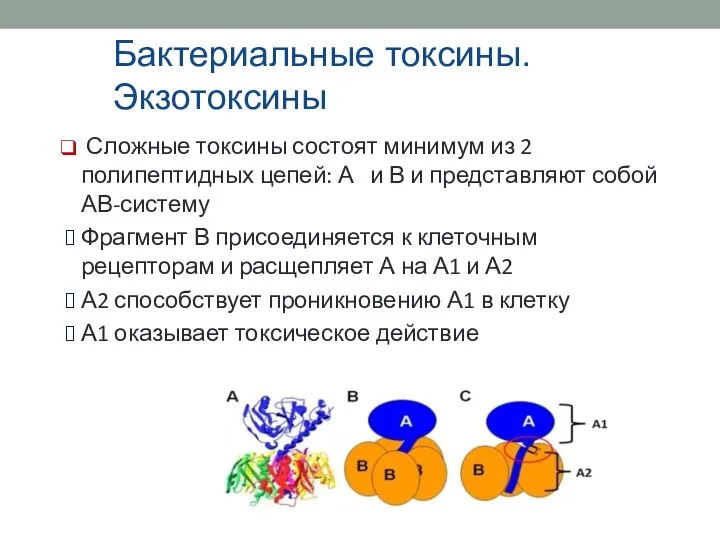
- 23. Бактериальные токсины. Экзотоксины Сложные токсины состоят минимум из 2 полипептидных цепей: А и В и представляют
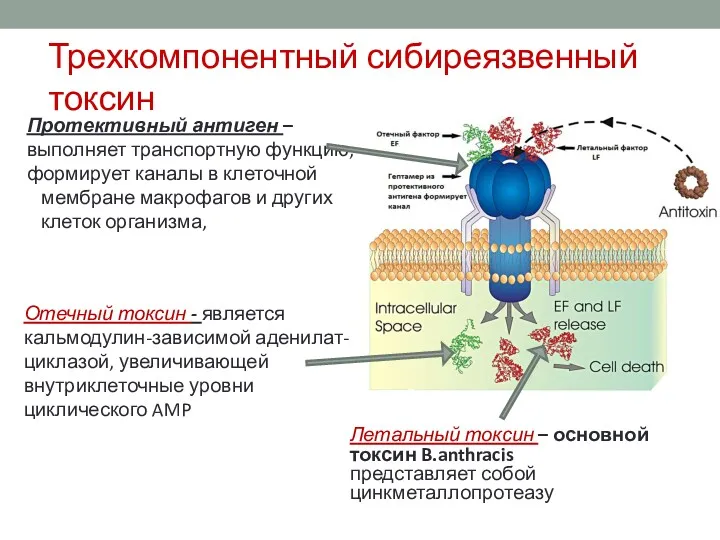
- 24. Трехкомпонентный сибиреязвенный токсин Протективный антиген – выполняет транспортную функцию, формирует каналы в клеточной мембране макрофагов и
- 25. БЕЛКОВЫЕ ТОКСИНЫ РАЗДЕЛЯЮТ ПО СТЕПЕНИ СВЯЗИ С БАКТЕРИАЛЬНОЙ КЛЕТКОЙ А. Токсины, секретируемые во внешнюю среду (дифтерийный
- 26. Токсины, ингибирующие синтез белка (цитотоксины) Токсины, повреждающие клеточные мембраны Функциональные блокаторы (активаторы путей метаболизма вторичных мессенджеров)
- 27. Бактериальные токсины. Экзотоксины Токсины, ингибирующие синтез белка (цитотоксины): Дифтерийный гистотоксин и токсин А синегнойной палочки взаимодействуют
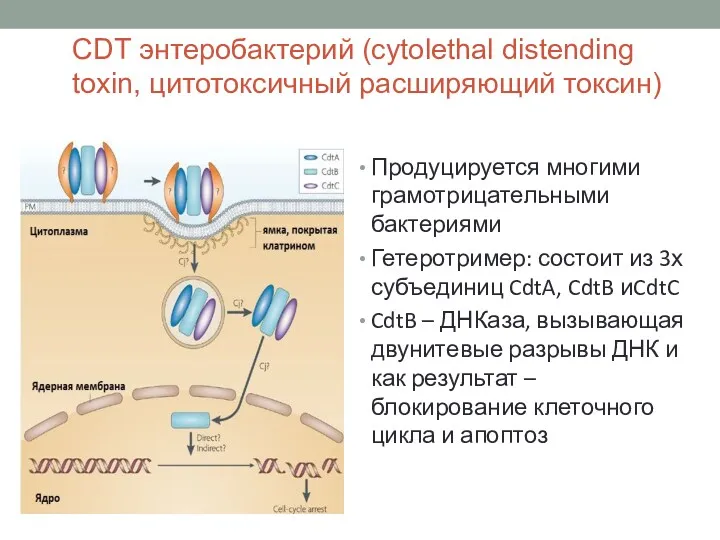
- 28. CDT энтеробактерий (cytolethal distending toxin, цитотоксичный расширяющий токсин) Продуцируется многими грамотрицательными бактериями Гетеротример: состоит из 3х
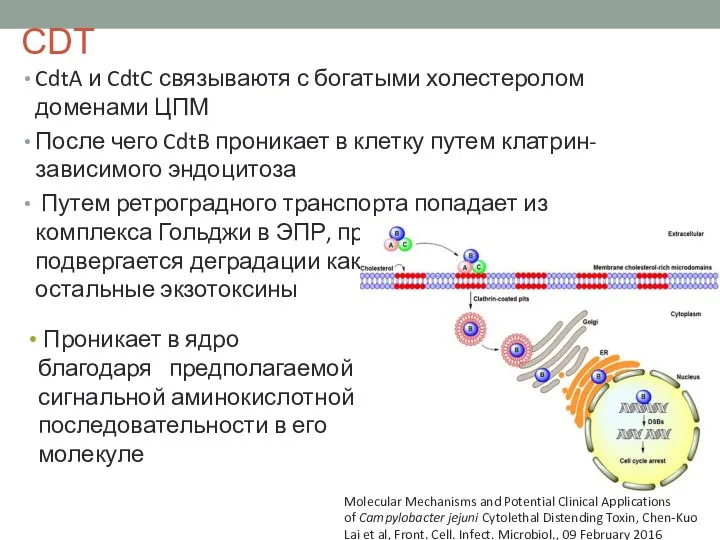
- 29. СDT CdtA и CdtC связываютя с богатыми холестеролом доменами ЦПМ После чего CdtB проникает в клетку
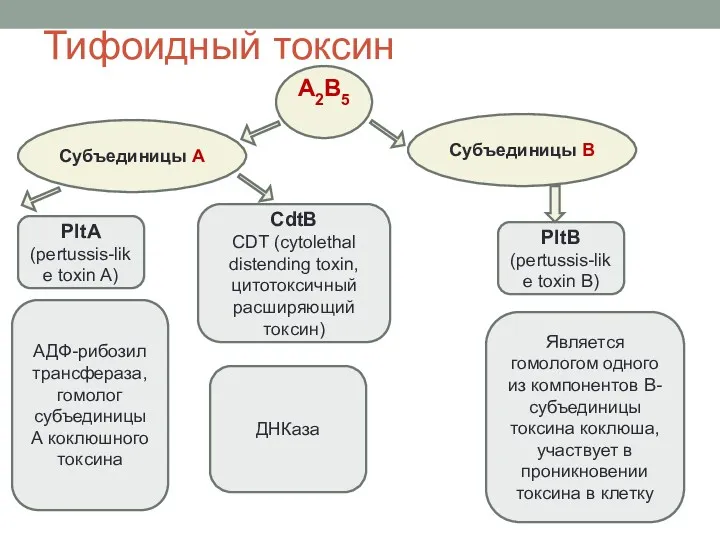
- 30. Субъединицы А Субъединицы В A2B5 PltA (pertussis-like toxin A) CdtB CDT (cytolethal distending toxin, цитотоксичный расширяющий
- 31. PltA, PltB, и CdtB кодируются генами в составе одного оперона. S.Typhi продуцирует токсин только в клетках
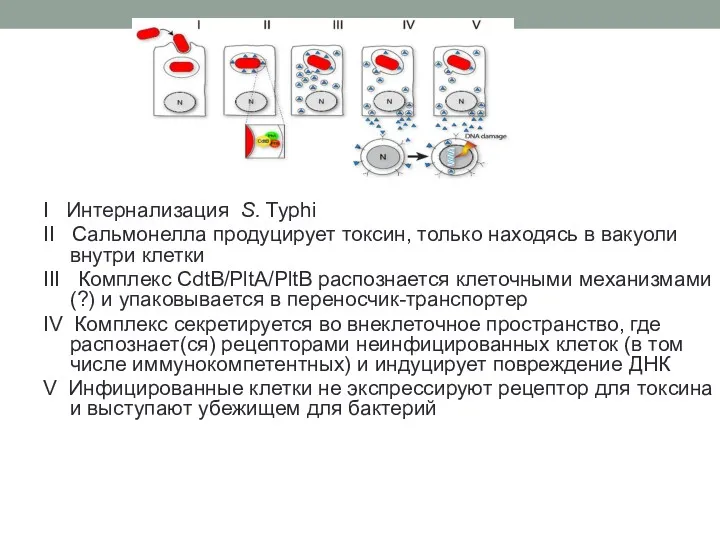
- 32. I Интернализация S. Typhi II Сальмонелла продуцирует токсин, только находясь в вакуоли внутри клетки III Комплекс
- 33. Экзотоксины Бактерии способны использовать свой токсин, чтобы защищаться от своих конкурентов: например, энтеротоксин кишечной палочки предотвращает
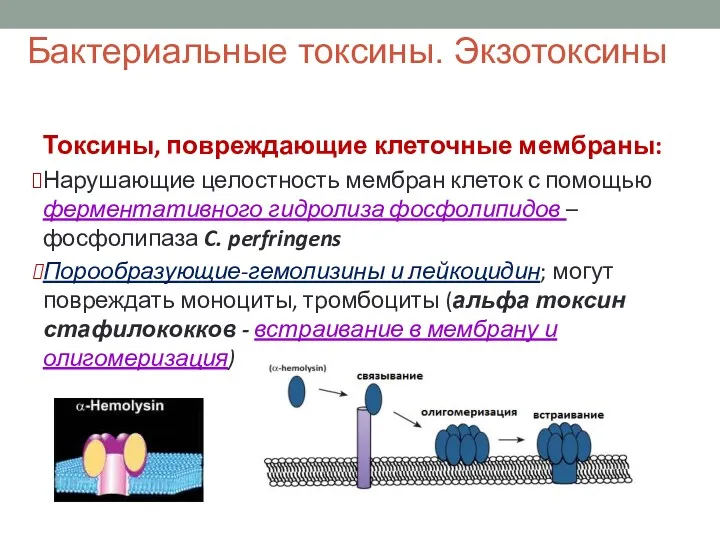
- 34. Бактериальные токсины. Экзотоксины Токсины, повреждающие клеточные мембраны: Нарушающие целостность мембран клеток с помощью ферментативного гидролиза фосфолипидов
- 35. Бактериальные токсины. Экзотоксины Функциональные блокаторы (активаторы путей метаболизма вторичных мессенджеров): Эти токсины способствуют усилению синтеза цАМФ,
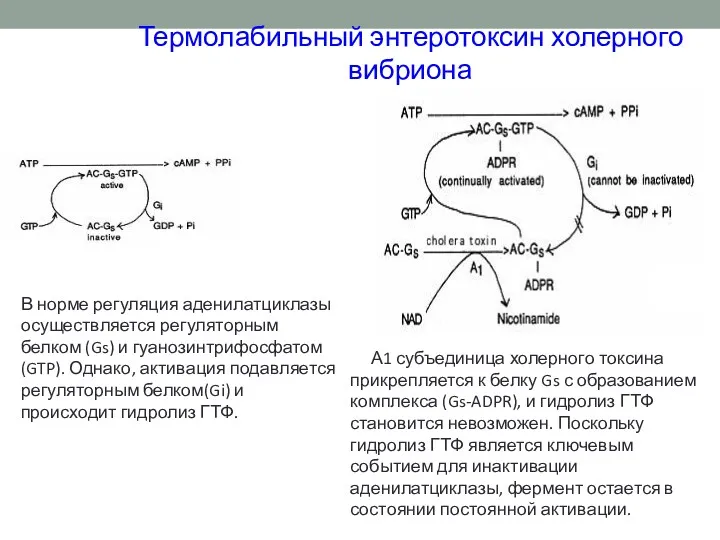
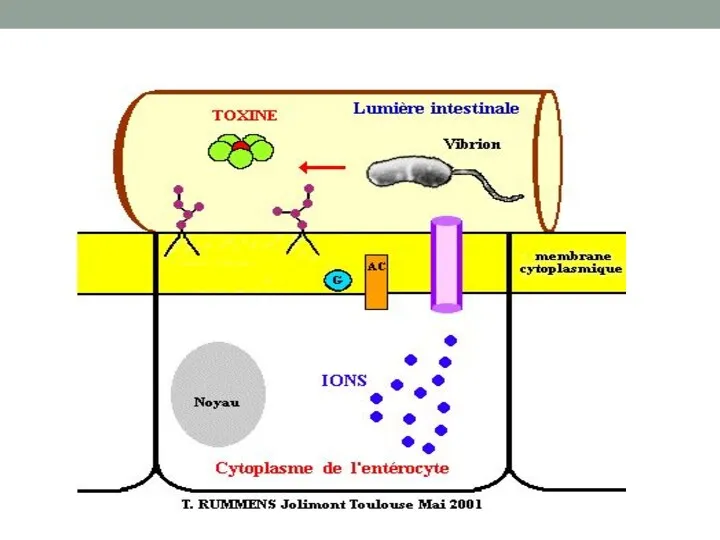
- 36. Термолабильный энтеротоксин холерного вибриона В норме регуляция аденилатциклазы осуществляется регуляторным белком (Gs) и гуанозинтрифосфатом(GTP). Однако, активация
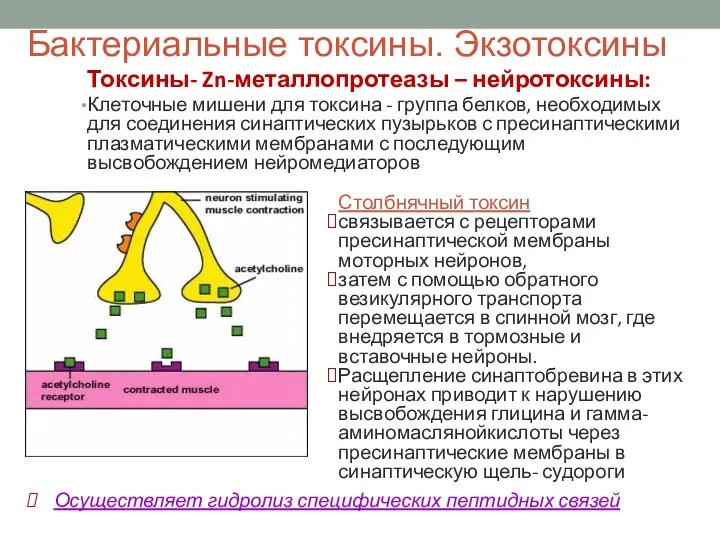
- 38. Бактериальные токсины. Экзотоксины Токсины- Zn-металлопротеазы – нейротоксины: Клеточные мишени для токсина - группа белков, необходимых для
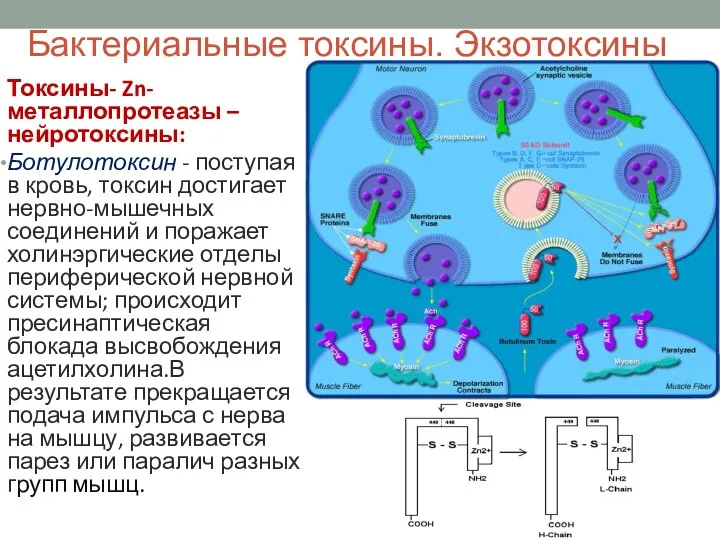
- 39. Бактериальные токсины. Экзотоксины Токсины- Zn-металлопротеазы – нейротоксины: Ботулотоксин - поступая в кровь, токсин достигает нервно-мышечных соединений
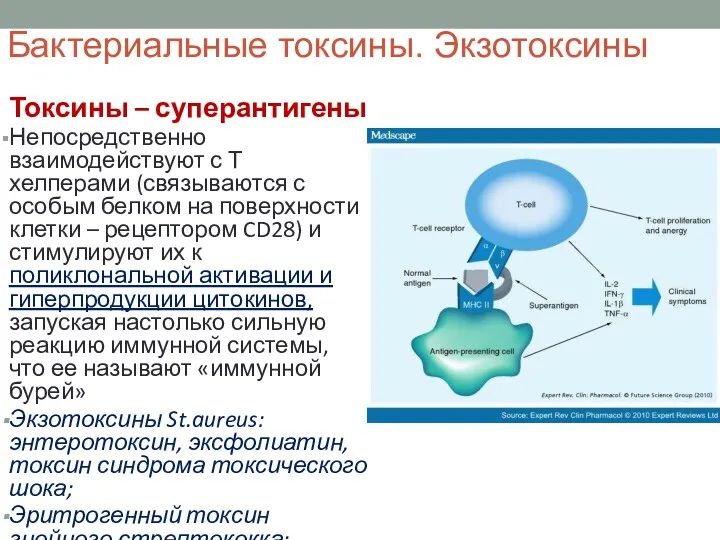
- 40. Бактериальные токсины. Экзотоксины Токсины – суперантигены Непосредственно взаимодействуют с Т хелперами (связываются с особым белком на
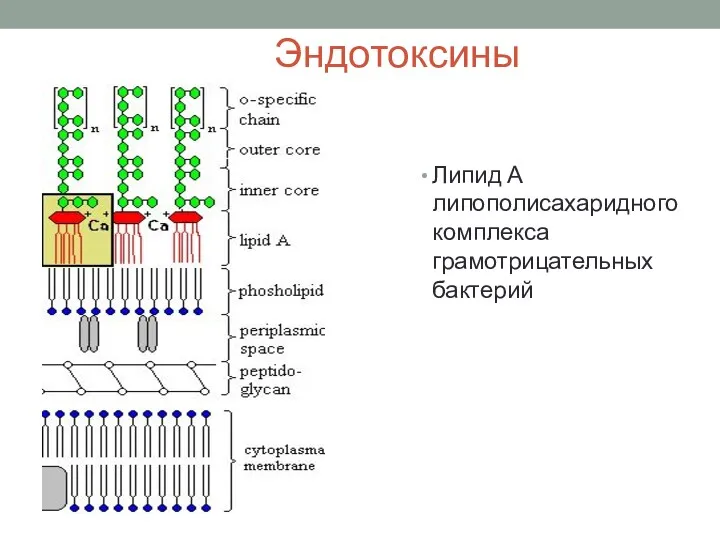
- 41. Эндотоксины Липид А липополисахаридного комплекса грамотрицательных бактерий
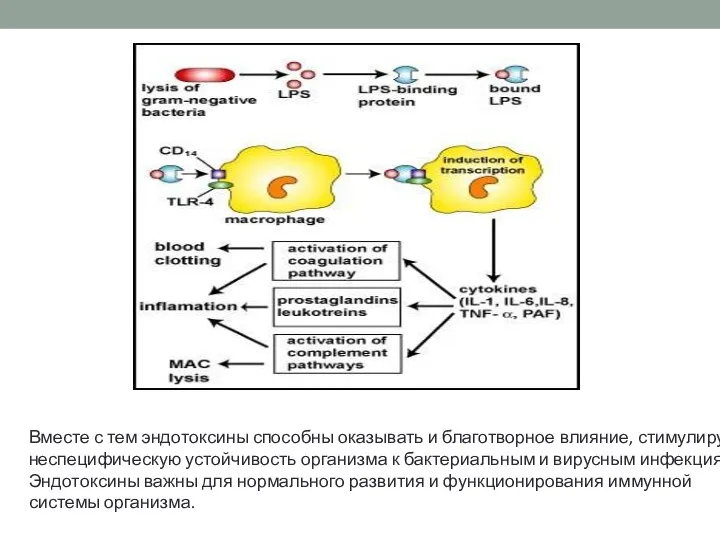
- 42. Эндотоксин. Основные характеристики: Иммуногенность Стимуляция выработки физиологически активных веществ Пирогенность Активация комплемента по альтернативному пути Накопление
- 43. Вместе с тем эндотоксины способны оказывать и благотворное влияние, стимулируя неспецифическую устойчивость организма к бактериальным и
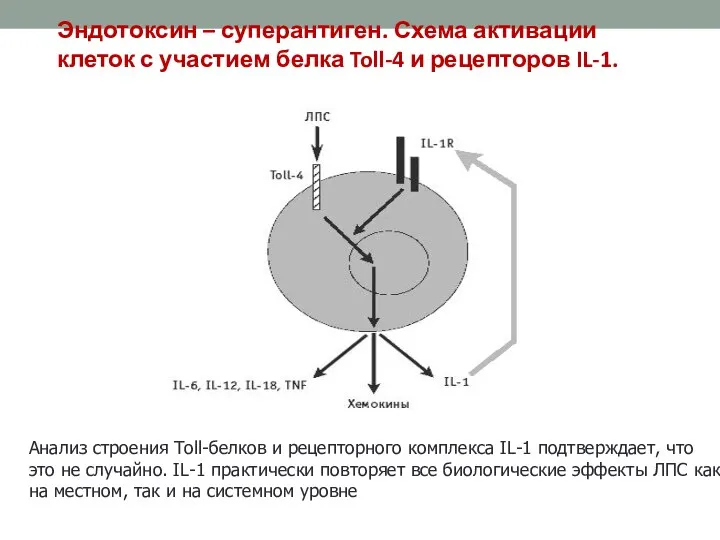
- 44. Устойчив : Чувствителен: К кислым хлору, Низким температурам ультрафиолету Эндотоксин – суперантиген. Схема активации клеток с
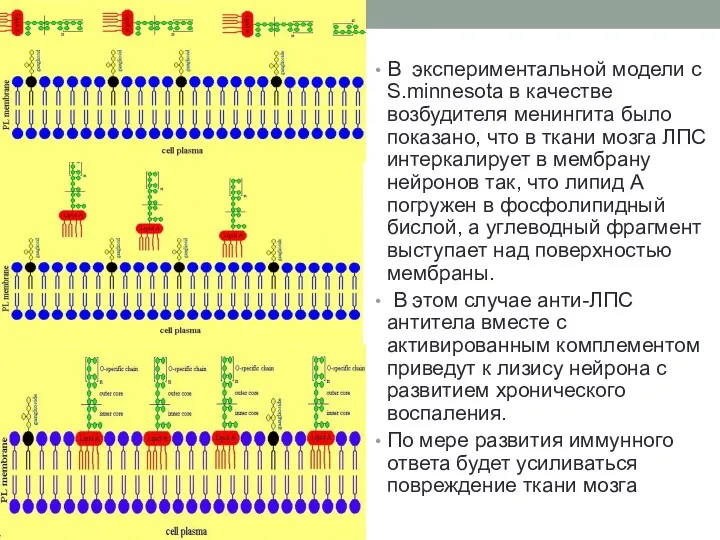
- 45. В экспериментальной модели с S.minnesota в качестве возбудителя менингита было показано, что в ткани мозга ЛПС
- 46. Токсины, ингибирующие синтез белка (цитотоксины) АДФ-рибозилирование (дифтерийный, синегнойный) Отщепляет адениловый остаток в 28s рРНК эукариотических рибосом
- 48. Скачать презентацию
























 Поле и его обитатели
Поле и его обитатели Биотические факторы среды
Биотические факторы среды Лесные дары. Ягоды
Лесные дары. Ягоды Опорно-двигательная система человека
Опорно-двигательная система человека Костная и мышечная системы. Скелет головы
Костная и мышечная системы. Скелет головы Антропогенез
Антропогенез Ботаника
Ботаника Кальцій у організмі людини
Кальцій у організмі людини Энергетический обмен. Метаболизм (обмен веществ)
Энергетический обмен. Метаболизм (обмен веществ) Фиксация молекулярного азота (азотфиксация, диазотрофия) микроорганизмами
Фиксация молекулярного азота (азотфиксация, диазотрофия) микроорганизмами Семенные растения
Семенные растения Структурные компоненты клетки и их физиологические функции
Структурные компоненты клетки и их физиологические функции Технология выращивания комнатных растений
Технология выращивания комнатных растений Орган зрения
Орган зрения Размножение и развитие животных. 3 класс
Размножение и развитие животных. 3 класс Биологические полимеры - нуклеиновые кислоты
Биологические полимеры - нуклеиновые кислоты Экскурсия по Лапландскому заповеднику
Экскурсия по Лапландскому заповеднику Презентация к внеклассному мероприятию Муравьи- общественные насекомые
Презентация к внеклассному мероприятию Муравьи- общественные насекомые презентация к уроку по теме: Цветок. Строение и значение цветка
презентация к уроку по теме: Цветок. Строение и значение цветка Задачи по генетике
Задачи по генетике Биотические факторы
Биотические факторы Слуховая сенсорная система
Слуховая сенсорная система Приспособленность организмов к определенной среде обитания
Приспособленность организмов к определенной среде обитания Генетична рівновага в популяціях і її порушення
Генетична рівновага в популяціях і її порушення Государственная итоговая аттестация обучающихся за основное общее образование по биологии в 2023 году
Государственная итоговая аттестация обучающихся за основное общее образование по биологии в 2023 году Лекарственные и съедобные растения, произрастающие в Якутии
Лекарственные и съедобные растения, произрастающие в Якутии Питание и пищеварение
Питание и пищеварение Красная книга растений
Красная книга растений