Содержание
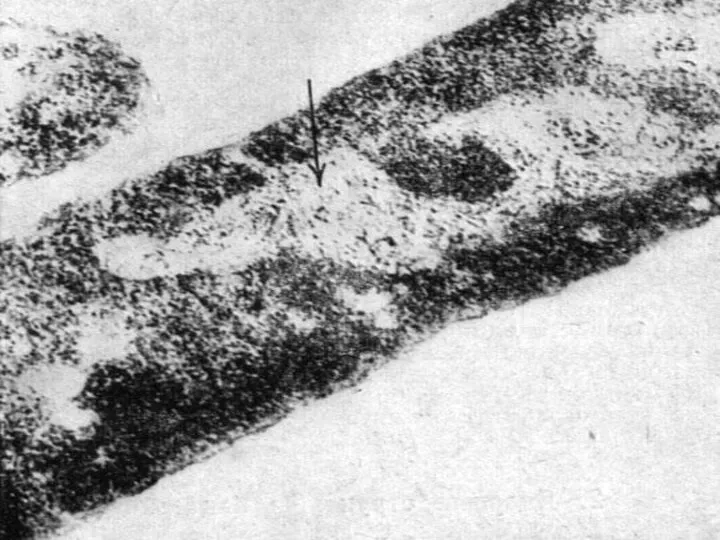
- 2. нуклеоид компактное тело, расположенное в центре клетке и ориентированное вдоль ее продольной оси Исключение гигантская бактерия
- 3. 2 цепочечная правозакрученная ДНК (бактериальная хромосома), несущая генетическую информацию для процессов, обеспечивающих жизнедеятельности клетки ДНК нуклеоида
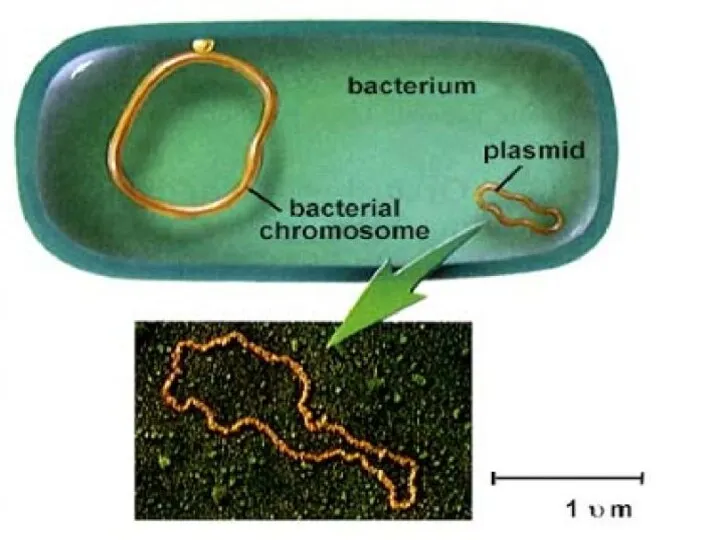
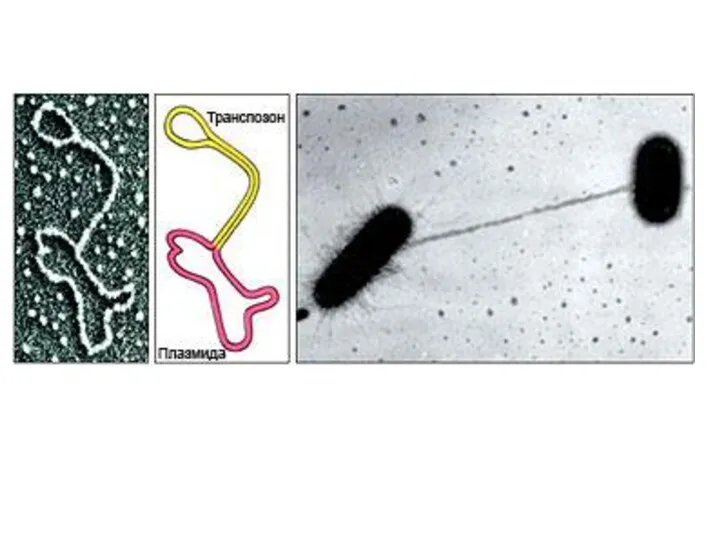
- 7. ПЛАЗМИДЫ Плазмиды образованы молекулами ДНК. Регуляторные плазмиды участвуют в компенсировании тех или иных дефектов метаболизма бактериальной
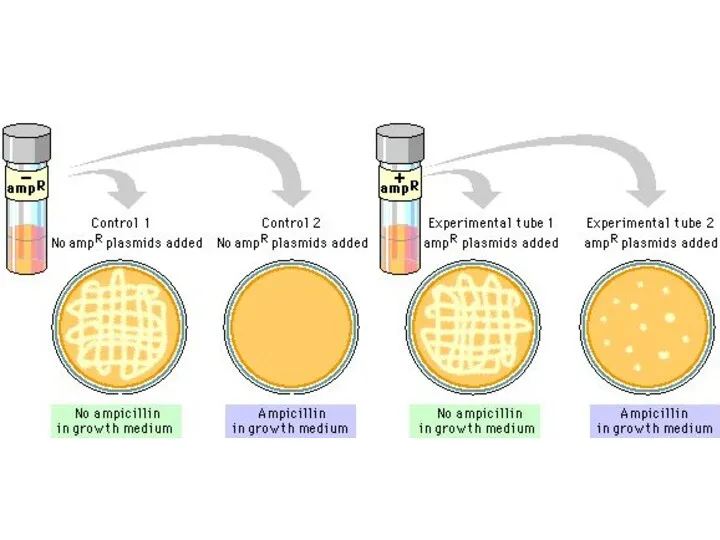
- 8. ГРУППЫ ПЛАЗМИД F-плазмиды контролируют синтез F-пилей, способствующих передачи генетического материала от бактерий-доноров (F+) к бактериям-реципиентам (F–)
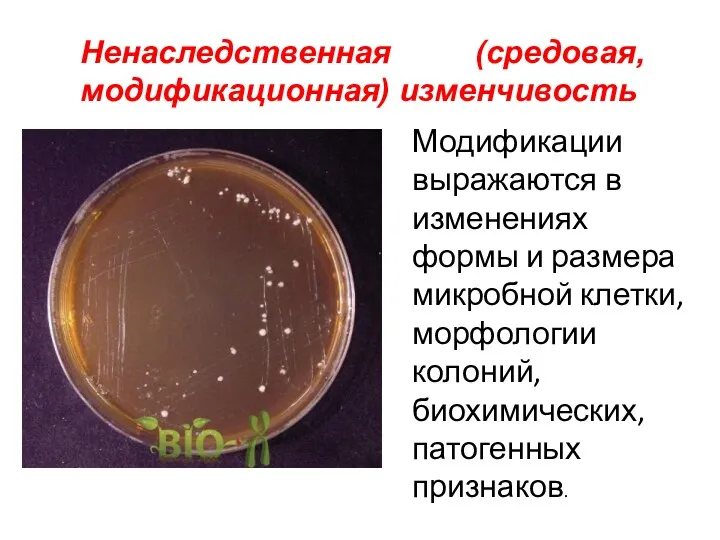
- 16. Ненаследственная (средовая, модификационная) изменчивость Модификации выражаются в изменениях формы и размера микробной клетки, морфологии колоний, биохимических,
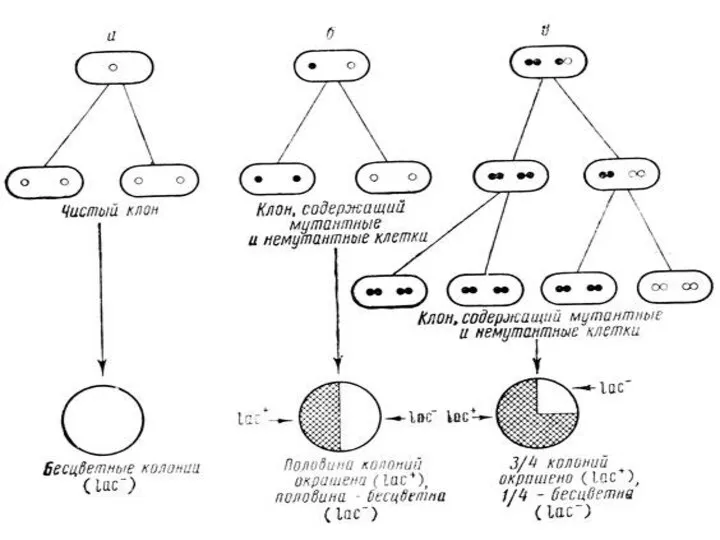
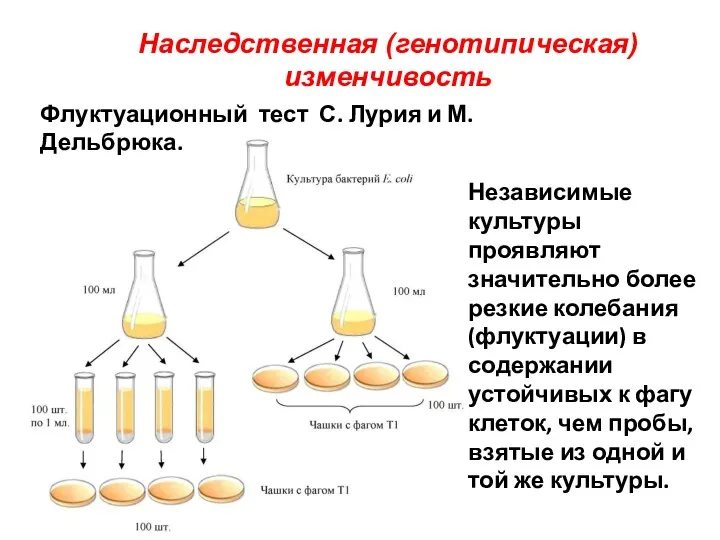
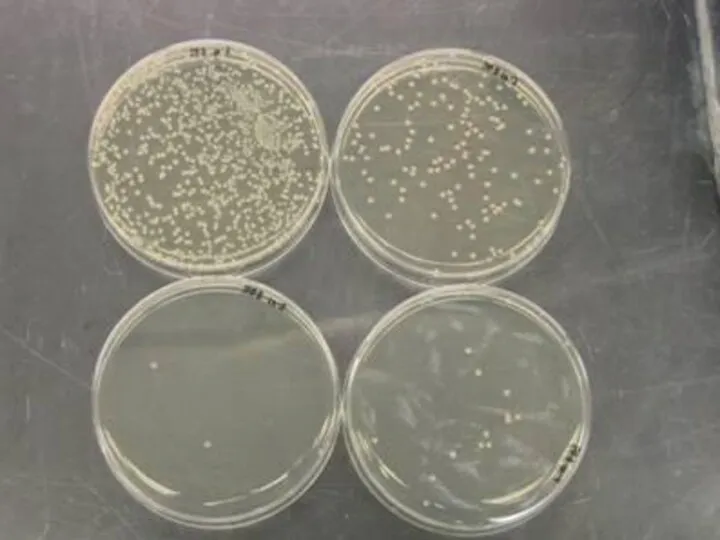
- 18. Наследственная (генотипическая) изменчивость Флуктуационный тест С. Лурия и М. Дельбрюка. Независимые культуры проявляют значительно более резкие
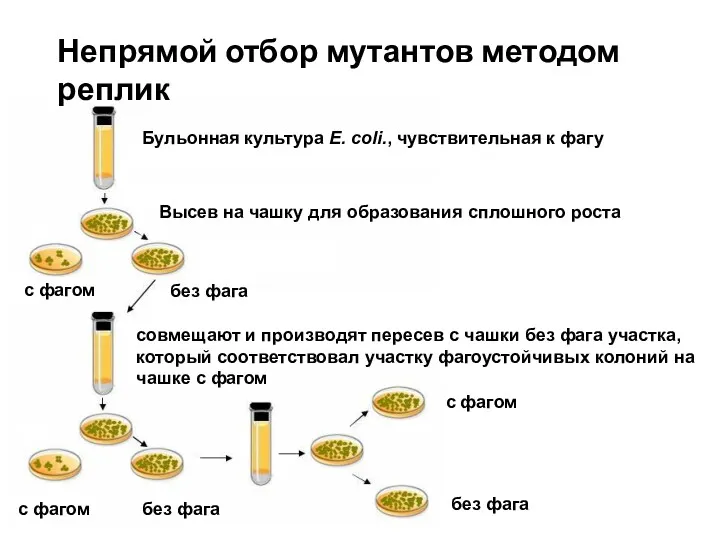
- 19. Непрямой отбор мутантов методом реплик Бульонная культура E. coli., чувствительная к фагу Высев на чашку для
- 26. Генетичекий обмен у бактерий процесс передачи генетического материала у бактерий. Основные пути осуществления: -трансформация -трансдукция -конъюгация
- 27. Общей особенностью процессов конъюгации, трансформации и трансдукции у бактерий является не добавление новых участков ДНК, а
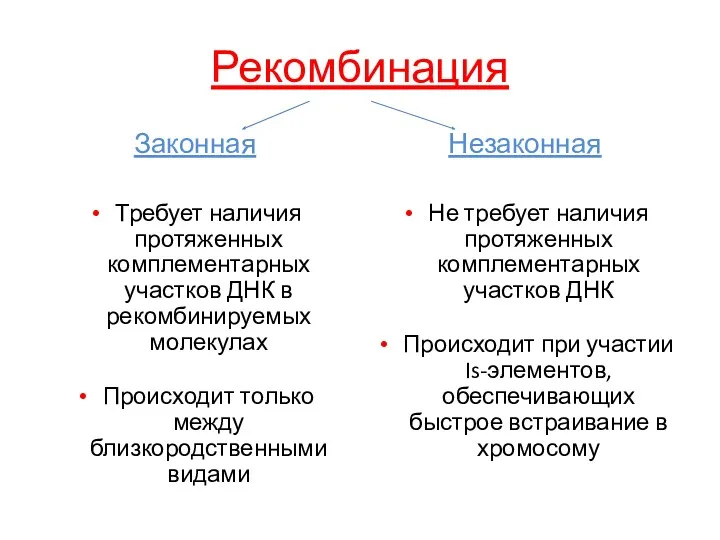
- 28. Рекомбинация Законная Требует наличия протяженных комплементарных участков ДНК в рекомбинируемых молекулах Происходит только между близкородственными видами
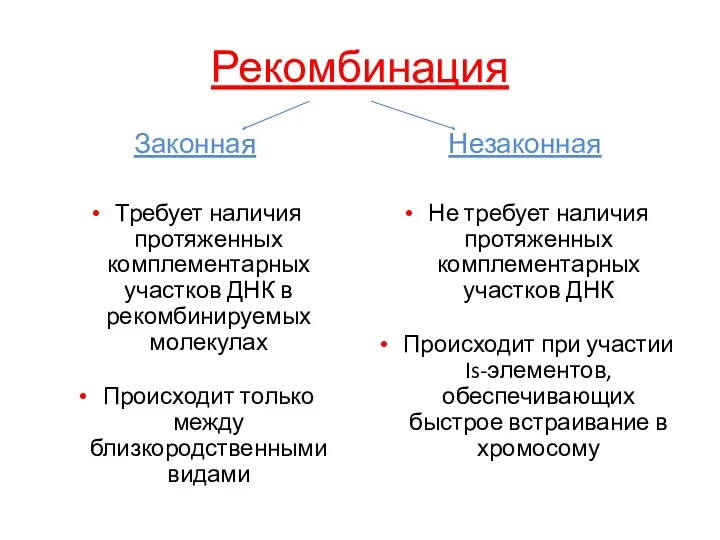
- 29. Рекомбинация Законная Требует наличия протяженных комплементарных участков ДНК в рекомбинируемых молекулах Происходит только между близкородственными видами
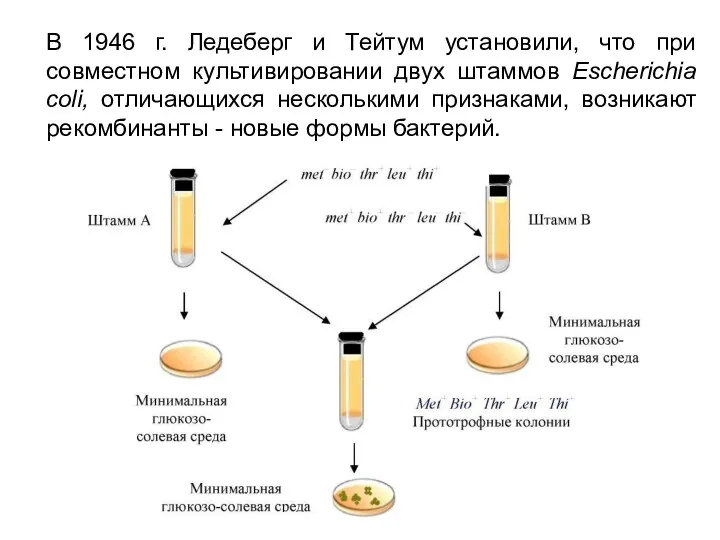
- 30. В 1946 г. Ледеберг и Тейтум установили, что при совместном культивировании двух штаммов Escherichia coli, отличающихся
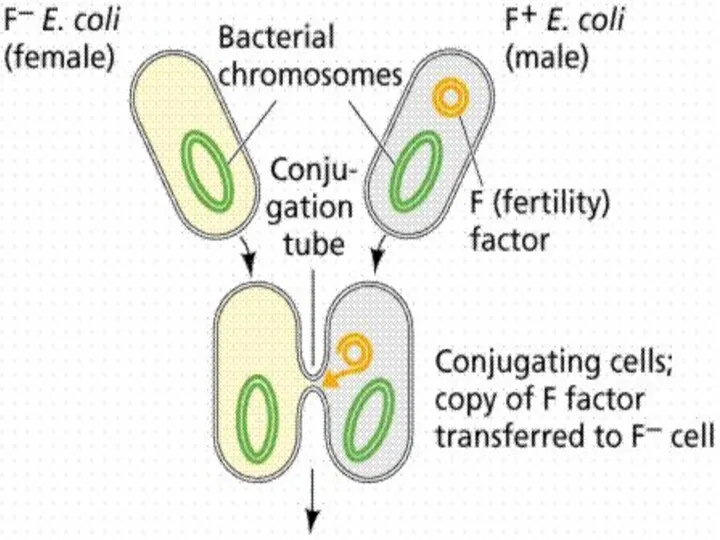
- 31. Конъюгация Необходимое условие : наличие в клетке-доноре трансмиссивной плазмиды. Процесс конъюгации у бактерий впервые был обнаружен
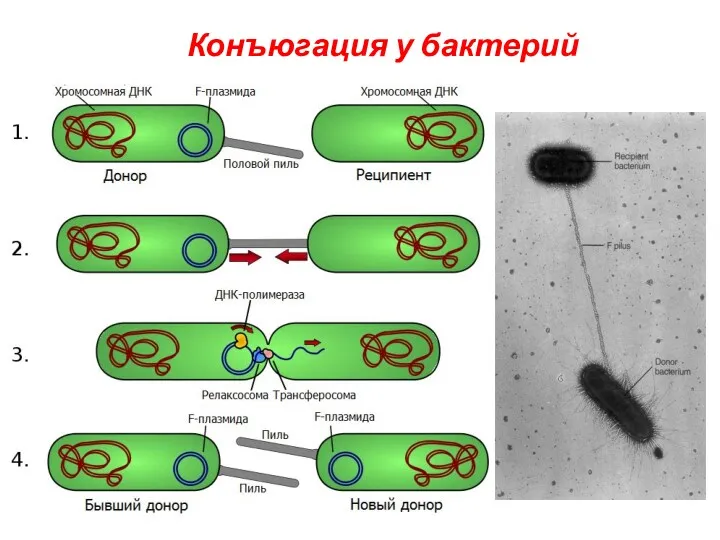
- 32. Конъюгация у бактерий
- 33. Этот процесс контролируется F-плазмидами (F-факторами), которые, находясь в цитоплазме клетки, могут реплицироваться автономно(F+-клетки), а могут быть
- 34. Основные этапы: Прикрепление клетки-донора к реципиентной клетке с помощью половых ворсинок Образование между обеими клетками конъюгационного
- 35. Типы скрещивания: Скрещивание F+ x F- :передается только F-плазмида, при этом F- клетка становится F+-клеткой,приобретая плазмиду
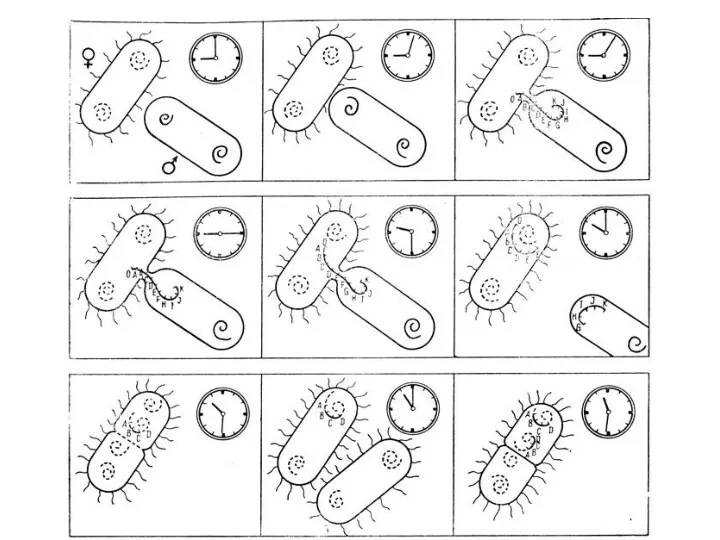
- 37. Постановка опыта скрещивания Hfr x F- по передаче локусов Pro, Thr, Leu В опыт берут: Донор-штамм
- 38. Результаты опыта: На контрольных чашках рост отсутствует На опытной чашке вырастают рекомбинанты С помощью данного опыта
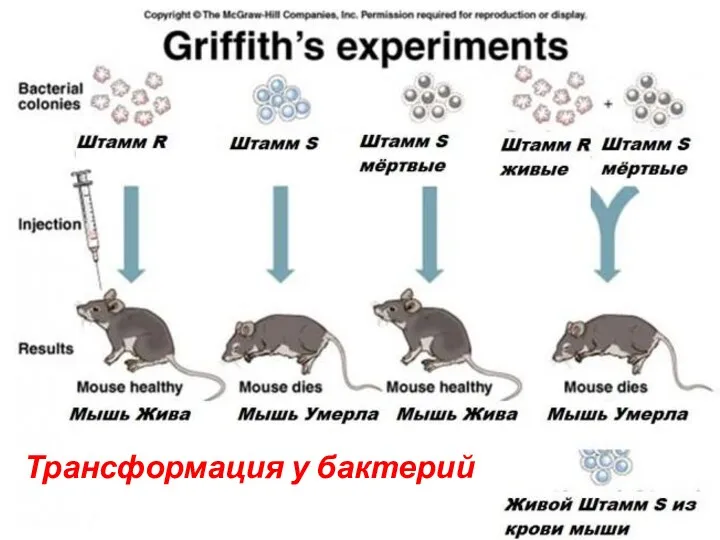
- 39. Трансформация Передача генетического материала между бактериями при помощи фрагментов ДНК. Впервые была воспроизведена Ф.Гриффитсом в 1928
- 40. Трансформация у бактерий
- 41. S-форма пневмакокков R-форма
- 42. Условия, необходимые для успешной трансформации: ДНК донора должна быть выделена из бактериальной культуры того же вида,
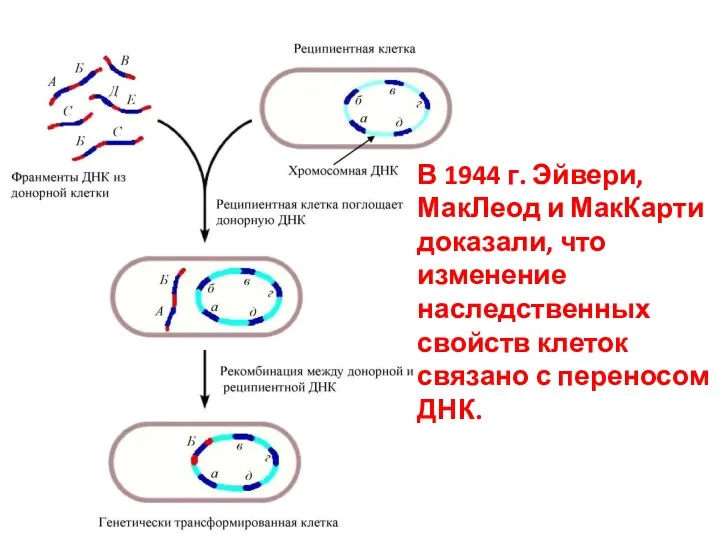
- 43. Стадии трансформации Адсорбция ДНК-донора на клетке-реципиенте Проникновение ДНК внутрь клетки-реципиента Соединение ДНК с гомологичным участком хромосомы
- 44. В 1944 г. Эйвери, МакЛеод и МакКарти доказали, что изменение наследственных свойств клеток связано с переносом
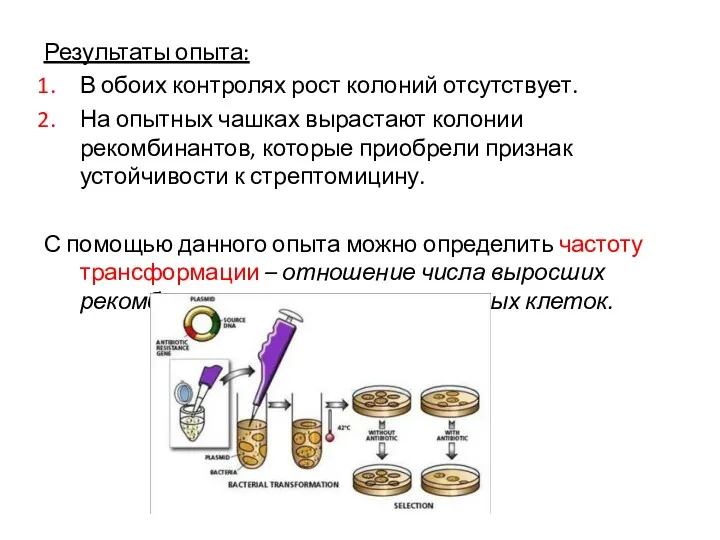
- 45. Постановка опыта по передаче локуса устойчивости к стрептомицину В опыт берут: ДНК стрептомицинустойчивого штамма Стрептомицинчувствительную культуру
- 46. Результаты опыта: В обоих контролях рост колоний отсутствует. На опытных чашках вырастают колонии рекомбинантов, которые приобрели
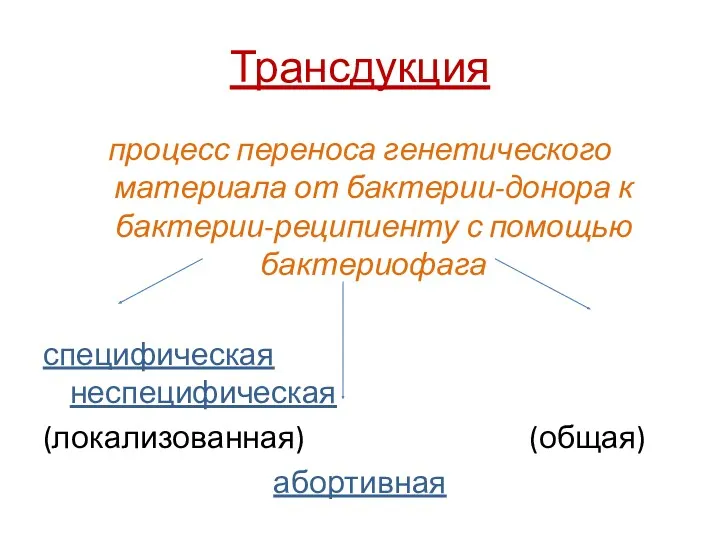
- 47. Трансдукция процесс переноса генетического материала от бактерии-донора к бактерии-реципиенту с помощью бактериофага специфическая неспецифическая (локализованная) (общая)
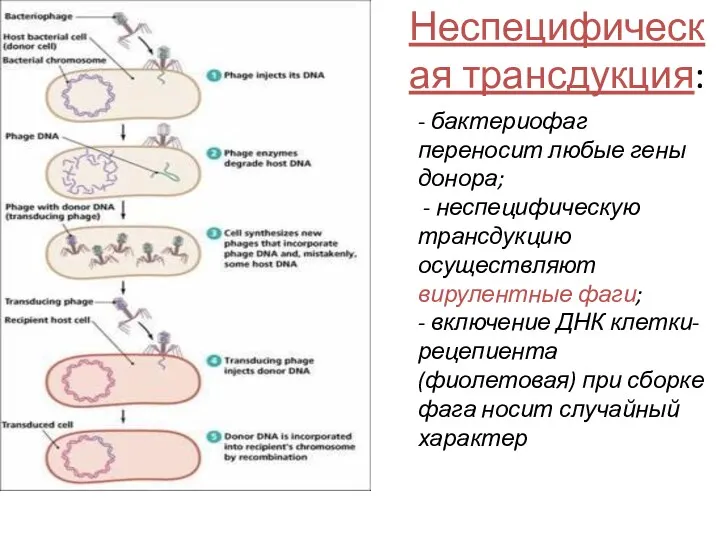
- 48. - бактериофаг переносит любые гены донора; - неспецифическую трансдукцию осуществляют вирулентные фаги; - включение ДНК клетки-рецепиента
- 49. Основные этапы: Адгезия на поверхности бактерии-донора с последующим проникновением Размножение бактериофага внутри клетки Самосборка фаговых частиц
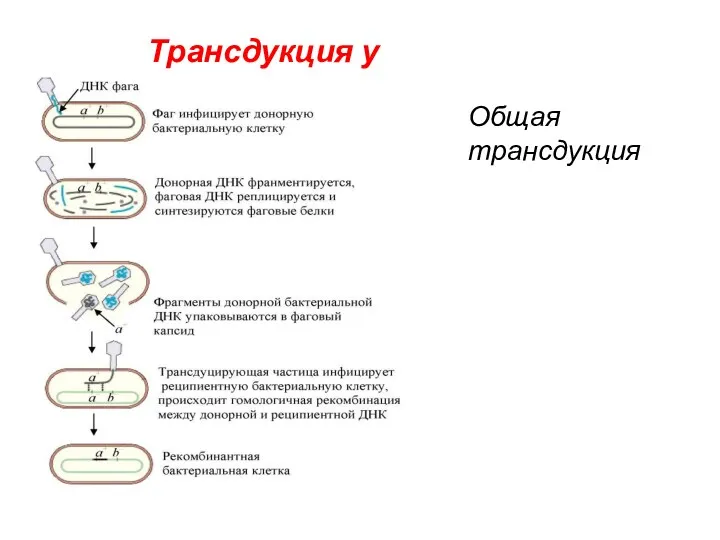
- 50. Трансдукция у бактерий Общая трансдукция
- 51. Основные этапы: Интеграция ДНК умеренного бактериофага в определенный участок хромосомы клетки-донора Захват соседних бактериальных генов (например,
- 52. Постановка опыта по передаче локуса «gal+» В опыт берут: Трансдуцирующий фаг, выделенный из «gal+» E.coli Бульонную
- 53. Результаты опыта: В контроле культуры-реципиента выросли бесцветные «gal-» колонии На опытной чашке: бесцветные «gal-» колонии культуры-реципиента
- 55. Скачать презентацию























 Значення та охорона членистоногих
Значення та охорона членистоногих Особенности строения прокариотической клетки
Особенности строения прокариотической клетки Симбиотические организмы лишайники
Симбиотические организмы лишайники Вода, її роль у життєдіяльності організмів
Вода, її роль у життєдіяльності організмів Прокариотты және эукариотты өсімдіктер клеткасы
Прокариотты және эукариотты өсімдіктер клеткасы Мы в ответе за тех, кого приручили
Мы в ответе за тех, кого приручили Внешнее строение листа
Внешнее строение листа Строение, виды и значение вирусов. Прионы. Вироиды
Строение, виды и значение вирусов. Прионы. Вироиды Покормите птиц 2020. Эколого-культурная акция
Покормите птиц 2020. Эколого-культурная акция Гигиена органов пищеварения. Предупреждение желудочно–кишечных инфекций
Гигиена органов пищеварения. Предупреждение желудочно–кишечных инфекций Ткани животных
Ткани животных Простые и сложные соцветия
Простые и сложные соцветия Дәріс №2. Жасушалық технологияның негізі– жасуша өсіндісі
Дәріс №2. Жасушалық технологияның негізі– жасуша өсіндісі Введение генов в клетки растений - основные способы
Введение генов в клетки растений - основные способы Воздействие человека и его деятельности на животных
Воздействие человека и его деятельности на животных Строение, размножение и развитие рыб
Строение, размножение и развитие рыб Функциональная анатомия мышц конечностей
Функциональная анатомия мышц конечностей Физиология пищеварения
Физиология пищеварения Семейство зайцев. Школьная научно практическая конференция
Семейство зайцев. Школьная научно практическая конференция Развитие и устойчивость экосистем
Развитие и устойчивость экосистем Регуляция кровообращения
Регуляция кровообращения Способи годівлі птахів
Способи годівлі птахів Методы биологических исследований
Методы биологических исследований Промежуточные филаменты
Промежуточные филаменты Ақтөбеде сирек кездесетін өсімдіктер
Ақтөбеде сирек кездесетін өсімдіктер Систематика класса Птицы
Систематика класса Птицы 20231221_baranova_gmo
20231221_baranova_gmo Экология и природопользование. Экосистемы
Экология и природопользование. Экосистемы