Коллоиды бывают:
1. Минеральные (преобладают в почвах):
- коллоидные формы кремнезёма;
коллоиды глинистых минералов. Ядро коллоида образованного глинистым минералом является ацидоидом, так как носит отрицательный заряд, не зависимый от рН.
ядра коллоидов аморфных полуторных (гидр)оксидов железа и алюминия имеют зависимый от рН среды переменный заряд и называются амфолитоиды.
2. Органические коллоиды: представлены амфолитоидами - полисахарами и белковыми веществами; аминогруппы белковых веществ могут быть базоидами – то есть поглощать анионы. Типичных базоидов в почвах нет. Гумусовые вещества имеют кислотную природу, поэтому они являются ацидоидами.
3. Органо-минеральные коллоиды представлены глино-гумусовым гумином, гуматы кальция и магния.
Свойства коллоидов:
1. Коагуляция – это переход коллоида из состояния золя в гель.
2. Пептизация – это переход коллоида из геля в золь.
Гель -коллоидный осадок
Золь - коллоидный раствор









 Зеленые водоросли
Зеленые водоросли Строение и функции органов дыхания
Строение и функции органов дыхания Клас Павукоподібні
Клас Павукоподібні Среды обитания живых организмов
Среды обитания живых организмов Что мы не знаем о грибах.
Что мы не знаем о грибах. Моногибридное скрещивание.Задачи.
Моногибридное скрещивание.Задачи. Пищеварительная система. Общий план строения стенки пишеварительной трубки
Пищеварительная система. Общий план строения стенки пишеварительной трубки Вегетативті жүйке жүйесі
Вегетативті жүйке жүйесі Служебные собаки
Служебные собаки Жиры, Белки и Углеводы человека
Жиры, Белки и Углеводы человека Есте сақтау қабілетінің биохимиялық механизмі
Есте сақтау қабілетінің биохимиялық механизмі Викторина по биологии и химии (вопросы)
Викторина по биологии и химии (вопросы) Біологія та майбутнє людства
Біологія та майбутнє людства Такие разные полезные бактерии
Такие разные полезные бактерии Бабочка Адмирал
Бабочка Адмирал Безусловные рефлексы, их значение. Условные рефлексы, образование и торможение
Безусловные рефлексы, их значение. Условные рефлексы, образование и торможение Регуляція вісцеральних функцій організму. Фізіологія автономної нервової системи
Регуляція вісцеральних функцій організму. Фізіологія автономної нервової системи Понятие об организме. Доядерные и ядерные организмы
Понятие об организме. Доядерные и ядерные организмы Органы и системы органов
Органы и системы органов ПРЕДПРОФИЛЬНЫЙ КУРС ХИМИЯ И ПРАКТИЧЕСКОЕ РАТЕНИЕВОДСТВО КАК СРЕДСТВО ФОРМИРОВАНИЯ УУД И РАЗВИТИЯ ТВОРЧЕСКОЙ АКТИВНОСТИ ОБУЧАЮЩИХСЯ
ПРЕДПРОФИЛЬНЫЙ КУРС ХИМИЯ И ПРАКТИЧЕСКОЕ РАТЕНИЕВОДСТВО КАК СРЕДСТВО ФОРМИРОВАНИЯ УУД И РАЗВИТИЯ ТВОРЧЕСКОЙ АКТИВНОСТИ ОБУЧАЮЩИХСЯ Гистология. Электронный альбом
Гистология. Электронный альбом Энзимология. Структура и механизм действия ферментов. (Лекция 2)
Энзимология. Структура и механизм действия ферментов. (Лекция 2) Предпосылки эволюционных преобразований органов. Аномалии и пороки развития
Предпосылки эволюционных преобразований органов. Аномалии и пороки развития Определение пола. Наследование признаков, сцепленных с полом
Определение пола. Наследование признаков, сцепленных с полом Приспособления организмов к среде обитания
Приспособления организмов к среде обитания Structure of DNA and its function
Structure of DNA and its function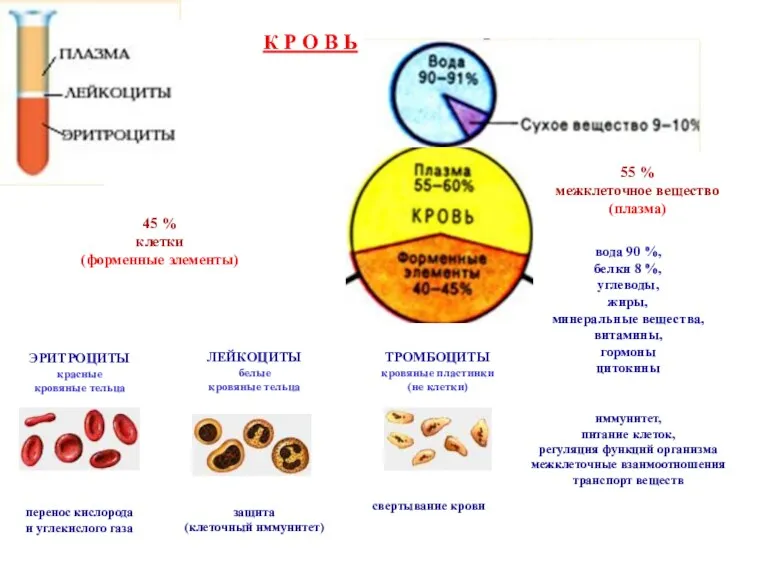 Кровь
Кровь Разработка урока по биологии Углеводы и липиды 9 класс (проектная деятельность)
Разработка урока по биологии Углеводы и липиды 9 класс (проектная деятельность)