Содержание
- 2. Генная инженерия, или техника рекомбинантных ДНК, - это совокупность приемов, позволяющих in vitro перенести генетический материал
- 3. Методами генной инженерии возможно преодолевать межвидовые барьеры, то есть переносить гены и передавать отдельные наследственные признаки
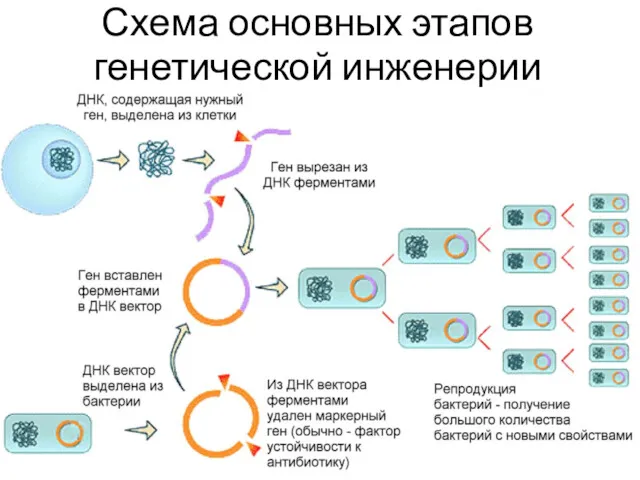
- 4. I выделение нужного (целевого) гена; II встраивание гена в генетический элемент, способный к репликации (вектор); III
- 5. Схема основных этапов генетической инженерии
- 6. А. Химико-ферментативный синтез генов применяют наиболее часто. Химическим путем синтез олигонуклеотиды или праймеры (короткие одноцепочечные фрагменты
- 7. Б. Синтез генов с помощью обратной транскрипции на мРНК. Выделяют мРНК соответствующего гена из полирибосом и
- 8. Гены также могут быть получены из уже созданных геномных библиотек, которые представляют собой совокупность фрагментов геномной
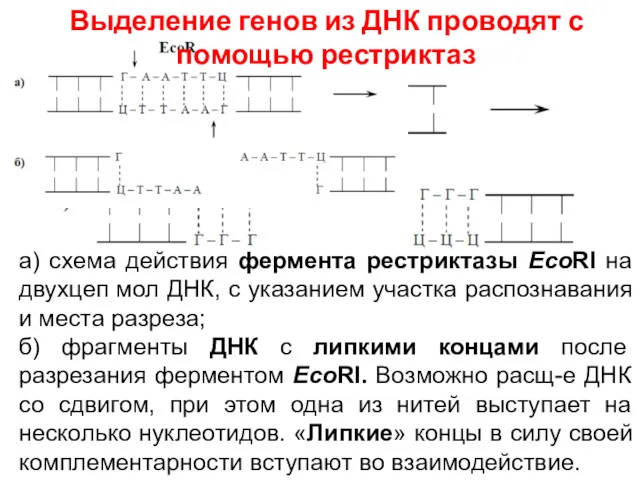
- 9. Необходимо точно знать расположение гена и вырезать его при помощи рестриктаз. Каждая из рестриктаз узнает свой
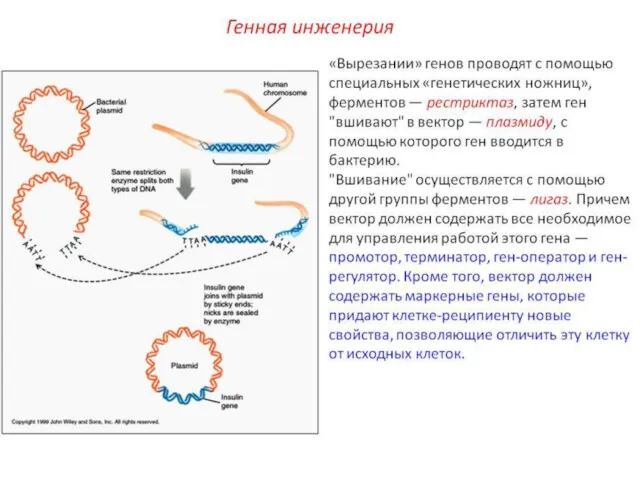
- 10. Выделенный или синтезированный ген не может самостоятельно встраиваться в ДНК клетки-мишени и тем более начинать функционировать.
- 11. вектор должен быть небольшим и содержать сайты рестрикции для нескольких рестриктаз, должен обладать определенной емкостью; вектор
- 12. иметь функциональный ген промотор (прокариотический или эукариотический), способный экспрессироваться в клетке; - должен иметь маркерный ген,
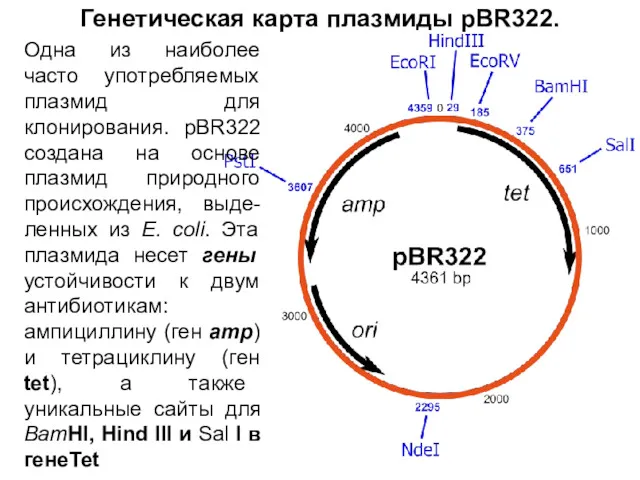
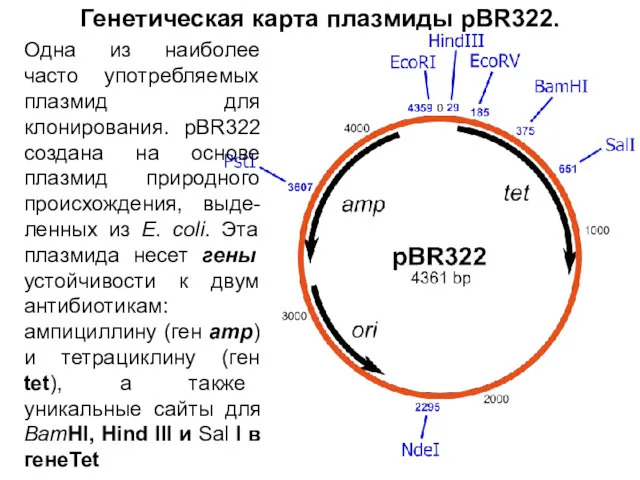
- 14. Генетическая карта плазмиды pBR322. Одна из наиболее часто употребляемых плазмид для клонирования. pBR322 создана на основе
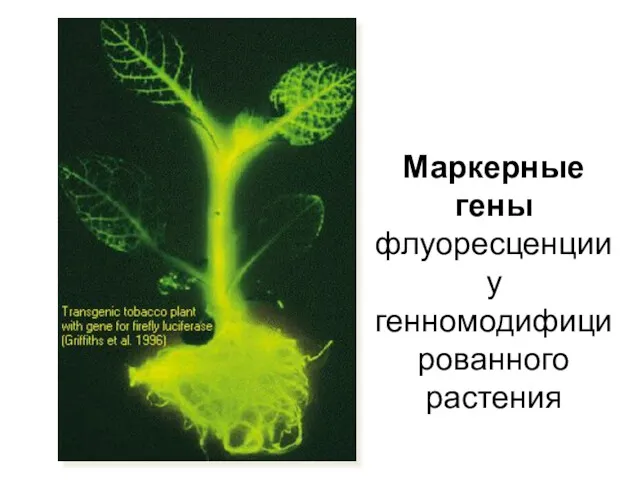
- 15. Маркерные гены флуоресценции у генномодифицированного растения
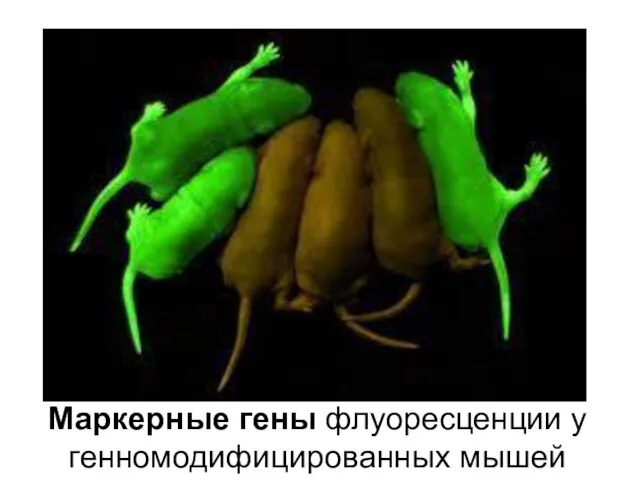
- 16. Маркерные гены флуоресценции у генномодифицированных мышей
- 17. В качестве прокариотических векторов чаще используют плазмиды бактерий, бактериофаги. Плазмиды бактерий способны реплицироваться независимо от хромосомы
- 18. Бактериальные клетки, содержащие такой вектор, устойчивы одновременно к ампициллину и тетрациклину. Плазмидные векторы удобны для клонирования
- 19. Бактериофаги – вирусы бактерий способны встраиваться в геном клетки хозяина (вызывать лизогенизацию). Бактериофаги широко распространены в
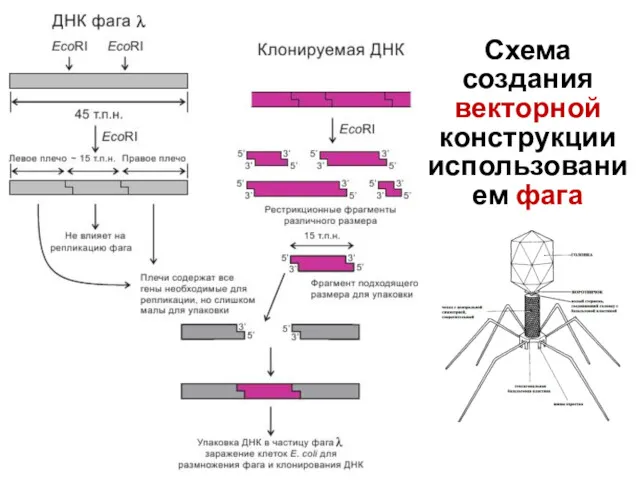
- 20. Из ДНК фага удаляют области, не существенные для репликации в клетках E.coli, и оставляют сайты, предназначенные
- 21. Схема создания векторной конструкции использованием фага
- 22. В качестве эукариотических векторов используют вирусы животных и растений, Ti плазмиды агробактерий (Agrobakterium tumefaciens), а также
- 23. Очищенную кольцевую плазмиду E.coli pBR322 обрабатывают ферментом рестриктазой BamH1, которая специфически разрезает плазмиду в единственном сайте,
- 24. Некоторые рестриктазы и расщепляемые ими последовательности.
- 25. а) схема действия фермента рестриктазы EcoRI на двухцеп мол ДНК, с указанием участка распознавания и места
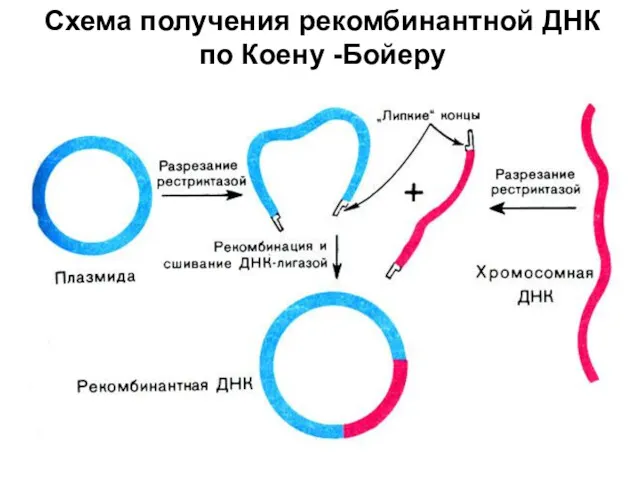
- 26. Схема получения рекомбинантной ДНК по Коену -Бойеру
- 27. Поскольку липкие концы этих двух ДНК взаимно комплементарны, они спариваются с образованием гибридных молекул. Далее смесь
- 28. При включении фрагментов ДНК в участок гена резистентности к тетрациклину, устойчивость к тетрациклину из-за этой вставки
- 29. Генетическая карта плазмиды pBR322. Одна из наиболее часто употребляемых плазмид для клонирования. pBR322 создана на основе
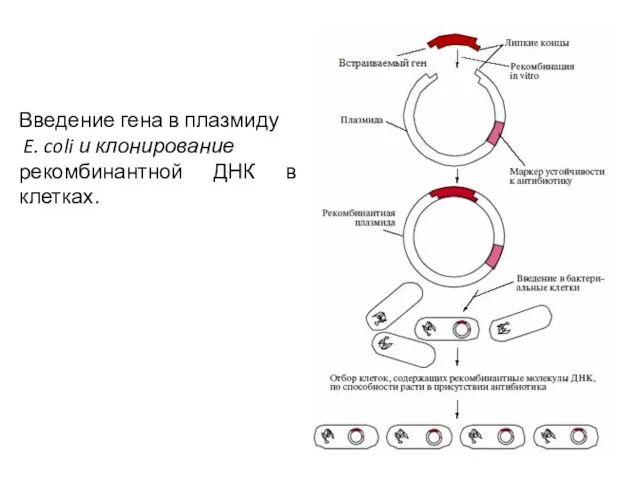
- 30. Введение гена в плазмиду E. coli и клонирование рекомбинантной ДНК в клетках.
- 31. Для того чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться в
- 32. Для введения вектора делают клетки компетентными путем обработки хлористым кальцием, полиэтиленгликолем, тепловым ударом или лизоцимом, после
- 33. В эту же область встраивают маркерные гены, для отличия рекомбинантной ДНК от исходного вектора. Ёмкость бактериофага
- 34. а) конъюгация – генетический материал клеток при сближении переходит из одной клетки в другую в виде
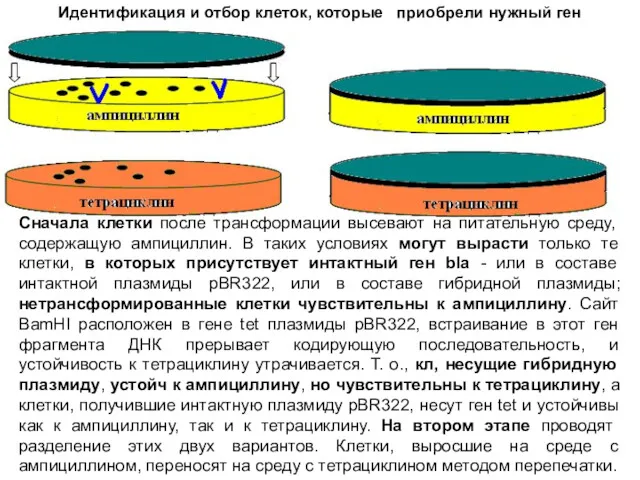
- 36. осуществляют уже после клонирования в клетках E. coli. Сначала клетки после трансформации высевают на питательную среду,
- 37. На втором этапе проводят разделение этих двух вариантов. Клетки, выросшие на среде с ампициллином, переносят на
- 38. Сначала клетки после трансформации высевают на питательную среду, содержащую ампициллин. В таких условиях могут вырасти только
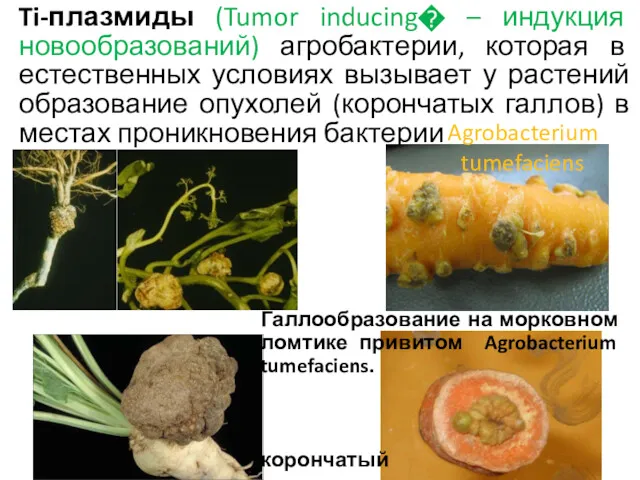
- 39. Ti-плазмиды (Tumor inducing� – индукция новообразований) агробактерии, которая в естественных условиях вызывает у растений образование опухолей
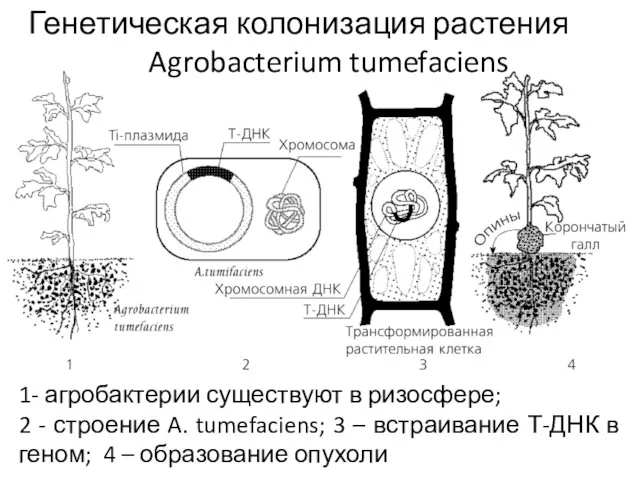
- 40. Генетическая колонизация растения Agrobacterium tumefaciens 1- агробактерии существуют в ризосфере; 2 - строение A. tumefaciens; 3
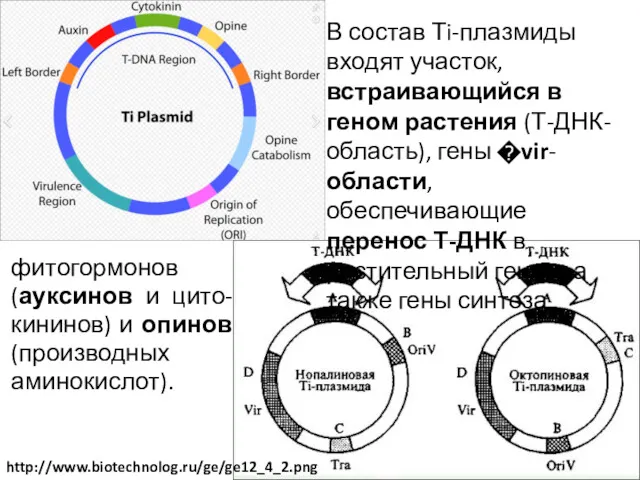
- 41. В состав Тi-плазмиды входят участок, встраивающийся в геном растения (Т-ДНК- область), гены �vir-области, обеспечивающие перенос Т-ДНК
- 42. Т. о., кроме Т-ДНК в плазмидах имеются область, кодирующая функцию конъюгации (Tra), область репликации (Ori V)
- 44. Скачать презентацию


























 An introduction to metabolism
An introduction to metabolism Счастливый случай. 7 класс
Счастливый случай. 7 класс Фрукты и овощи. Польза
Фрукты и овощи. Польза Пингвины (фото и картинки)
Пингвины (фото и картинки) Микрофлора организма человека
Микрофлора организма человека Исследовательская деятельность на уроках биологии и во внеурочное время как средство развития творческих способностей
Исследовательская деятельность на уроках биологии и во внеурочное время как средство развития творческих способностей Межвидовые взаимоотношения организмов Виды биотических взаимоотношений (2)
Межвидовые взаимоотношения организмов Виды биотических взаимоотношений (2) Сенсорные системы
Сенсорные системы Домашние животные и птицы
Домашние животные и птицы Улитки ахатины, как домашние животные
Улитки ахатины, как домашние животные Биологиялық белсенді затттардың сапалық құрамы мен сандық мөлшеріне әсер ететін факторлар
Биологиялық белсенді затттардың сапалық құрамы мен сандық мөлшеріне әсер ететін факторлар Самые необычные животные планеты
Самые необычные животные планеты Размножение и развитие человека
Размножение и развитие человека Что такое плесень и откуда она берется?
Что такое плесень и откуда она берется? Систематика и характеристика голосеменных растений
Систематика и характеристика голосеменных растений Декоративные растения. Основы ландшафтной композиции
Декоративные растения. Основы ландшафтной композиции Выращивание из семян растения мушмула
Выращивание из семян растения мушмула Птицы леса. Желна
Птицы леса. Желна Дикие животные леса. Для дошкольников. (Часть 1)
Дикие животные леса. Для дошкольников. (Часть 1) Ядовитые растения и животные
Ядовитые растения и животные Введение в физиологию. Возбудимые ткани
Введение в физиологию. Возбудимые ткани Структура нуклеиновых кислот и белков
Структура нуклеиновых кислот и белков Животные национальные символы стран мира
Животные национальные символы стран мира Знакомые незнакомцы. Лесной доктор - дятел
Знакомые незнакомцы. Лесной доктор - дятел Генетика человека. Генетические методы. Терминология
Генетика человека. Генетические методы. Терминология Среды жизни планеты Земля
Среды жизни планеты Земля Класс Пресмыкающиеся, или Рептилии
Класс Пресмыкающиеся, или Рептилии Методи розведення сільськогосподарських тварин, добір та підбір тварин
Методи розведення сільськогосподарських тварин, добір та підбір тварин