Содержание
- 2. История открытия и изучения В 1908 г. русский учёный-гистолог Александр Александрович Максимов сделал доклад на съезде
- 3. 1970 год – Пеpвые тpанcплантации cтволовых клеток. Еcть cведения, что в 70-х годах в бывшем CCCP
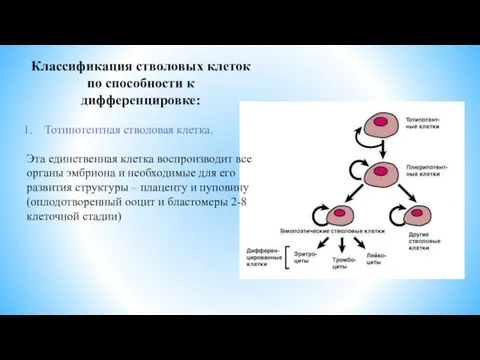
- 4. Классификация стволовых клеток по способности к дифференцировке: Тотипотентная стволовая клетка. Эта единственная клетка воспроизводит все органы
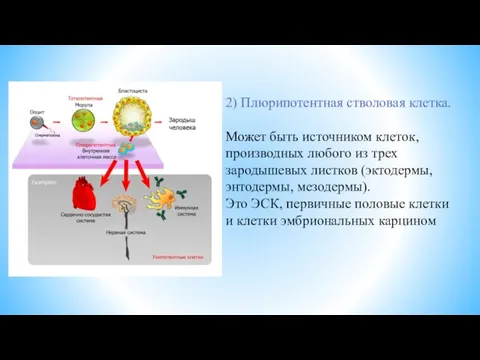
- 5. 2) Плюрипотентная стволовая клетка. Может быть источником клеток, производных любого из трех зародышевых листков (эктодермы, энтодермы,
- 6. 3) Мультипотентная стволовая клетка. Способна образовывать специализированные клетки нескольких типов (печени, крови и т.д.) 4) Унипотентная
- 7. Источники выделения стволовых клеток Эмбриональные стволовые клетки(ЭСК) получают из внутренней клеточной массы бластоцисты, которая формируется к
- 8. все СК костного мозга тканеспецифичные стволовые клетки располагаются в различных видах тканей и отвечают за обновление
- 9. – СК кожи; – СК жировой ткани; – СК нервной ткани; – СК мышечной ткани; –
- 10. Популяция стволовых клеток кожи. Основным клеточным компонентом являются кератиноциты Базальный слой эпидермиса включает стволовые и транзиторные
- 11. СК жировой ткани По данным литературы, из 1 мл жира сразу после его забора можно выделить
- 12. Нейральные стволовые клетки Нейрогенез и самообновление нейральных стволовых клеток в ЦНС обнаружено в строго локализованных областях
- 13. СК мышечной ткани – клетки-сателлиты. являются предшественниками миоцитов поперечно-полосатой мускулатуры и располагаются под базальной мембраной мышечного
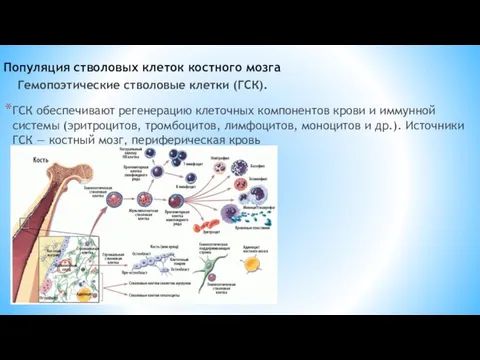
- 14. Популяция стволовых клеток костного мозга ГСК обеспечивают регенерацию клеточных компонентов крови и иммунной системы (эритроцитов, тромбоцитов,
- 15. Мезенхимальные (стромальные) стволовые клетки (МСК). МСК костного мозга представляют собой популяцию плюрипотентных клеток, способных дифференцироваться в
- 16. Основные свойства СКК Способность к самообновлению и пролиферации- длительному размножению и продукции большого кол-ва себе подобных
- 17. Отличия стволовой клетки от соматической В отличии от соматической клетки, стволовая клетка является бессмертной (иммортальной) Отличаются
- 18. Индуцированные плюрипотентные стволовые клетки (ИПСК) ИПСК – клетки, полученные при репрограммировании соматических клеток человека, путем переноса
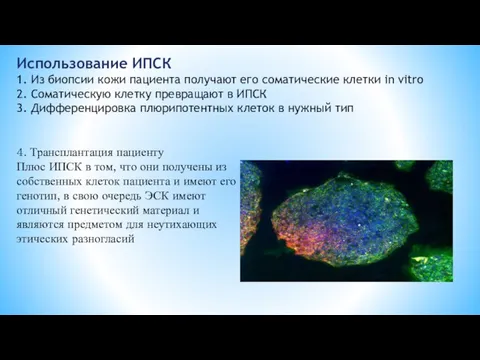
- 19. Использование ИПСК 1. Из биопсии кожи пациента получают его соматические клетки in vitro 2. Соматическую клетку
- 20. Основные направления, по которым развиваются биомедицинские клеточные технологии: Технологии культивирования (получения, хранения СК); Создание банков (хранение,
- 21. Технологии культивирования (получения, хранения СК) Данная технология постепенно сложилась на протяжении последних 100 лет. Еще в
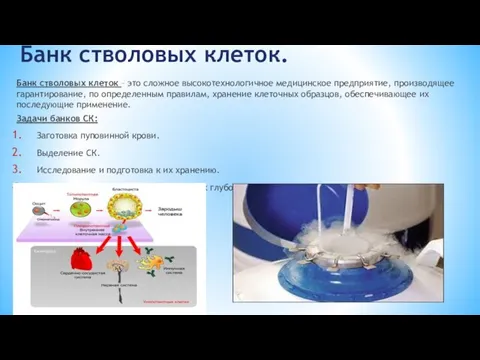
- 22. Банк стволовых клеток. Банк стволовых клеток – это сложное высокотехнологичное медицинское предприятие, производящее гарантирование, по определенным
- 23. Терапевтическое клонирование. В терапевтическом клонировании используется процесс, известный как пересадка ядер соматических клеток, (замена ядра клетки,
- 24. Генная инженерия. Генная инженерия – это одно из клеточных инновационных технологий XXI века, при которой применяют
- 25. Тканевая инженерия. Тканевая инженерия - создание новых тканей и органов для терапевтической реконструкции поврежденного органа посредством
- 26. Регенеративная медицина. Регенеративная медицина – это современное направление медицины, позволяющее восстанавливать нарушенные функции органа или целого
- 27. Иммуногистоцитохимия – метод идентификации и определения локализации в клетке и тканях различных структур, имеющих антигенные свойства,
- 28. Эти методы широко используются для: 1. дифференциальной диагностики опухолей, определения источника 2.метастаза при неясном очаге опухоли,
- 29. Принцип метода Основой ИГХ-метода является иммунологическая реакция антигена и антитела. ИГХ-методы позволяют локализовать и идентифицировать клеточные
- 30. Моноклональные антитела получают методом гибридной технологии. Несмотря на то, что их получение многоэтапное и сложное, они,
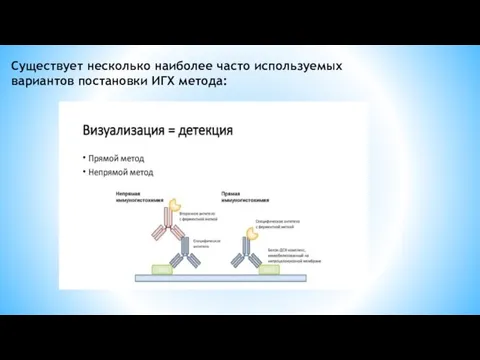
- 31. Существует несколько наиболее часто используемых вариантов постановки ИГХ метода:
- 33. Учет результатов исследования. Для учета результатов ИГХ-исследования необходим световой микроскоп соответствующего класса. Системы архивации и анализа
- 34. Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли. Иммуногистохимическое
- 35. Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов
- 36. 1. ER / PR (Эстрогеновые и прогестероновые рецепторы, ER- еstrogen receptor, PR-progesterone receptor) ER и PR
- 37. 2. Her2Neu (от англ. Human Epidermal Growth Factor Receptor 2) Her2Neu - это рецептор эпидермального фактора
- 38. 3. Ki-67 Ki-67 - это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и
- 39. Иммуннофлюоресценция Более полувека назад иммунофлюоресценция, ворвавшись в медицину, совершила технологическую революцию в изучении патогенеза и разработке
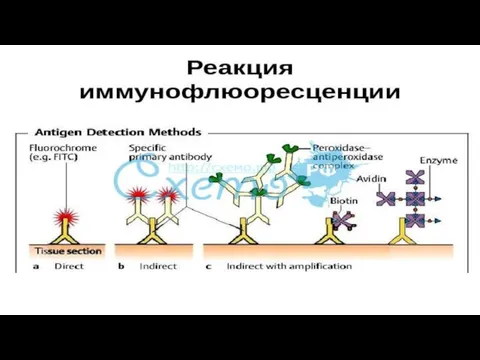
- 40. Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических АГ с помощью АТ, конъюгированных
- 41. Применение Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения АТ
- 42. Классификация Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что
- 46. Механизм действия Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают
- 47. Проточная цитофлуориметрия - это метод, основанный на измерении светорассеивания и специфической флуоресценции клеток при освещении их
- 48. Для того чтобы отличить клетки друг от друга и проанализировать их параметры ЦФ Ее физические принципы
- 50. В ходе анализа возможно определять 5-10 различных параметров клетки: размер, содержание ДНК, белков и липидов, антигенные
- 51. Преимущества проточной цитометрии Проточная цитометрия является достаточно мощным методом с массой уникальных достоинств: быстрый анализ (до
- 53. Скачать презентацию









































 Предмет и задачи медицинской микробиологии (лекция 1)
Предмет и задачи медицинской микробиологии (лекция 1) فيتامين C بدون حركات
فيتامين C بدون حركات Субстратное фосфорилирование. Виды брожения
Субстратное фосфорилирование. Виды брожения Закономерности преобразования функций органов в филогенезе. Примеры изменений функций органов у человека
Закономерности преобразования функций органов в филогенезе. Примеры изменений функций органов у человека Царство Животные. Общая характеристика. Классификация животных
Царство Животные. Общая характеристика. Классификация животных Движение крови по сосудам. Регуляция кровоснабжения
Движение крови по сосудам. Регуляция кровоснабжения HLA антигендері мен аурушандыққа тұқым қуалау бейімділігінің байланысы
HLA антигендері мен аурушандыққа тұқым қуалау бейімділігінің байланысы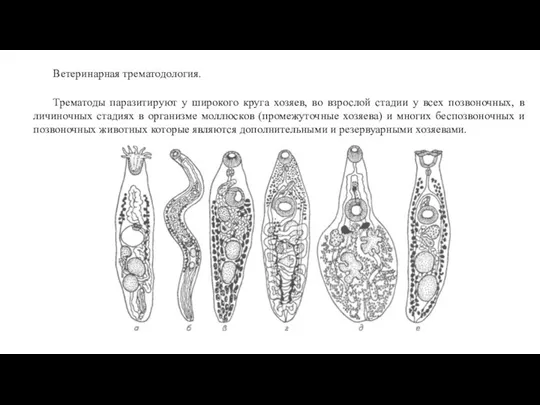 Ветеринарная трематодология
Ветеринарная трематодология Генетика мікроорганізмів
Генетика мікроорганізмів The main mechanisms of speciation
The main mechanisms of speciation Науки о человеке и их методы. 8 класс
Науки о человеке и их методы. 8 класс Тварини і рослини які находяться під загрозою зникнення
Тварини і рослини які находяться під загрозою зникнення Отделы нервной системы
Отделы нервной системы Зоопарки мира
Зоопарки мира Лимбическая система
Лимбическая система Презентация учеников Канарейка
Презентация учеников Канарейка Биология. Живая природа
Биология. Живая природа Факторы эволюции, их генетические основы. Лекция 4
Факторы эволюции, их генетические основы. Лекция 4 Эндокринная система. Роль эндокринной регуляции. Функция желез внутренней секреции
Эндокринная система. Роль эндокринной регуляции. Функция желез внутренней секреции Теорії Ж.Б. Ламарка
Теорії Ж.Б. Ламарка Пластиды (пластос - оформленный)
Пластиды (пластос - оформленный) Рассказ об увиденных растениях и животных на территории зеленых насаждений нашей школы №54
Рассказ об увиденных растениях и животных на территории зеленых насаждений нашей школы №54 Ткани растений
Ткани растений Эволюция строения и функций органов и их систем
Эволюция строения и функций органов и их систем Сосуды малого и большого кругов кровообращения
Сосуды малого и большого кругов кровообращения Структурно-функціональна організація клітини. (Лекція 1)
Структурно-функціональна організація клітини. (Лекція 1) Увеличение антропогенного пресса водоёмы
Увеличение антропогенного пресса водоёмы Тест по биологии (7 класс) по теме Моллюски для системы тестирования PROClass
Тест по биологии (7 класс) по теме Моллюски для системы тестирования PROClass