Содержание
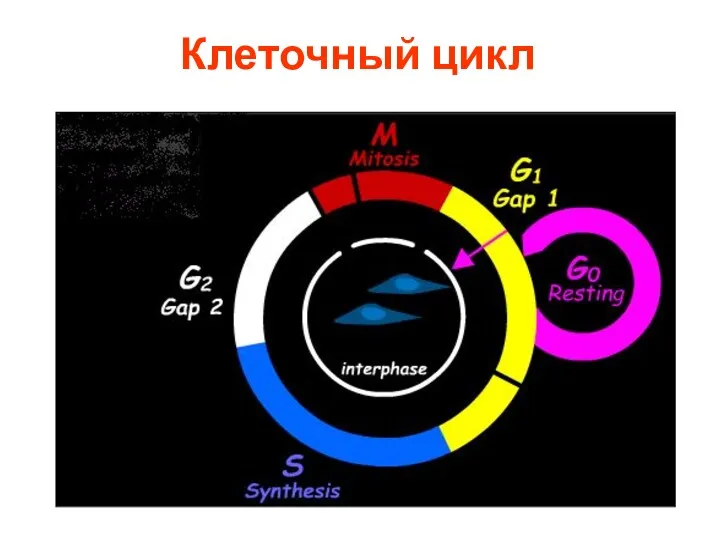
- 2. Клеточный цикл
- 3. Определение фаз КЦ Период между двумя делениями называется интерфазой. В клетках млекопитающих интерфаза длится от 12
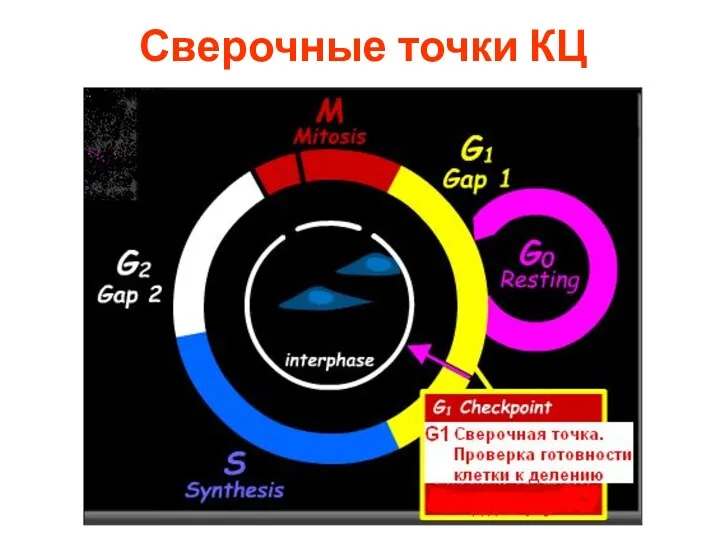
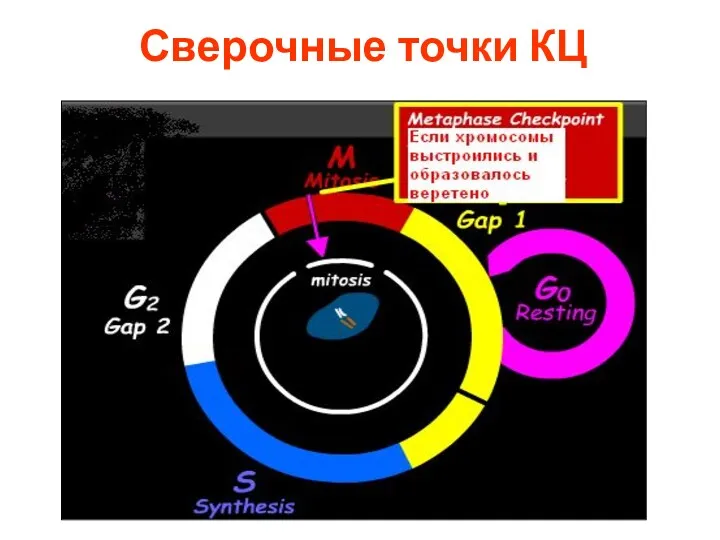
- 4. Сверочные точки КЦ
- 5. G1-сверочная точка Проверка повреждения ДНК Роль белка р53
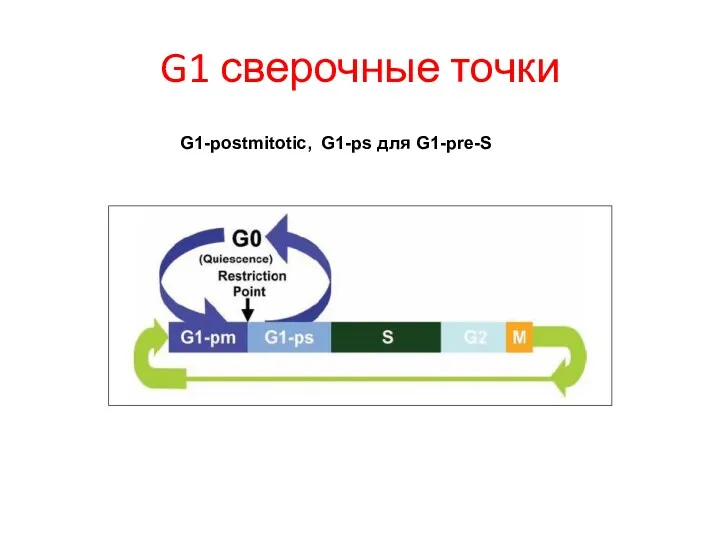
- 6. G1 сверочные точки G1-postmitotic, G1-ps для G1-pre-S
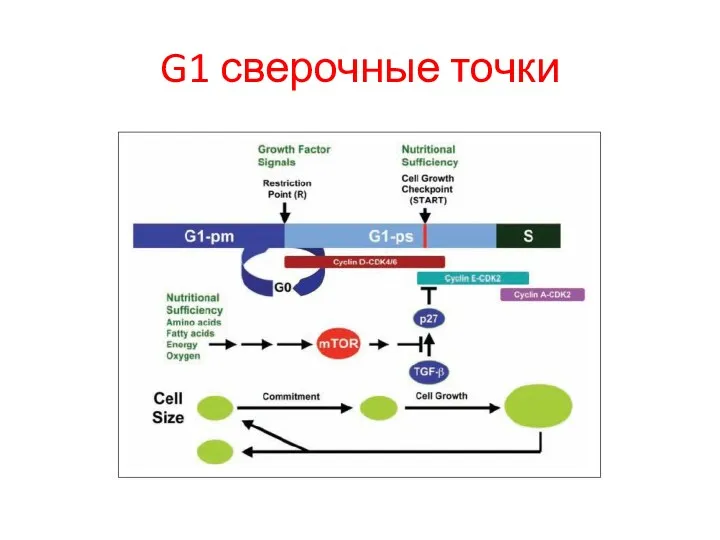
- 7. G1 сверочные точки
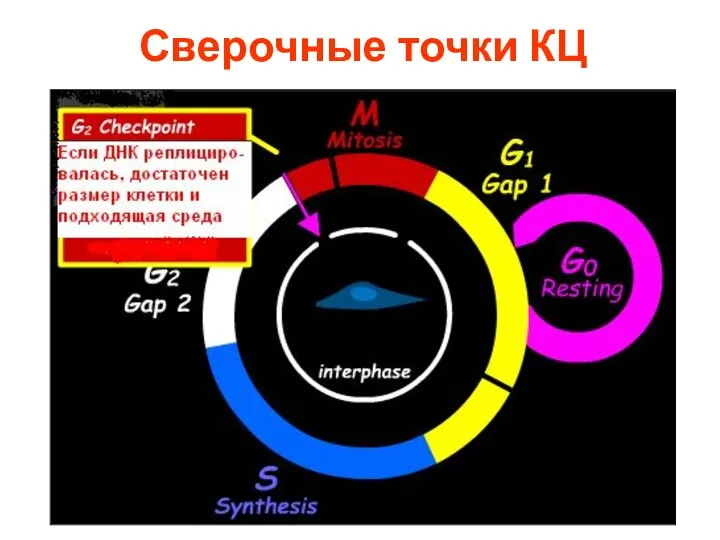
- 8. Сверочные точки КЦ
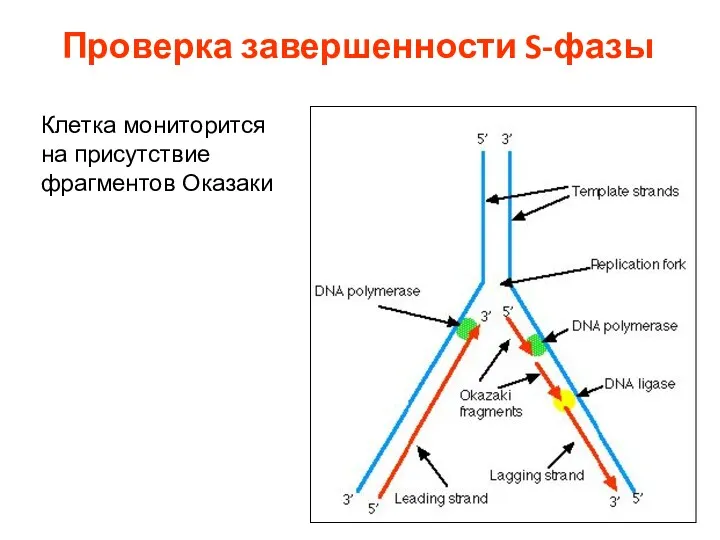
- 9. Проверка завершенности S-фазы Клетка мониторится на присутствие фрагментов Оказаки
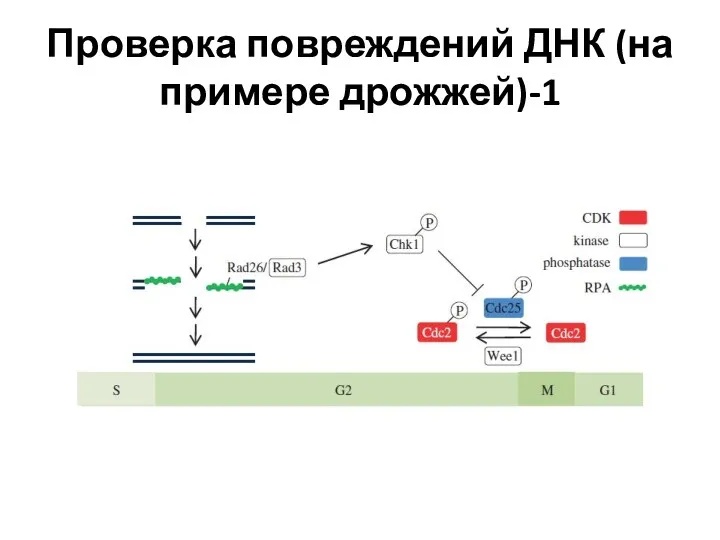
- 10. Проверка повреждений ДНК (на примере дрожжей)-1
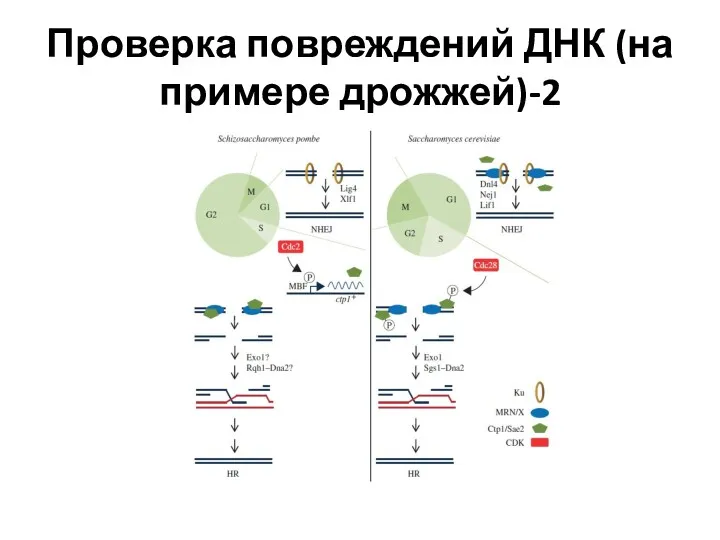
- 11. Проверка повреждений ДНК (на примере дрожжей)-2
- 12. Сверочные точки КЦ
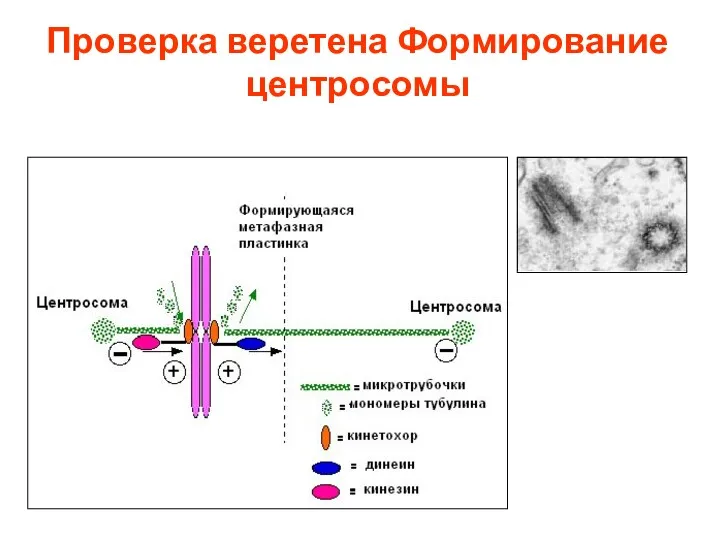
- 13. Проверка веретена Формирование центросомы
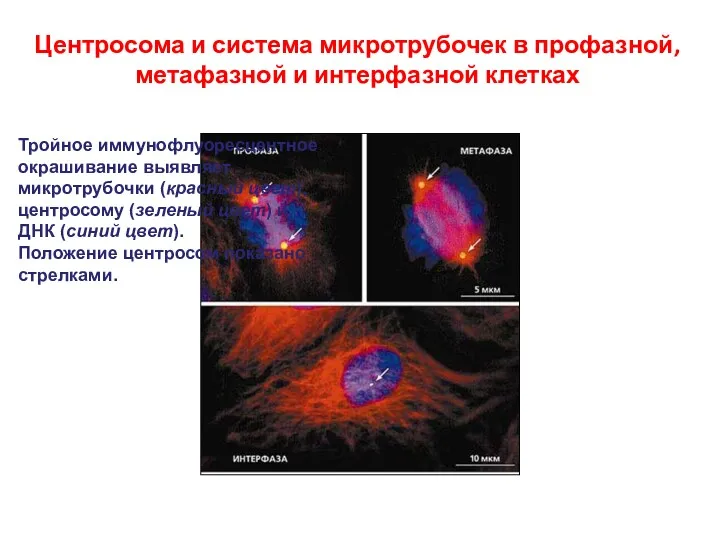
- 14. Центросома и система микротрубочек в профазной, метафазной и интерфазной клетках Тройное иммунофлуоресцентное окрашивание выявляет микротрубочки (красный
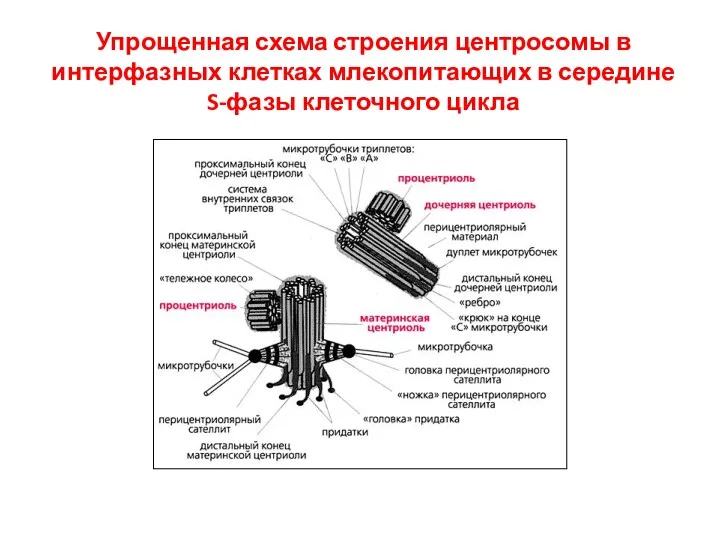
- 15. Упрощенная схема строения центросомы в интерфазных клетках млекопитающих в середине S-фазы клеточного цикла
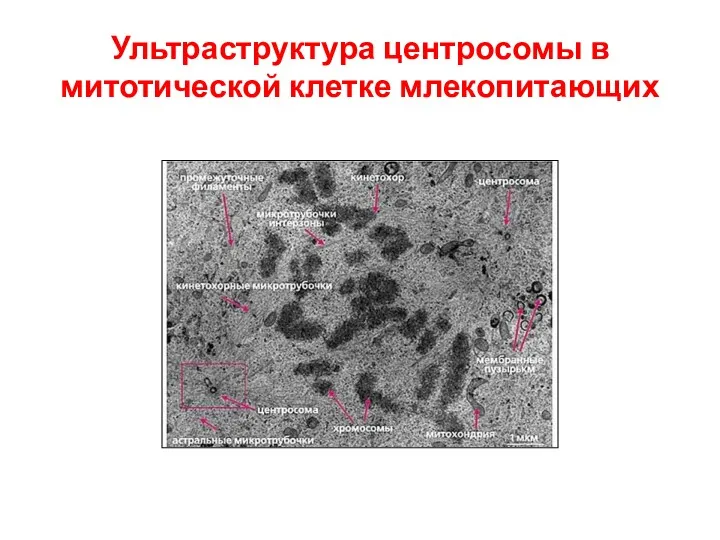
- 16. Ультраструктура центросомы в митотической клетке млекопитающих
- 17. Роль BRCА1 в формировании центросомы BRCA1 - обладает убиквитин-зависимой лигазной активностью. Контролирует локализацию гамма-тубулина в центросоме
- 18. Регуляция центросом BRCA1-зависимой убиквитиновой лигазой и Aurora A киназой Результат потери функции BRCA1 и переэкспрессии AURRA
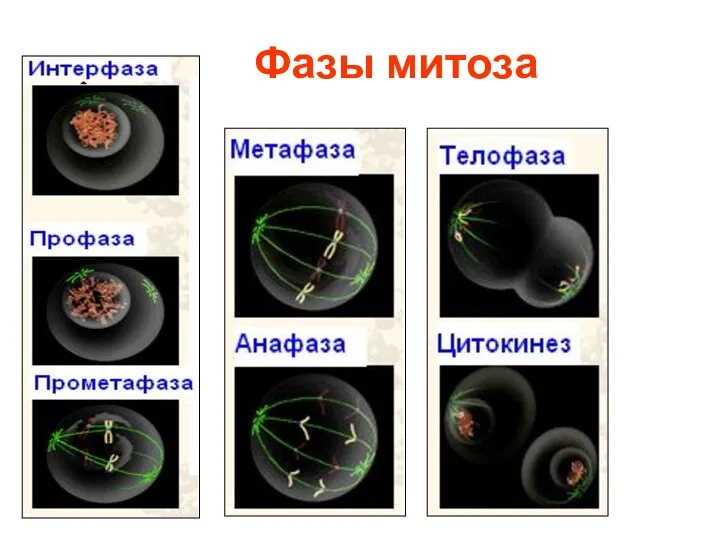
- 19. Фазы митоза
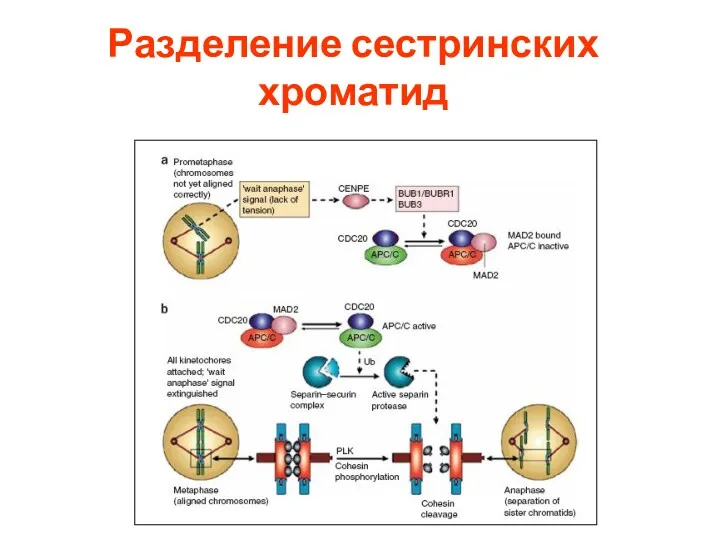
- 20. Разделение сестринских хроматид
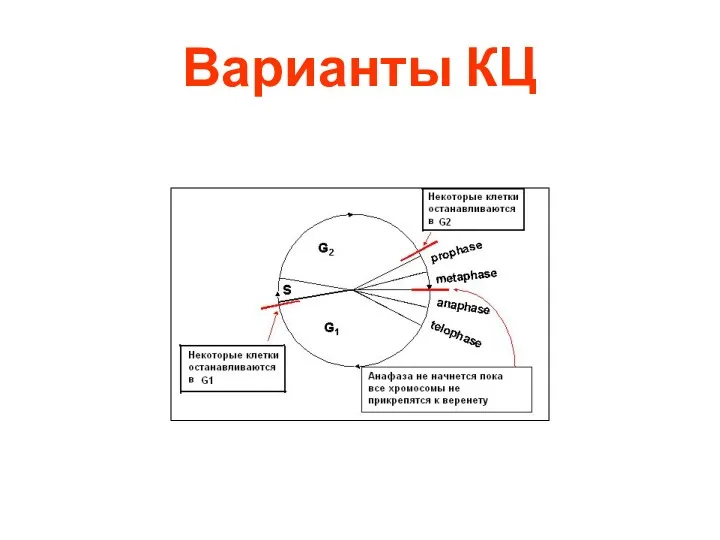
- 21. Варианты КЦ
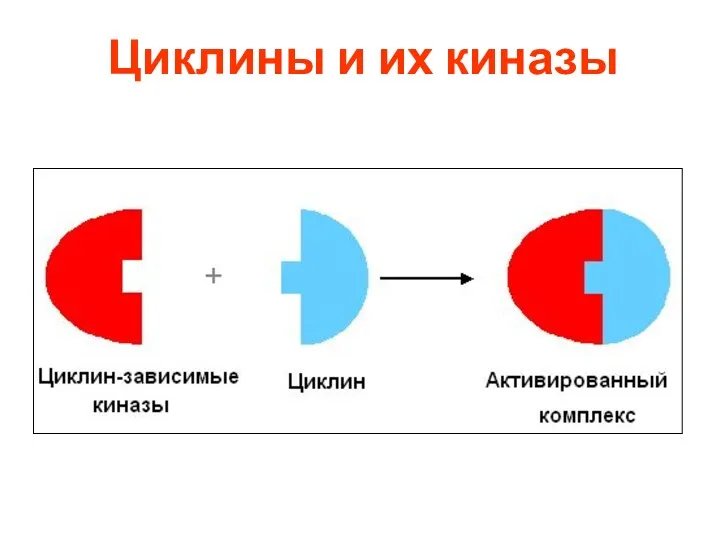
- 22. Циклины и их киназы
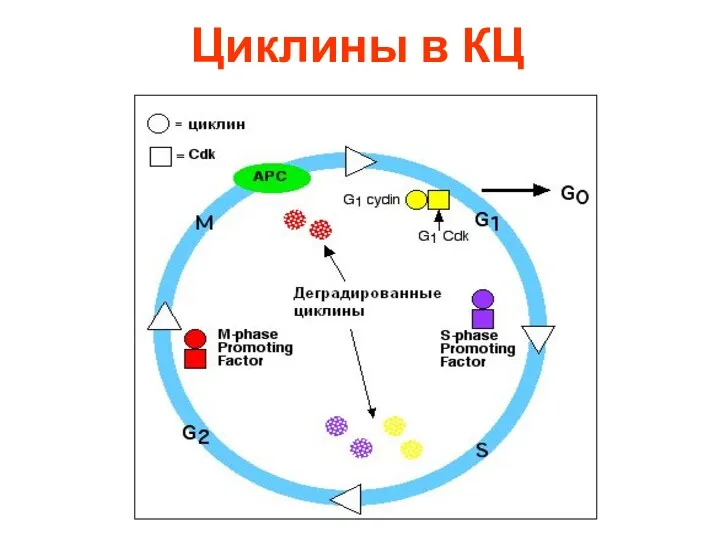
- 23. Циклины в КЦ
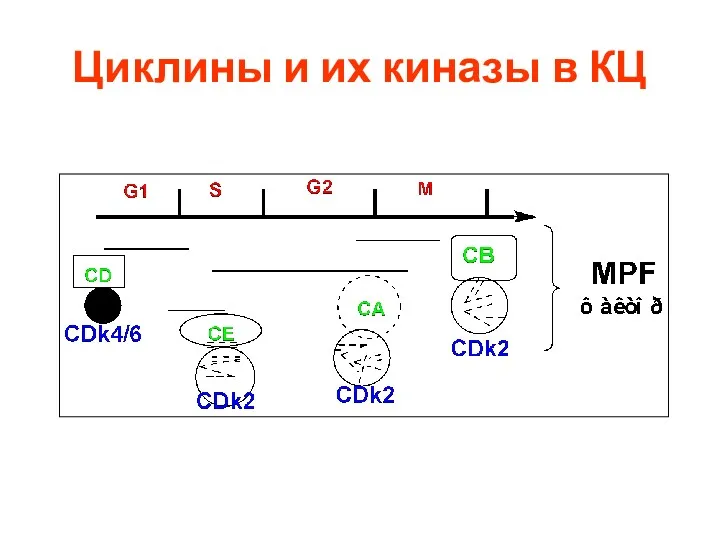
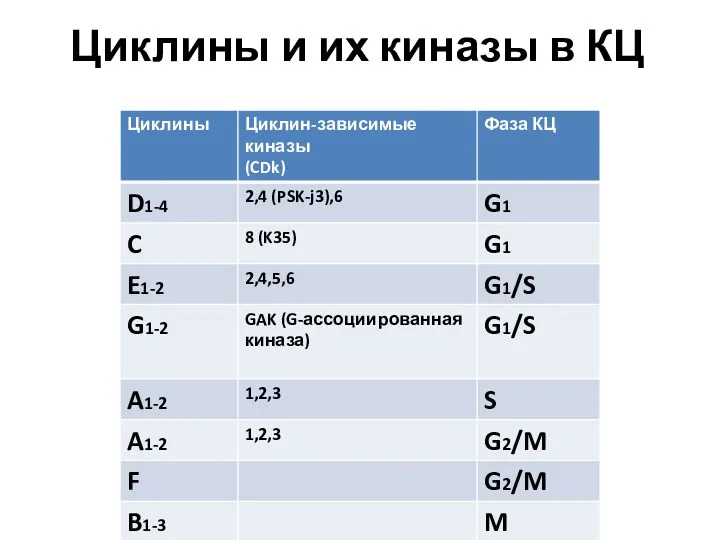
- 24. Циклины и их киназы в КЦ
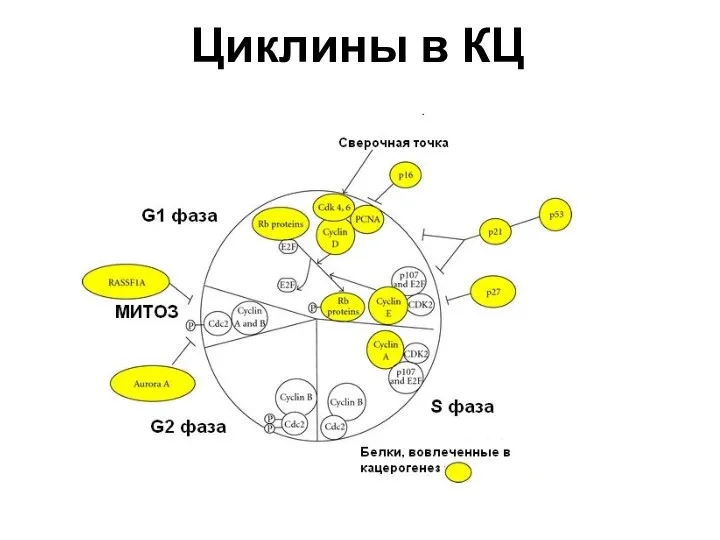
- 25. Циклины в КЦ
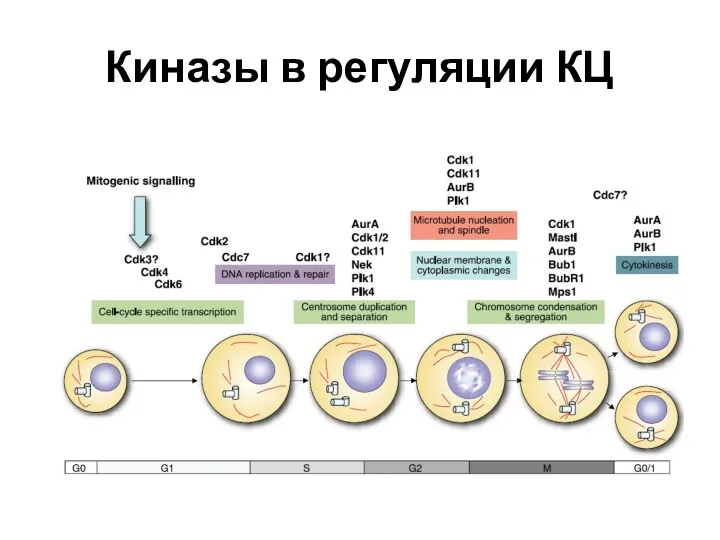
- 26. Киназы в регуляции КЦ
- 27. Циклины и их киназы в КЦ
- 28. CDk, циклины и их субстраты-1
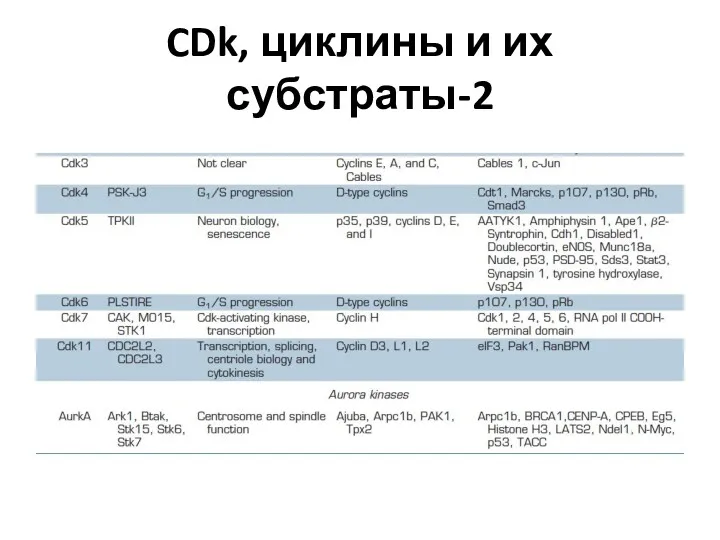
- 29. CDk, циклины и их субстраты-2
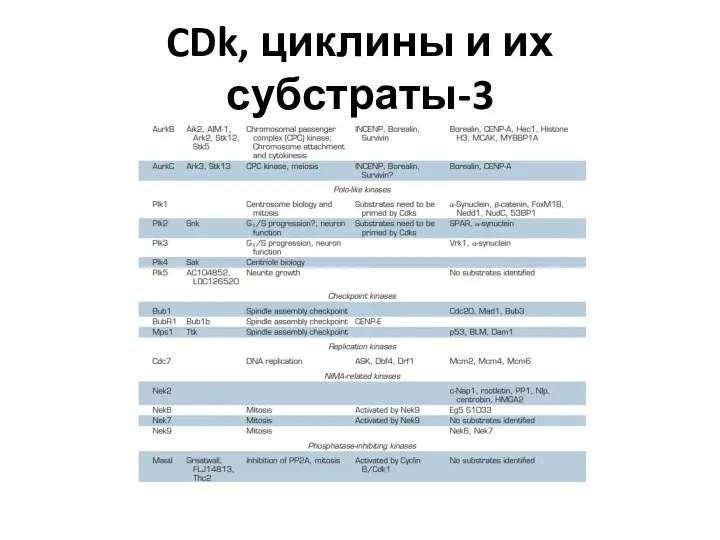
- 30. CDk, циклины и их субстраты-3
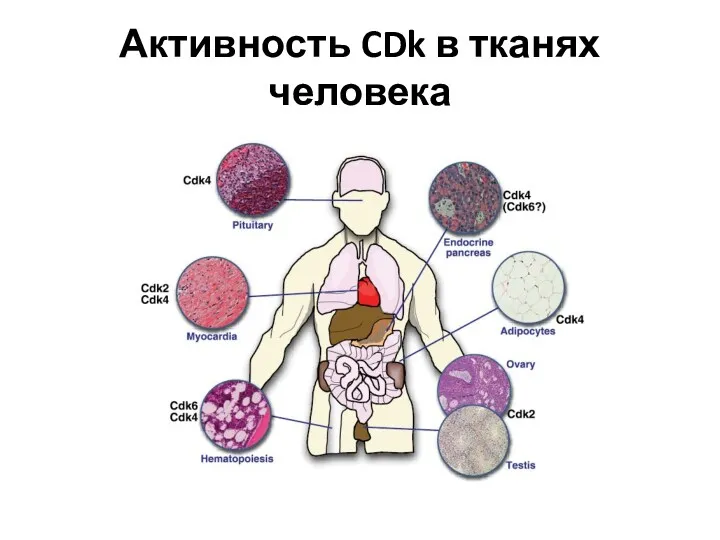
- 31. Активность CDk в тканях человека
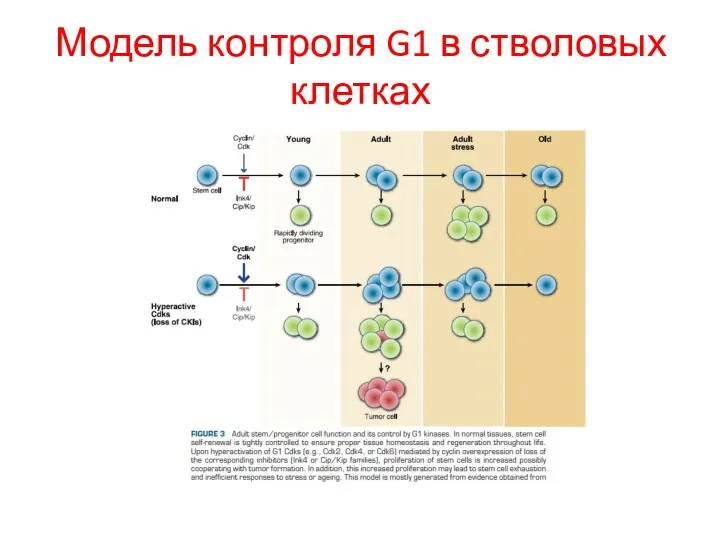
- 32. Модель контроля G1 в стволовых клетках
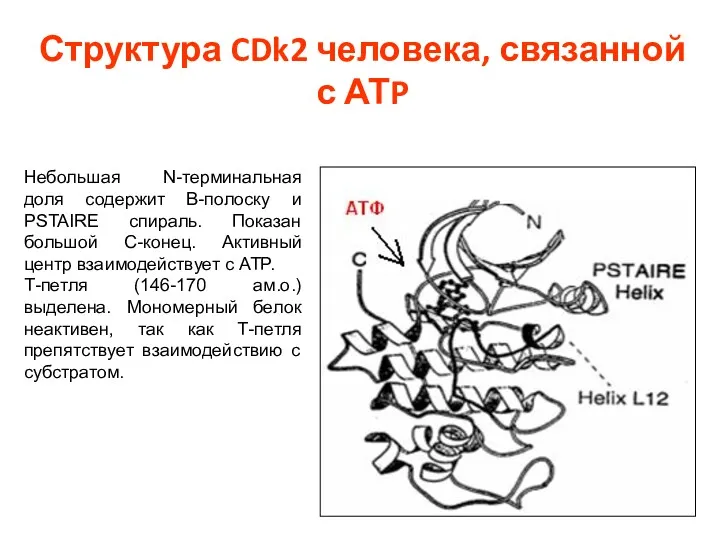
- 33. Структура CDk2 человека, связанной с АТP Небольшая N-терминальная доля содержит В-полоску и PSTAIRE спираль. Показан большой
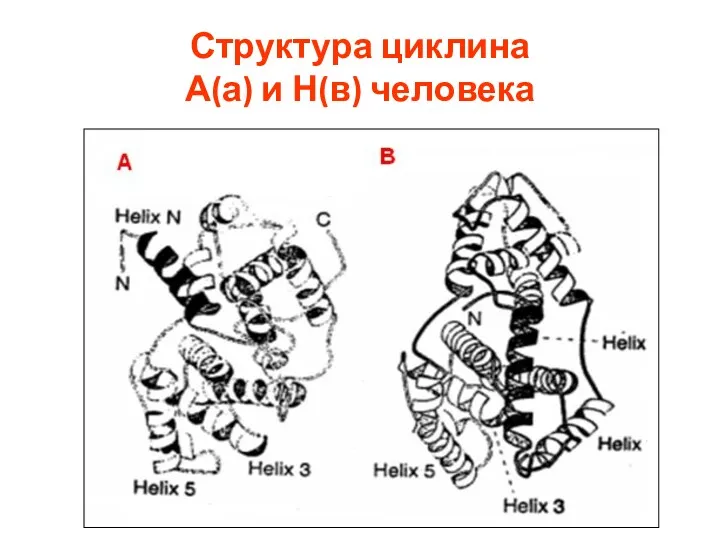
- 34. Структура циклина А(а) и Н(в) человека
- 35. Структура Cdk2-циклин А1-АТP комплекса человека Cdk2 расположена слева. Циклин А – справа. Т-петля обозначена черной стрелкой.
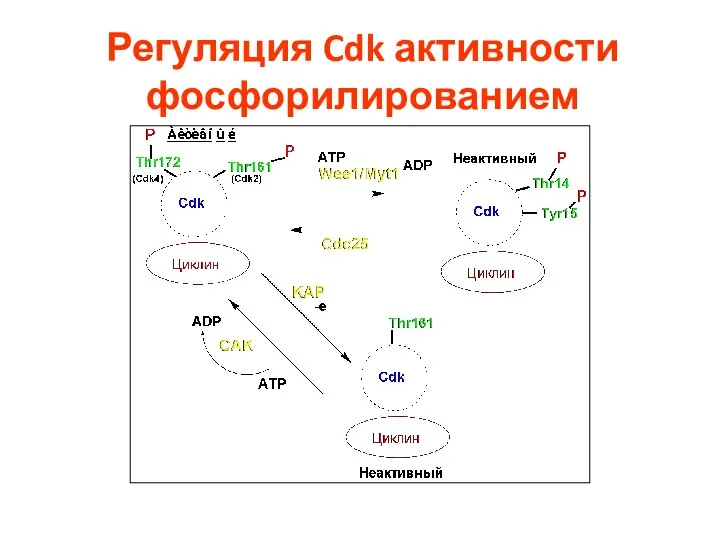
- 36. Регуляция Cdk активности фосфорилированием
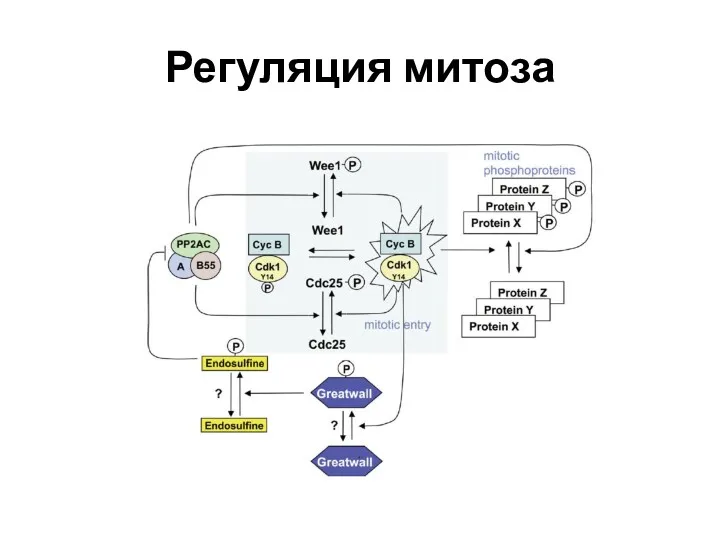
- 37. Регуляция митоза
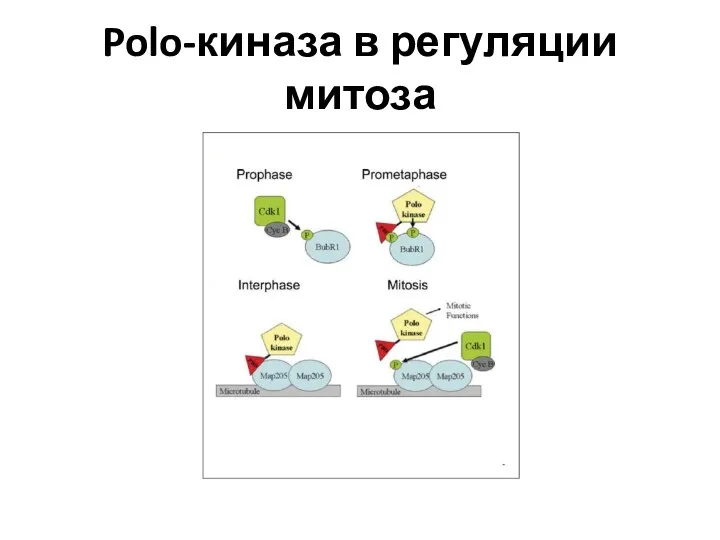
- 38. Polo-киназа в регуляции митоза
- 39. Ингибиторы Cdks 2 Семейства CKI: Cip/Kip (Cdk ингибиторные белки) р21, р27,р57 – ингибируют Cdk2 и Cdk4/6
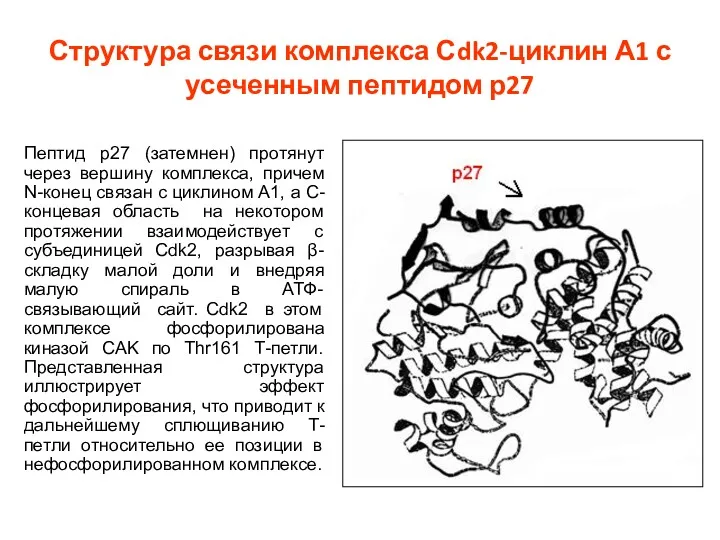
- 40. Структура связи комплекса Сdk2-циклин А1 с усеченным пептидом р27 Пептид р27 (затемнен) протянут через вершину комплекса,
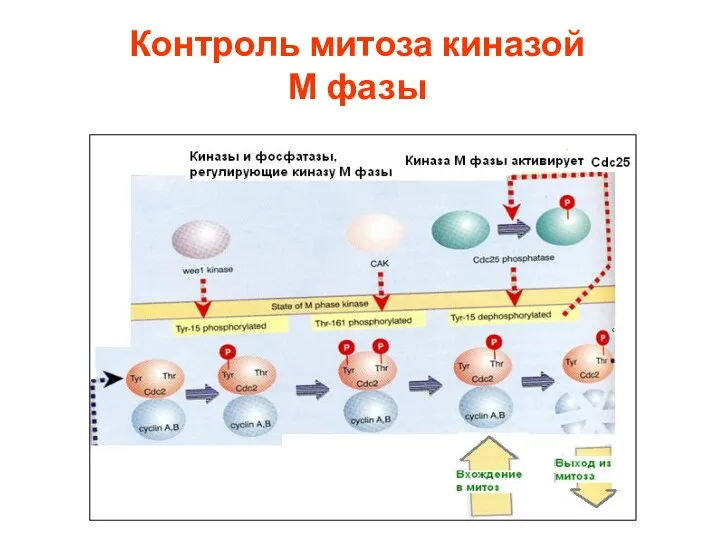
- 41. Контроль митоза киназой М фазы
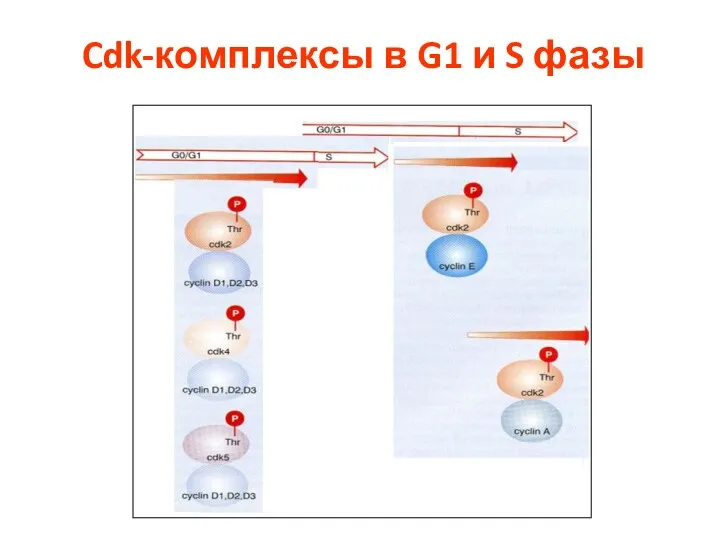
- 42. Cdk-комплексы в G1 и S фазы
- 43. Регуляция циклинов - Транскрипция (E2F стимулирует ЦА и Е в S фазе) или ЦD RAS-RAF-MAP киназный
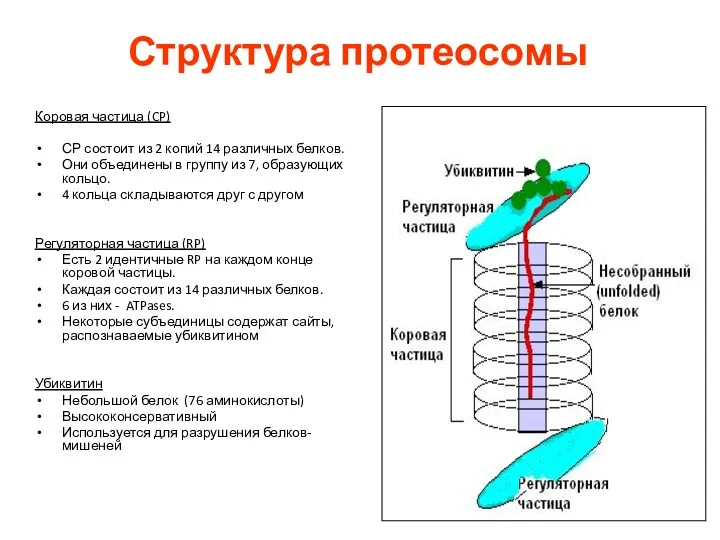
- 44. Структура протеосомы Коровая частица (CP) СР состоит из 2 копий 14 различных белков. Они объединены в
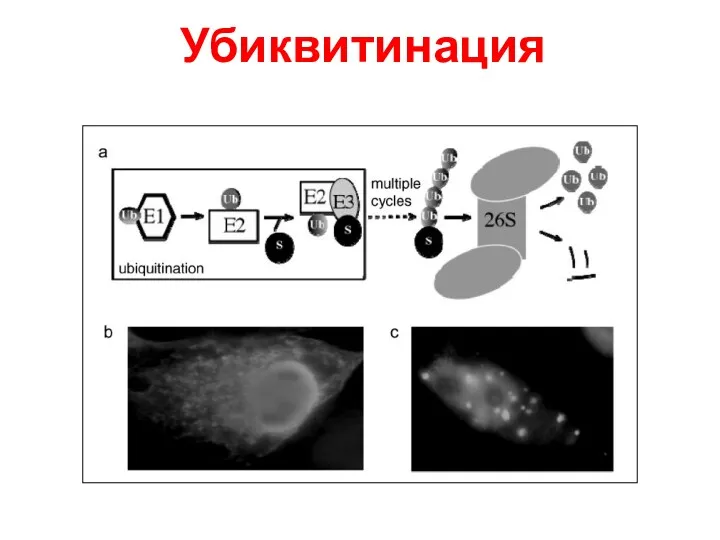
- 45. Убиквитинация
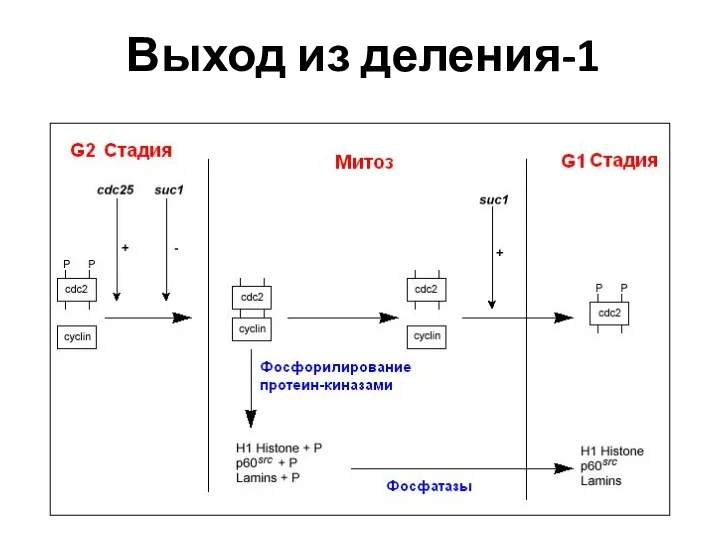
- 46. Выход из деления-1
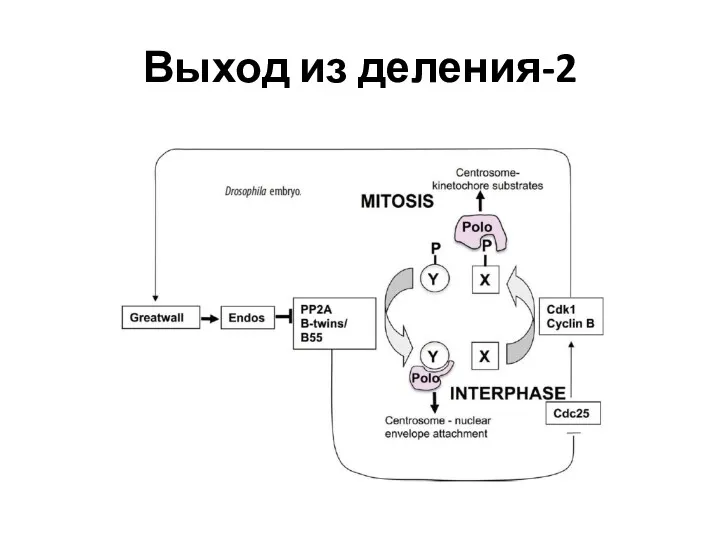
- 47. Выход из деления-2
- 48. Деструкция митотических циклинов Циклосома АРС (anaphase promoting complex) – метафаза-анафаза (Cdc20) и выход из митоза (Hct1).
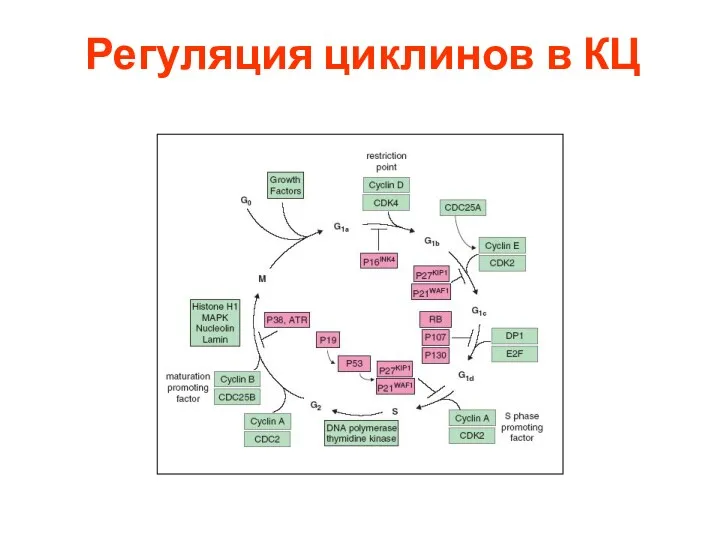
- 49. Регуляция циклинов в КЦ
- 50. Нобелевская премия по физиологии и медицине за 2001 г. Присуждена американцу Леланду Хартвеллу и англичанам Тимоти
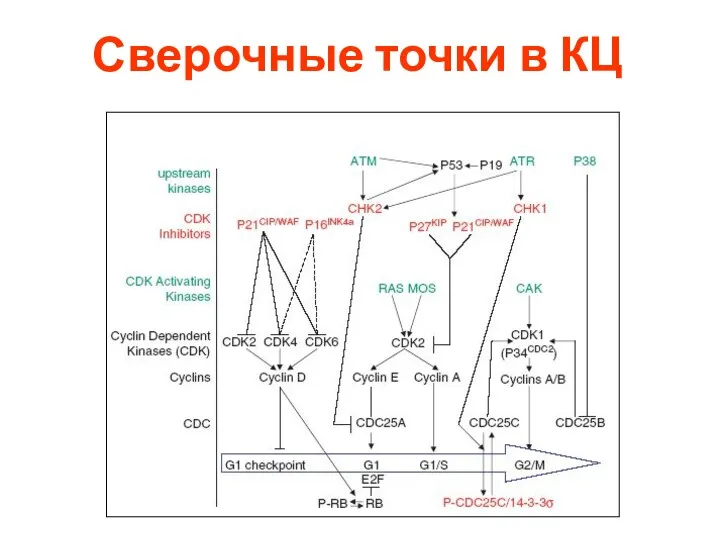
- 51. Сверочные точки в КЦ
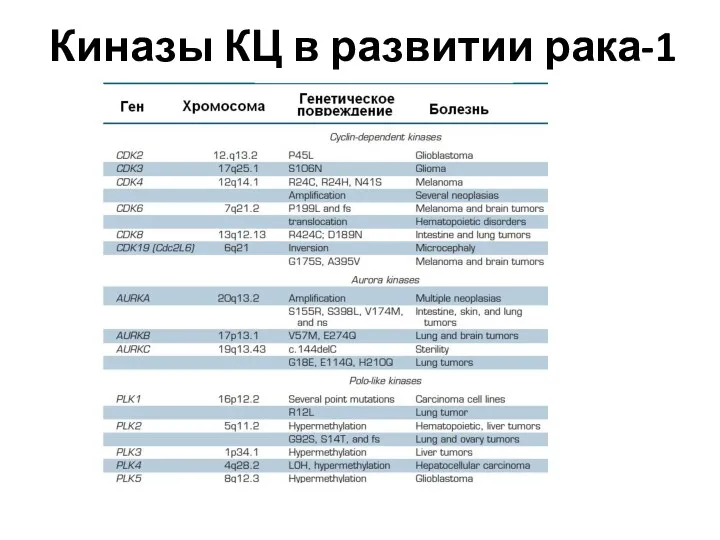
- 52. Киназы КЦ в развитии рака-1
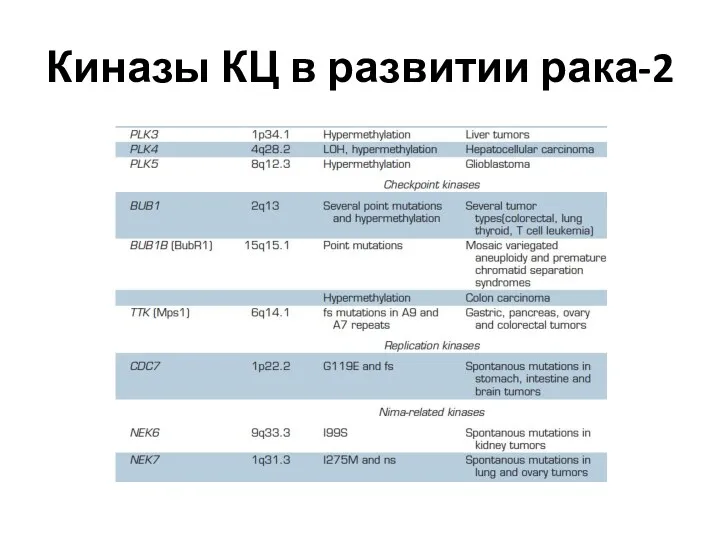
- 53. Киназы КЦ в развитии рака-2
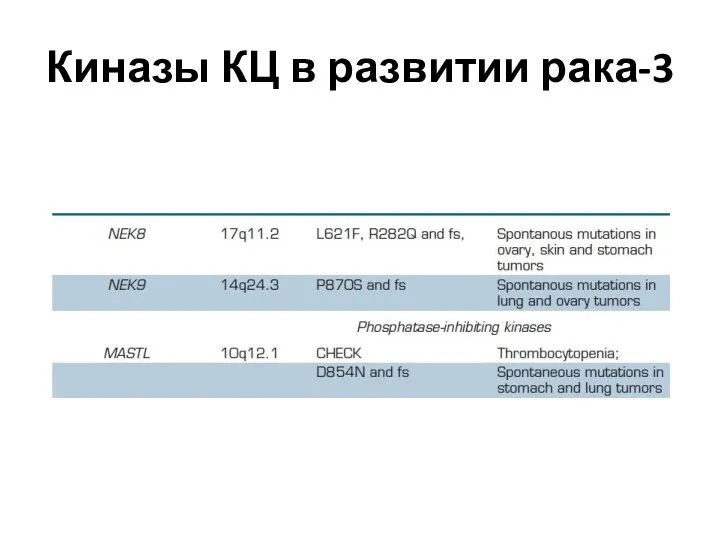
- 54. Киназы КЦ в развитии рака-3
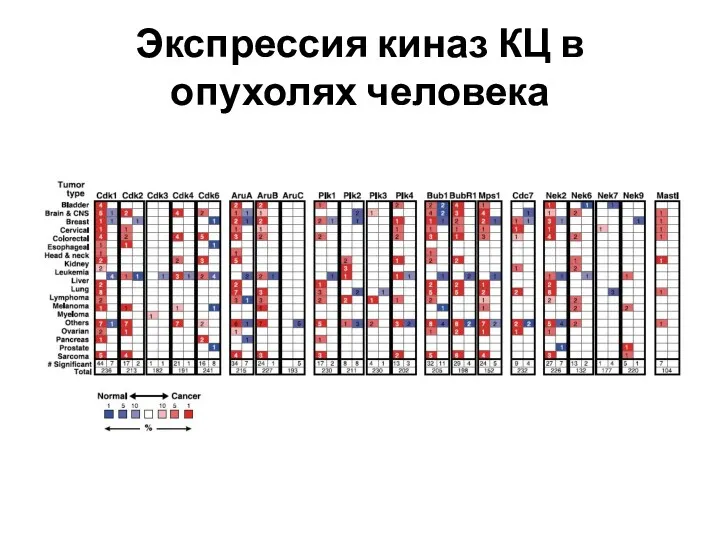
- 55. Экспрессия киназ КЦ в опухолях человека
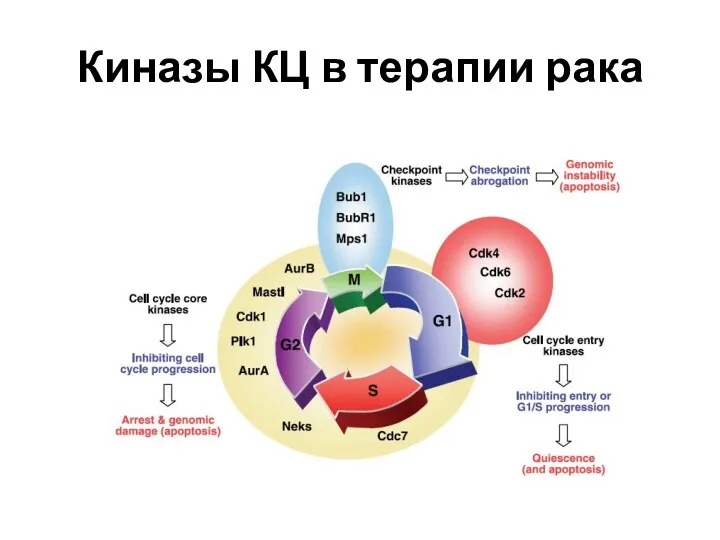
- 56. Киназы КЦ в терапии рака
- 57. 2. Раковые супрессорные гены или онкосупрессоры RB р53 (ТР53) Развитие рака происходит из-за потери функции РСГ
- 58. RB Белок
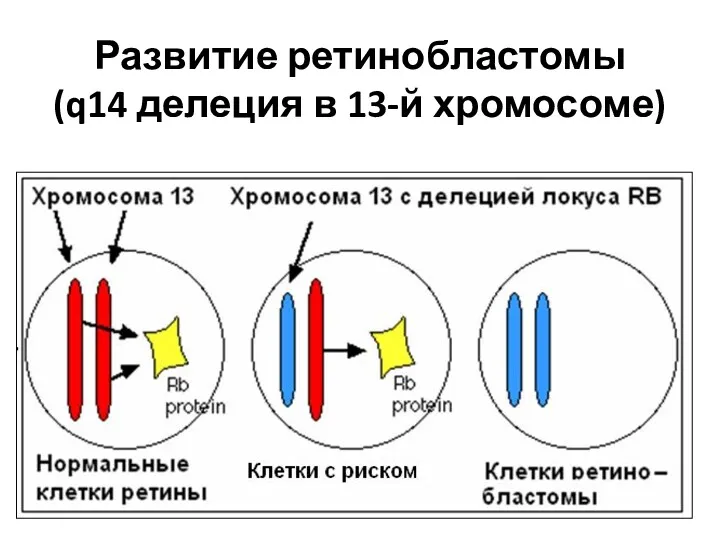
- 59. Развитие ретинобластомы (q14 делеция в 13-й хромосоме)
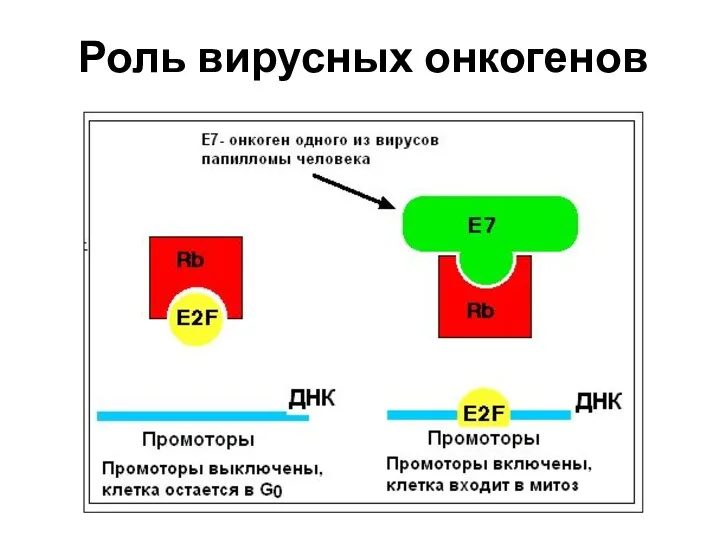
- 60. Роль вирусных онкогенов
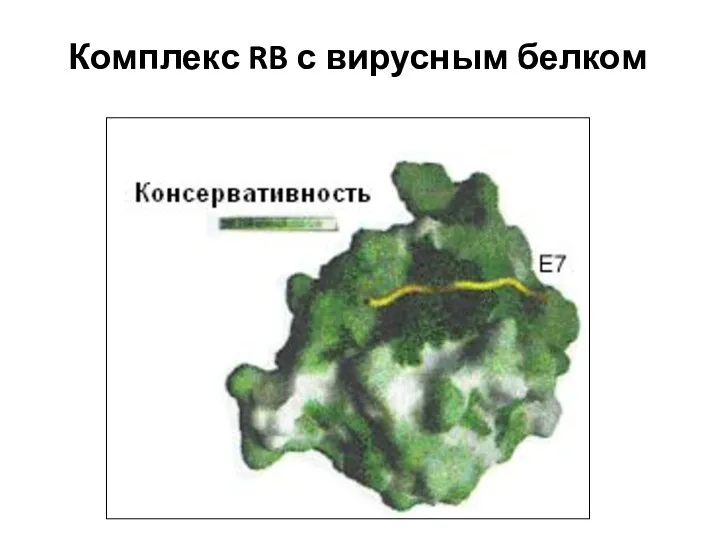
- 61. Комплекс RB с вирусным белком
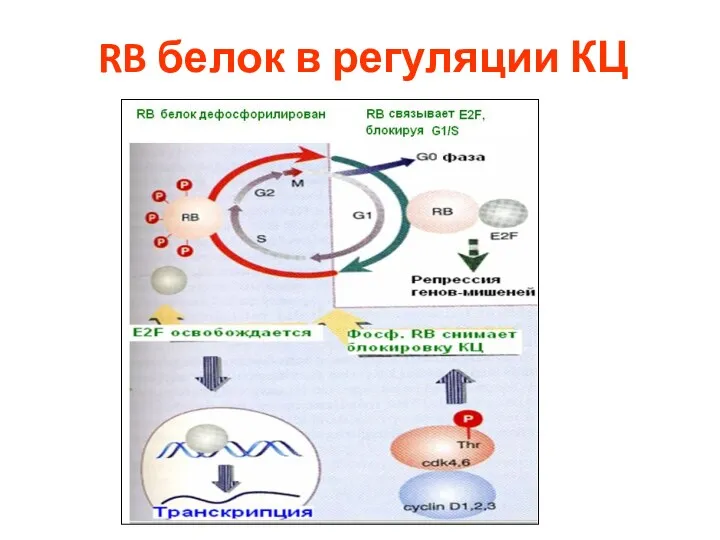
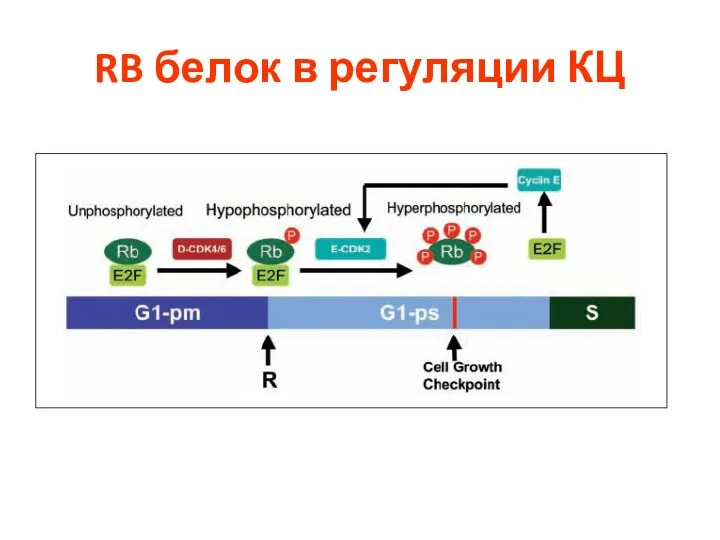
- 62. RB белок в регуляции КЦ
- 63. RB белок в регуляции КЦ
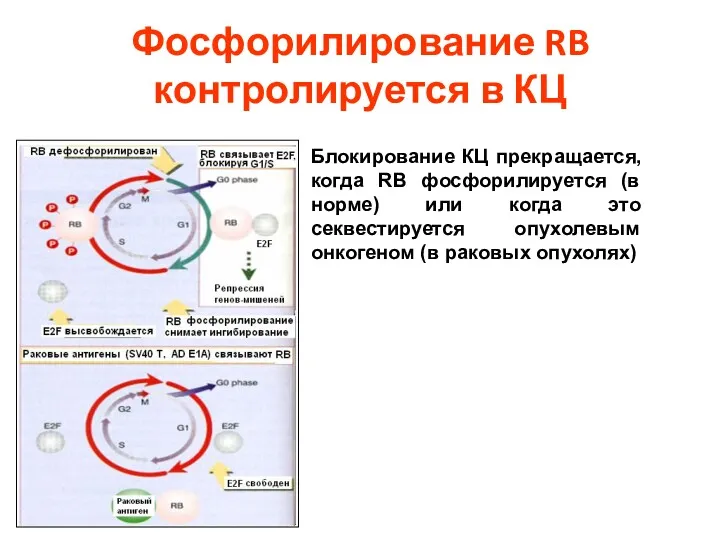
- 64. Фосфорилирование RB контролируется в КЦ Блокирование КЦ прекращается, когда RB фосфорилируется (в норме) или когда это
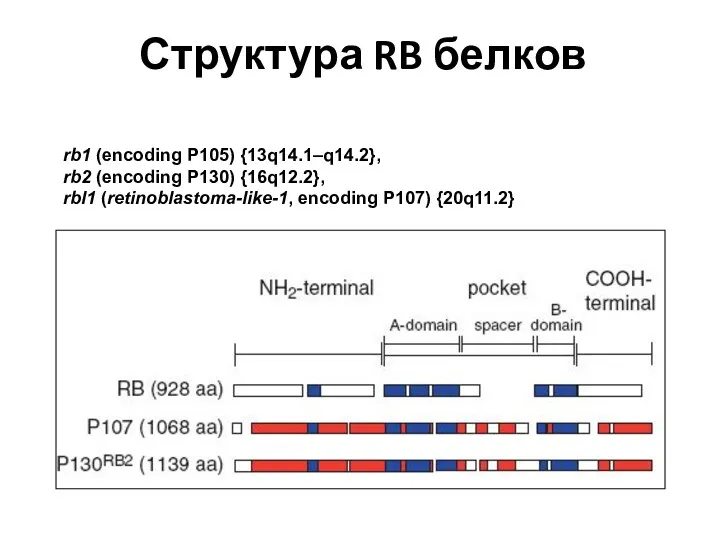
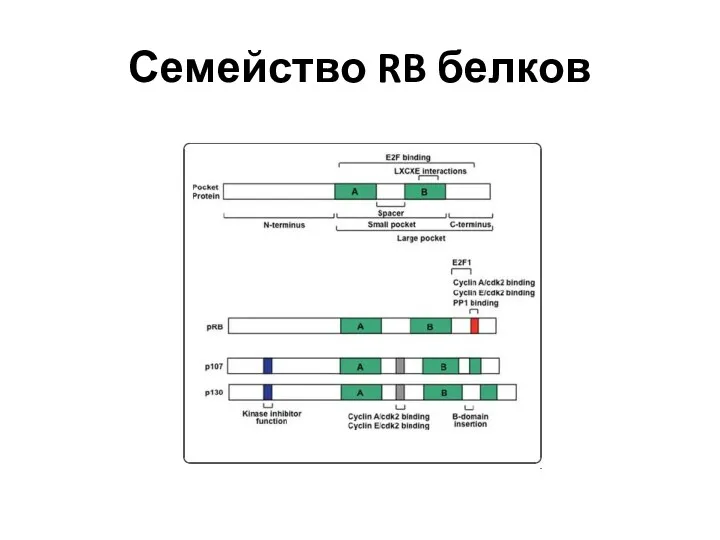
- 65. Структура RB белков rb1 (encoding P105) {13q14.1–q14.2}, rb2 (encoding P130) {16q12.2}, rbl1 (retinoblastoma-like-1, encoding P107) {20q11.2}
- 66. Семейство RB белков
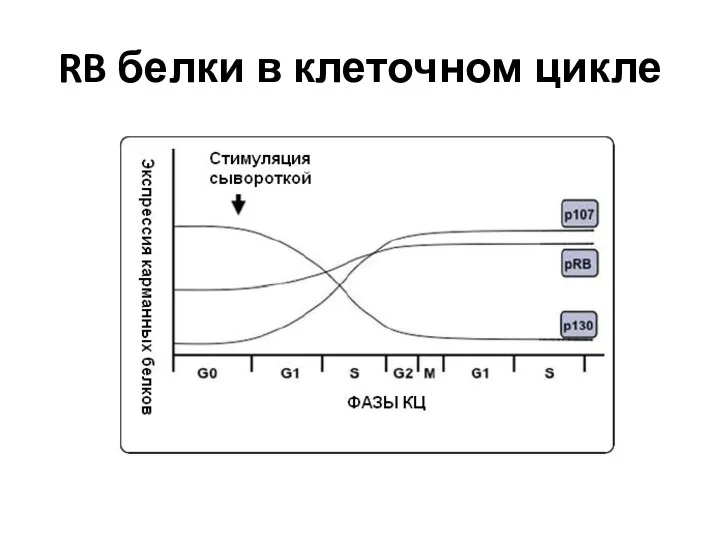
- 67. RB белки в клеточном цикле
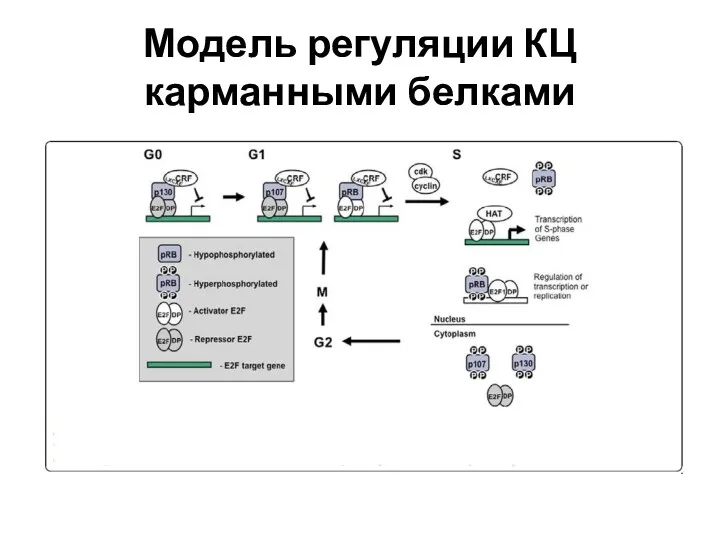
- 68. Модель регуляции КЦ карманными белками
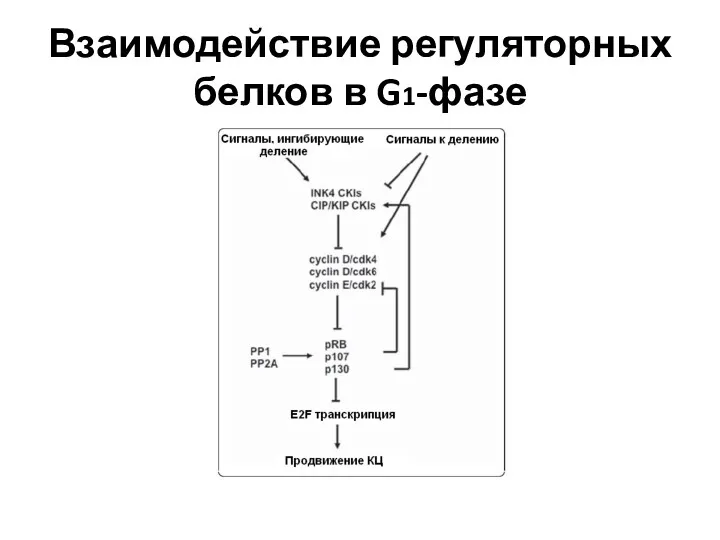
- 69. Взаимодействие регуляторных белков в G1-фазе
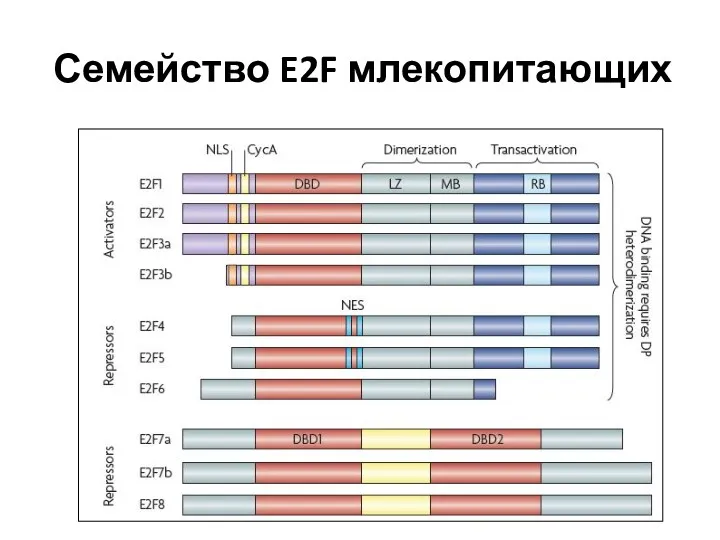
- 70. Семейство E2F млекопитающих
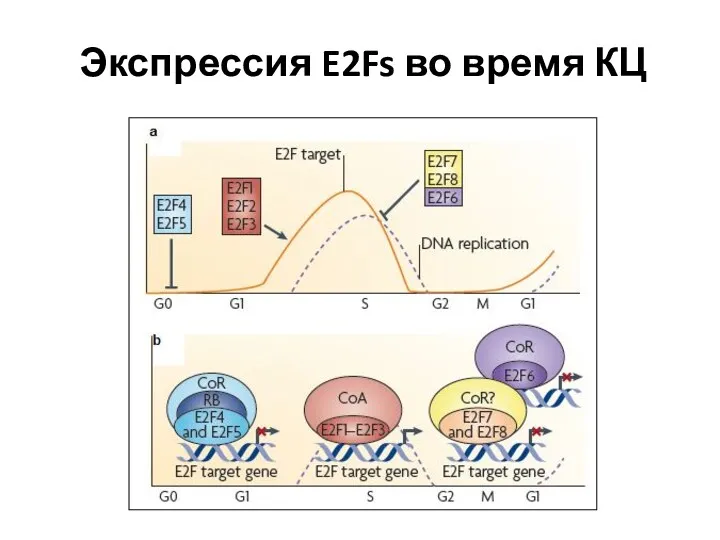
- 71. Экспрессия E2Fs во время КЦ
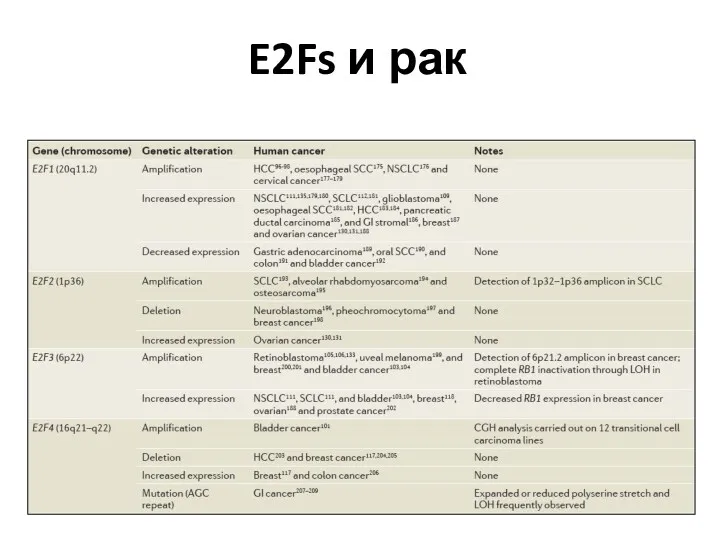
- 72. E2Fs и рак
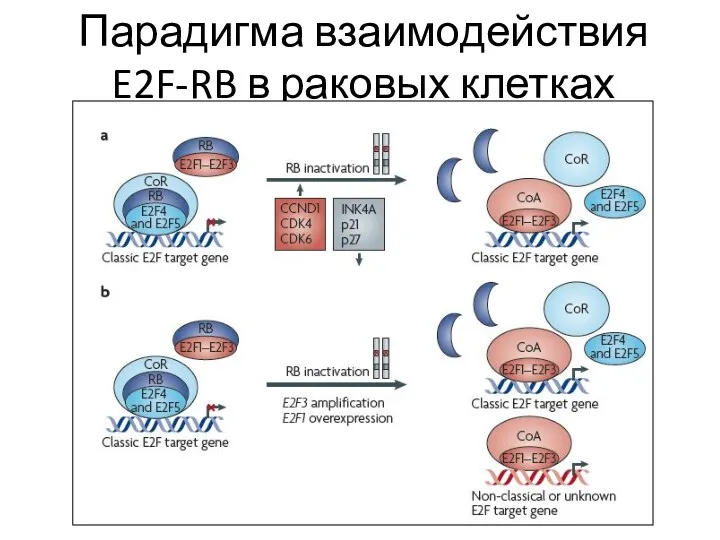
- 73. Парадигма взаимодействия E2F-RB в раковых клетках
- 74. В ядре непролиферирующих клеток остается RB гипофосфорилированным и формирует белковый комплекс E2F-RB, т.о. ингибируются гены, регулирующие
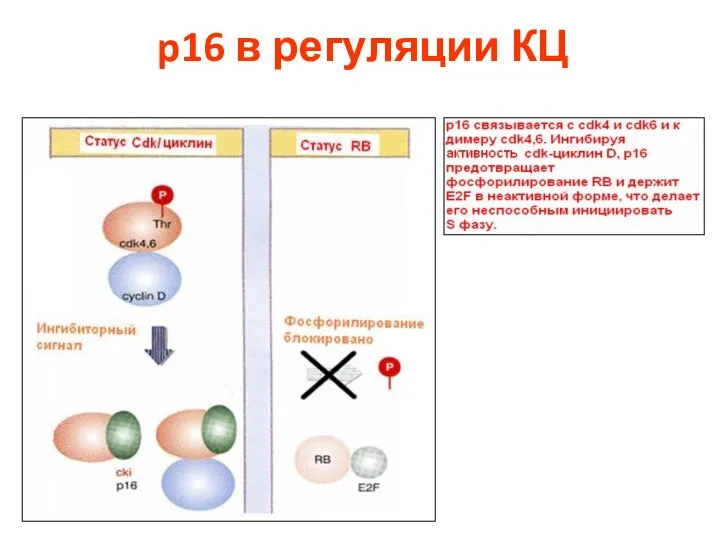
- 75. p16 в регуляции КЦ
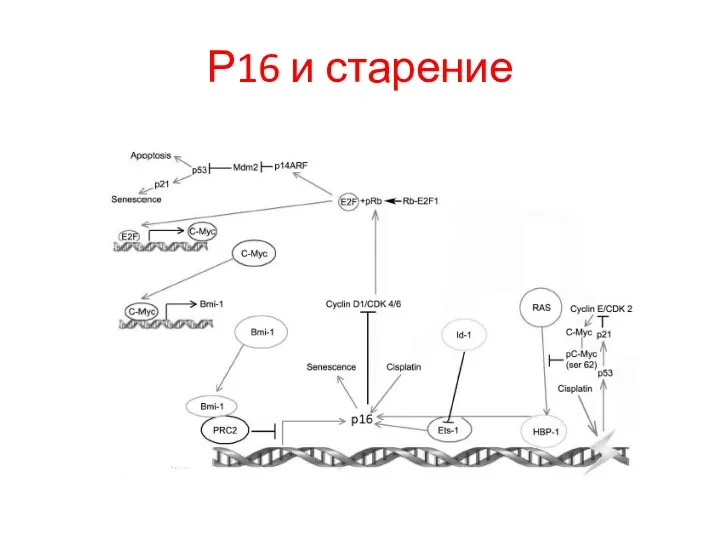
- 76. Р16 и старение
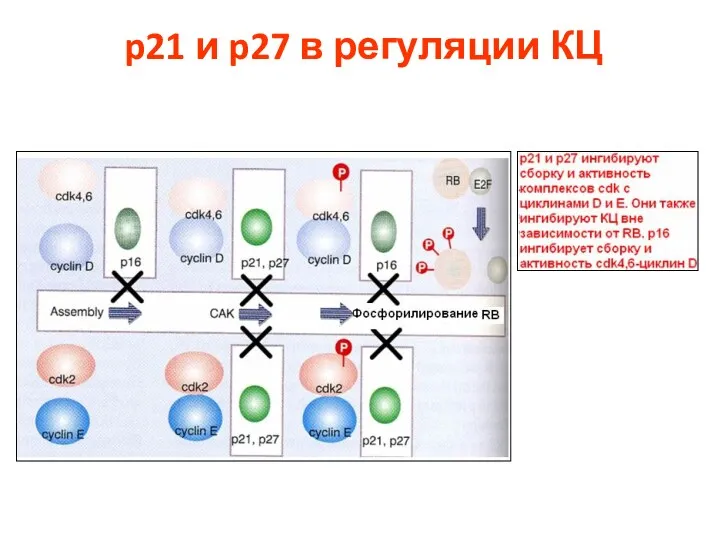
- 77. p21 и p27 в регуляции КЦ
- 78. Белок p53 – ключевой онкосупрессор. Роль в онкологии
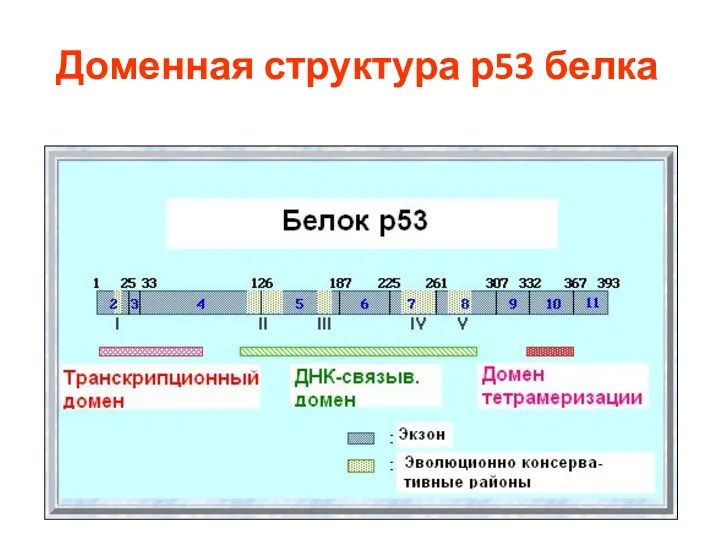
- 79. Структура и функции р53 - ДНК-связывающий белок (впервые описан в 1979 г.) - Фактор транскрипции (активация,
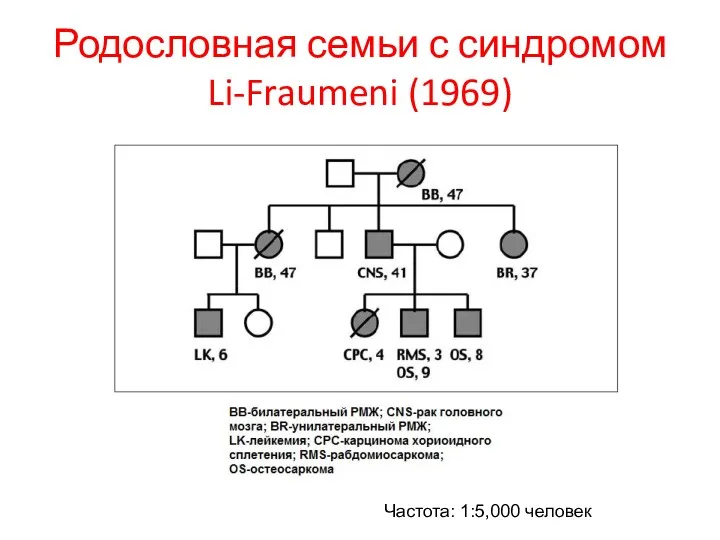
- 80. Родословная семьи с синдромом Li-Fraumeni (1969) Частота: 1:5,000 человек
- 81. Последовательности, узнаваемые р53 PuPuPuC(A/T)(T/A)GPyPyPy
- 82. Доменная структура р53 белка
- 83. Доменная структура р53 белка
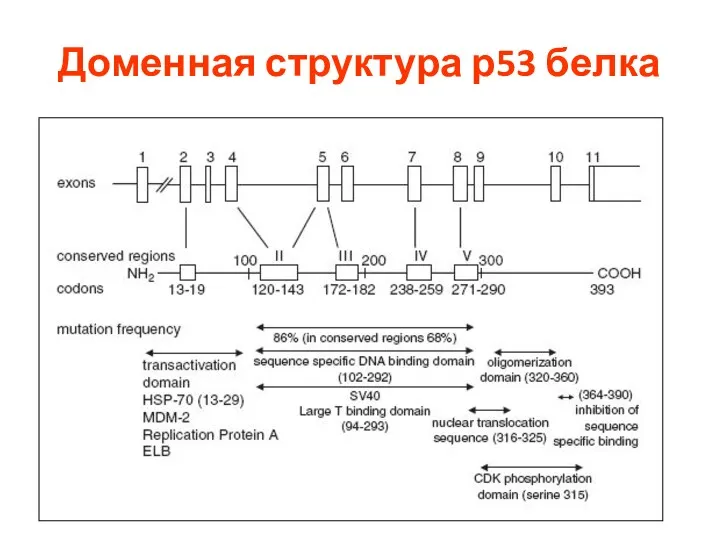
- 84. Структура корового домена р53
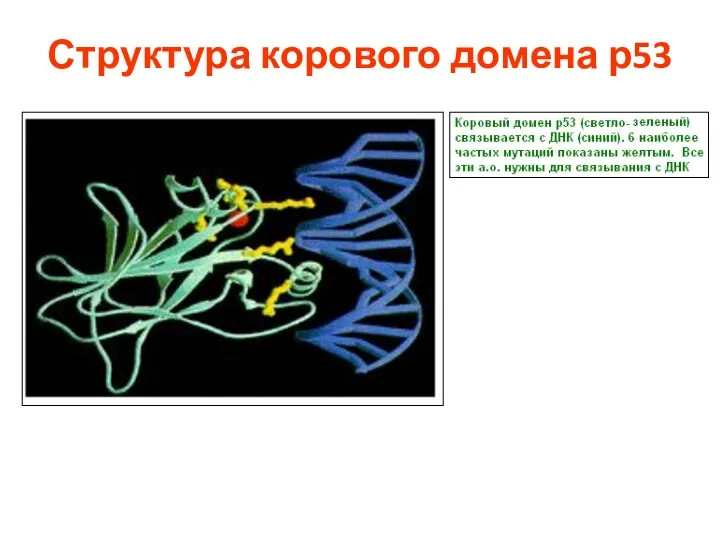
- 85. 3D структура p53
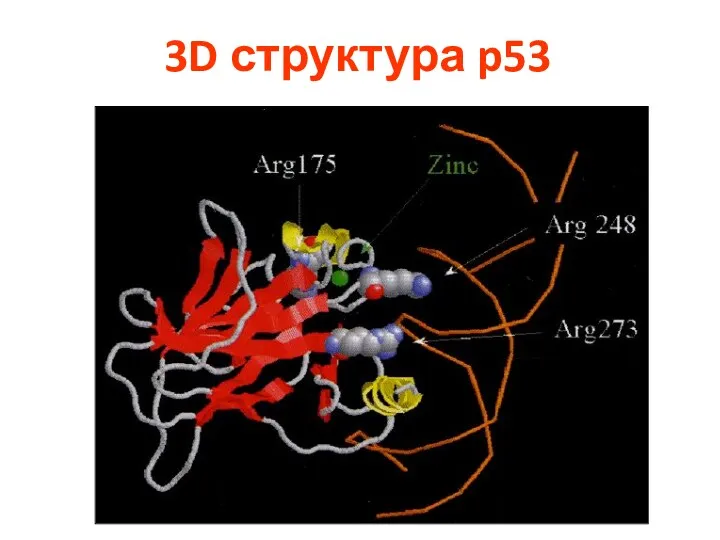
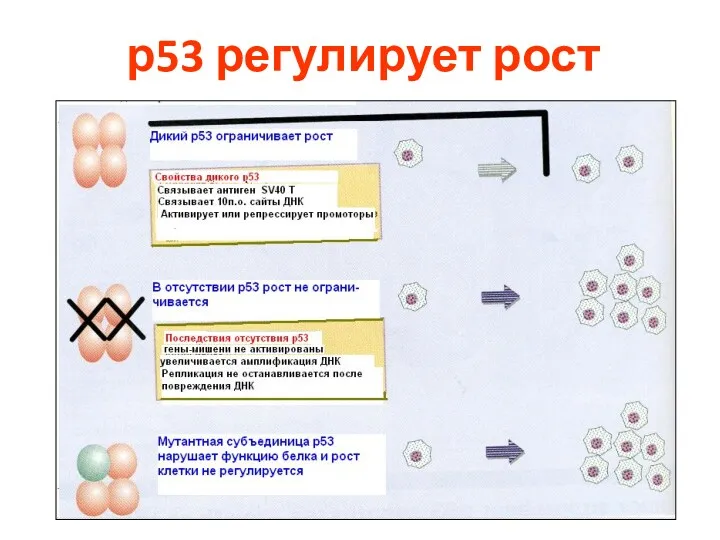
- 86. р53 регулирует рост
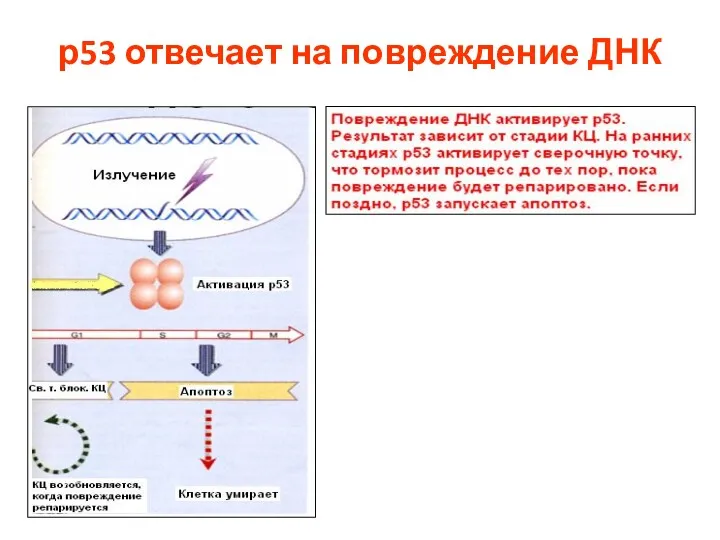
- 87. р53 отвечает на повреждение ДНК
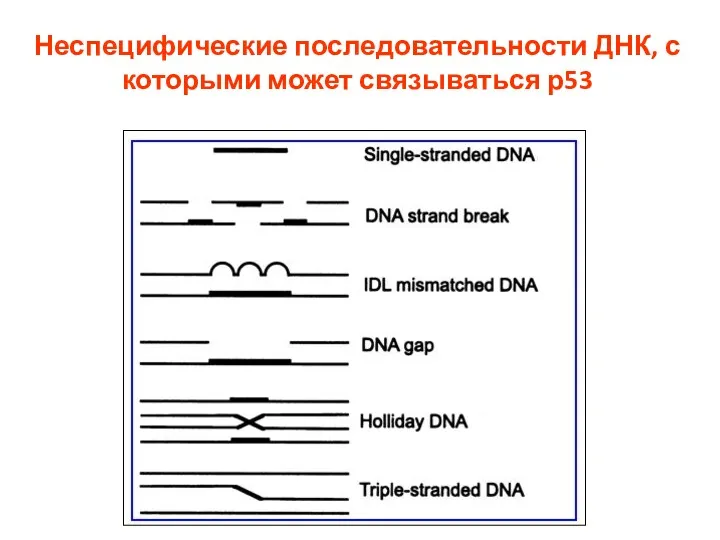
- 88. Неспецифические последовательности ДНК, с которыми может связываться р53
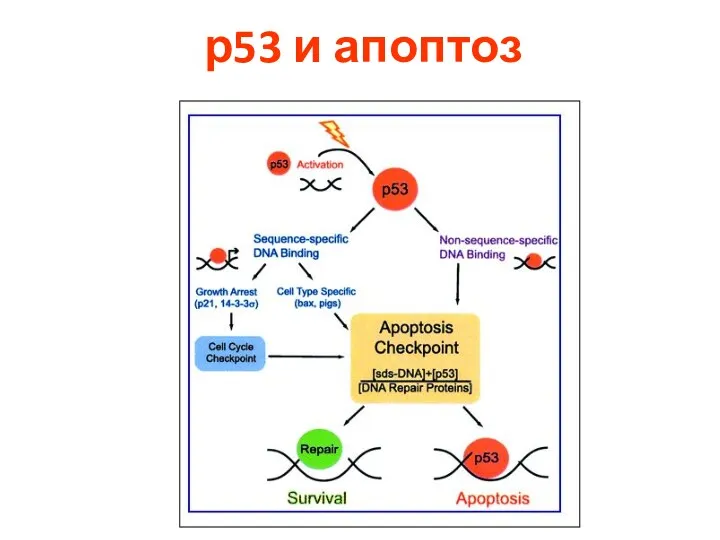
- 89. р53 и апоптоз
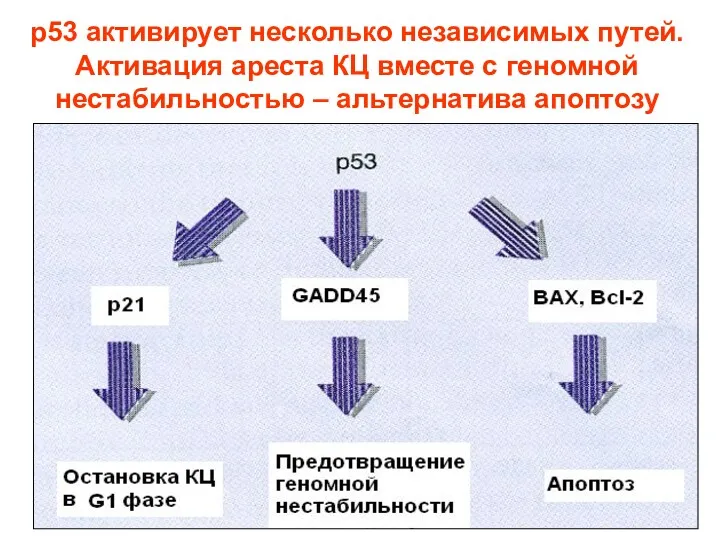
- 90. p53 активирует несколько независимых путей. Активация ареста КЦ вместе с геномной нестабильностью – альтернатива апоптозу
- 91. Регуляция активности р53 1. В норме его экспрессия невелика и контролируется убиквинированием и протеосомной деградацией. 2.
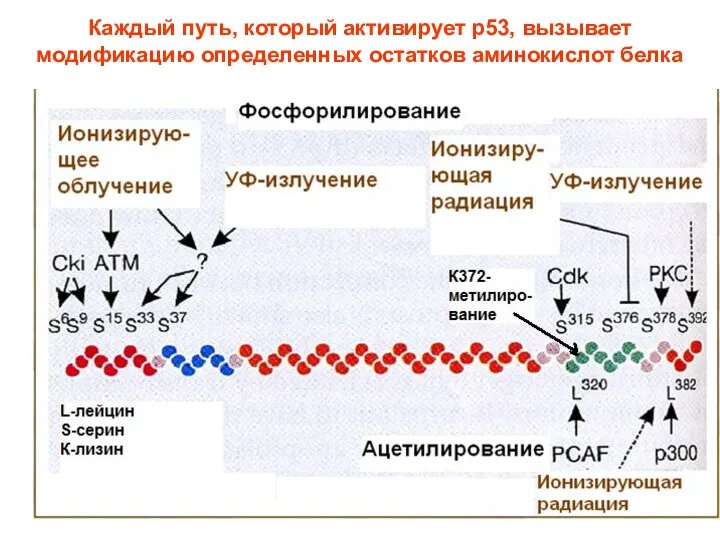
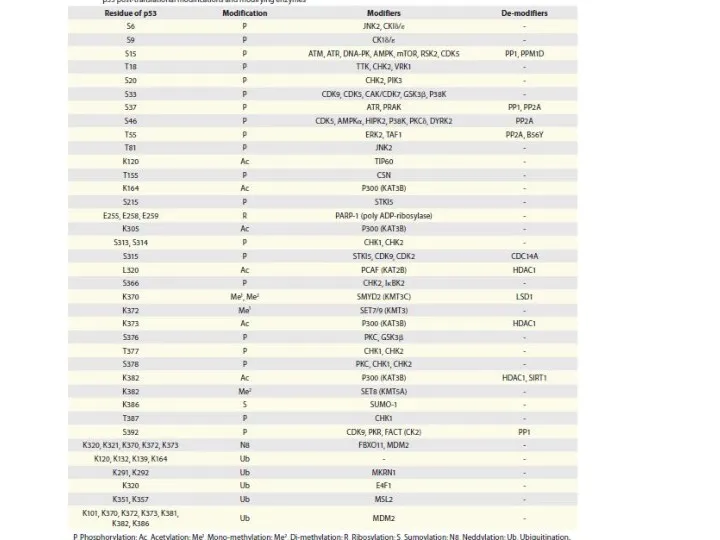
- 92. Каждый путь, который активирует р53, вызывает модификацию определенных остатков аминокислот белка
- 94. MDM2 в регуляции р53 1991 г. - впервые показано его взаимодействие с р53
- 95. Структура белка Mdm2
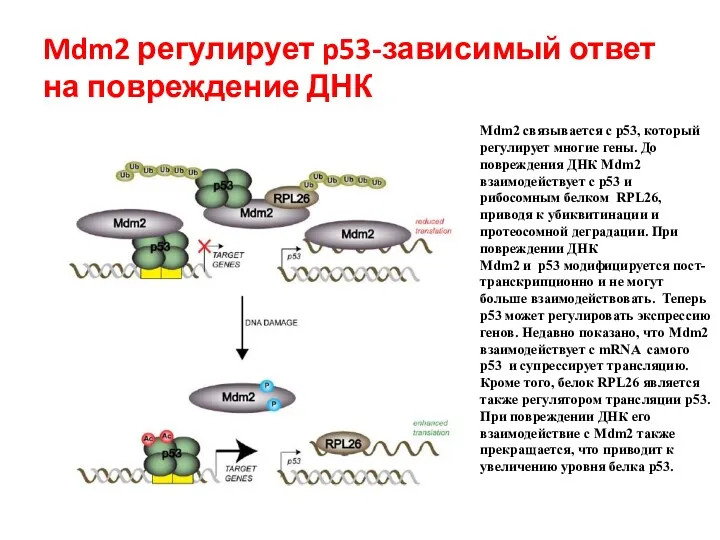
- 96. Mdm2 регулирует p53-зависимый ответ на повреждение ДНК Mdm2 связывается с p53, который регулирует многие гены. До
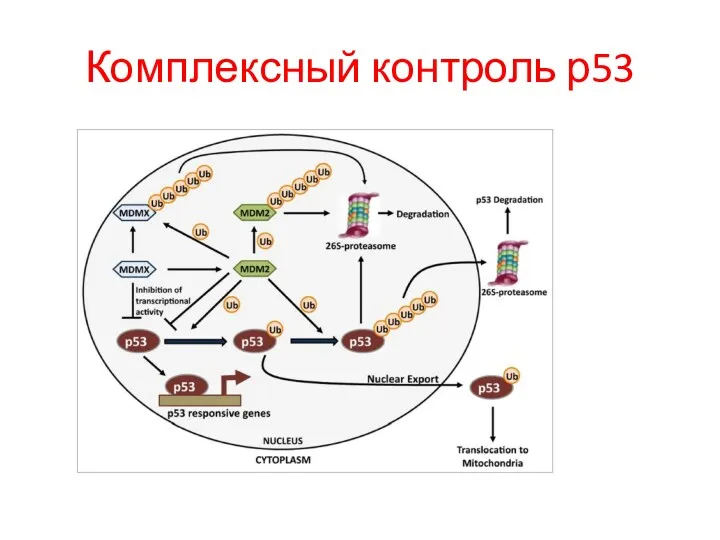
- 97. Комплексный контроль р53
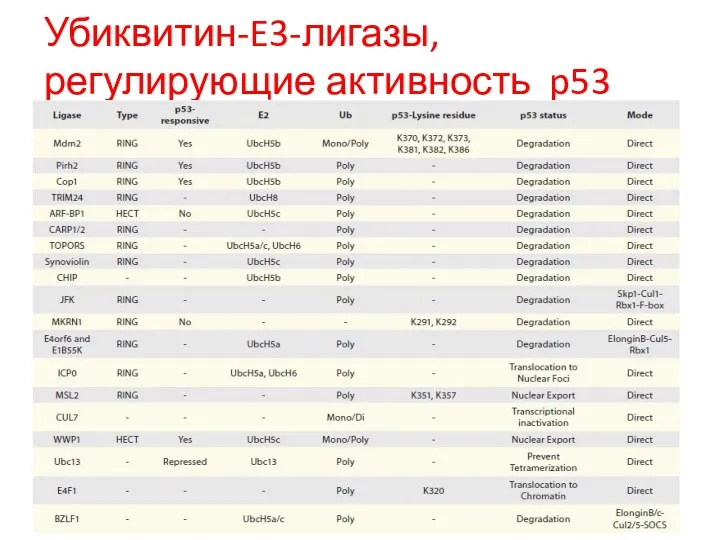
- 98. Убиквитин-E3-лигазы, регулирующие активность p53
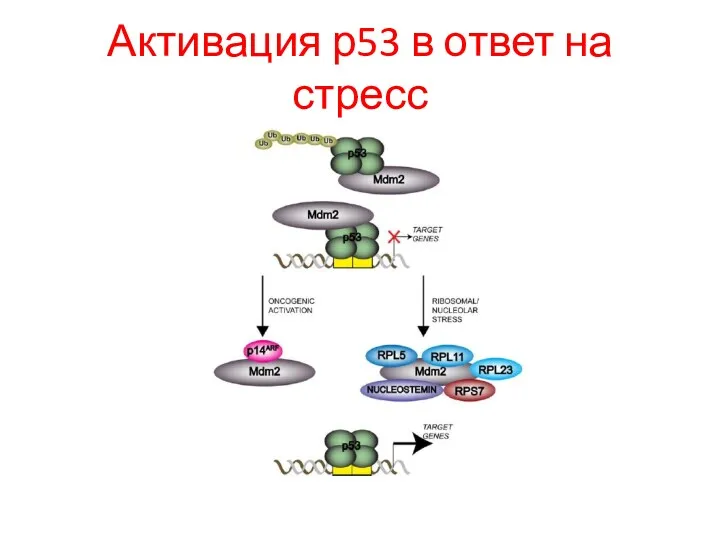
- 99. Активация р53 в ответ на стресс
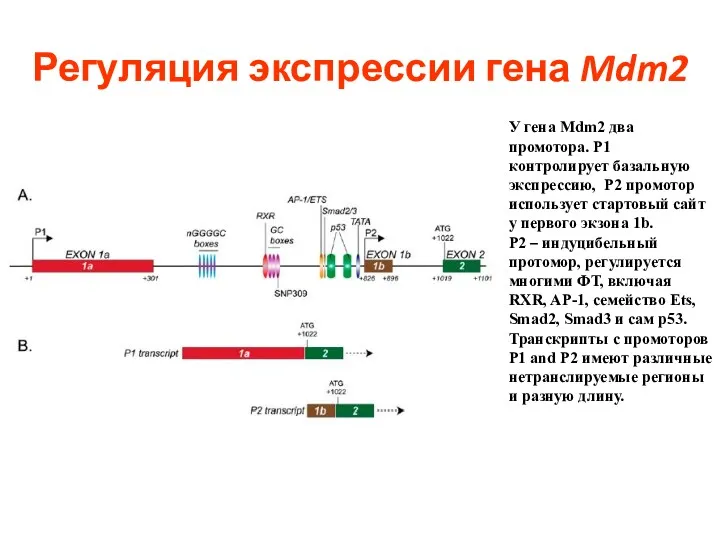
- 100. Регуляция экспрессии гена Mdm2 У гена Mdm2 два промотора. P1 контролирует базальную экспрессию, P2 промотор использует
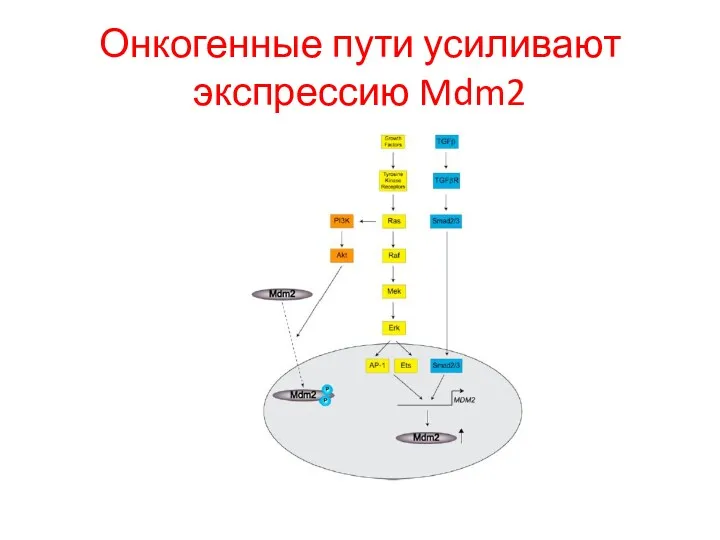
- 101. Онкогенные пути усиливают экспрессию Mdm2
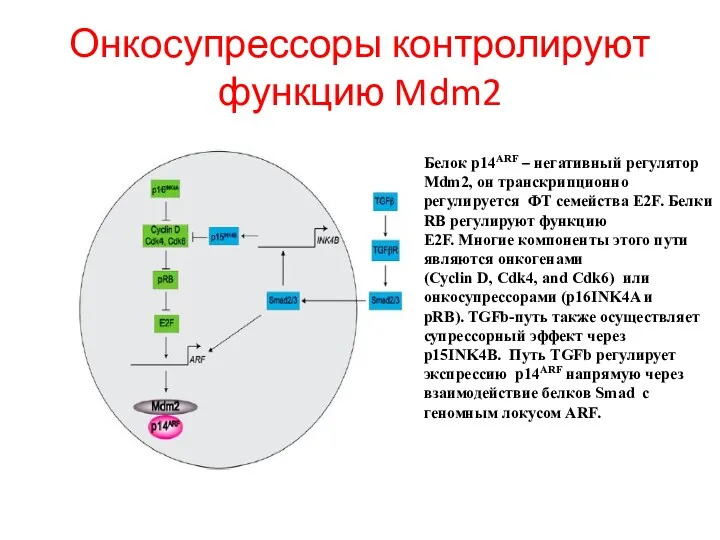
- 102. Онкосупрессоры контролируют функцию Mdm2 Белок p14ARF – негативный регулятор Mdm2, он транскрипционно регулируется ФТ семейства E2F.
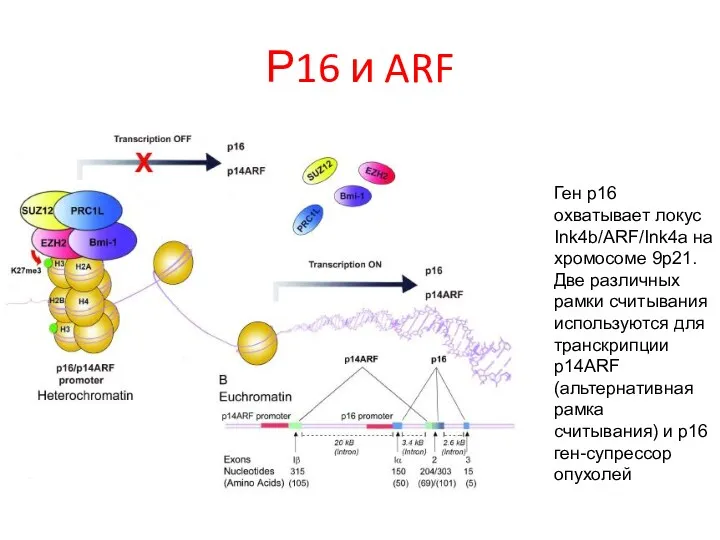
- 103. Р16 и ARF Ген p16 охватывает локус Ink4b/ARF/Ink4a на хромосоме 9p21. Две различных рамки считывания используются
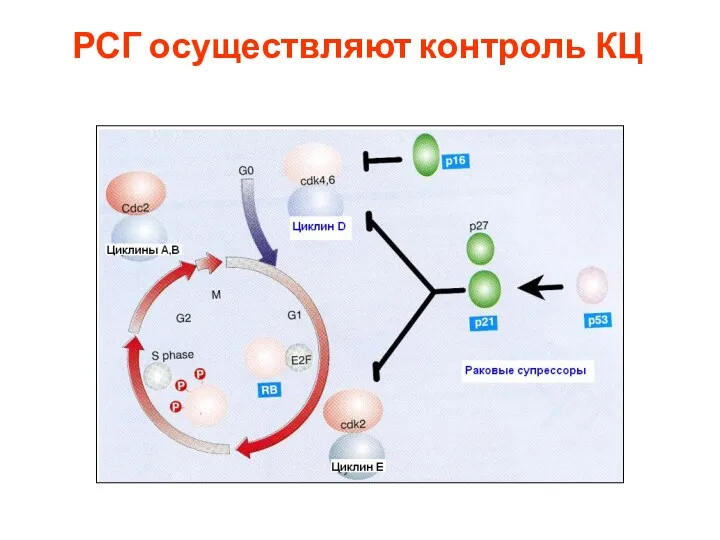
- 104. РСГ осуществляют контроль КЦ
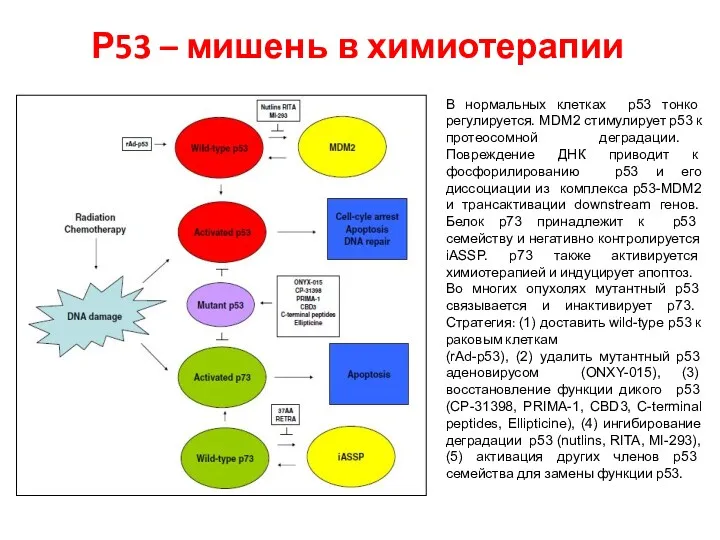
- 105. Р53 – мишень в химиотерапии В нормальных клетках p53 тонко регулируется. MDM2 стимулирует p53 к протеосомной
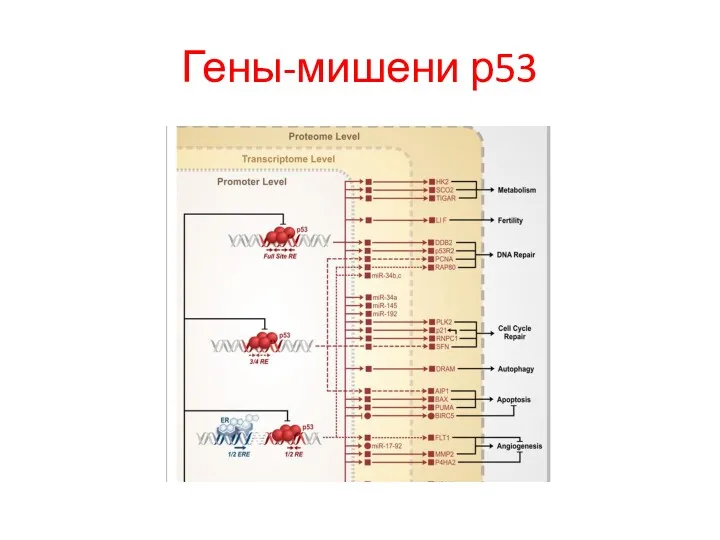
- 106. Гены-мишени р53
- 107. 2011 г.: Согласно IARC, выявляется более, чем 26 000 соматических мутаций в (TP53 database version R14
- 108. Наиболее часто встречаемые мутации р53
- 109. Относительная частота герминальных мутаций в p53
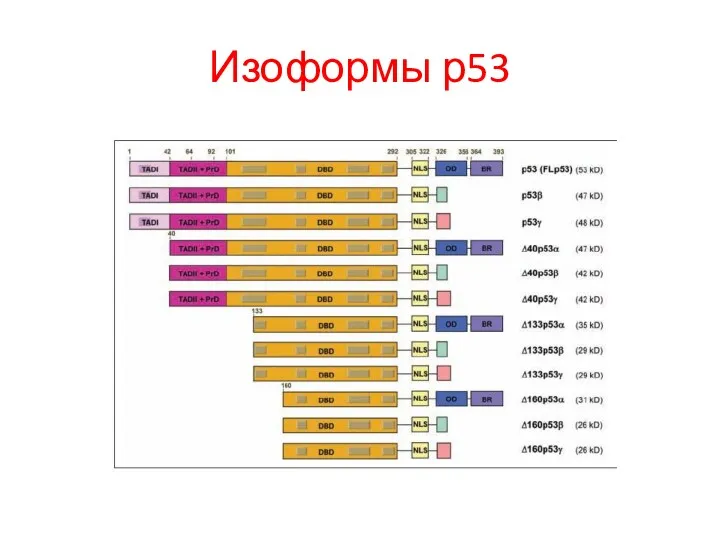
- 110. Изоформы р53
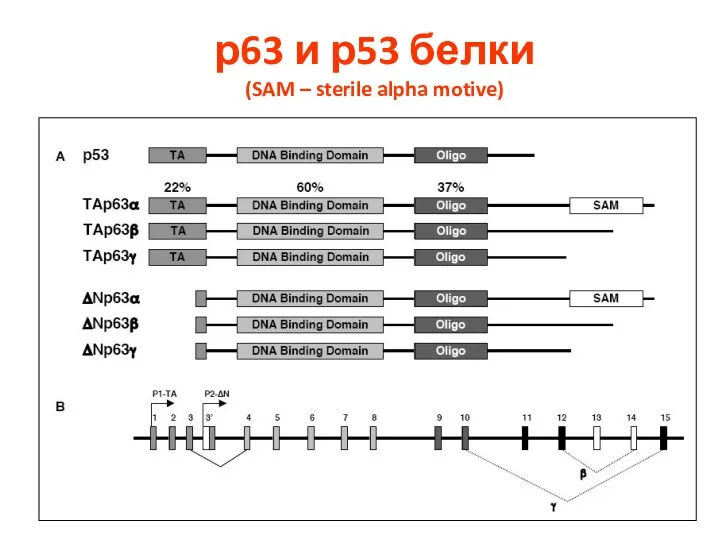
- 111. р63 и р53 белки (SAM – sterile alpha motive)
- 112. Экспрессия р63 в опухолях
- 113. Восстановление активности р53 Введение в опухоль дикого p53 с помощью репликативно-дефектного аденовирусного вектора CP-31398 – молекула
- 114. Маркеры РМЖ на 17-хромосоме Wei Zhang and Yingyan Yu «The Important Molecular Markers on Chromosome 17
- 115. Функции маркеров
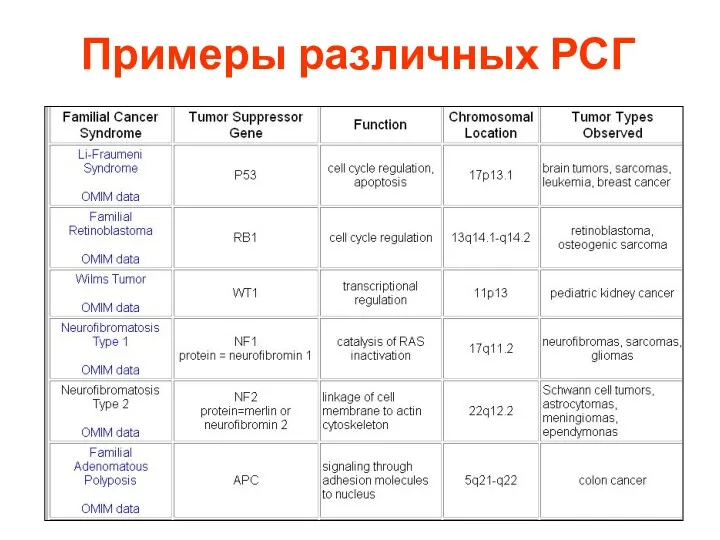
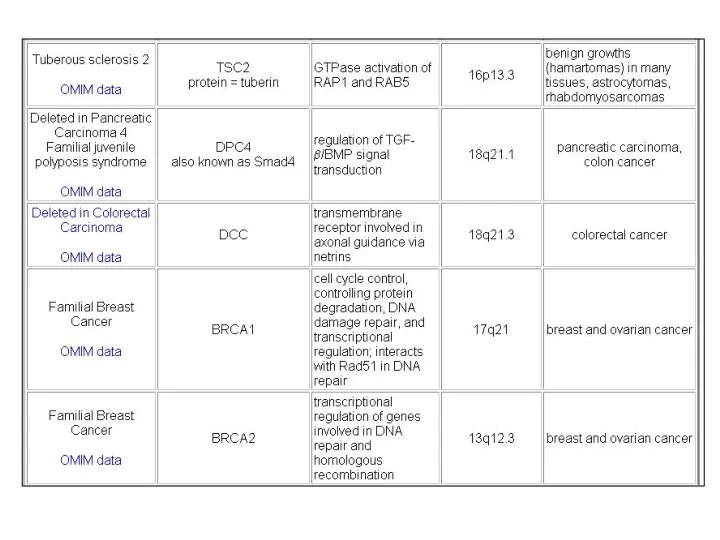
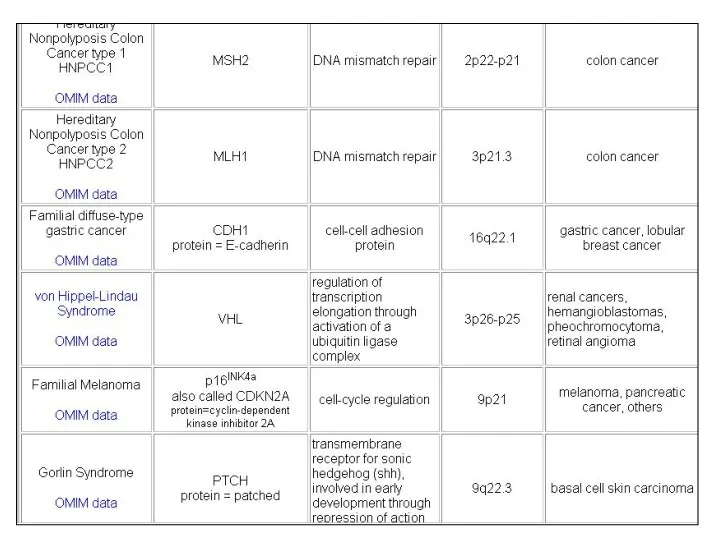
- 116. Примеры различных РСГ
- 119. Примеры нокаутных мышей с инактивированными РСГ или ПО
- 121. Скачать презентацию


























 Методы экологических исследований. Лекция 6
Методы экологических исследований. Лекция 6 Скелет. Строение, состав и соединение костей
Скелет. Строение, состав и соединение костей День птиц
День птиц Комнатные растения в интерьере
Комнатные растения в интерьере Царство Phyta (растения)
Царство Phyta (растения) Тип: моллюски. Класс: двустворчатые. Устрица
Тип: моллюски. Класс: двустворчатые. Устрица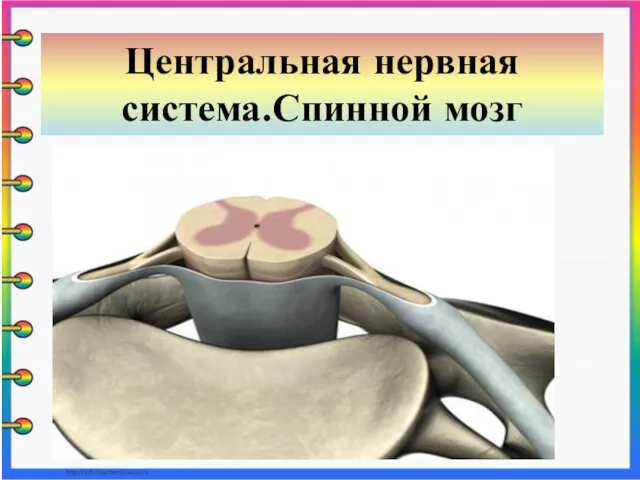 Строение и функции спинного мозга
Строение и функции спинного мозга Презентация к уроку биологии 8 кл.
Презентация к уроку биологии 8 кл. Самые необычные животные планеты
Самые необычные животные планеты Строение тела человека и его функциональные системы
Строение тела человека и его функциональные системы Разнообразие грибов. Значение грибов в природе и жизни человека
Разнообразие грибов. Значение грибов в природе и жизни человека Отряд Чешуекрылые, или Бабочки
Отряд Чешуекрылые, или Бабочки Общие вопросы анатомии и физиологии человека
Общие вопросы анатомии и физиологии человека Витамины. Определение, классификация
Витамины. Определение, классификация Растения-хищники
Растения-хищники Урок биологии в 10 классе Дигибридное скрещивание
Урок биологии в 10 классе Дигибридное скрещивание Бактерии. Строение клетки
Бактерии. Строение клетки Класс пресмыкающиеся
Класс пресмыкающиеся Нанобиотехнологии прокариот. Экпрессия генов
Нанобиотехнологии прокариот. Экпрессия генов Строение, размножение и развитие рыб
Строение, размножение и развитие рыб Эволюция опорно – двигательной системы у животных
Эволюция опорно – двигательной системы у животных Мифологические лекарственные растения
Мифологические лекарственные растения Презентация по теме Видоизменения корней. 6 класс. ФГОС ООО.
Презентация по теме Видоизменения корней. 6 класс. ФГОС ООО. Жердің даму тарихы
Жердің даму тарихы Строение цветка
Строение цветка Происхождение человека. Стадии антропосоциогенеза. Адаптация человека
Происхождение человека. Стадии антропосоциогенеза. Адаптация человека Экзотические птицы
Экзотические птицы Строение растительной клетки
Строение растительной клетки