Содержание
- 2. Методы расшифровки нуклеотидной последовательности нуклеиновых кислот в отечественной литературе принято называть методами секвенирования. Еще в 50-е
- 3. КЛАССИЧЕСКИЕ МЕТОДЫ СЕКВЕНИРОВАНИЯ ДНК Классические методы секвенирования ДНК были разработаны в конце прошлого века и в
- 4. Для проведения секвенирования с помощью капиллярного электрофореза используют самый распространенный на сегодняшний день способ подготовки ДНК
- 5. Особенность метода «терминации цепи» заключается в использовании химически модифицированных дезоксирибонуклеотидов, составляющих нуклеотидную последовательность ДНК. Каждая разновидность
- 6. Автоматические секвенаторы разделяют эти фрагменты по величине, как ионы, движущиеся в электрическом поле от «минуса» к
- 7. Относительно невысокая стоимость, точность, а также простота автоматизации делают этот метод широко используемым в лабораторной практике.
- 8. В начале XXI века достигнут предел производительности секвенаторов на основе капиллярного электрофореза, в одном приборе до
- 9. Пиросеквенирование ДНК. Метод пиросеквенирования основан на определении пирофосфата, образующегося при синтезе комплементарной цепи ДНК. В 1988
- 10. Согласно этой технологии растворы четырех типов нуклеотидов добавляются последовательно в процессе секвенирования фрагментов ДНК и отмываются
- 11. Простые химические реакции и надежная система детекции исключают необходимость использования в данном методе гелей, электрофореза и
- 12. Однако метод не позволяет качественно определить длину секвенированных фрагментов ДНК более 200 п.н., а также точно
- 13. Методы секвенирования ДНК нового поколения Чтобы снизить стоимость процедуры секвенирования и увеличить ее производительность, в новых
- 15. Сейчас высококачественного секвенирования геномов (точностью 99,999 % и более) добиваются, как минимум, после 30-кратного «прочтения» их
- 16. Высокопроизводительное пиросеквенирование ДНК. В 2004 г. компания «454 Life Sciences» дополнила метод пиросеквенирования возможностями современных технологий.
- 17. После проведения всех предварительных этапов пробоподготовки каждый из четырех видов нуклеотидов, смешанный с другими реактивами для
- 18. Длина единичного фрагмента ДНК, секвенируемого методом высокопроизводительного пиро- секвенирования, достигает 1000 п.н. с точностью до 99
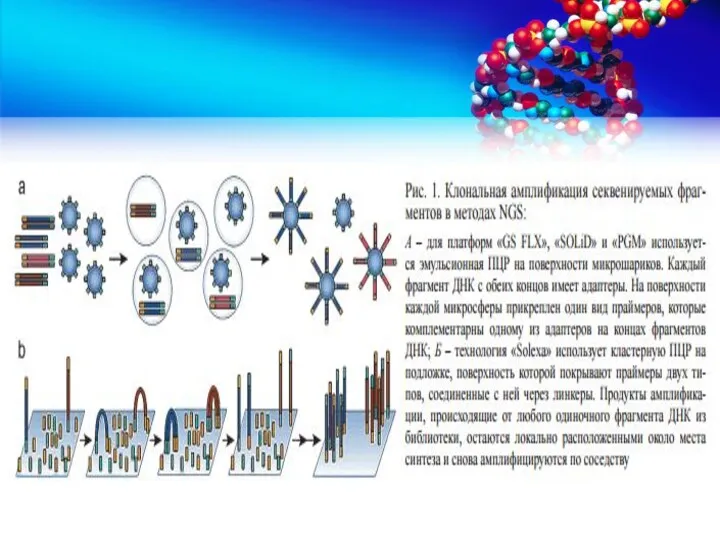
- 19. Секвенирование на молекулярных кластерах с использованием флуоресцентно меченных предшественников В 2005 г. компанией «Illumina» предложен метод
- 20. Далее ДНК денатурируют и проводят секвенирование ее одноцепочечных фрагментов. Для этого добавляют свободно плавающие праймеры и
- 21. Длина единичного фрагмента ДНК, секвенируемого данным методом, достигает 300 п.н. с точностью 99 %. Последняя выпущенная
- 22. Циклическое лигазное секвенирование. В 2007 г. компанией «Applied Biosystems» (теперь входит в состав корпорации «Life Technologies»)
- 23. В данном методе также используют эмульсионную ПЦР, после которой каждая из микросфер содержит на своей поверхности
- 24. Затем происходит сшивание (лигирование) другого зонда, комплементарно соединившегося со следующими пятью основаниями, от зонда уже присоединенного
- 25. Длина единичного фрагмента ДНК, секвенируемого методом лигирования, достигает 75 п.н. с точностью до 99,99 %. Выпущенный
- 26. Полупроводниковое секвенирование. В 2010 г. компания «Ion Torrent» (США) (теперь входит в состав корпорации «Life Technologies»)
- 27. Данный метод не требует модификации нуклеотидных оснований, хемилюминесцентных или флуоресцентных меток. Когда нуклеотид включается в комплементарную
- 28. Затем последовательно добавляют реакционные ПЦР смеси, отличающиеся по составу наличием в них только одного из 4
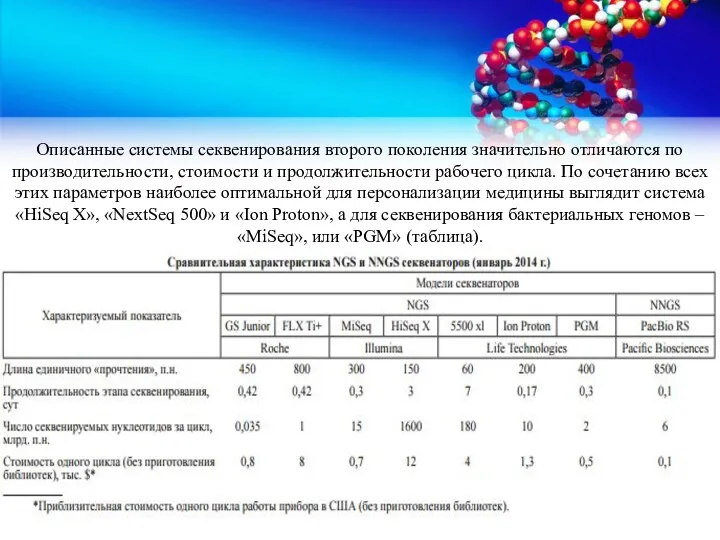
- 29. Описанные системы секвенирования второго поколения значительно отличаются по производительности, стоимости и продолжительности рабочего цикла. По сочетанию
- 30. Методы секвенирования новейшего поколения Методы секвенирования третьего поколения (NNGS) призваны исправить основные недостатки методов второго поколения,
- 31. Технология секвенирования одной молекулы. В 2008 г. компания «Helicos BioSciences» впервые продемонстрировала на своем приборе метод
- 32. Затем метку удаляют и добавляют по очереди каждый из четырех типов меченых нуклеотидов, детектируя свечение в
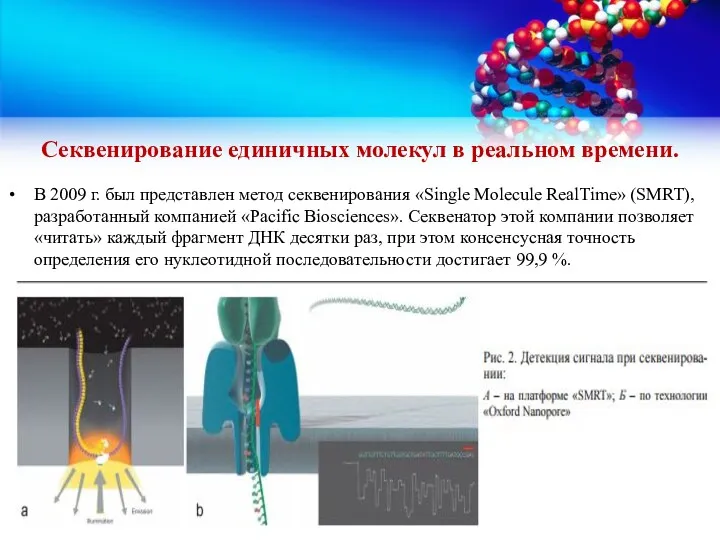
- 33. Секвенирование единичных молекул в реальном времени. В 2009 г. был представлен метод секвенирования «Single Molecule RealTime»
- 34. Технология данного метода основана на секвенировании в реальном времени одно- нитевых фрагментов ДНК длиной до 10000
- 35. Прибор «PacBio RS», основанный на этой технологии, имеет высокую собственную стоимость, но в то же время
- 36. Секвенирование через нанопоры. Возможность использовать матрицы с нанопорами для быстрого секвенирования ДНК исследуется уже более 15
- 37. Нанопоры представляют собой наноотверстия, которые могут быть биологическими, например порообразующий белок в мембране как липидный бислой,
- 38. Однако данная технология имеет, по крайней мере, два серьезных технических препятствия для реализации: отсутствие надежного подхода
- 39. Другой предложенный фирмой «IBM» вариант технологии – «ДНК Транзистор», использует многослойную (диэлектрик-металл) мембрану. Изменение напряжения между
- 40. Недавно компания «Oxford Nanopore Technologies» заявила о том, что практически доработала технологию секвенирования на основе нанопор
- 41. На сегодняшний день из практически реализованных методов секвенирования третьего поколения функционирует только платформа «SMRT» (Pacific Biosciences).
- 43. Скачать презентацию





































 Следы птиц Сочинского Причерноморья
Следы птиц Сочинского Причерноморья Дополнительный_материал_11.40_05.02.2024_eb5cb3bf (1)
Дополнительный_материал_11.40_05.02.2024_eb5cb3bf (1) Вирусные болезни растений. Фитопатогенные вирусы и микоплазмы. (Лекция 6)
Вирусные болезни растений. Фитопатогенные вирусы и микоплазмы. (Лекция 6) Методы исследования клетки
Методы исследования клетки Факторы эволюции. Приспособленность. Критерии вида
Факторы эволюции. Приспособленность. Критерии вида Механизм действия ферментов. Этапы ферментативного катализа
Механизм действия ферментов. Этапы ферментативного катализа Витамины. Общая характеристика витаминов
Витамины. Общая характеристика витаминов Презентация Витамины
Презентация Витамины Болезни овощей и фруктов
Болезни овощей и фруктов Собаки в нашем доме
Собаки в нашем доме Доказательства эволюции органического мира
Доказательства эволюции органического мира Закрепление материала по биологии для 5-ого класса
Закрепление материала по биологии для 5-ого класса Будова рослин. Клітини та тканини рослин
Будова рослин. Клітини та тканини рослин Черная книга животных и птиц
Черная книга животных и птиц Медузы. Стадии жизненного цикла
Медузы. Стадии жизненного цикла Ріст рослин в умовах невагомості
Ріст рослин в умовах невагомості Розы Ленс
Розы Ленс Physiology of eye. Physiology of vision
Physiology of eye. Physiology of vision Строение и работа сердца
Строение и работа сердца Функциональная анатомия мочеполовой системы
Функциональная анатомия мочеполовой системы История развития органического мира
История развития органического мира Мутагенез. Механизмы защиты генома от мутагенных воздействий
Мутагенез. Механизмы защиты генома от мутагенных воздействий Прокариот и эукариот
Прокариот и эукариот Что такое природа
Что такое природа Подтип позвоночные (или черепные). Рыбы
Подтип позвоночные (или черепные). Рыбы Зачем животным нужны хвосты
Зачем животным нужны хвосты История создания микроскопа
История создания микроскопа Полярный медведь
Полярный медведь