Структура і функції білків. Ферменти. Вітаміни, гормони, фактори росту, їх роль у життєдіяльності організмів презентация
Содержание
- 2. МОЛЕКУЛЯРНА БІОЛОГІЯ – вивчає білки та нуклеїнові кислоти Молекулярна біологія досліджує закономірності спадковості організмів на молекулярному
- 3. МОЛЕКУЛЯРНА БІОЛОГІЯ – вивчає білки та нуклеїнові кислоти Результати досліджень з молекулярної біології вказують на те,
- 4. МОЛЕКУЛЯРНА БІОЛОГІЯ – вивчає білки та нуклеїнові кислоти Від специфіки первинної структури БІЛКА залежить конформація білка
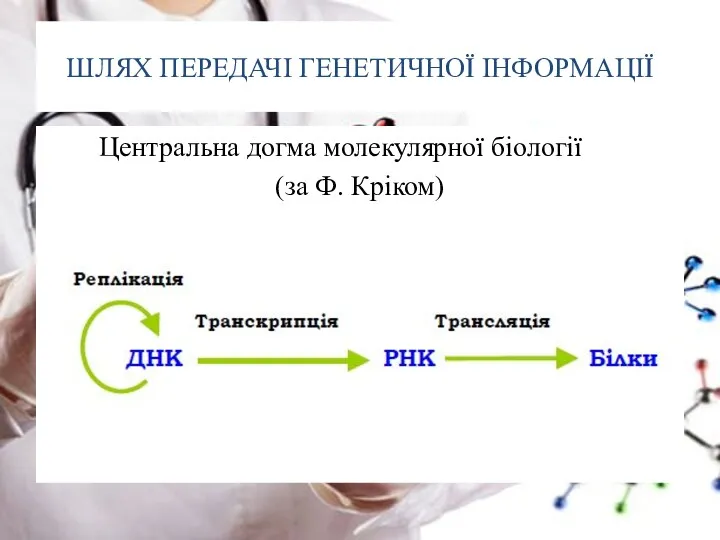
- 5. ШЛЯХ ПЕРЕДАЧІ ГЕНЕТИЧНОЇ ІНФОРМАЦІЇ Центральна догма молекулярної біології (за Ф. Кріком)
- 6. БІООРГАНІЧНІ МОЛЕКУЛИ Нуклеїнові кислоти (ДНК, різні типи РНК) Білки
- 7. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Білки – біополімери, мономерами яких є амінокислоти Амінокислоти – органічні сполуки, які
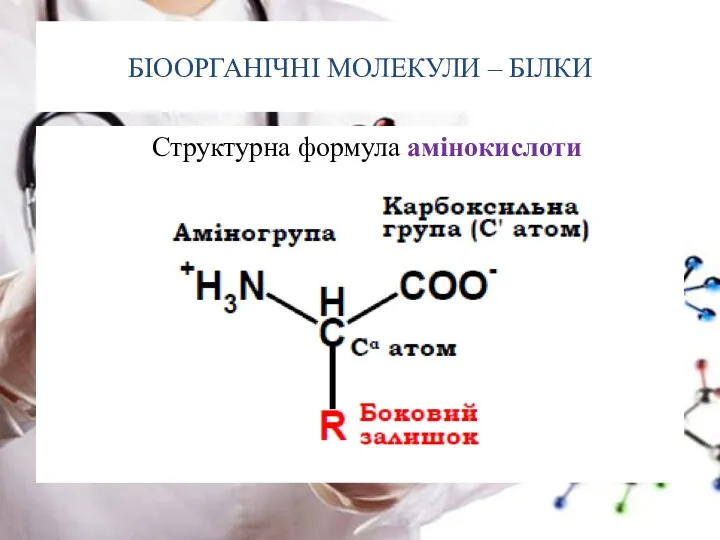
- 8. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Структурна формула амінокислоти
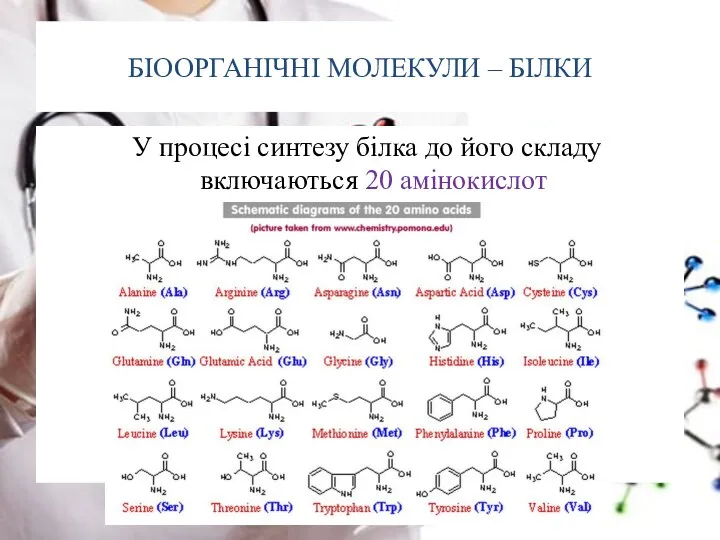
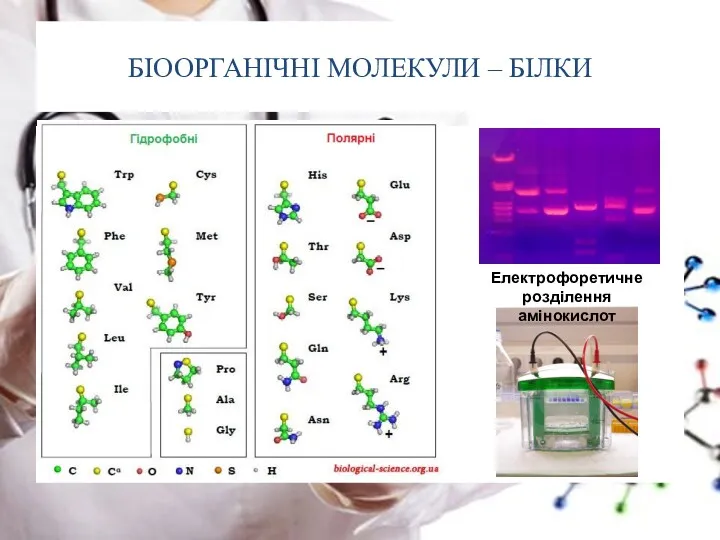
- 9. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ У процесі синтезу білка до його складу включаються 20 амінокислот
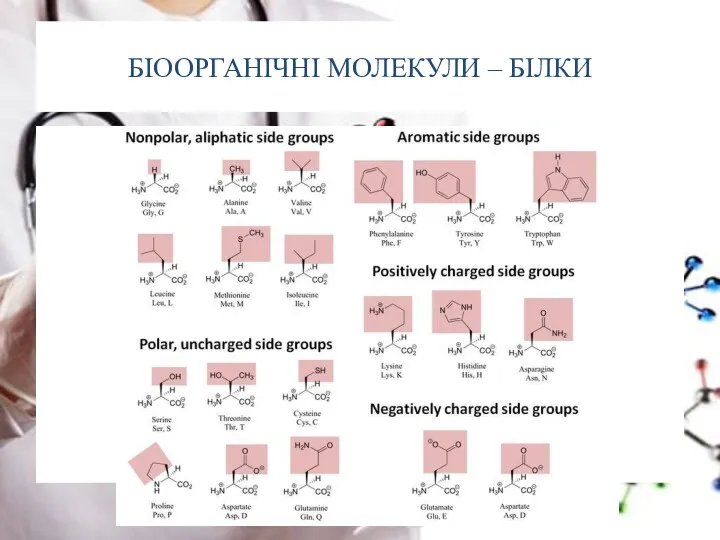
- 10. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
- 11. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
- 12. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ У процесі синтезу білка до його складу включаються 20 амінокислот Амінокислоти Незамінні
- 13. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
- 14. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ
- 15. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Електрофоретичне розділення амінокислот
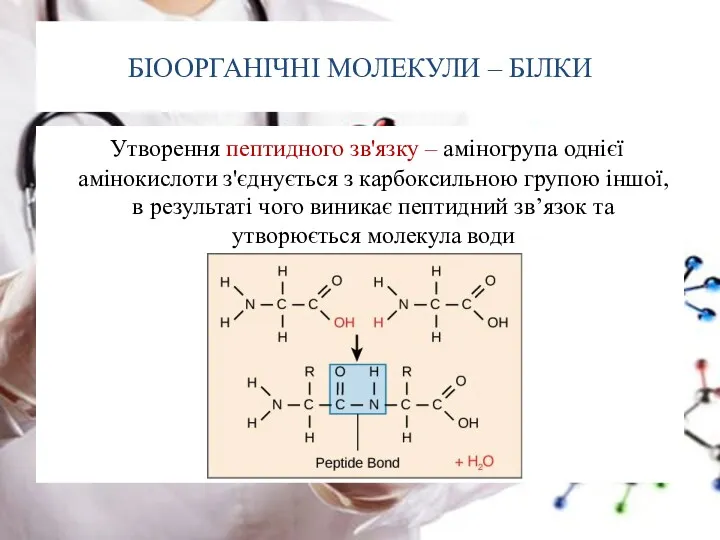
- 16. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Утворення пептидного зв'язку – аміногрупа однієї амінокислоти з'єднується з карбоксильною групою іншої,
- 17. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Утворення пептидного зв'язку
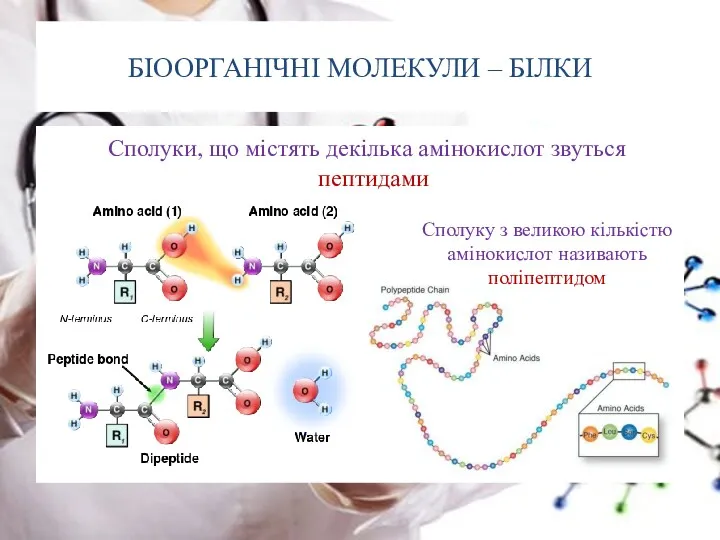
- 18. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ Сполуки, що містять декілька амінокислот звуться пептидами Сполуку з великою кількістю амінокислот
- 19. БІООРГАНІЧНІ МОЛЕКУЛИ – БІЛКИ До складу більшості білків входить 300-500 амінокислотних залишків, але є й більші
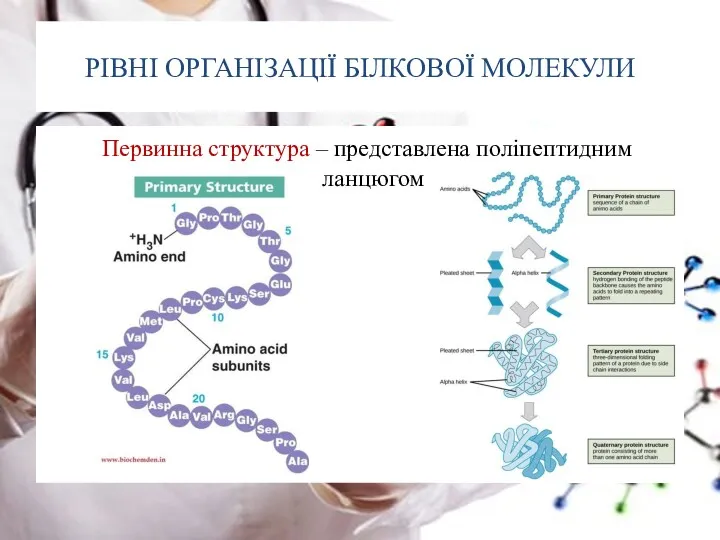
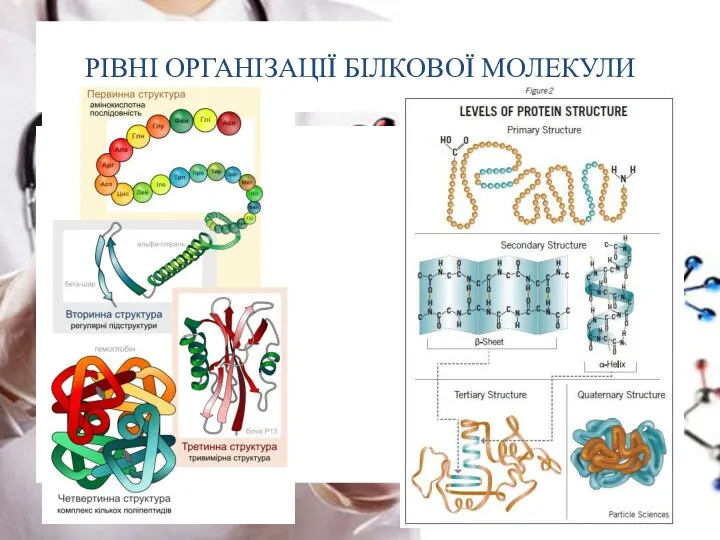
- 20. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Первинна структура – представлена поліпептидним ланцюгом
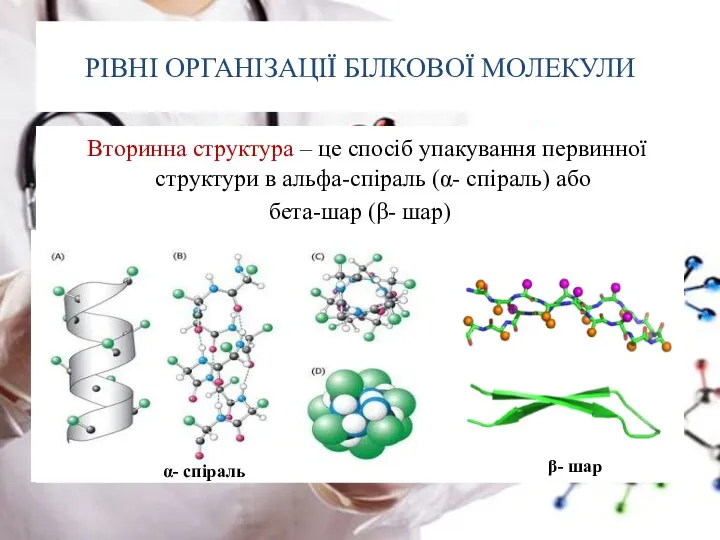
- 21. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Вторинна структура – це спосіб упакування первинної структури в альфа-спіраль (α- спіраль)
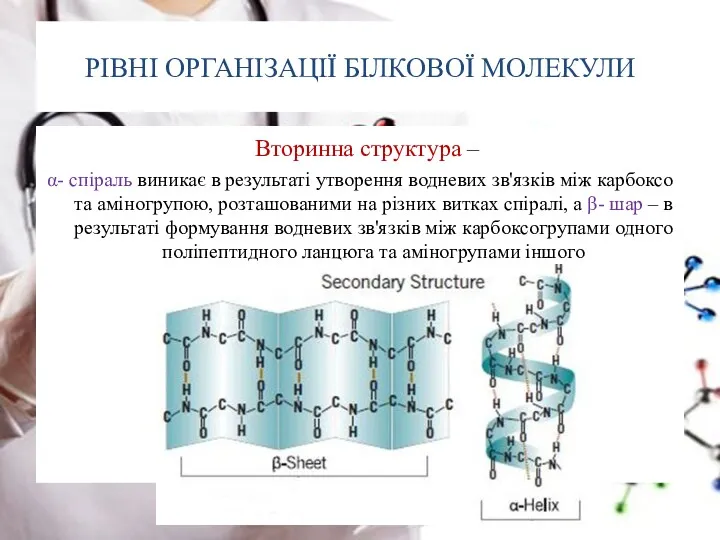
- 22. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Вторинна структура – α- спіраль виникає в результаті утворення водневих зв'язків між
- 23. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Вторинна структура – α- спіраль виникає в результаті утворення водневих зв'язків між
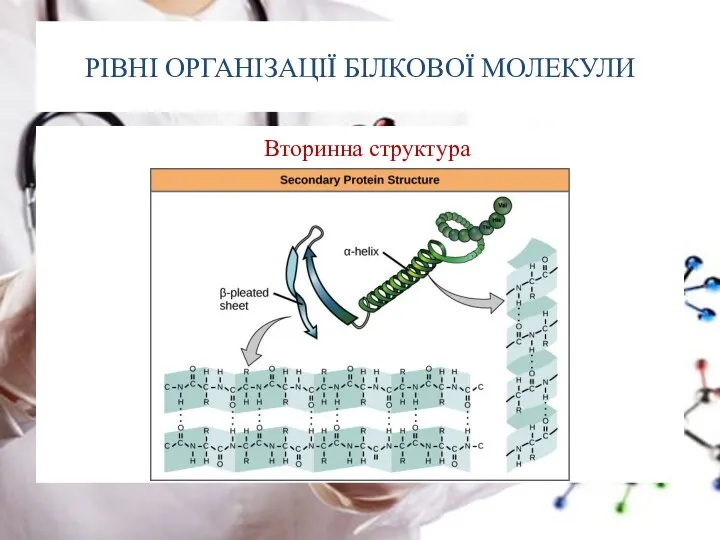
- 24. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Вторинна структура
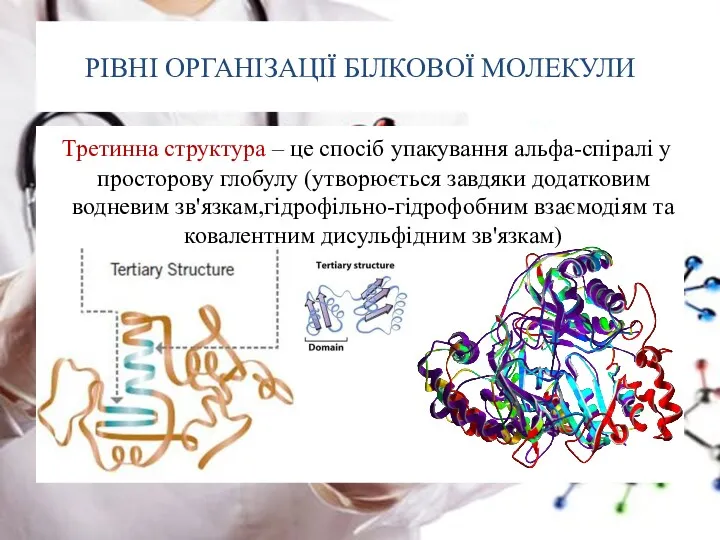
- 25. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Третинна структура – це спосіб упакування альфа-спіралі у просторову глобулу (утворюється завдяки
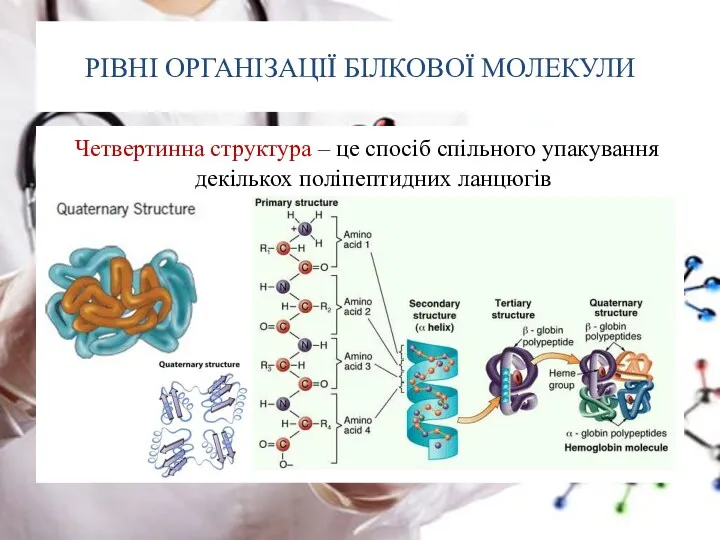
- 26. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ Четвертинна структура – це спосіб спільного упакування декількох поліпептидних ланцюгів
- 27. РІВНІ ОРГАНІЗАЦІЇ БІЛКОВОЇ МОЛЕКУЛИ
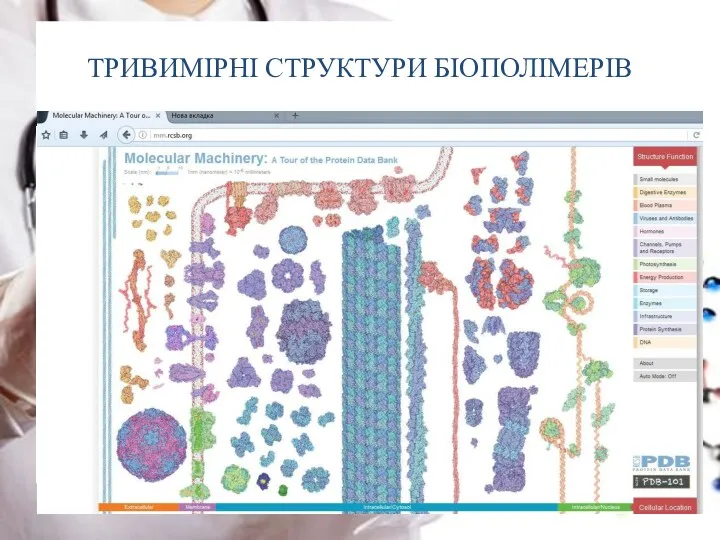
- 28. ТРИВИМІРНІ СТРУКТУРИ БІОПОЛІМЕРІВ
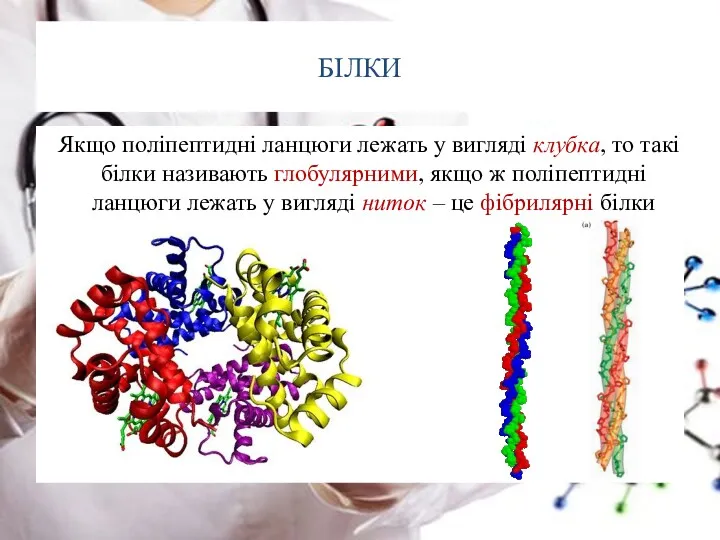
- 29. БІЛКИ Якщо поліпептидні ланцюги лежать у вигляді клубка, то такі білки називають глобулярними, якщо ж поліпептидні
- 30. ДЕНАТУРАЦІЯ ТА РЕНАТУРАЦІЯ БІЛКА Починаючи зі вторинної структури, просторова конформація макромолекул білка підтримується переважно слабкими хімічними
- 31. БІОФУНКЦІЇ БІЛКІВ
- 32. БІОФУНКЦІЇ БІЛКІВ
- 33. БІОФУНКЦІЇ БІЛКІВ
- 34. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ Ферменти – це білкові молекули, що є біологічними каталізаторами Каталітична функція притаманна особливим
- 35. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ Ферментативні реакції в клітині є анаболічні (реакції синтезу) та катаболічні (реакції розпаду). Сукупність
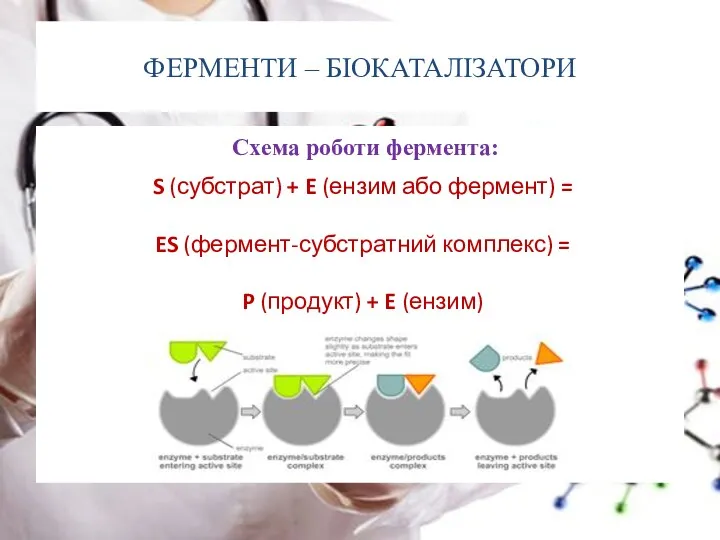
- 36. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ Схема роботи фермента: S (субстрат) + E (ензим або фермент) = ES (фермент-субстратний
- 37. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ Каталітична активність ферменту зумовлена не всією його молекулою, а лише її невеликою ділянкою,
- 38. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ Ферменти бувають простими та складними Прості ферменти – це білкові молекули (пепсин, трипсин
- 39. ФЕРМЕНТИ – БІОКАТАЛІЗАТОРИ Кожна молекула ферменту може здійснювати від кількох тисяч до кількох мільйонів операцій одного
- 40. ВЛАСТИВОСТІ ФЕРМЕНТІВ Ферменти мають наступні властивості: 1) всі ферменти є глобулярними білками; 2) вони збільшують швидкість
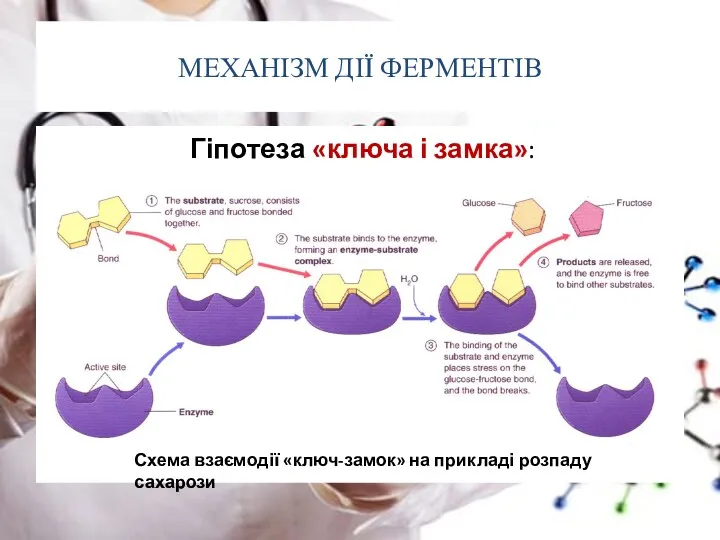
- 41. МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ Існує дві гіпотези, що пояснюють як діють ферменти: одна з них називається “
- 42. МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ Гіпотеза «ключа і замка»: Схема взаємодії «ключ-замок» на прикладі розпаду сахарози
- 43. МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ Існує дві гіпотези, що пояснюють як діють ферменти: одна з них називається “
- 44. МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ Гіпотеза «рука і рукавичка»: Схема взаємодії «рука-рукавичка» Схема ілюструє кошландівську гіпотезу індукованої відповідності
- 45. ВИКОРИСТАННЯ ФЕРМЕНТІВ
- 46. ВІТАМІНИ Вітаміни – це низькомолекулярні органічні сполуки різної хімічної природи, що виконують важливі біохімічні та фізіологічні
- 47. ВІТАМІНИ Вітаміни – це низькомолекулярні органічні сполуки різної хімічної природи, що виконують важливі біохімічні та фізіологічні
- 48. ВІТАМІНИ
- 49. ВІТАМІНИ
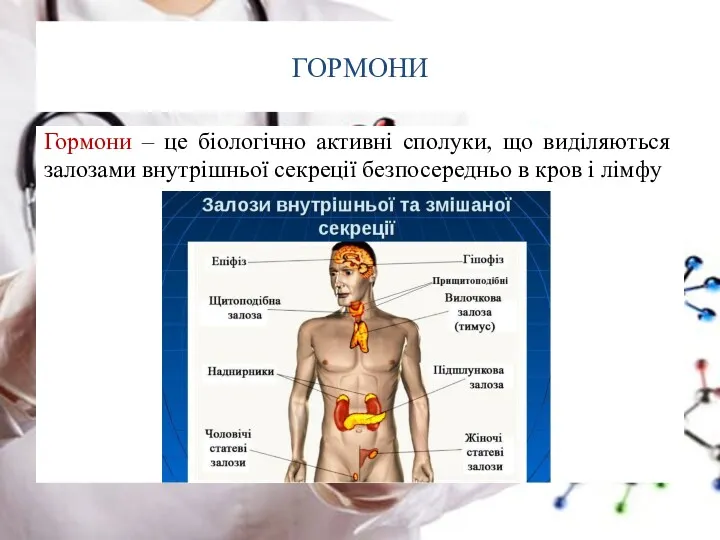
- 50. ГОРМОНИ Гормони – це біологічно активні сполуки, що виділяються залозами внутрішньої секреції безпосередньо в кров і
- 51. ГОРМОНИ Гормони – це біологічно активні сполуки, що виділяються залозами внутрішньої секреції безпосередньо в кров і
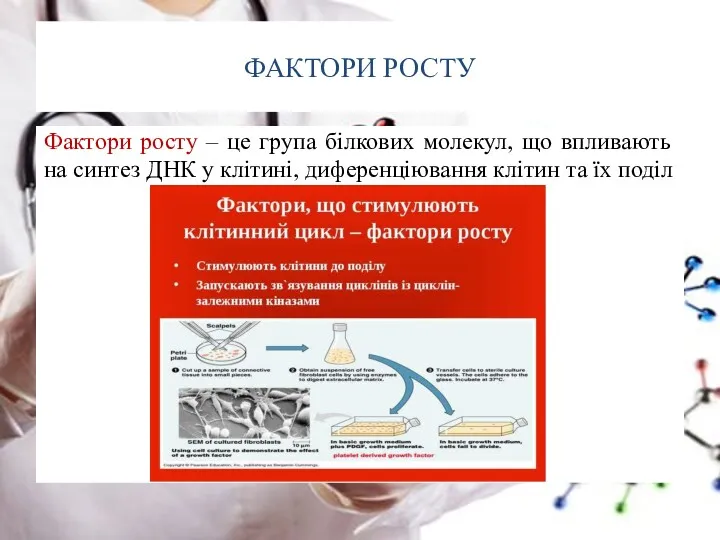
- 52. ФАКТОРИ РОСТУ Фактори росту – це група білкових молекул, що впливають на синтез ДНК у клітині,
- 54. Скачать презентацию































 Системы органов. Опорно-двигательная. Строение кости. Скелет
Системы органов. Опорно-двигательная. Строение кости. Скелет Вирусы – неклеточная форма жизни…
Вирусы – неклеточная форма жизни… Плоды
Плоды Презентации по биологии 8 класс
Презентации по биологии 8 класс Разработка урока по биологии Витамины 8 класс
Разработка урока по биологии Витамины 8 класс Гормоны, биологически активные вещества органической природы
Гормоны, биологически активные вещества органической природы Урок биологии в 5 кл. Красная книга Чувашской Республики
Урок биологии в 5 кл. Красная книга Чувашской Республики Методы антропогенетики
Методы антропогенетики Использование теории развития критического мышления на уроках биологии
Использование теории развития критического мышления на уроках биологии Биосинтез белка
Биосинтез белка Розробка технологічного процесу виробництва комбікормів в умовах ФГ Росток
Розробка технологічного процесу виробництва комбікормів в умовах ФГ Росток Плоды. Общая характеристика плодов. Принципы классификации плодов
Плоды. Общая характеристика плодов. Принципы классификации плодов HММ, поиск генов и профилей
HММ, поиск генов и профилей Сочетает ли в себе грибная клетка растительные и животные черты
Сочетает ли в себе грибная клетка растительные и животные черты Способы размножения растений
Способы размножения растений Комнатные растения
Комнатные растения Презентация урока 6 класс ФГОС.
Презентация урока 6 класс ФГОС. Физиология пищеварения
Физиология пищеварения Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4)
Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4) Простейшие: внешнее строение и образ жизни
Простейшие: внешнее строение и образ жизни Комнатные растения
Комнатные растения Рациональное питание. Кулинария
Рациональное питание. Кулинария Смачна, але шкідлива їжа
Смачна, але шкідлива їжа Типы питания клеток. Автотрофы и гетеротрофы
Типы питания клеток. Автотрофы и гетеротрофы Строение и функции кожи. 8 класс
Строение и функции кожи. 8 класс Задания ЕГЭ Экологические факторы среды
Задания ЕГЭ Экологические факторы среды Флористическое разнообразие травянистого яруса пойменной дубравы с. Шыгырдан Батыревского района Чувашской республики
Флористическое разнообразие травянистого яруса пойменной дубравы с. Шыгырдан Батыревского района Чувашской республики Жертвы эволюции
Жертвы эволюции