Содержание
- 2. Дәріс жоспары Су әмбебап еріткіш ретінде. Ағза тіршілігінде ерітінділердің маңызы Ерітінділердің коллигативтік қасиеттері және осмостық шиеленіс
- 3. Роль воды – 1. составная часть всех клеток и тканей организма. 2. средой, в которой протекают
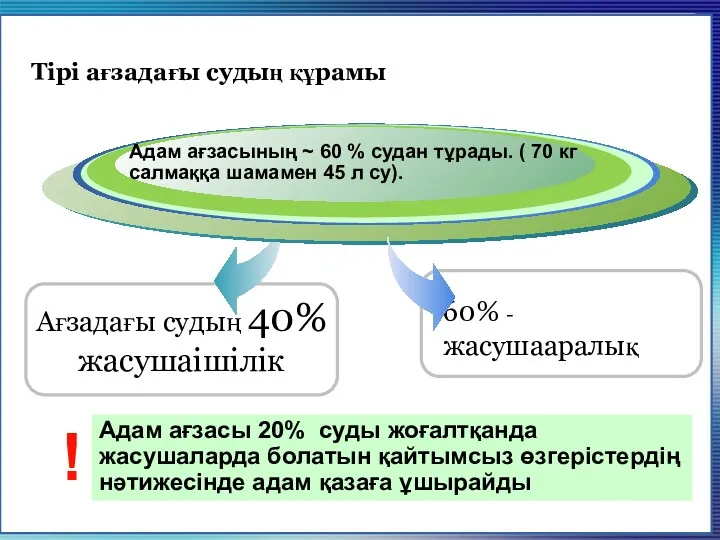
- 4. Тірі ағзадағы судың құрамы Адам ағзасы 20% суды жоғалтқанда жасушаларда болатын қайтымсыз өзгерістердің нәтижесінде адам қазаға
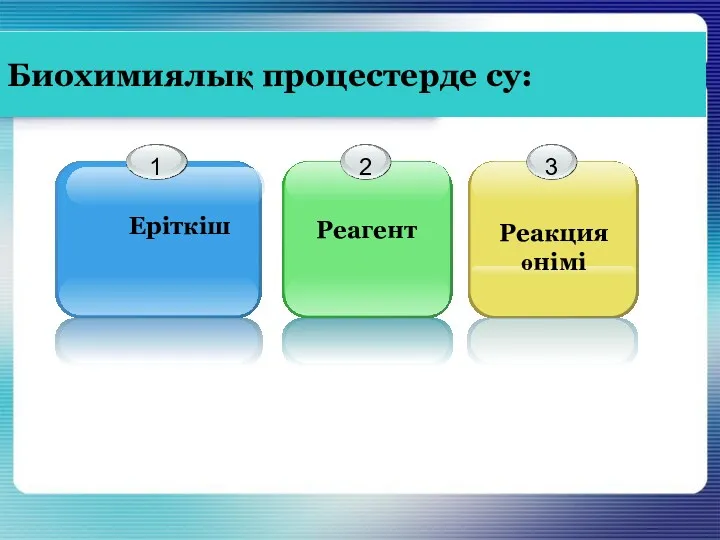
- 5. Биохимиялық процестерде су: Реагент
- 6. www.themegallery.com Ерітінді – екі немесе одан да көп компоненттерден (жеке заттардан) тұратын гомогенді жүйе
- 7. Ерітінділердің еріген заттың мөлшері бойынша жіктелуі Аса қанық ерітінді - концентрациясы каныққан ерітіндінің концентрациясынан жоғары болатын,
- 8. Ерітінділердің электр тогын өткізу қабілетіне орай жіктелуі Электролит ерітінділері – ерітіндісі өз бойынан электр тогін өткізетін,
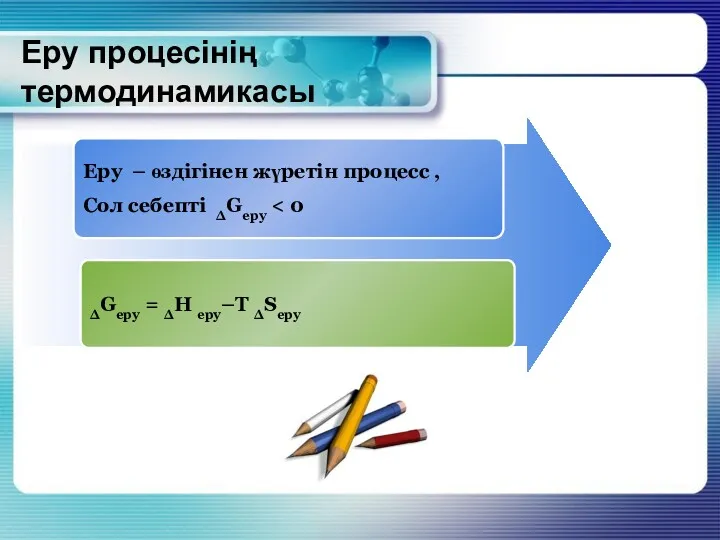
- 9. Еру процесінің термодинамикасы
- 10. Ерітінділердің коллигативтік қасиеттері - салыстырмалы сипаттамалары еріген заттың табиғатына тәуелсіз, тек бөлшектерінің санына ғана тәуелді қасиеттері
- 11. ерітіндінің қайнау температурасының таза еріткіштің қайнау температурасына қарағанда салыстымалы жоғарылауы ерітіндінің бетіндегі еріткіштің қаныққан бу қысымының
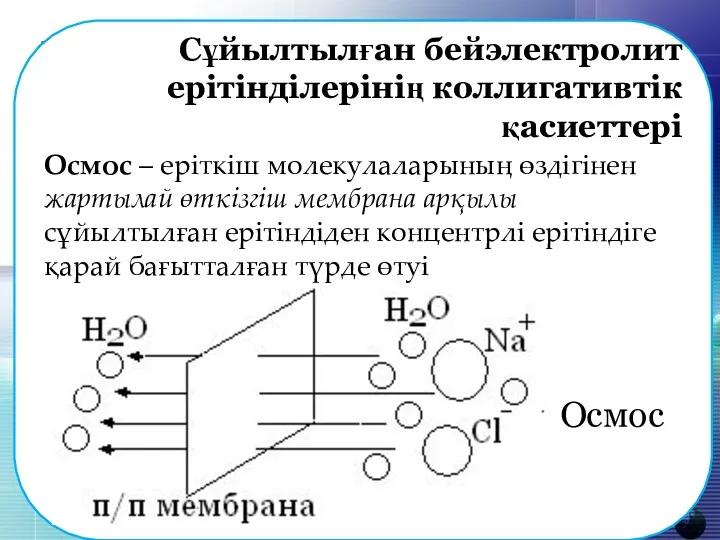
- 12. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері Осмос – еріткіш молекулаларының өздігінен жартылай өткізгіш мембрана арқылы сұйылтылған ерітіндіден
- 13. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері Осмостық қысым (π) – осмосты тоқтату үшін ерітіндіге қажет қысым, яғни,
- 14. Росм (адам қанының) = const және 370С-та 740 – 780 кПа-ға немесе 7,4-7,8 атм –ға тең
- 15. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері ΔТқайнау=Е⋅ b(x) Тек қана бейэлектролит ерітінділері үшін или ΔТқату=К⋅ b(x)
- 16. Изотонды коэффициент – i Изотонды коэффициент (i) - идеал емес ерітінділердегі молекулааралық әрекеттесулерді ескеру үшін енгізілген
- 17. Изотонды коэффициент – i Электролит ерітінділері үшін (i) концентрациялары бірдей болғанда электролиттердің осмостық қысымы бейэлектролиттердің осмостық
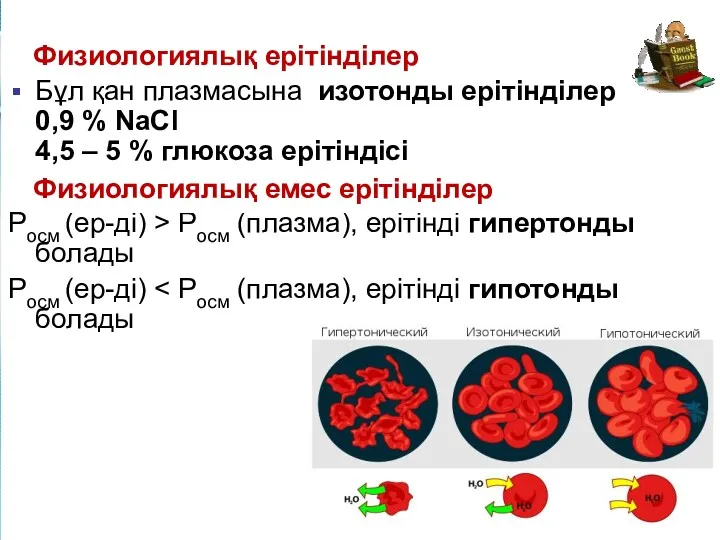
- 18. Ортаның изотондылығы бұзылған жағдайда эритроциттер Росм ер-ді > Росм қан, гипертонды ерітінді Жасушаның жиырылуы - плазмолиз
- 19. www.themegallery.com Физиологиялық ерітінділер Бұл қан плазмасына изотонды ерітінділер 0,9 % NaCl 4,5 – 5 % глюкоза
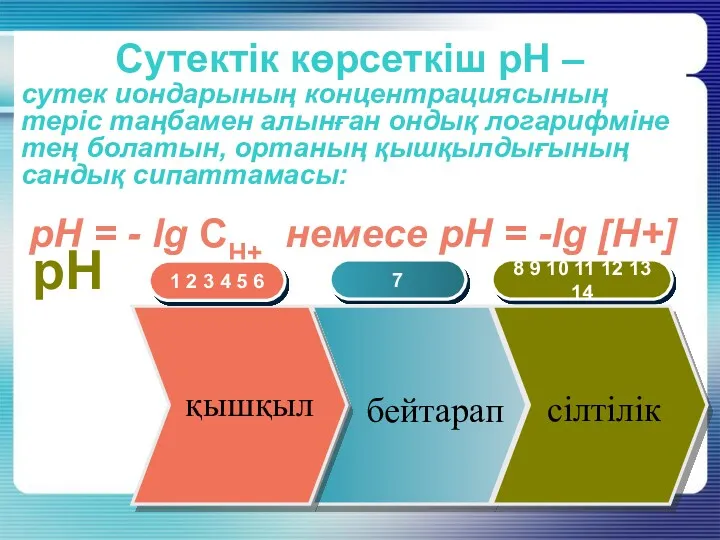
- 20. Сутектік көрсеткіш рН – сутек иондарының концентрациясының теріс таңбамен алынған ондық логарифміне тең болатын, ортаның қышқылдығының
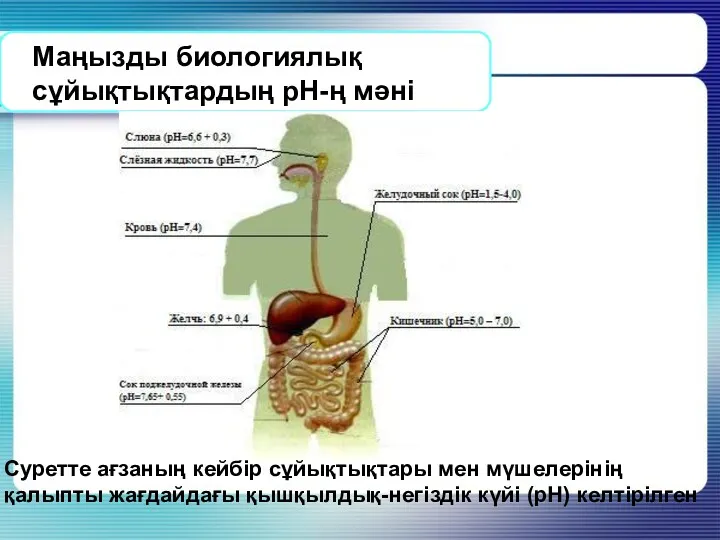
- 21. Маңызды биологиялық сұйықтықтардың рН-ң мәні Суретте ағзаның кейбір сұйықтықтары мен мүшелерінің қалыпты жағдайдағы қышқылдық-негіздік күйі (рН)
- 22. Защитные мех-мы поддержания пострН-ң оянства рН: рН-ң тұрақтылығын бір қалпында ұстап тұратын қорғаушы механизмдер: физиологиялық –
- 23. БУФЕРЛІК ЖҮЙЕЛЕР Буферлік жүйелер – сырттан әсер болғанда өзінің қандай да бір параметрінің шамасын өзгертпей, тұрақты
- 24. Қанның буферлік жүйелері
- 25. Буферлік ерітінділердің әсер ету механизмі НА ↔ Н+ + А– а/ А– + Н+ → НА
- 26. мұндағы Сa– күшті қышқыл эквивалентінің молярлық концентрациясы, моль/л; Va– қосылған күшті қышқыл көлемі, мл; Vб –
- 27. Механизм действия гидрокарбонатной буферной системы Действие гидрокарбонатного буфера при попадании в него сильной кислоты или щелочи
- 28. Механизм действия гидрокарбонатной буферной системы Действие гидрокарбонатного буфера при попадании в него сильной кислоты или щелочи
- 30. Тотығу-тотықсыздану электроды – редокс жүйемен үйлескен инертті металл, бұл электродта пайда болатын потенциал редокс потенциал деп
- 31. Ұлпалар мен мүшелердегі редокс жүйелер: 1. Пирожүзім қышқылы/сүт қышқылы, 2. гем/гематин, 3. цитохромдар, 4. Аскорбин қышқылы/дегидроаскорбин
- 32. Тыныс алу тізбегі– органикалық субстраттардан оттекке (митохондрияда) электрон тасымалдау арқылы жүретін тотығу-тотықсыздану реакцияларының жүйелілігі
- 33. Ағзадағы тотығу-тотықсыздану процестердің сипаттамасы: биологиялық тотығу – ағзаның тіршілігіне керекті энергия АТФ-ң макроэргиялық байланыстарында нәтижесінде бөлініп,
- 34. Хлор, озон (суды озондау), сутегі асқын тотығы, йод ерітіндісі тәрізді көптеген тотықтырғыштар микроорганизмдерді жою үшін бактериялық
- 36. Скачать презентацию


























 Формы естественного отбора
Формы естественного отбора Наследственные и врожденные заболевания. ЗППП
Наследственные и врожденные заболевания. ЗППП Отдел Покрытосеменные Класс Двудольные
Отдел Покрытосеменные Класс Двудольные Разработка технологической карты урока биологии Фотосинтез. Хемосинтез
Разработка технологической карты урока биологии Фотосинтез. Хемосинтез Что общего у разных растений
Что общего у разных растений Биохимия клеточной поверхности микроорганизмов
Биохимия клеточной поверхности микроорганизмов Влияние физических факторов на микроорганимы
Влияние физических факторов на микроорганимы Мінез-құлық қалыптасуының жалпы принцептері. ЖЖІӘ туралы түсінік. Туа біткен және жүре пайда болған іс әрекеттерінің түрлері
Мінез-құлық қалыптасуының жалпы принцептері. ЖЖІӘ туралы түсінік. Туа біткен және жүре пайда болған іс әрекеттерінің түрлері Царство Harosa (=SAR)
Царство Harosa (=SAR) Лес - природный комплекс
Лес - природный комплекс Строение и свойства воды
Строение и свойства воды Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21)
Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21) Пеларгония (герань, журавельник)
Пеларгония (герань, журавельник) Происхождения человека. Сходства и различия с животными
Происхождения человека. Сходства и различия с животными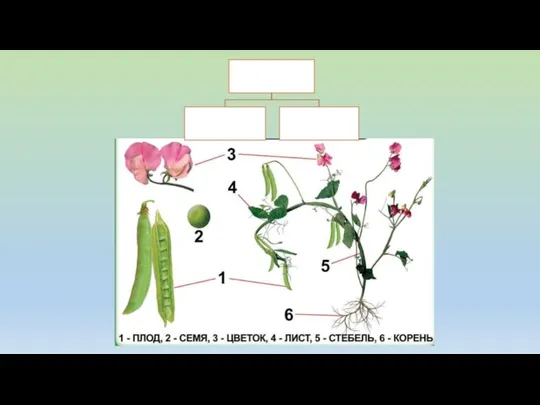 Внешнее и внутреннее строение семян
Внешнее и внутреннее строение семян Где живут белые медведи (окружающий мир, 1 класс)
Где живут белые медведи (окружающий мир, 1 класс) Растения индикаторы окружающей среды
Растения индикаторы окружающей среды Класс двудольные растения
Класс двудольные растения Презентация к уроку 5 класса ФГОС
Презентация к уроку 5 класса ФГОС Нервная система. Периферическая нервная система. Вегетативная нервная система
Нервная система. Периферическая нервная система. Вегетативная нервная система Строение, свойства, биологическая роль нуклеотидов и нуклеиновых кислот. Катаболизм нуклеиновых кислот
Строение, свойства, биологическая роль нуклеотидов и нуклеиновых кислот. Катаболизм нуклеиновых кислот Фрукти і овочі: характеристика, вимоги до якості, умови зберігання
Фрукти і овочі: характеристика, вимоги до якості, умови зберігання Структура и функции надорганизменных генетических систем. (Тема 4)
Структура и функции надорганизменных генетических систем. (Тема 4) Органічні молекули живого. Біополімери
Органічні молекули живого. Біополімери Чарлз Роберт Дарвин
Чарлз Роберт Дарвин Бесполое размножение
Бесполое размножение Формирование поведения животных (2)
Формирование поведения животных (2) Углеводы. Историческая справка
Углеводы. Историческая справка