Содержание
- 5. 2H2S + CO2 -> CH2O + 2S + H2O В отличие от эукариот, некоторые цианобактерии (в
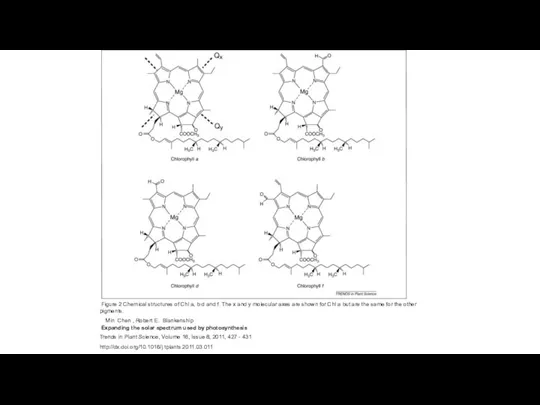
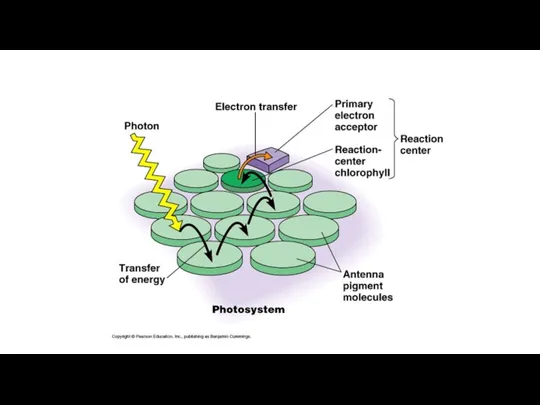
- 6. Figure 2 Chemical structures of Chl a, b d and f. The x and y molecular
- 7. Каротиноиды цианобактерий: β-каротин у них содержится в больших пропорциях, чем у эукариот, встречаются α-каротин, зеаксантин эхиненон,
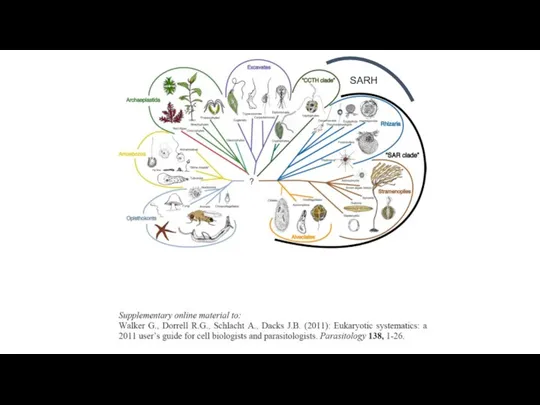
- 12. SARH
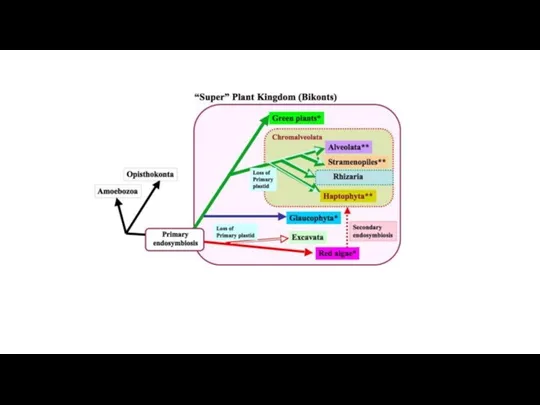
- 13. The distribution of photosynthesis across the eukaryotes. Dorrell R G , Howe C J J Cell
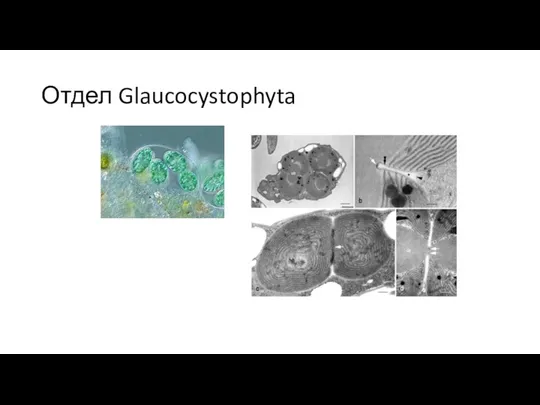
- 16. Отдел Glaucocystophyta
- 17. Отдел Rhodophyta
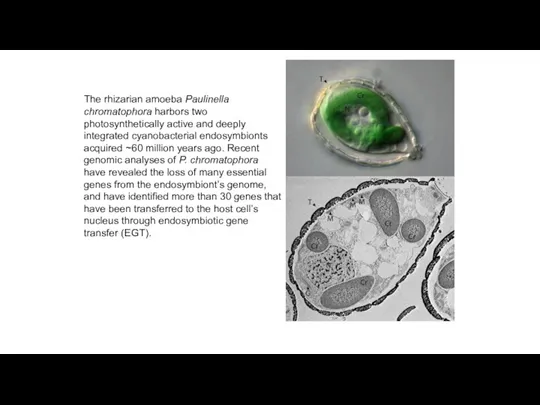
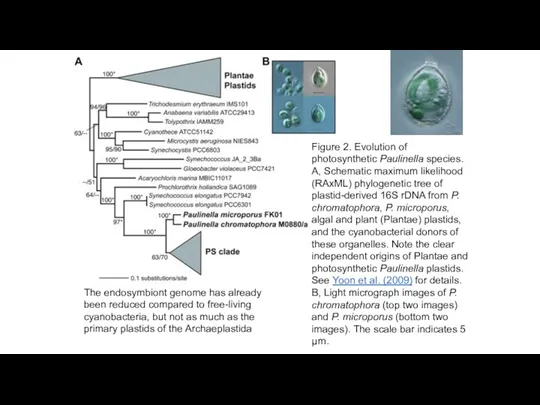
- 21. The rhizarian amoeba Paulinella chromatophora harbors two photosynthetically active and deeply integrated cyanobacterial endosymbionts acquired ~60
- 22. Figure 2. Evolution of photosynthetic Paulinella species. A, Schematic maximum likelihood (RAxML) phylogenetic tree of plastid-derived
- 25. b) A Spheroid body of the diatom Rhopalodia gibba. SM: Symbiontophoric membrane SBM: Spheroid body membrane.
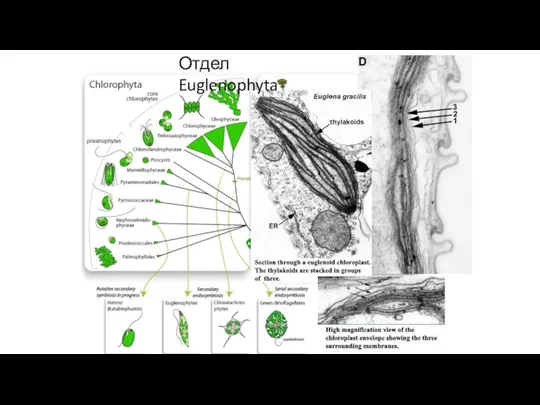
- 26. Отдел Euglenophyta Отдел Euglenophyta
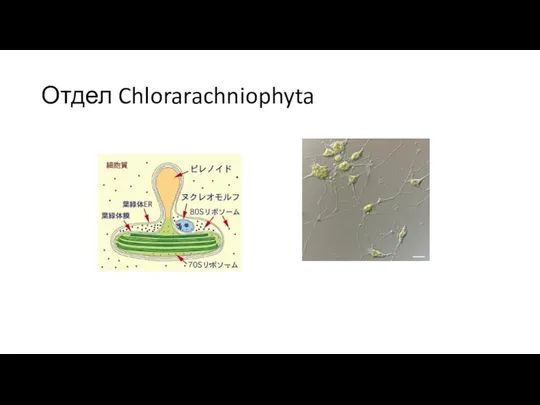
- 27. Отдел Chlorarachniophyta
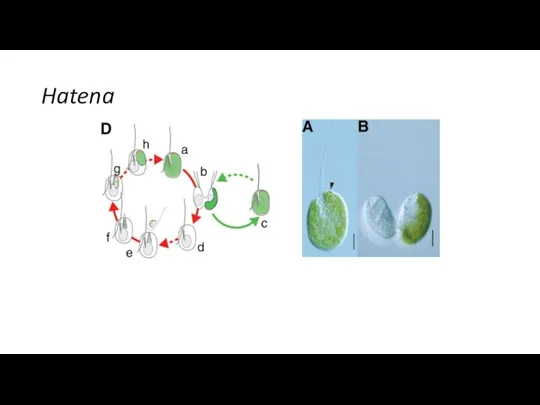
- 28. Hatena
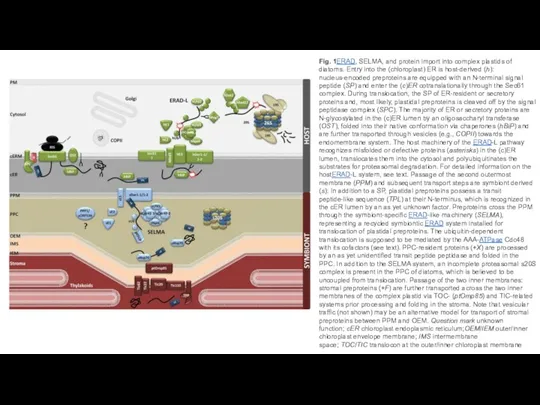
- 31. Fig. 1ERAD, SELMA, and protein import into complex plastids of diatoms. Entry into the (chloroplast) ER
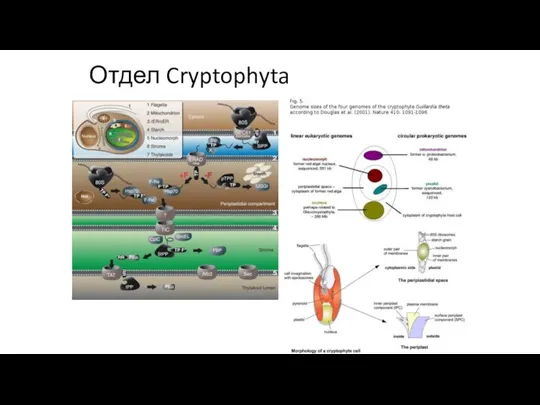
- 32. Отдел Cryptophyta
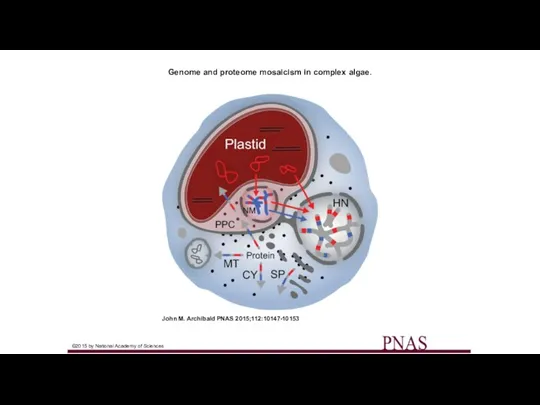
- 33. Genome and proteome mosaicism in complex algae. John M. Archibald PNAS 2015;112:10147-10153 ©2015 by National Academy
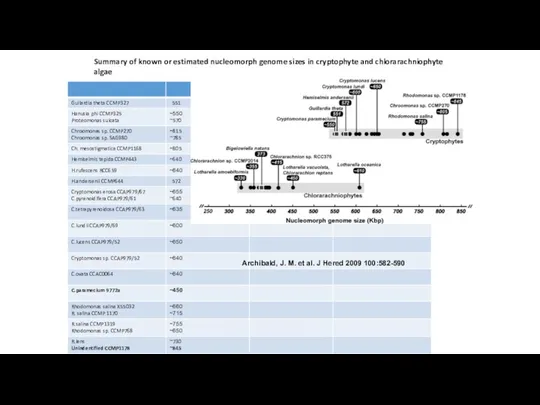
- 34. Archibald, J. M. et al. J Hered 2009 100:582-590 Summary of known or estimated nucleomorph genome
- 37. Характеристики геномов нуклеоморф
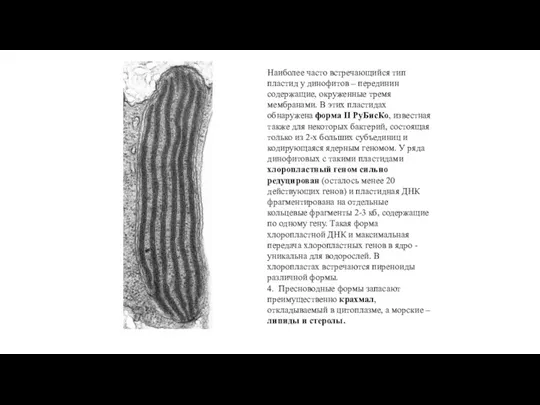
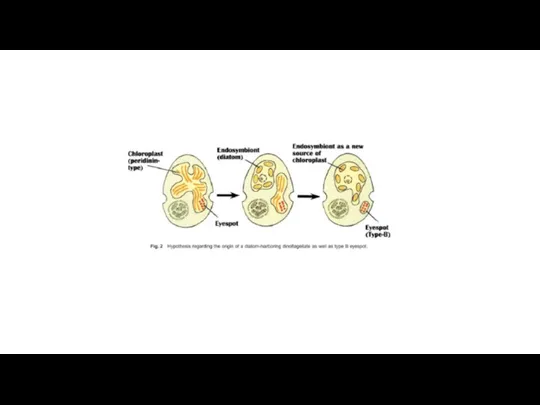
- 42. Наиболее часто встречающийся тип пластид у динофитов – перединин содержащие, окруженные тремя мембранами. В этих пластидах
- 44. Prasinophyte-производные «пластиды»: Постоянные зеленые хлоропласты в Lepidodinium (Watanabe et al. 1991, Elbrächter and Schnepf 1996, Hansen
- 45. Haptophyte-произошедшие пластиды: В этой ветви (Karenia, Karlodinium, Takayama) фотосинтезирующие органеллы представляют настоящие пластиды – гены для
- 46. Dictyophyte-производные пластиды: Один вид динофлагеллят (Podolampas bipes) содержит постоянный диктиохофициевый эндосимбионт с хлоропластами и ядром (Schnepf
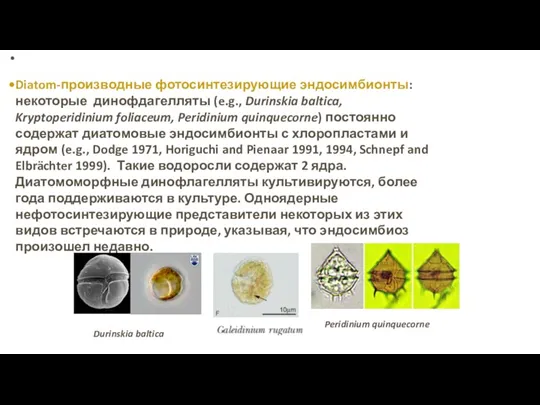
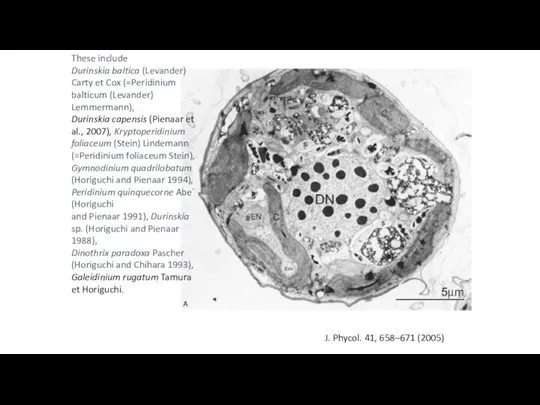
- 47. Diatom-производные фотосинтезирующие эндосимбионты: некоторые динофдагелляты (e.g., Durinskia baltica, Kryptoperidinium foliaceum, Peridinium quinquecorne) постоянно содержат диатомовые эндосимбионты
- 49. These include Durinskia baltica (Levander) Carty et Cox (=Peridinium balticum (Levander) Lemmermann), Durinskia capensis (Pienaar et
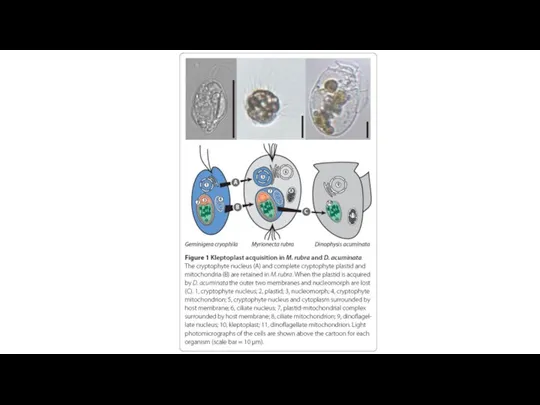
- 51. Cryptophyte-клептохлоропласты: Большинство видов рода Dinophysis содержат или целые криптомонады или только их хлоропласты (Schnepf and Elbrächter
- 52. Myrionecta rubra
- 55. The relationship between Convoluta roscoffensis and Tetraselmis convolutae Symsagittifera roscoffensis Tetraselmis spp. in Symsagittifera (=Convoluta) spp.),
- 57. Функционирующие клептопласты широко распространены среди моллюсков рода Elysia (менее 10 дней у E. hedgpethi (Greene, 1970),
- 60. Species of Costasiella investigated. Christa G et al. J. Mollus. Stud. 2014;mollus.eyu026 © The Author 2014.
- 64. Скачать презентацию





































 Опасность биологического оружия
Опасность биологического оружия Семейства рыб
Семейства рыб Різноманітність ссавців
Різноманітність ссавців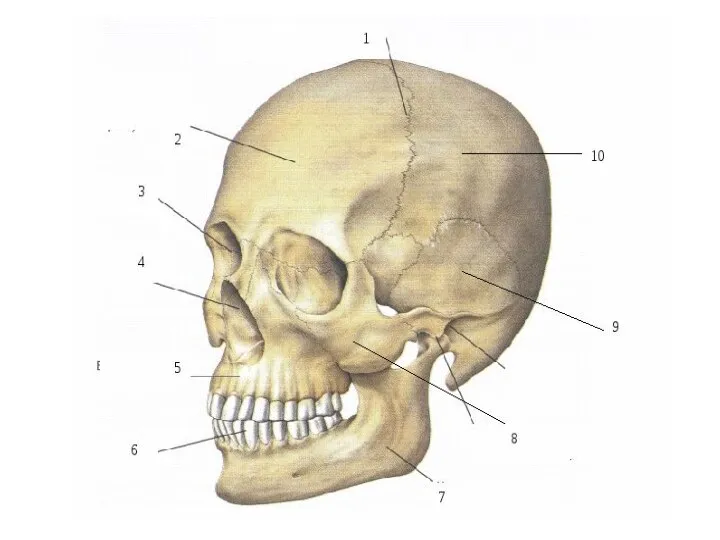 Скелет
Скелет Фізіологія як наука. Біоелектричні явища в збудливих тканинах
Фізіологія як наука. Біоелектричні явища в збудливих тканинах Отряд Приматы
Отряд Приматы Дыхательная система
Дыхательная система Генетически модифицированные организмы
Генетически модифицированные организмы KS4 Biology. The Breathing System
KS4 Biology. The Breathing System Цикл митоз
Цикл митоз Презентация к уроку Гигиена дыхания
Презентация к уроку Гигиена дыхания Местообитание и экологические ниши. Основные типы взаимодействий организмов
Местообитание и экологические ниши. Основные типы взаимодействий организмов Ангиология. Анатомия сердца
Ангиология. Анатомия сердца Эндокринная система человека
Эндокринная система человека Цветковые растения
Цветковые растения Рух крові артеріями
Рух крові артеріями Большие полушария. Базальные ганглии. Кора больших полушарий
Большие полушария. Базальные ганглии. Кора больших полушарий Изолирующие механизмы. Видообразование
Изолирующие механизмы. Видообразование Характеристики природного сообщества растений как биосистемы.
Характеристики природного сообщества растений как биосистемы. Понятия старения и старости. Теории старения. Организация гериатрической службы в Российской Федерации
Понятия старения и старости. Теории старения. Организация гериатрической службы в Российской Федерации Биосфера. Царства живой природы
Биосфера. Царства живой природы Отряды насекомых с полным превращением. Отряд Жесткокрылые (Жуки)
Отряды насекомых с полным превращением. Отряд Жесткокрылые (Жуки) Як вчяться пташенята
Як вчяться пташенята Витамины и их роль в обмене веществ
Витамины и их роль в обмене веществ Стресс у животных
Стресс у животных Породы домашних животных
Породы домашних животных Наследственная изменчивость
Наследственная изменчивость Чарлз Дарвин об эволюции органического мира
Чарлз Дарвин об эволюции органического мира