Содержание
- 3. Определение. Вестерн-блоттинг (вестерн-блот, белковый иммуноблот, Western bloting) аналитический метод, используемый для определения специфичных белков в образце.
- 4. Определение. Вестерн-блоттинг (вестерн-блот, белковый иммуноблот, Western bloting) Вестерн-блоттинг был разработан в лаборатории Джорджа Старка (Стенфорд, Великобритания)
- 5. Вестерн-блоттинг был разработан в лаборатории Джорджа Старка (Стенфорд, Великобритания)
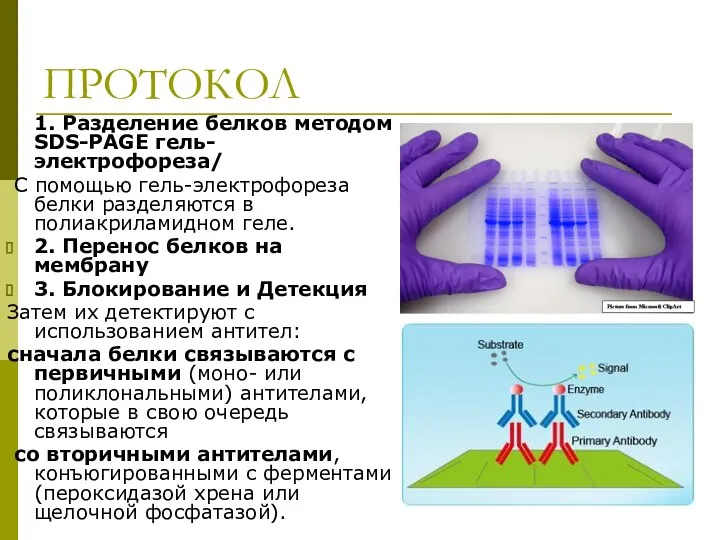
- 6. протокол. ПРОТОКОЛ 1. Разделение белков методом SDS-PAGE гель-электрофореза/ С помощью гель-электрофореза белки разделяются в полиакриламидном геле.
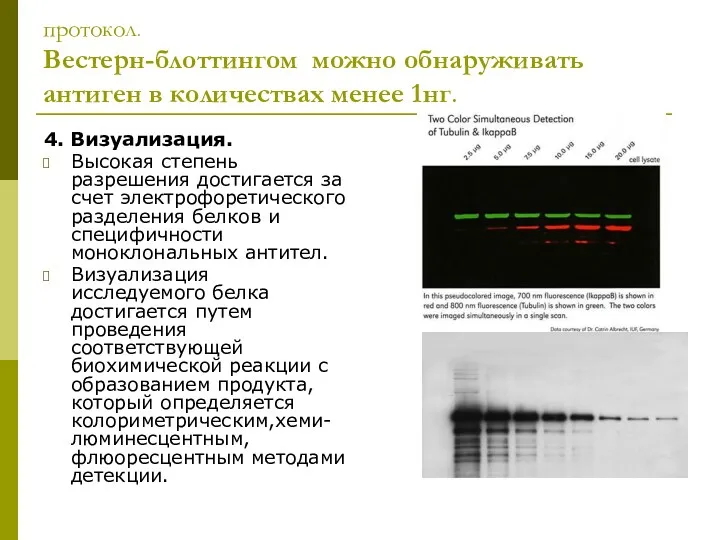
- 7. протокол. Вестерн-блоттингом можно обнаруживать антиген в количествах менее 1нг. 4. Визуализация. Высокая степень разрешения достигается за
- 8. 5. Анализ. Количество белка оценивается с помощью денситометрии.
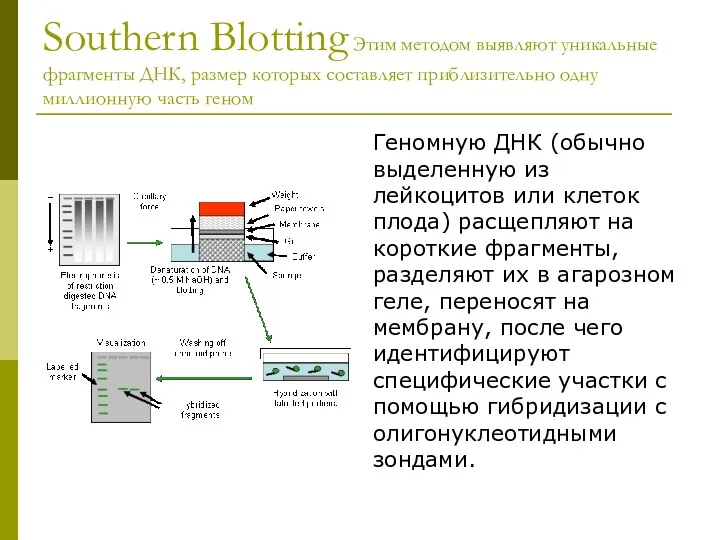
- 9. Southern Blotting Этим методом выявляют уникальные фрагменты ДНК, размер которых составляет приблизительно одну миллионную часть геном
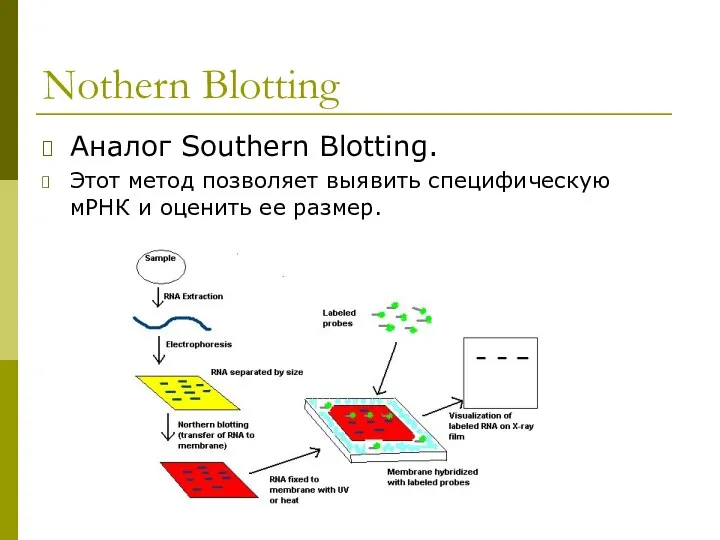
- 10. Nothern Blotting Аналог Southern Blotting. Этот метод позволяет выявить специфическую мРНК и оценить ее размер.
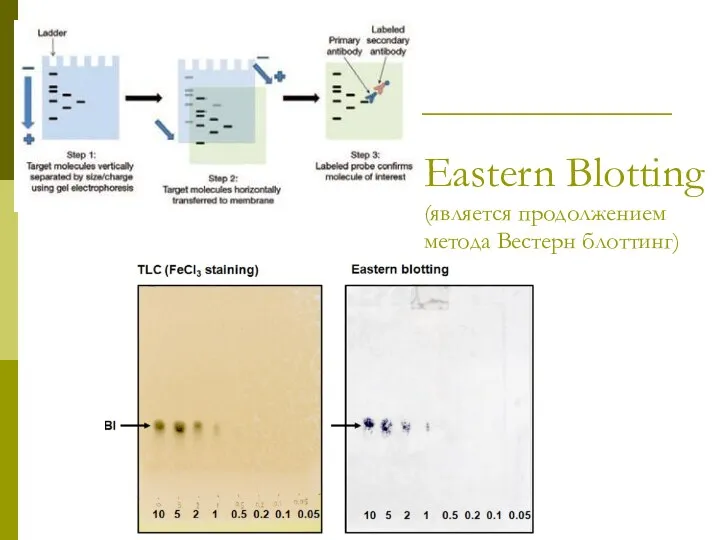
- 11. Eastern Blotting (является продолжением метода Вестерн блоттинг)
- 12. Определение метода Вестерн Блоттинг Метод основан на комбинации гель-электрофореза и иммунохимической реакции «антиген-антитело».
- 13. «Твердая фаза» для иммуноблота пористые материалы типа нитроцеллюлозы (PVDF) в виде наполнителей в объеме или в
- 14. Типы твердой фазы для Вестерн блоттинга
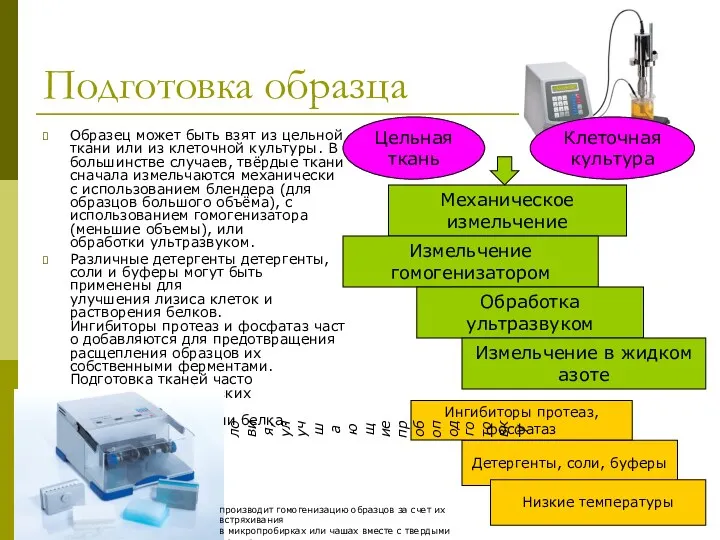
- 15. Подготовка образца Образец может быть взят из цельной ткани или из клеточной культуры. В большинстве случаев,
- 16. Гель-электрофорез. Наиболее распространенный способ разделения белков — электрофорез в полиакриламидном геле в присутствии SDS по Лэмми
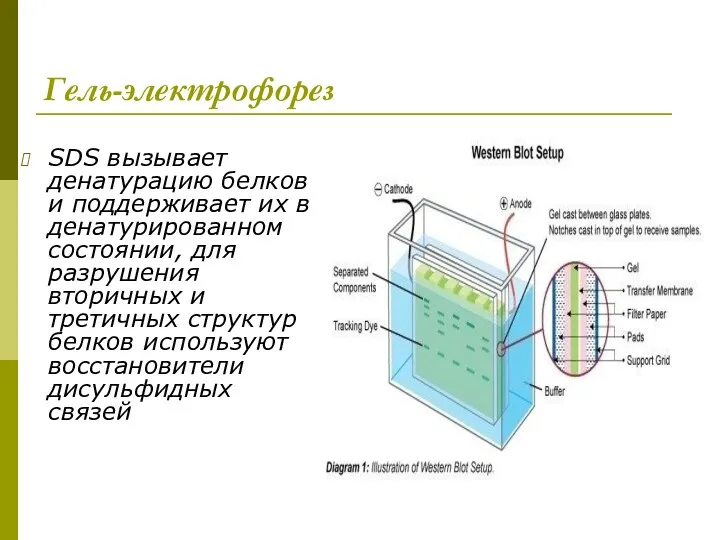
- 17. Гель-электрофорез SDS вызывает денатурацию белков и поддерживает их в денатурированном состоянии, для разрушения вторичных и третичных
- 18. Гель -электрофорез Подлежащие анализу белки в присутствии додецилсульфата натрия приобретают одинаковый отрицательный заряд, что делает возможным
- 19. Принцип электрофореза Предварительно денатурированные белки вносят в карманы «треков» (дорожек) акриламидного геля с низкой концентрацией (концентрирующий
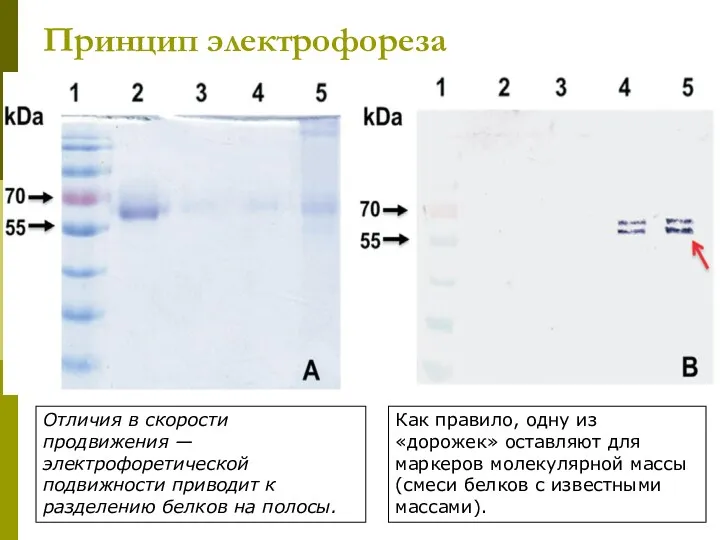
- 20. Принцип электрофореза Отличия в скорости продвижения — электрофоретической подвижности приводит к разделению белков на полосы. Как
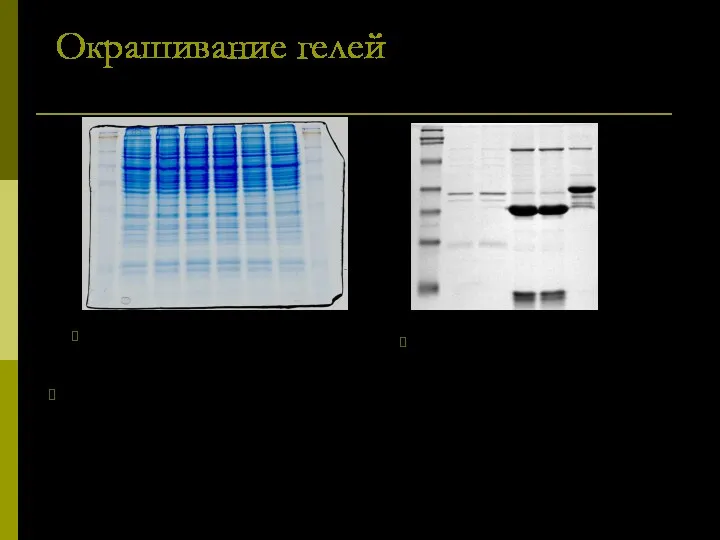
- 21. Окрашивание гелей Для визуализации результатов электрофореза чаще всего используют окрашивание белков в гелях красителем Кумасси или
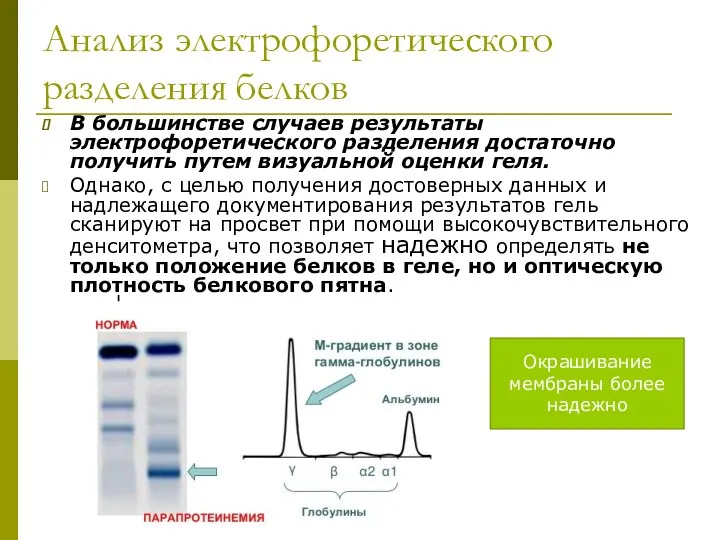
- 22. Анализ электрофоретического разделения белков В большинстве случаев результаты электрофоретического разделения достаточно получить путем визуальной оценки геля.
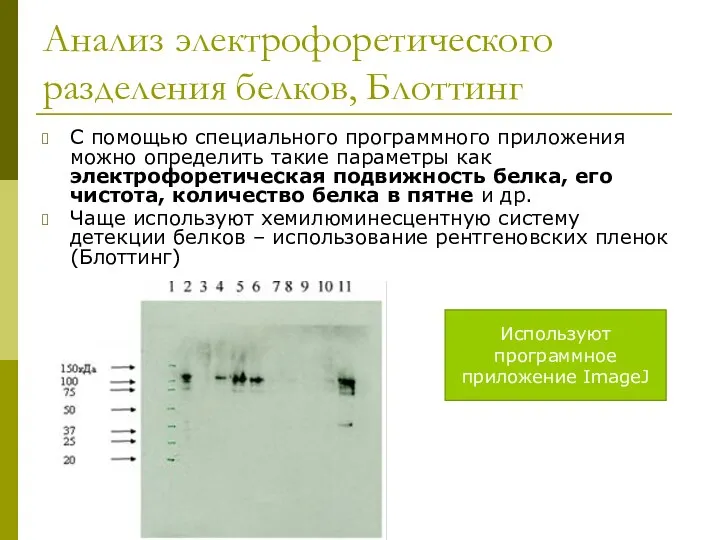
- 23. Анализ электрофоретического разделения белков, Блоттинг С помощью специального программного приложения можно определить такие параметры как электрофоретическая
- 24. Применение системы визуализации для WB (см. ниже)
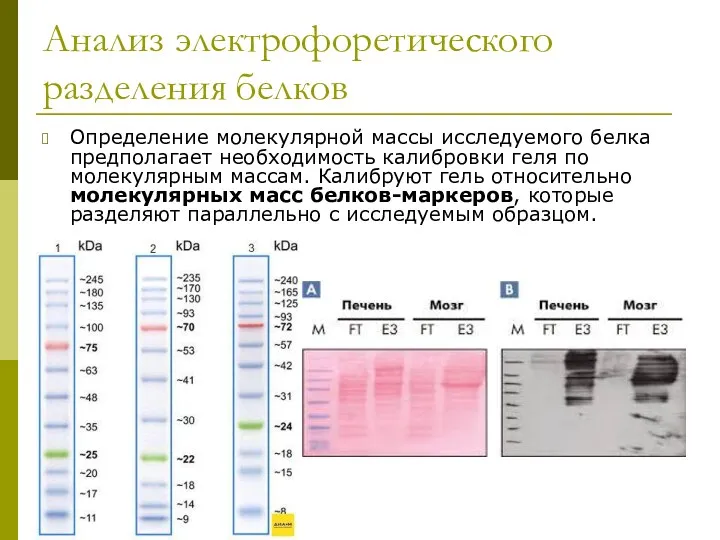
- 25. Анализ электрофоретического разделения белков Определение молекулярной массы исследуемого белка предполагает необходимость калибровки геля по молекулярным массам.
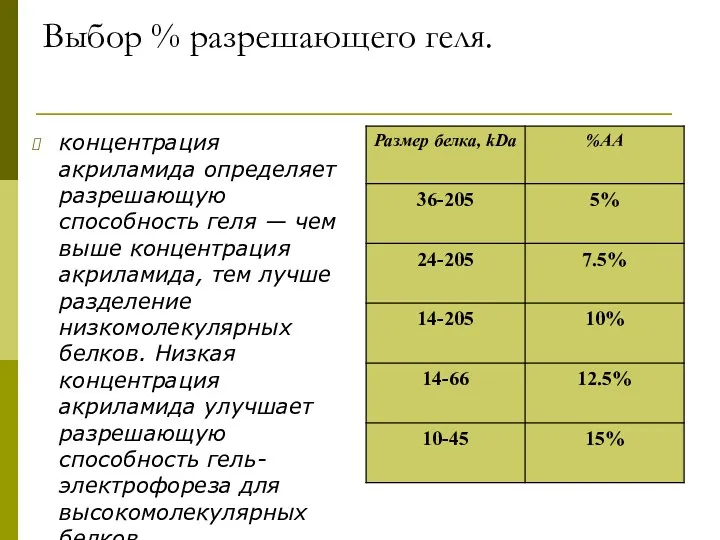
- 26. Выбор % разрешающего геля. концентрация акриламида определяет разрешающую способность геля — чем выше концентрация акриламида, тем
- 27. Перенос на мембрану Чтобы сделать белки доступными для антител и дальнейшей детекции, их вместе с полоской
- 28. Виды электроблоттинга Сухой Влажный Полусухой (semidry)
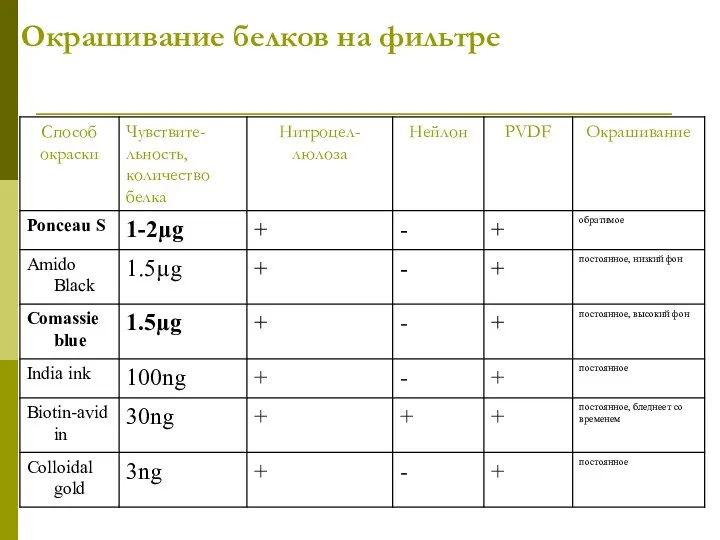
- 29. Окрашивание белков на фильтре
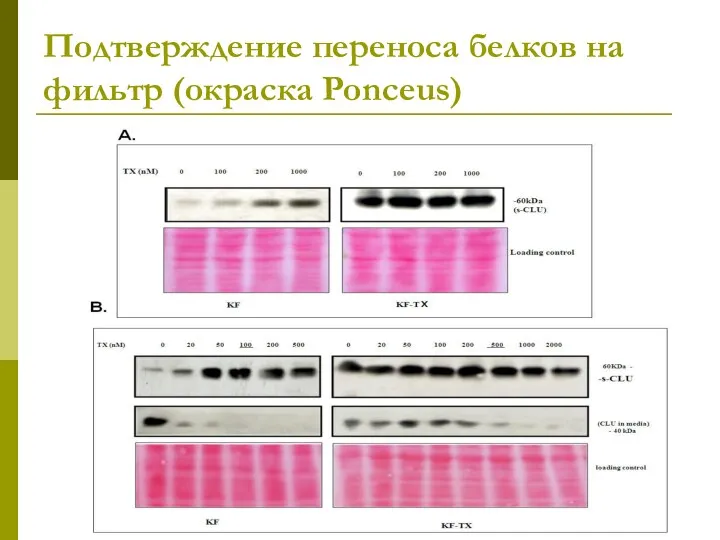
- 30. Подтверждение переноса белков на фильтр (окраска Ponceus)
- 31. Блокирование Как только выбрана мембрана, выбраны антитела и целевой белок, должны быть приняты меры по исключению
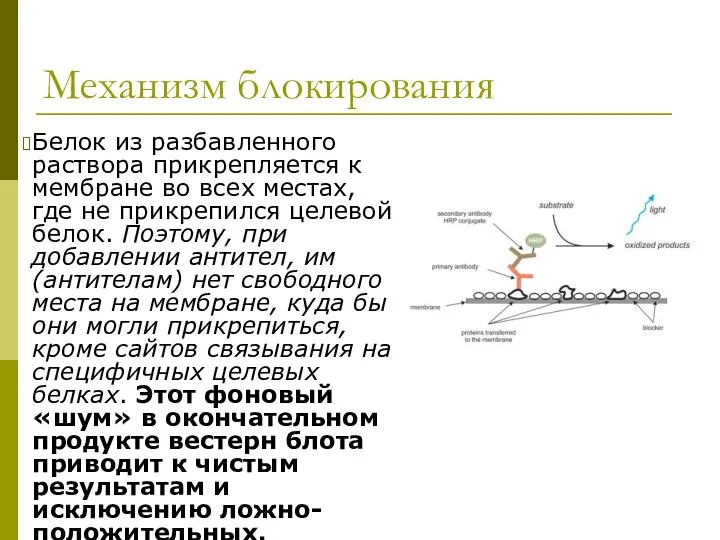
- 32. Механизм блокирования Белок из разбавленного раствора прикрепляется к мембране во всех местах, где не прикрепился целевой
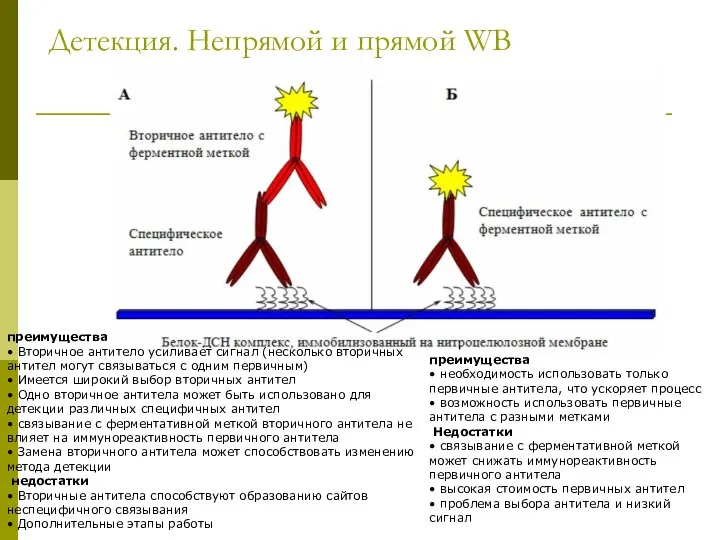
- 33. Детекция. Непрямой и прямой WB преимущества • необходимость использовать только первичные антитела, что ускоряет процесс •
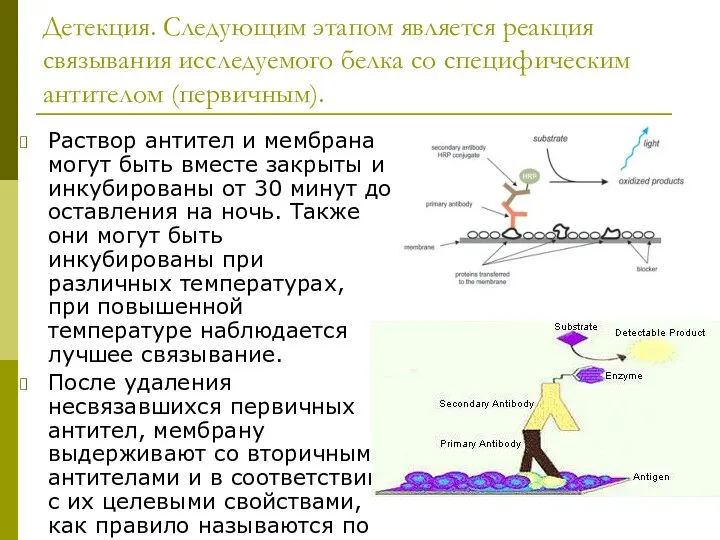
- 34. Детекция. Следующим этапом является реакция связывания исследуемого белка со специфическим антителом (первичным). Раствор антител и мембрана
- 35. Антитела для вестерн блоттинга. Механизм детекции. Антитела получают из животного источника и связываются с большинством первичных
- 36. Детекция. Другие методы детекции. Другой метод детекции вторичными антителами использует антитела со связанным флюорофором, который излучает
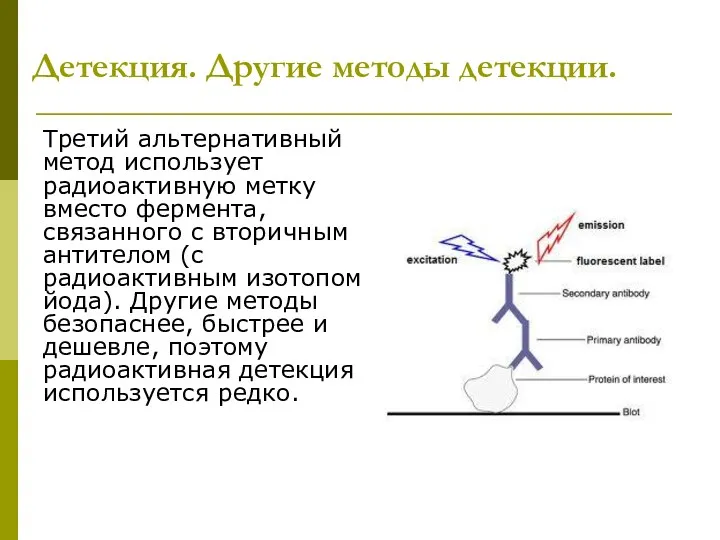
- 37. Детекция. Другие методы детекции. Третий альтернативный метод использует радиоактивную метку вместо фермента, связанного с вторичным антителом
- 38. Визуализация. Визуализация осуществляется с помощью гель-документирующих систем или цифровой камерой.
- 40. Представление фильма Stain free technology
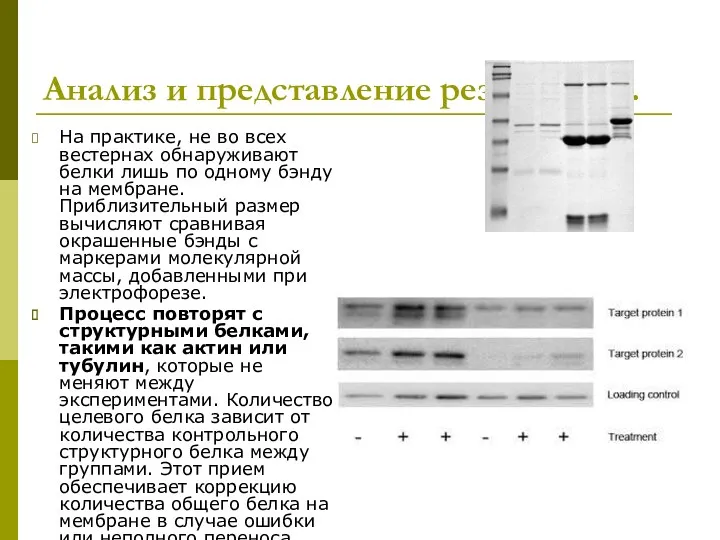
- 41. Анализ и представление результатов. На практике, не во всех вестернах обнаруживают белки лишь по одному бэнду
- 42. Анализ и представление результатов. Использование программного приложения Image J. Программного приложение Bio-Rad
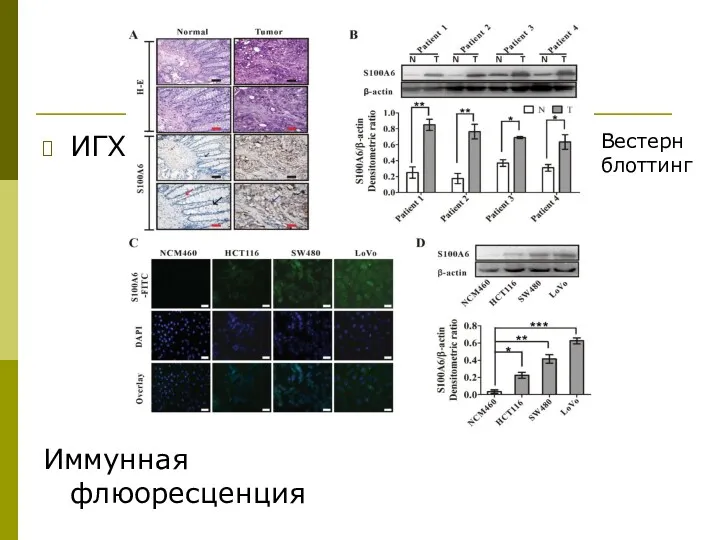
- 43. ИГХ Иммунная флюоресценция Вестерн блоттинг
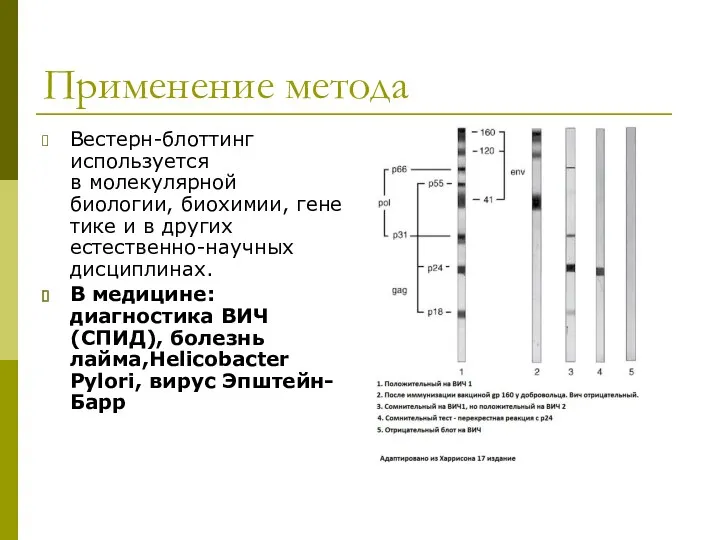
- 44. Применение метода Вестерн-блоттинг используется в молекулярной биологии, биохимии, генетике и в других естественно-научных дисциплинах. В медицине:
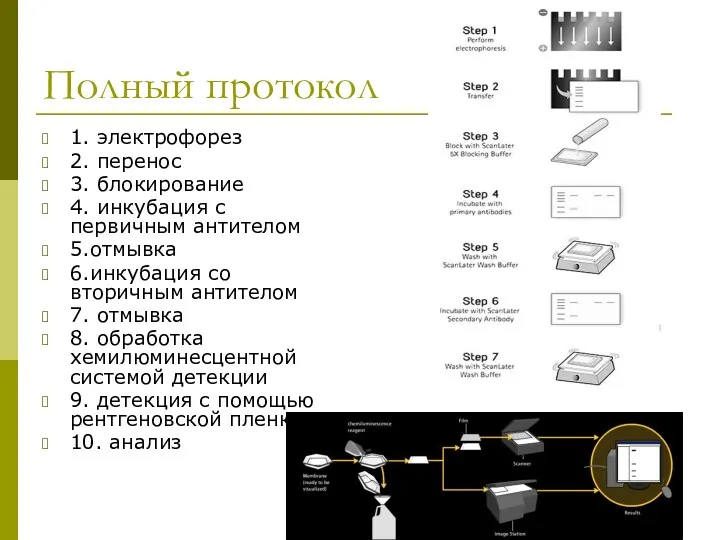
- 45. Полный протокол 1. электрофорез 2. перенос 3. блокирование 4. инкубация с первичным антителом 5.отмывка 6.инкубация со
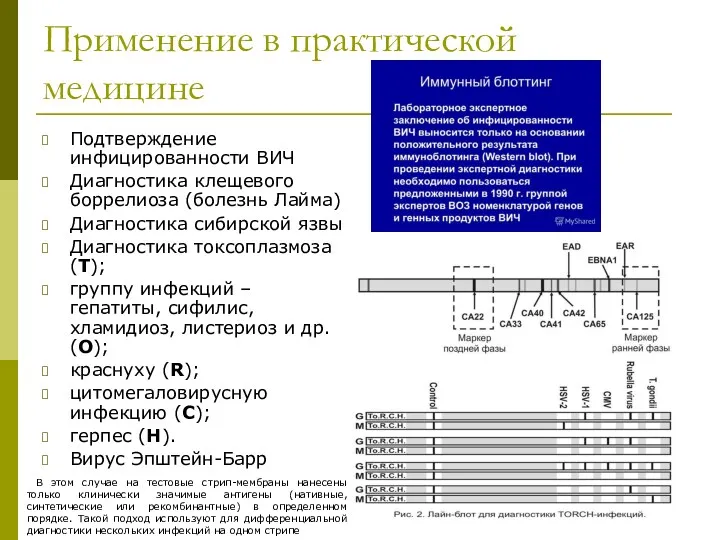
- 46. Применение в практической медицине Подтверждение инфицированности ВИЧ Диагностика клещевого боррелиоза (болезнь Лайма) Диагностика сибирской язвы Диагностика
- 52. Скачать презентацию























 Dinoflagellates
Dinoflagellates Центральная догма молекулярной биологии. Синтез РНК по матрице ДНК
Центральная догма молекулярной биологии. Синтез РНК по матрице ДНК Берегите птиц
Берегите птиц Клетка ең ұсақ тірі организм
Клетка ең ұсақ тірі организм Красная книга Челябинской области
Красная книга Челябинской области Важнейшие методы молекулярной биологии и генной инженерии
Важнейшие методы молекулярной биологии и генной инженерии Деление клетки – митоз, мейоз
Деление клетки – митоз, мейоз Север - богатый край.
Север - богатый край. Китообразные (лат. Cetacea)
Китообразные (лат. Cetacea) Селекционные линии и перспективные гибриды картофеля
Селекционные линии и перспективные гибриды картофеля Презентация по теме Анализаторы
Презентация по теме Анализаторы Патогенность микроорганизмов. Вирулентность. Факторы адгезии, мимикрия, ферменты, токсины
Патогенность микроорганизмов. Вирулентность. Факторы адгезии, мимикрия, ферменты, токсины Оценка иммунного статуса человека
Оценка иммунного статуса человека Хищные птицы национального парка Водлозерский, занесенные в Красную книгу Архангельской области
Хищные птицы национального парка Водлозерский, занесенные в Красную книгу Архангельской области Гепард
Гепард Экология человека
Экология человека Різноманітність рослин
Різноманітність рослин Механорецепторы кожи
Механорецепторы кожи Презентация Двоякодышащие рыбы
Презентация Двоякодышащие рыбы Органи розмноження
Органи розмноження Лимбическая система
Лимбическая система Витамины. Авитаминоз и гипервитаминоз
Витамины. Авитаминоз и гипервитаминоз Эволюция жизни на Земле
Эволюция жизни на Земле Зимующие птицы. Воробей
Зимующие птицы. Воробей Генетическая инженерия. Тема №1
Генетическая инженерия. Тема №1 Осеменение животных
Осеменение животных Безопасность генетически модифицированных пищевых продуктов
Безопасность генетически модифицированных пищевых продуктов Комнатные растения в интерьере школы
Комнатные растения в интерьере школы