Содержание
- 2. Возникновение биомолекул в пребиотическом бульоне Опыт Stenley Miller–Urey (Science,1953, V. 117. P. 528) Идентификация продуктов проводилась
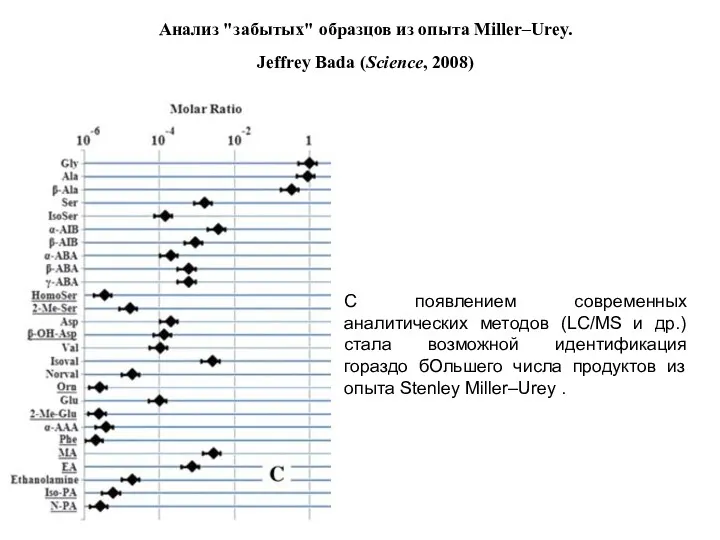
- 3. 9/15/2019 Анализ "забытых" образцов из опыта Miller–Urey. Jeffrey Bada (Science, 2008) С появлением современных аналитических методов
- 4. 9/15/2019 Биохимик Роберт Шапиро: Аминокислоты, синтезированные Миллером и Юри, значительно менее сложные молекулы, чем нуклеозиды и
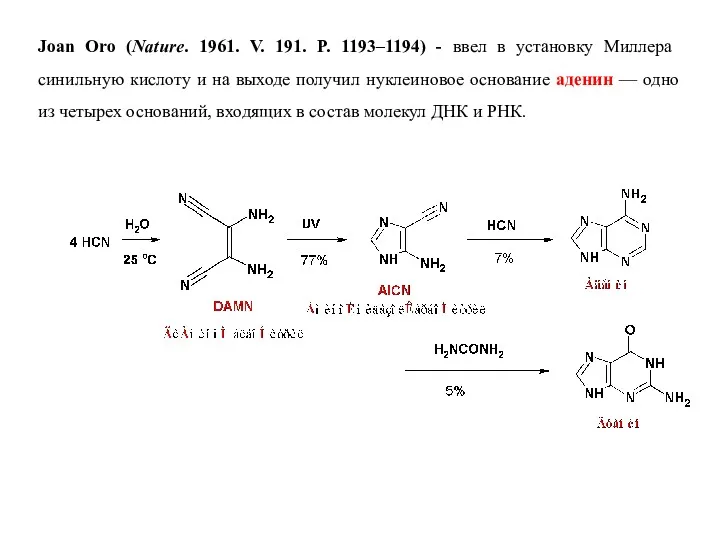
- 5. Joan Oro (Nature. 1961. V. 191. P. 1193–1194) - ввел в установку Миллера синильную кислоту и
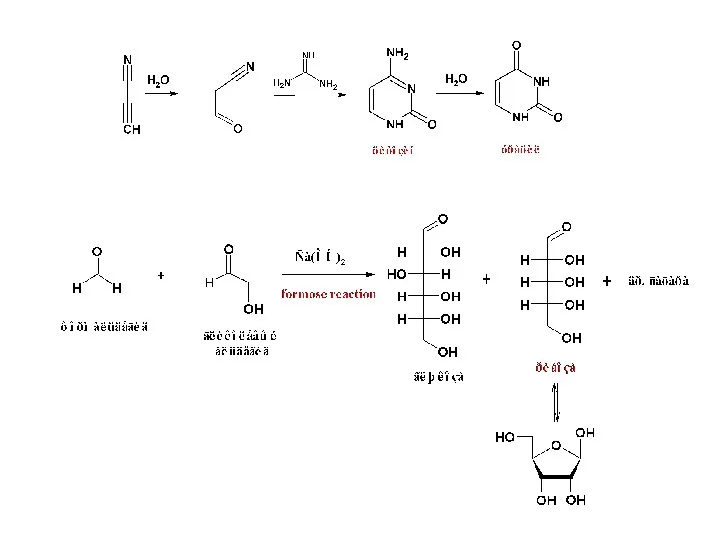
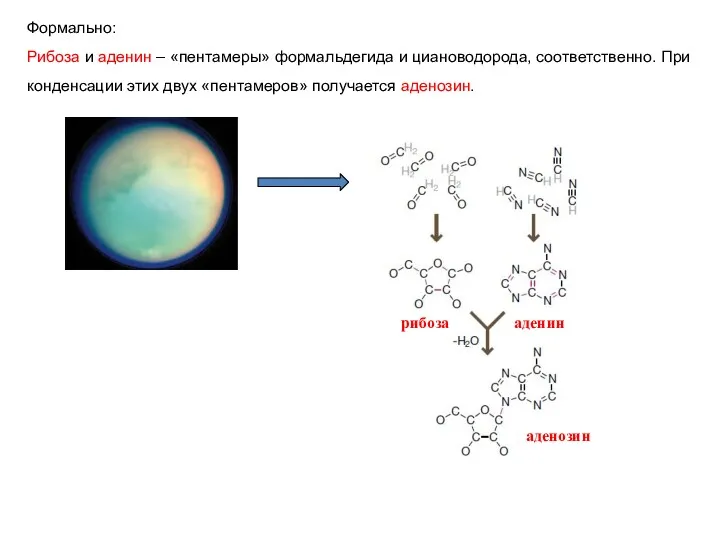
- 7. Формально: Рибоза и аденин – «пентамеры» формальдегида и циановодорода, соответственно. При конденсации этих двух «пентамеров» получается
- 8. Одним из основных аргументов критиков является отсутствие единой хиральности у синтезированных аминокислот. Действительно, полученные аминокислоты представляли
- 9. Начало гликобиологии и хиральность.
- 10. Углеводы Источник углеводов – процесс фотосинтеза. Первые из известных науке углеводов описывались брутто-формулой Cx(H2O)y – вещества,
- 11. конец 17 века (Кристиан Хьюгенс) – плоскополяризованный свет 1815 г. (Жан Батист Биот) – обнаружение природных
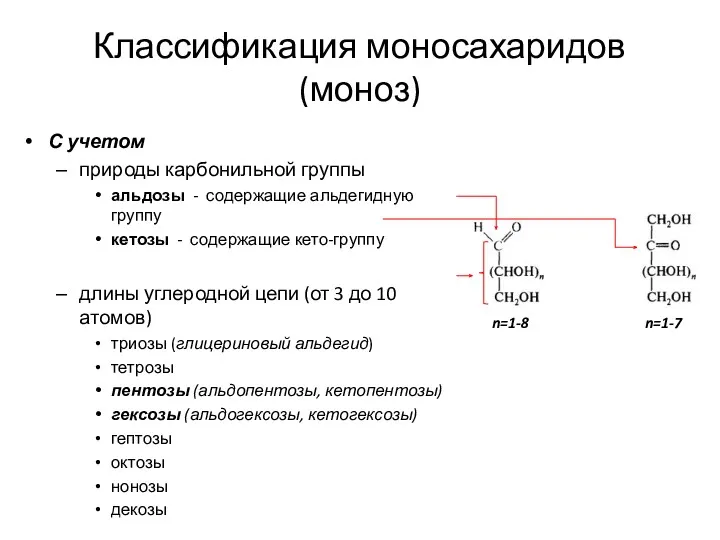
- 12. Классификация моносахаридов (моноз) С учетом природы карбонильной группы альдозы - содержащие альдегидную группу кетозы - содержащие
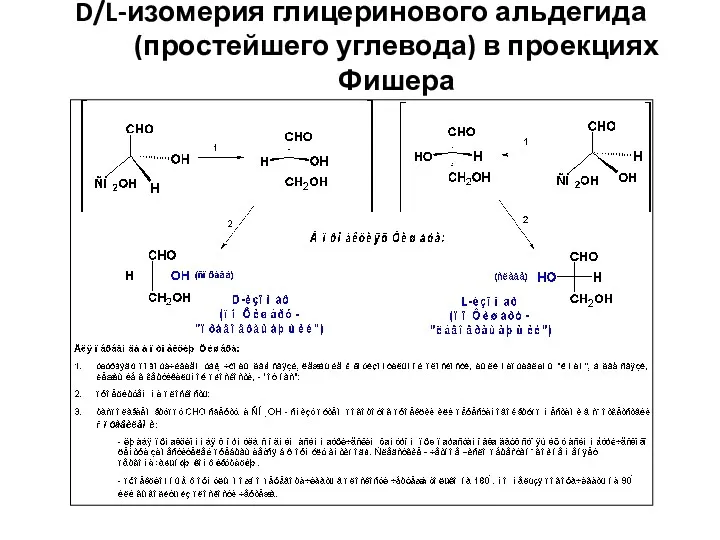
- 13. D/L-изомерия глицеринового альдегида (простейшего углевода) в проекциях Фишера
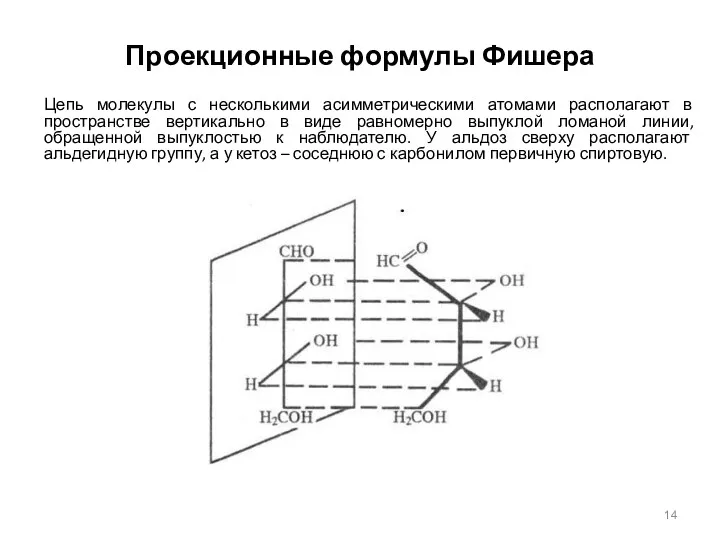
- 14. Проекционные формулы Фишера Цепь молекулы с несколькими асимметрическими атомами располагают в пространстве вертикально в виде равномерно
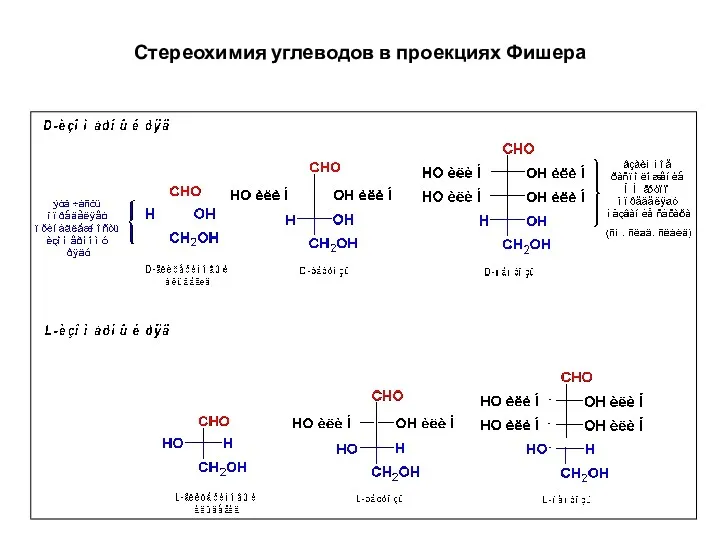
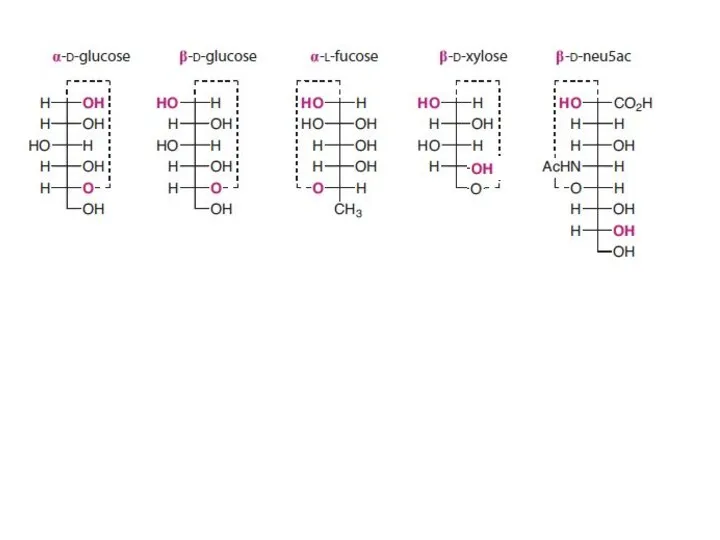
- 15. Стереохимия углеводов в проекциях Фишера
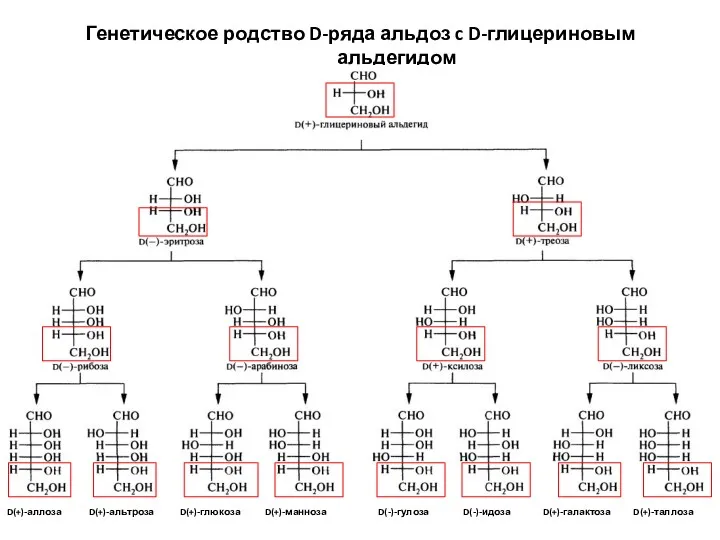
- 16. Генетическое родство D-ряда альдоз c D-глицериновым альдегидом D(+)-альтроза D(+)-аллоза D(+)-глюкоза D(+)-манноза D(-)-гулоза D(-)-идоза D(+)-галактоза D(+)-таллоза
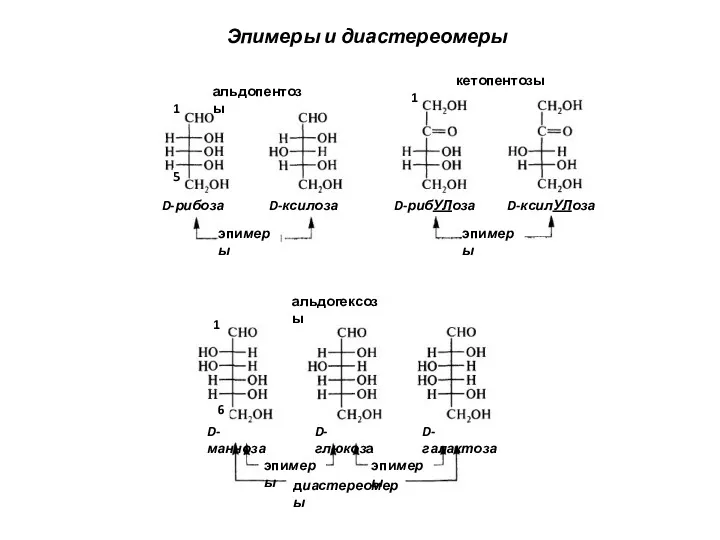
- 17. D-глюкоза D-галактоза D-манноза диастереомеры эпимеры эпимеры эпимеры эпимеры альдогексозы альдопентозы кетопентозы D-рибоза D-ксилоза D-рибУЛоза D-ксилУЛоза Эпимеры
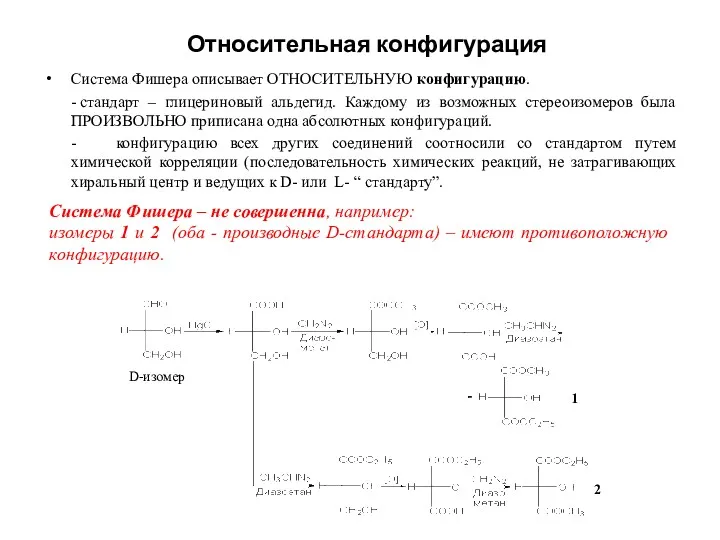
- 18. Система Фишера описывает ОТНОСИТЕЛЬНУЮ конфигурацию. - стандарт – глицериновый альдегид. Каждому из возможных стереоизомеров была ПРОИЗВОЛЬНО
- 19. Относительная конфигурация определяется химическими методами Абсолютная конфигурация определяется РСА (или теоретическим расчетом величины оптического вращения) и
- 20. http://www.chem.msu.su/rus/teaching/butin/p4.html Стереохимия (R/S и D/L-изомерия). Правила Кана-Ингольда-Прелога. Cahn–Ingold–Prelog priority rules, CIP system or CIP conventions. Полезная
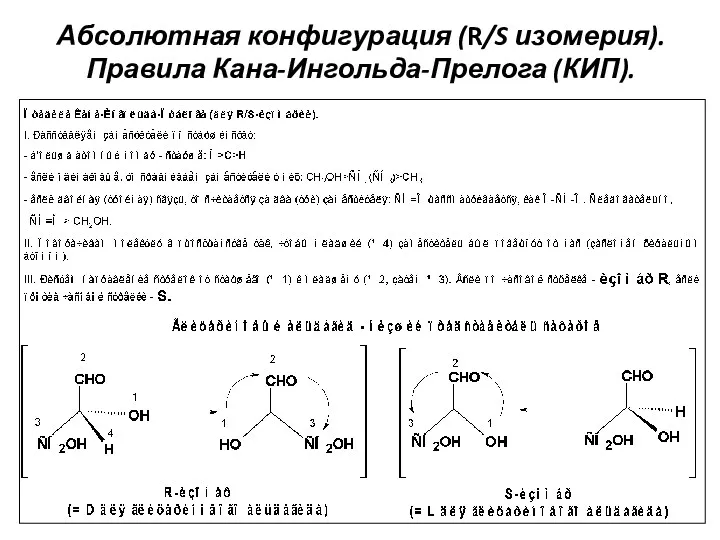
- 21. Абсолютная конфигурация (R/S изомерия). Правила Кана-Ингольда-Прелога (КИП).
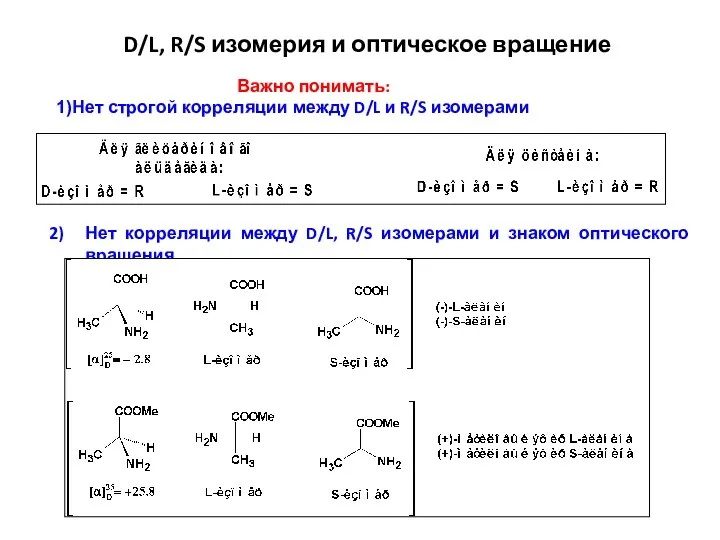
- 22. Важно понимать: Нет строгой корреляции между D/L и R/S изомерами D/L, R/S изомерия и оптическое вращение
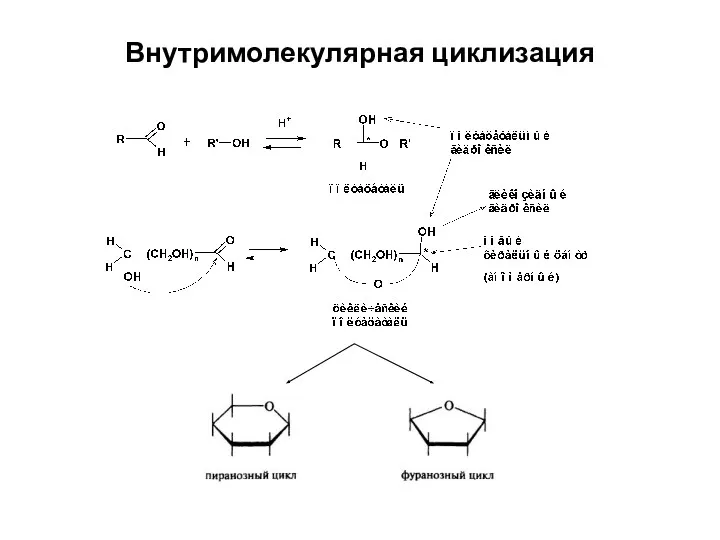
- 23. Внутримолекулярная циклизация
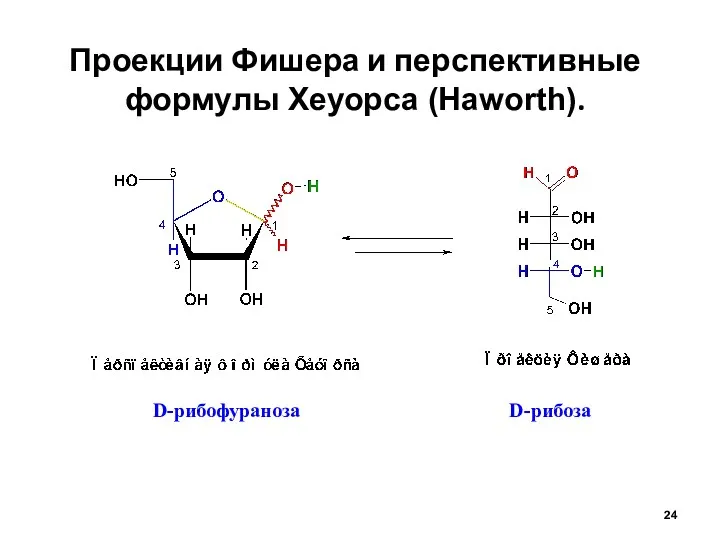
- 24. Проекции Фишера и перспективные формулы Хеуорса (Haworth). D-рибоза D-рибофураноза
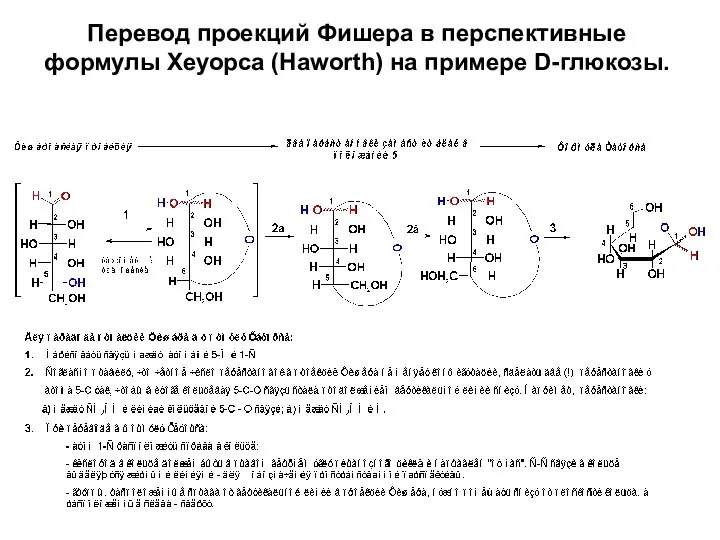
- 25. Перевод проекций Фишера в перспективные формулы Хеуорса (Haworth) на примере D-глюкозы.
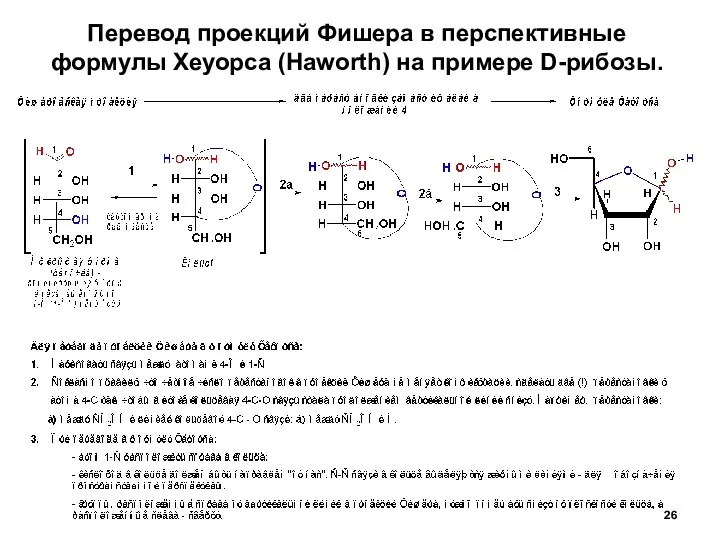
- 26. Перевод проекций Фишера в перспективные формулы Хеуорса (Haworth) на примере D-рибозы.
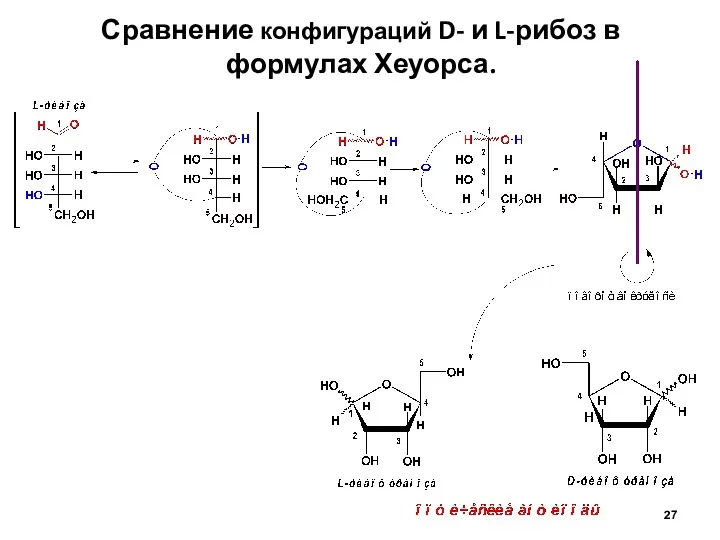
- 27. Сравнение конфигураций D- и L-рибоз в формулах Хеуорса.
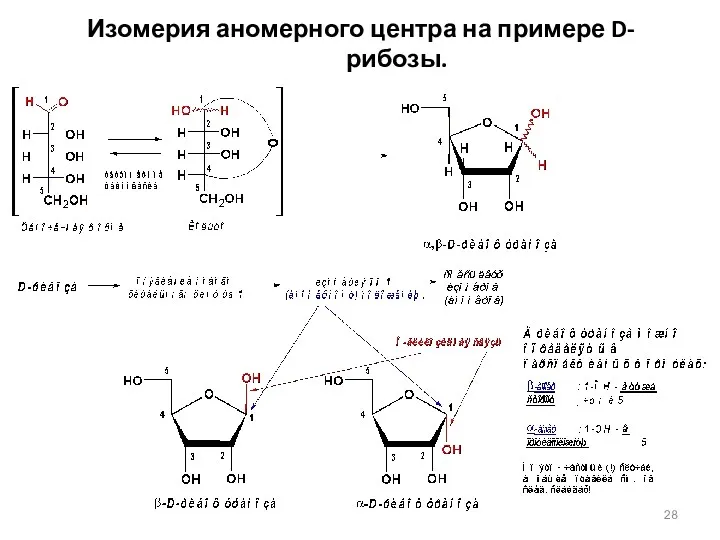
- 28. Изомерия аномерного центра на примере D-рибозы.
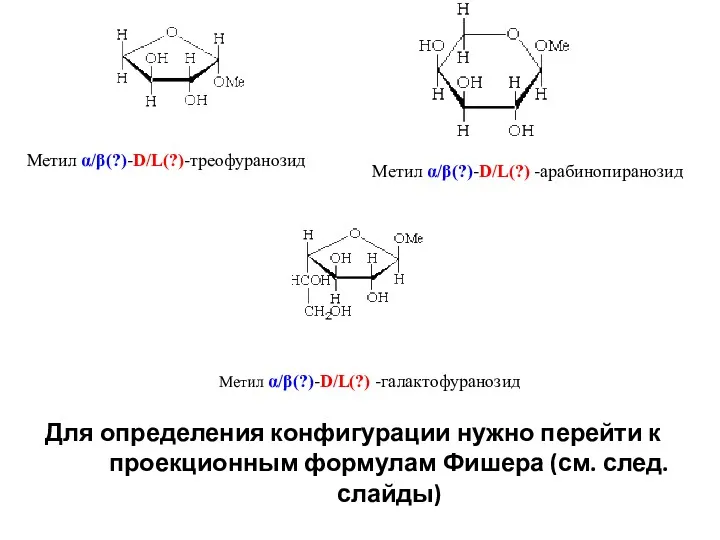
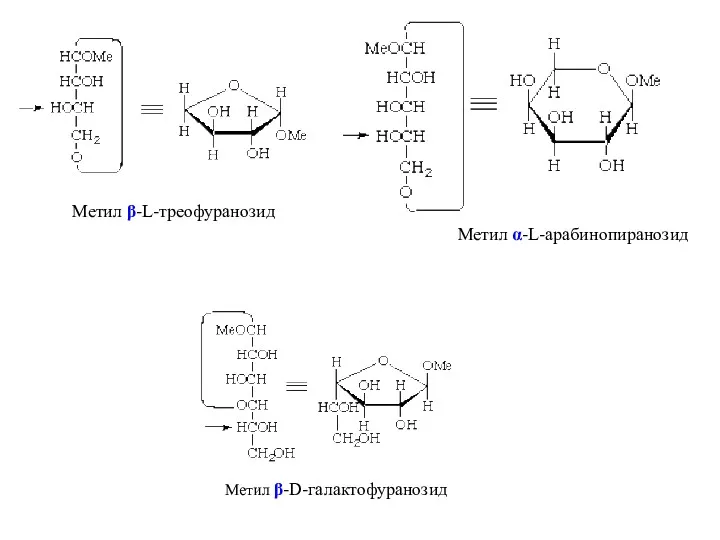
- 29. Метил α/β(?)-D/L(?) -арабинопиранозид Метил α/β(?)-D/L(?) -галактофуранозид Метил α/β(?)-D/L(?)-треофуранозид Для определения конфигурации нужно перейти к проекционным формулам
- 30. Номенклатура IUPAC The anomeric centre The new centre of chirality generated by hemiacetal ring closure is
- 31. Метил α-L-арабинопиранозид Метил β-L-треофуранозид Метил β-D-галактофуранозид
- 33. The anomeric reference atom and the anomeric configurational symbol (α or β) The anomeric reference atom
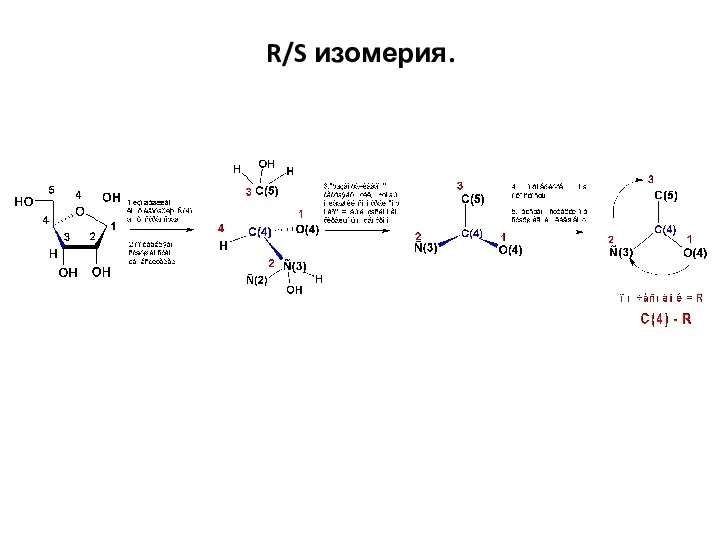
- 34. R/S изомерия. Правила Кана-Ингольда-Прелога. Еще раз… Рассматриваем молекулу (часть молекулы с хиральным центром и его заместителями)
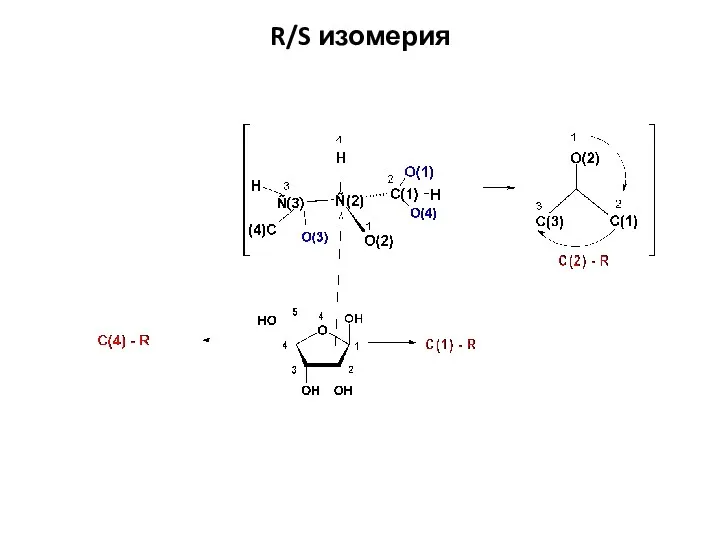
- 35. R/S изомерия.
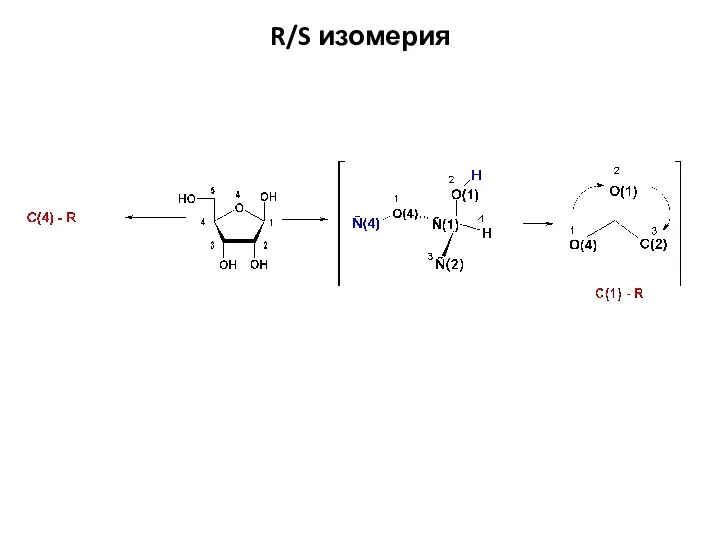
- 36. R/S изомерия
- 37. R/S изомерия
- 39. Скачать презентацию











 Класс земноводные или амфибии
Класс земноводные или амфибии Методы биологических исследований
Методы биологических исследований Происхождение и начальные этапы развития жизни на Земле
Происхождение и начальные этапы развития жизни на Земле Сечоутворення і сечовиведення
Сечоутворення і сечовиведення КЛЕТКА
КЛЕТКА Гены и хромосомы
Гены и хромосомы Parts of human body
Parts of human body Кишечнополостные
Кишечнополостные Развитие ребёнка 7-9 месяцев
Развитие ребёнка 7-9 месяцев Систематика
Систематика Эволюциялық ұғымдардың қалыптасуы және дамуы. Ч. Дарвиннің эволюциялық ілімінің негізгі қағидалары
Эволюциялық ұғымдардың қалыптасуы және дамуы. Ч. Дарвиннің эволюциялық ілімінің негізгі қағидалары Урок-практикум по решению задач по генетике
Урок-практикум по решению задач по генетике Классификация возрастных периодов
Классификация возрастных периодов Первичноназемные позвоночные амниоты. Класс рептилии
Первичноназемные позвоночные амниоты. Класс рептилии Многообразие водных биогеоценозов
Многообразие водных биогеоценозов Екосистема- сад
Екосистема- сад Консультация по разделу Насекомые Крыма
Консультация по разделу Насекомые Крыма Паразитические нематоды как средство биоконтроля численности вредителей
Паразитические нематоды как средство биоконтроля численности вредителей Ошущение. Возникновение ощущений
Ошущение. Возникновение ощущений презентация к уроку Многообразие покрытосеменных
презентация к уроку Многообразие покрытосеменных Тип Моллюски или Мягкотелые
Тип Моллюски или Мягкотелые Одомашнивание животных
Одомашнивание животных Класс Двудольные
Класс Двудольные Мать-и-мачеха. Рисуем по шагам
Мать-и-мачеха. Рисуем по шагам Проблема безпритульних тварин
Проблема безпритульних тварин Развитие представлений о возникновении жизни
Развитие представлений о возникновении жизни Развитие костей туловища и конечностей в онтогенезе: влияние факторов внешней и внутренней среды на их развитие
Развитие костей туловища и конечностей в онтогенезе: влияние факторов внешней и внутренней среды на их развитие Виды изменчивости. Модификационная изменчивость
Виды изменчивости. Модификационная изменчивость