Содержание
- 2. Секвенирование ДНК: методы определения последовательности фрагментов нуклеиновых кислот Общий принцип: проводят сравнение длин всех возможных концевых
- 3. Секвенирование ДНК по Сэнгеру (метод полимеразного копирования) I. Прежде всего фрагмент ДНК клонируют в фаге М13,
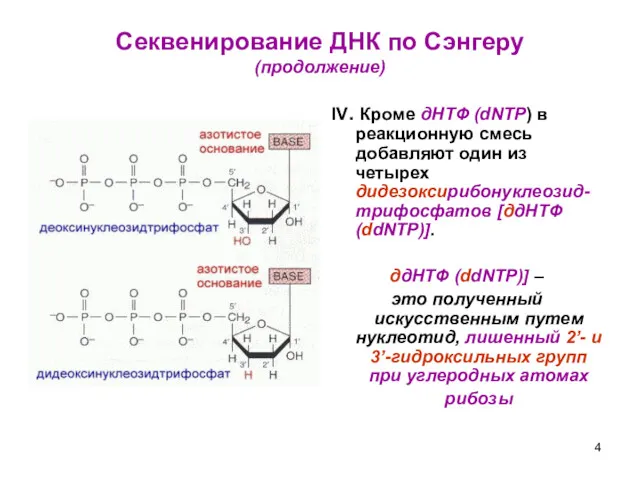
- 4. Секвенирование ДНК по Сэнгеру (продолжение) IV. Кроме дНТФ (dNTP) в реакционную смесь добавляют один из четырех
- 5. Секвенирование ДНК по Сэнгеру (продолжение) V. Затем с помощью ДНК-полимеразы ведут синтез второй (комплементарной) цепи ДНК.
- 6. Секвенирование ДНК по Сэнгеру (продолжение) VII. Затем четыре пробы вносят в соседние лунки пластины геля и
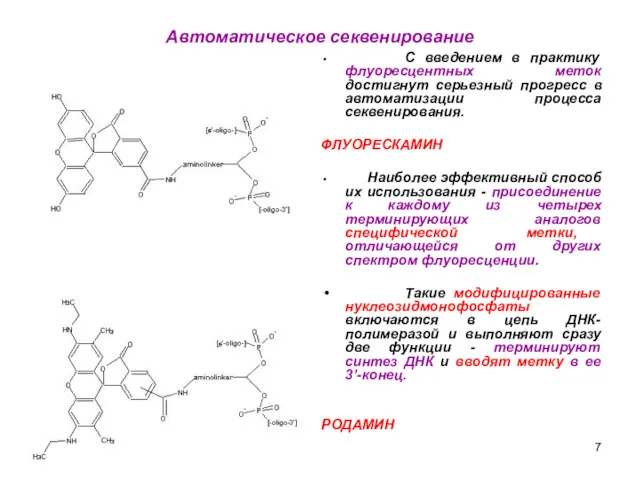
- 7. Автоматическое секвенирование С введением в практику флуоресцентных меток достигнут серьезный прогресс в автоматизации процесса секвенирования. ФЛУОРЕСКАМИН
- 8. Автоматическое секвенирование Все это значительно упростило процедуру секвенирования: ферментативную реакцию проводят в одной пробирке и, соответственно,
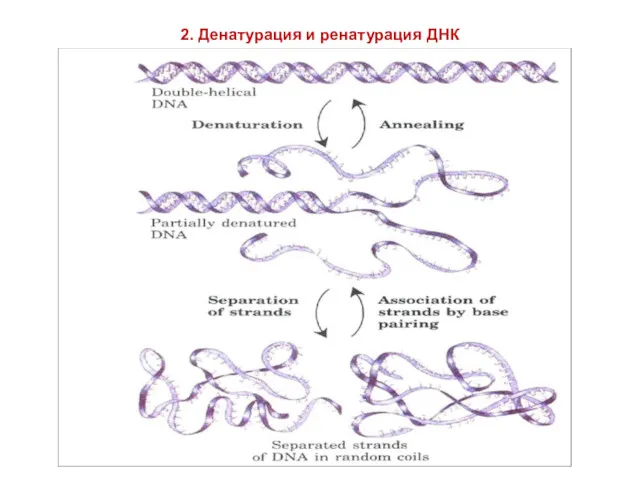
- 9. 2. Денатурация и ренатурация ДНК
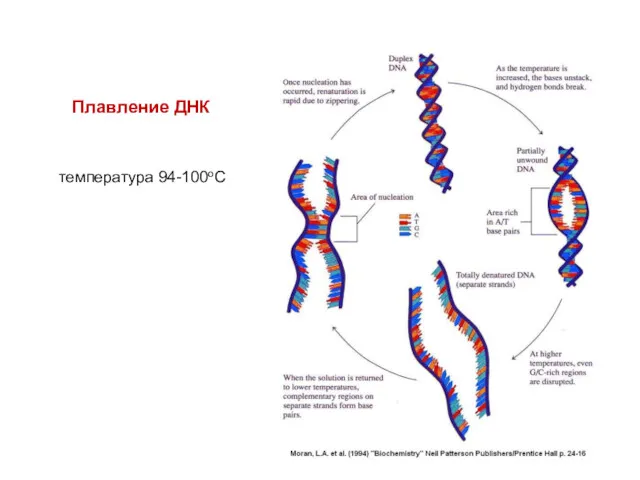
- 10. Плавление ДНК температура 94-100оС
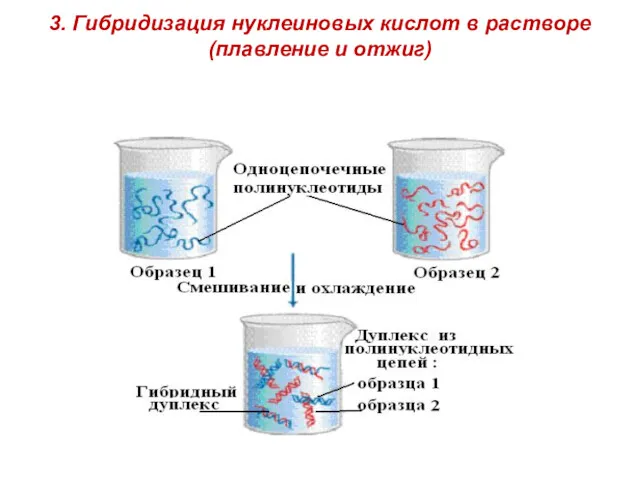
- 11. 3. Гибридизация нуклеиновых кислот в растворе (плавление и отжиг)
- 12. 4. Гибридизация нуклеиновых кислот на твердых подложках (блот-анализ) Термин блот-анализ (блотинг) применяют к процедуре иммобилизации нуклеиновых
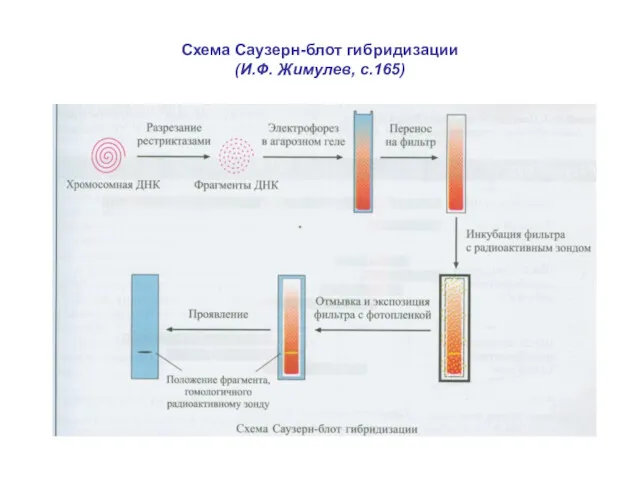
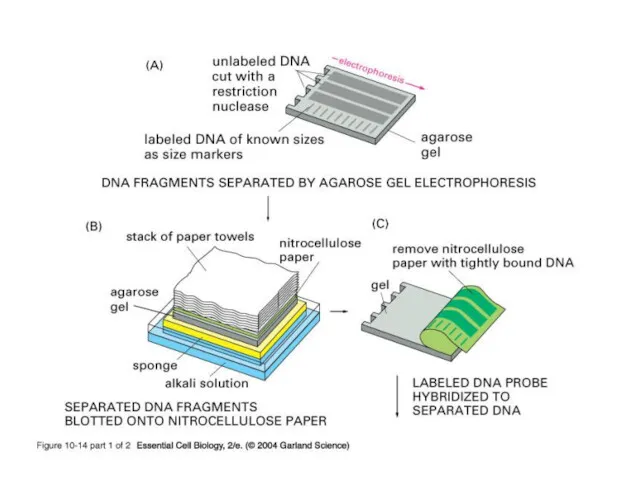
- 13. Схема Саузерн-блот гибридизации (И.Ф. Жимулев, с.165)
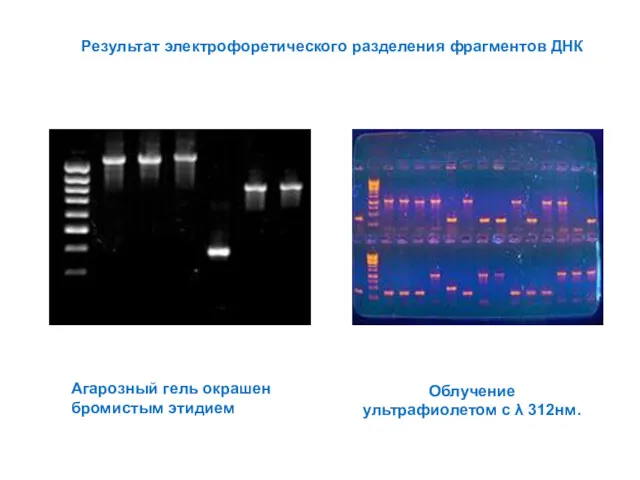
- 14. Результат электрофоретического разделения фрагментов ДНК Агарозный гель окрашен бромистым этидием Облучение ультрафиолетом с λ 312нм.
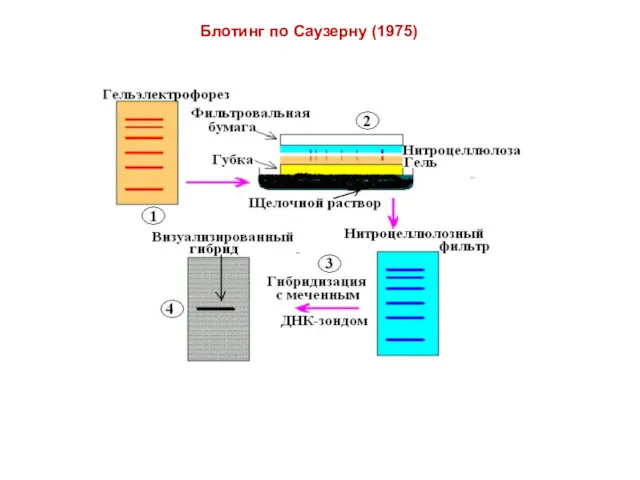
- 15. Блотинг по Саузерну (1975)
- 16. Блотинг по Саузерну (1975) . Гель помешают на фильтровальную бумагу, находящуюся в контакте с буфером. Мембрану
- 19. Виды блотинга Метод переноса ДНК из агарозного геля на нитроцеллюлозные или нейлоновые мембраны был назван по
- 20. 5. Гибридизация нуклеиновых кислот на чипах ЧИПЫ — пластинки с иммобилизованными мечеными ДНК-зондами. ДНК-зонд — фрагмент
- 23. Скачать презентацию











 Химические средства для борьбы с вредителями сельскохозяйственных культур
Химические средства для борьбы с вредителями сельскохозяйственных культур Презентация Голосеменные
Презентация Голосеменные презентация Пушистый доктор
презентация Пушистый доктор Происхождение человека
Происхождение человека Многообразие природы родного края. Краснодарский край
Многообразие природы родного края. Краснодарский край Биологическая опасность (угроза)
Биологическая опасность (угроза) Животные Красной Книги России
Животные Красной Книги России Пищеварительная система
Пищеварительная система Покормите птиц зимой
Покормите птиц зимой Электрофорез в полиакриламидном геле
Электрофорез в полиакриламидном геле Жизнедеятельность клетки
Жизнедеятельность клетки Головний мозок людини
Головний мозок людини Аэротенки и их классификация. (Лекция 5.4)
Аэротенки и их классификация. (Лекция 5.4) Духовно-нравственное воспитание на уроках биологии.
Духовно-нравственное воспитание на уроках биологии. Кость как орган. Часть ii
Кость как орган. Часть ii Процесс репродукции. Мужские и женские половые органы
Процесс репродукции. Мужские и женские половые органы Генетика человека
Генетика человека Тип Плоские черви. Класс Ленточные черви. Филогения животных организмов с элементами медицинской гельминтологии
Тип Плоские черви. Класс Ленточные черви. Филогения животных организмов с элементами медицинской гельминтологии Сцепленное наследование. Закон Моргана
Сцепленное наследование. Закон Моргана Урок биологии в 5 классе Наука о живой природе
Урок биологии в 5 классе Наука о живой природе Плод. Разнообразие и значение плодов. Строение цветка
Плод. Разнообразие и значение плодов. Строение цветка Покормите птиц зимой
Покормите птиц зимой Биологическое разнообразие. Его объединение и пути сохранения
Биологическое разнообразие. Его объединение и пути сохранения Интегрированный урок по биологии в 8 классе (Биология - физика – литература)
Интегрированный урок по биологии в 8 классе (Биология - физика – литература) Черенкование комнатных растений
Черенкование комнатных растений Основные этапы происхождения жизни на Земле
Основные этапы происхождения жизни на Земле Опорно-двигательный аппарат человека. Гигиена ОДА
Опорно-двигательный аппарат человека. Гигиена ОДА Значення рослин для життя на планеті Земля
Значення рослин для життя на планеті Земля