Содержание
- 2. БИОХИМИЯ – наука, изучающая химический состав живых организмов, химические процессы, которые лежат в основе жизнедеятельности и
- 3. ГЛАВНАЯ ЗАДАЧА БИОХИМИИ – ПОЗНАНИЕ ХИМИЧЕСКИХ ОСНОВ ЖИЗНИ, УСЛОВИЙ И МЕХАНИЗМОВ ЕЁ ВОЗНИКНОВЕНИЯ И РАЗВИТИЯ
- 4. Метаболизм – совокупность химических превращений веществ от момента поступления их в клетку до выделения конечных продуктов
- 5. Метаболизм Катаболизм – совокупность поэтапных ферментативных процессов расщепления сложных молекул до простых. Идет с высвобождением энергии
- 6. БЕЛКИ (протеины) – ВЫСОКОМОЛЕКУЛЯРНЫЕ АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, МАЛО ОТЛИЧАЮЩИЕСЯ ПО ЭЛЕМЕНТАРНОМУ СОСТАВУ, НО РЕЗКО ОТЛИЧАЮЩИЕСЯ ПО
- 7. Функции белков Каталитические (ферменты) Регуляторные (гормоны) Рецепторая (мембранные, цитозольные и др. рецепторы) Транспортные (Нb, трансферрин) Защитные
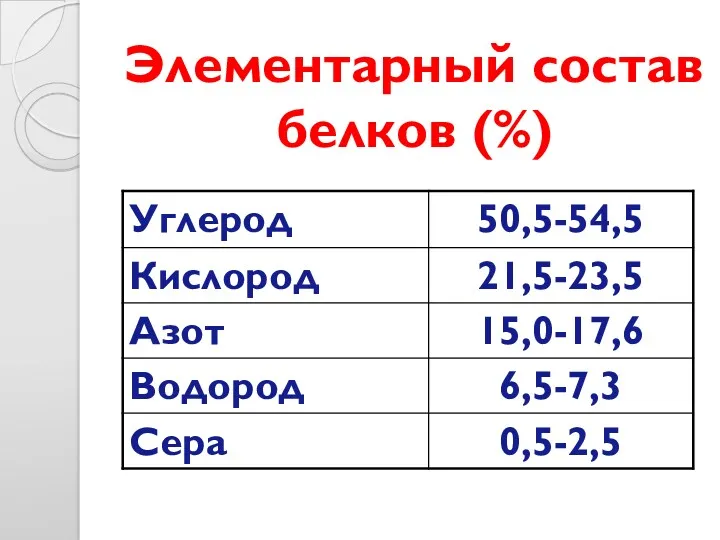
- 8. Элементарный состав белков (%)
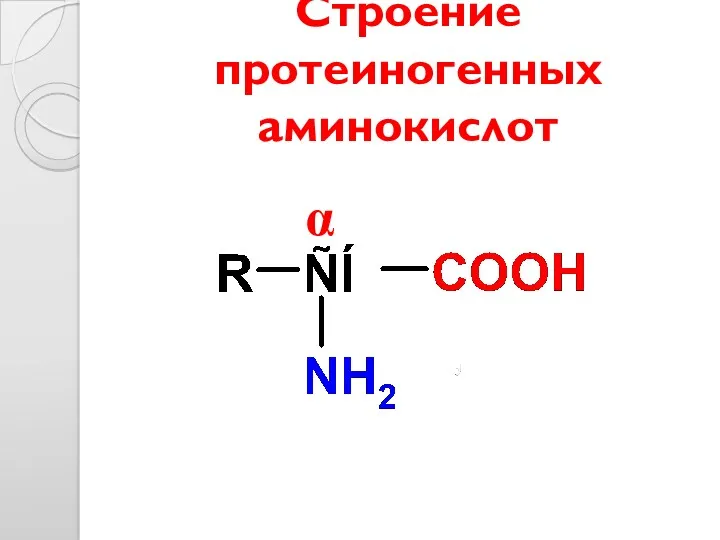
- 9. БЕЛКИ – биополимеры, структурными единицами которых (мономерами) являются α-аминокислоты, соединённые между собой пептидными связями. 20 аминокислот,
- 10. Строение протеиногенных аминокислот α
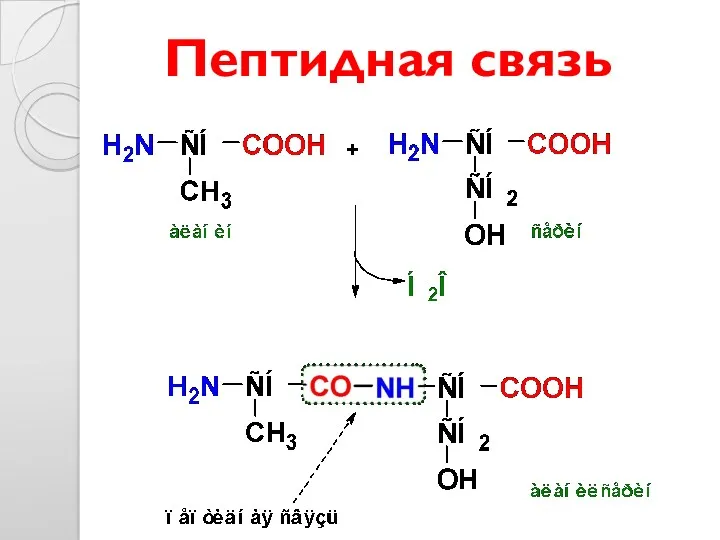
- 11. Пептидная связь
- 12. Классификация производных аминокислот 2-10 аминокислотных остатков – пептид, 10-100 ─" ─ полипептид, > 100 ─" ─
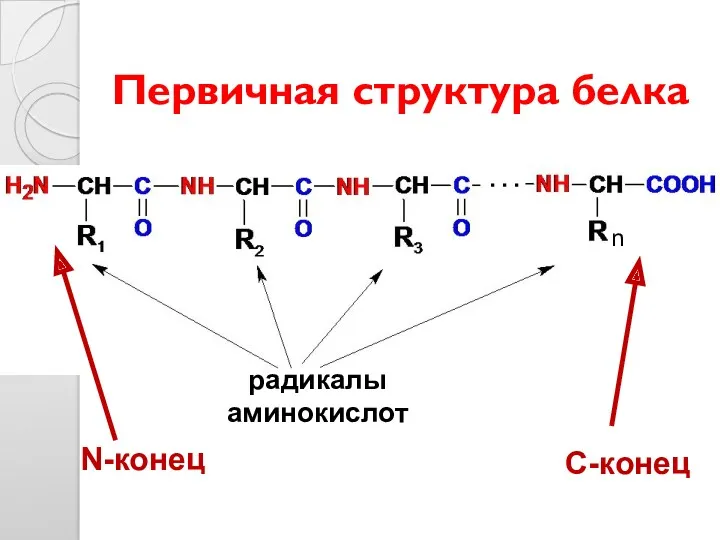
- 13. Первичная структура белка n N-конец С-конец радикалы аминокислот
- 14. Первичная структура определяет: Физико-химические свойства (размер, массу, растворимость, заряд и т.д.) Все последующие уровни структурной организации
- 15. Закономерности первичной стуктуры 1. Чем важнее роль белка в процессах жизнедеятельности, тем разнообразнее его аминокислотный состав
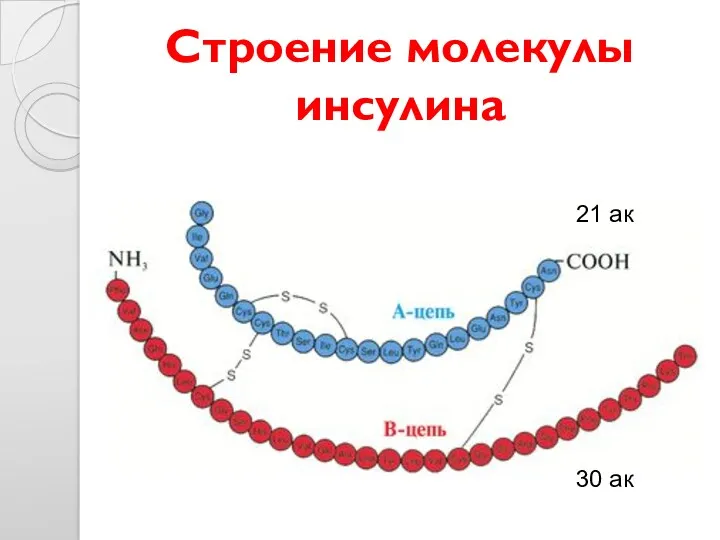
- 16. Строение молекулы инсулина 21 ак 30 ак
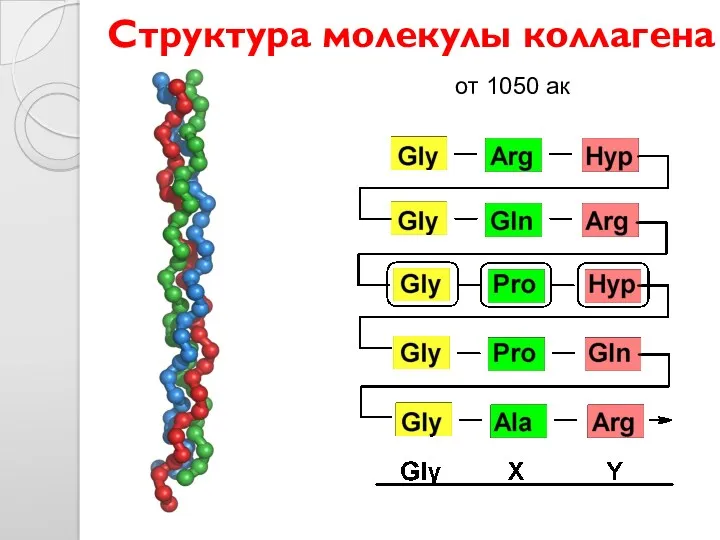
- 17. Структура молекулы коллагена от 1050 ак
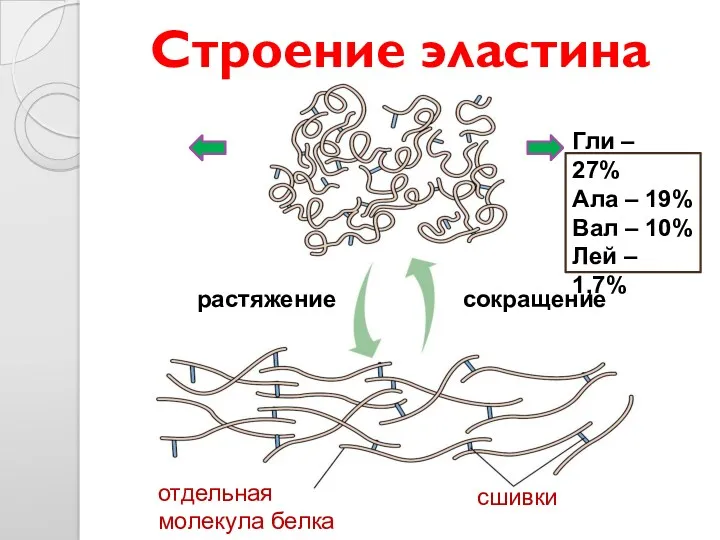
- 18. растяжение сокращение отдельная молекула белка сшивки Строение эластина Гли – 27% Ала – 19% Вал –
- 19. Закономерности первичной стуктуры 2. Чем важнее роль белка в процессах жизнедеятельности, тем больше сходство первичных структур
- 20. Закономерности первичной стуктуры 3. Чем ближе расположены виды на эволюционной лестнице, тем больше сходство первичных структур
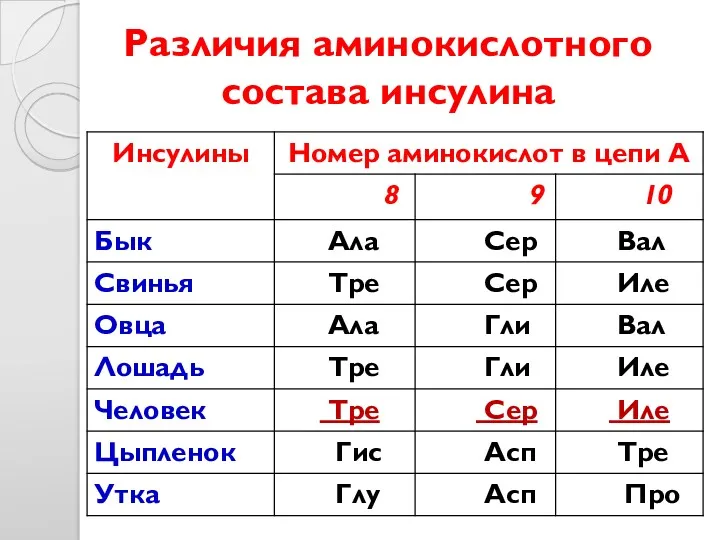
- 21. Различия аминокислотного состава инсулина
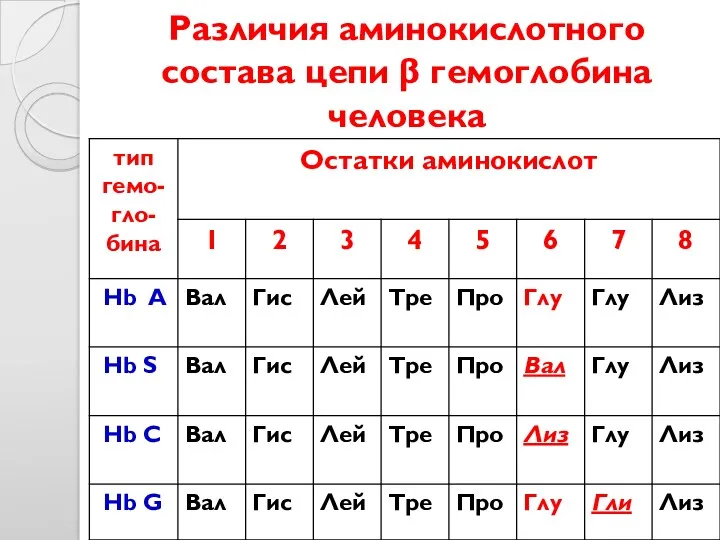
- 22. Различия аминокислотного состава цепи β гемоглобина человека
- 23. Методы изучения I структуры белка Методы «меток» – определение концевых аминокислот (методы Сэнджера, Эдмана, Акабори, дансильный)
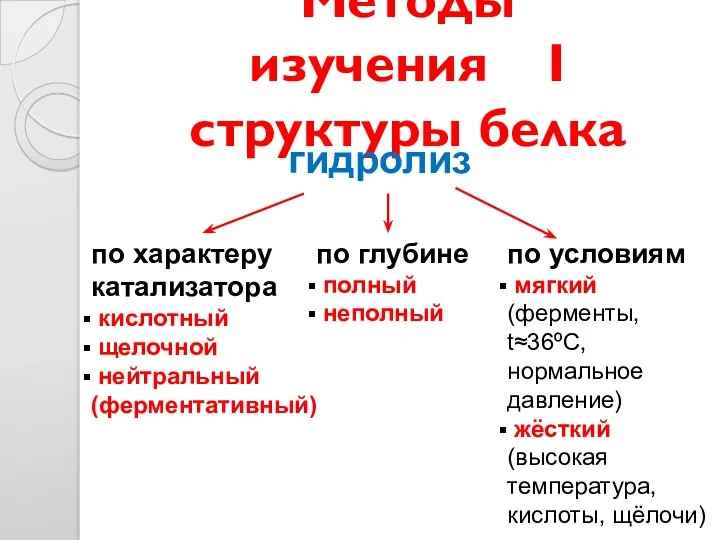
- 24. Методы изучения I структуры белка гидролиз по характеру катализатора кислотный щелочной нейтральный (ферментативный) по глубине полный
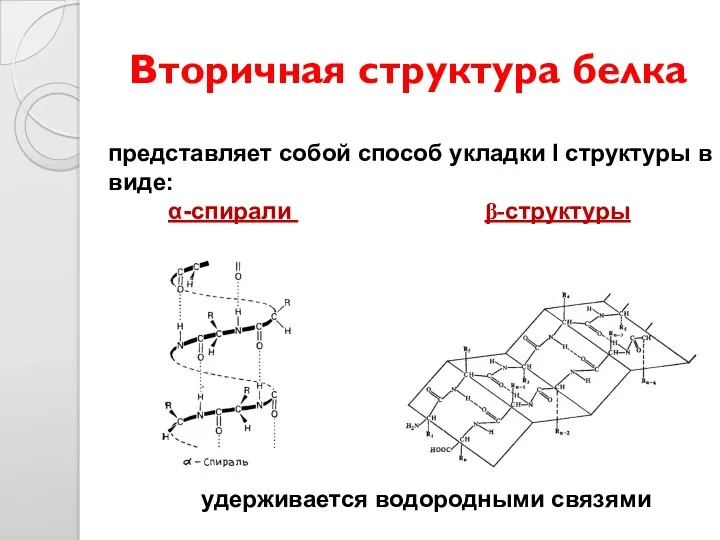
- 25. представляет собой способ укладки I структуры в виде: α-спирали β-структуры удерживается водородными связями Вторичная структура белка
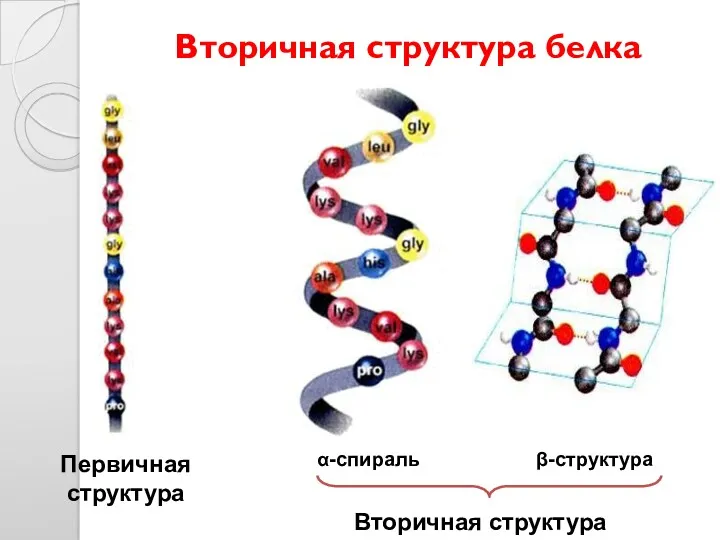
- 26. Вторичная структура белка Первичная структура α-спираль β-структура Вторичная структура
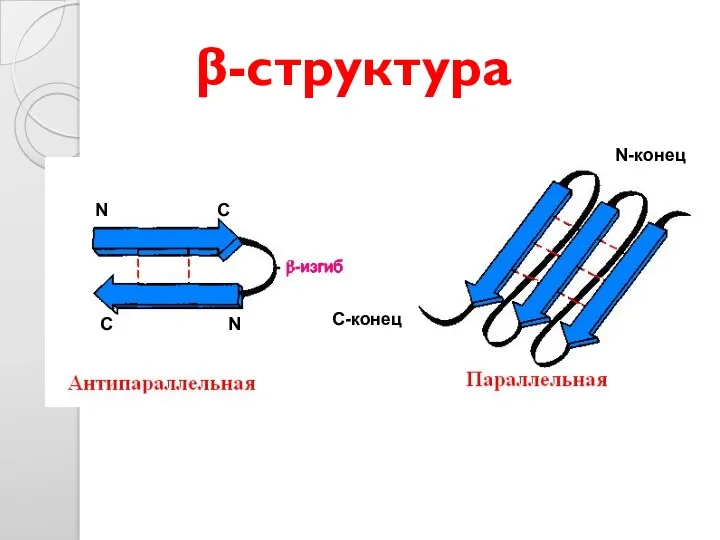
- 27. β-структура С-конец N-конец N C C N
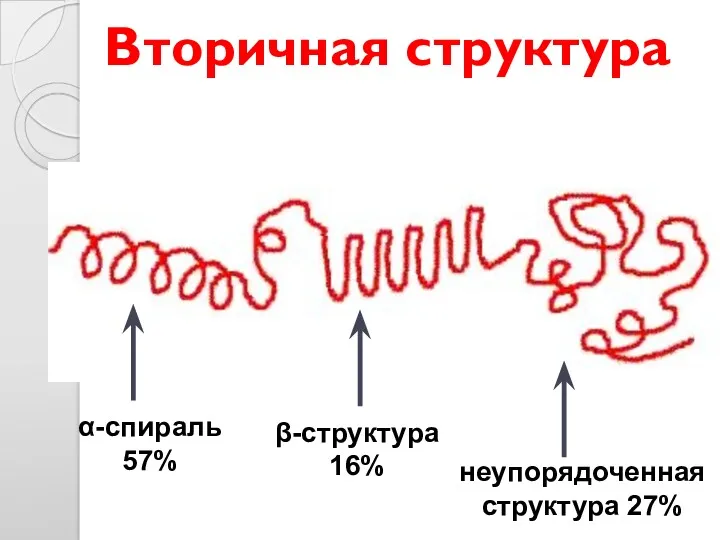
- 28. Вторичная структура α-спираль 57% β-структура 16% неупорядоченная структура 27%
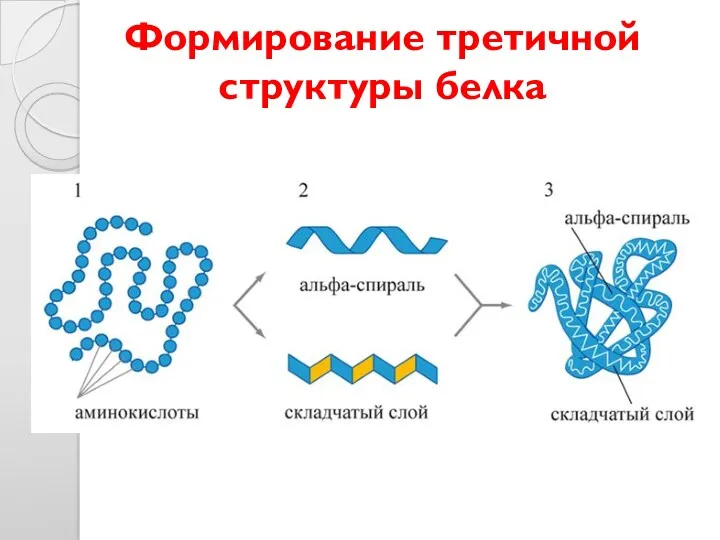
- 29. Формирование третичной структуры белка
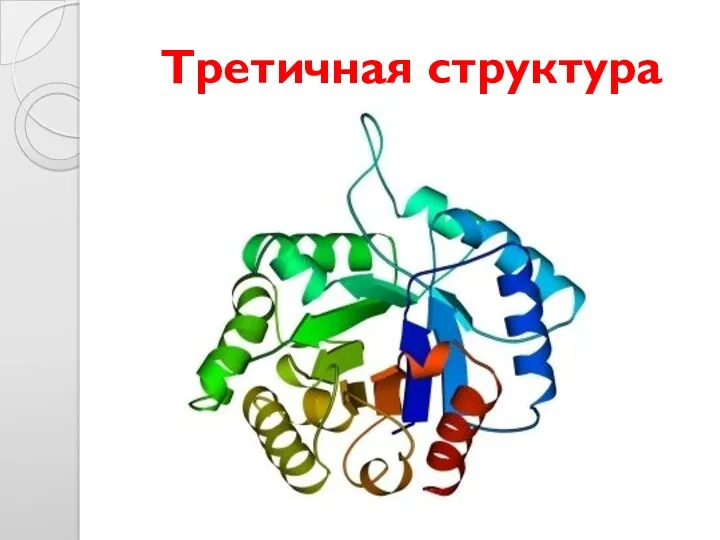
- 30. Третичная структура
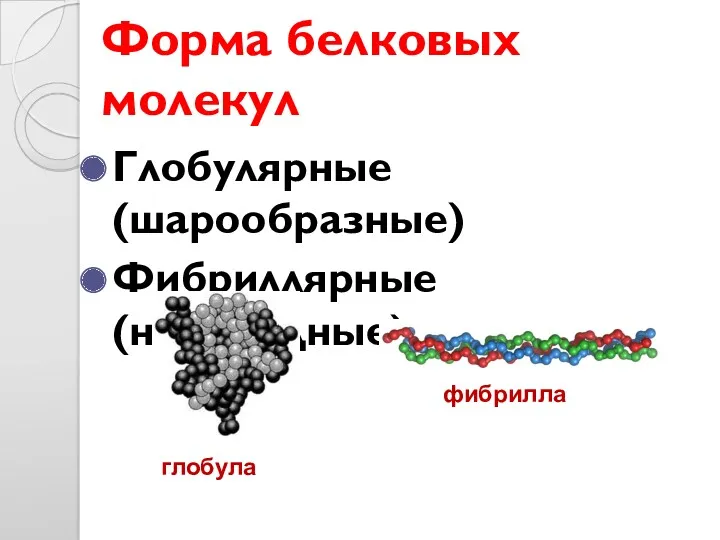
- 31. Форма белковых молекул Глобулярные (шарообразные) Фибриллярные (нитевидные) глобула фибрилла
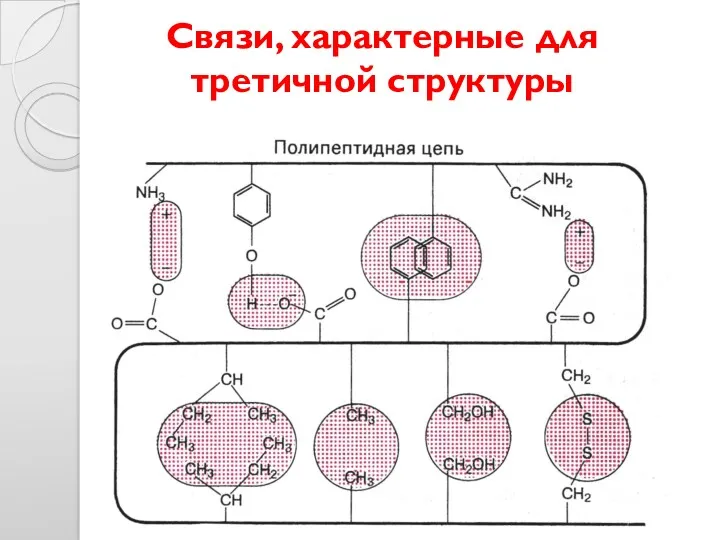
- 32. Связи, характерные для третичной структуры
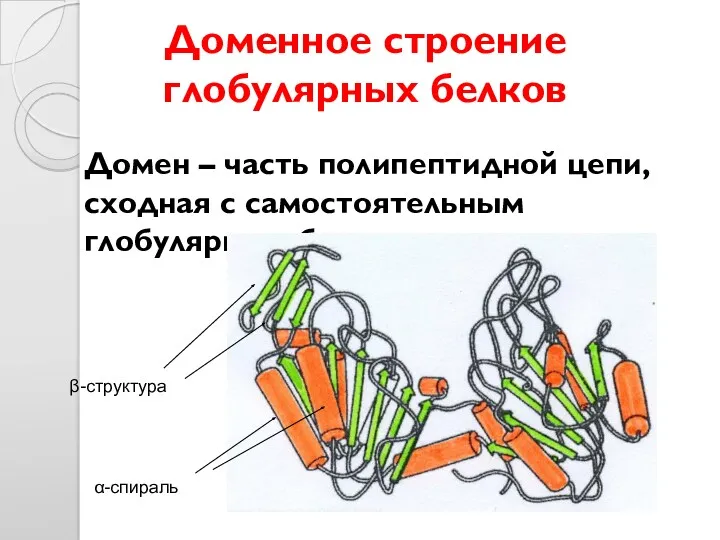
- 33. Доменное строение глобулярных белков Домен – часть полипептидной цепи, сходная с самостоятельным глобулярным белком α-спираль β-структура
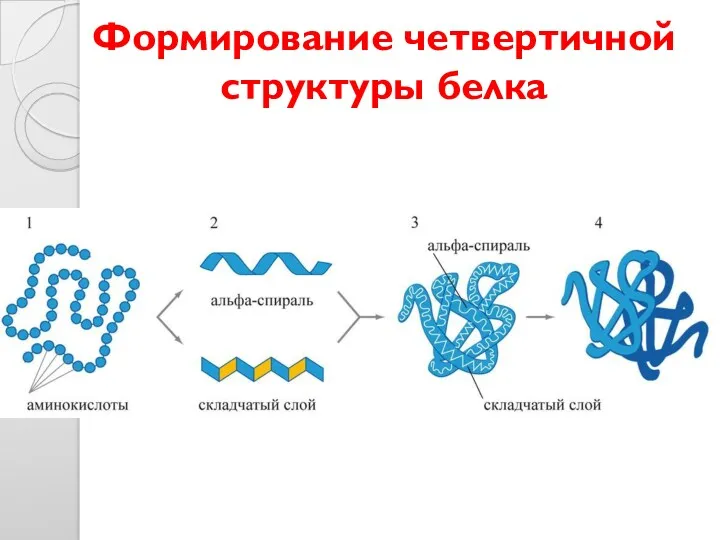
- 34. Формирование четвертичной структуры белка
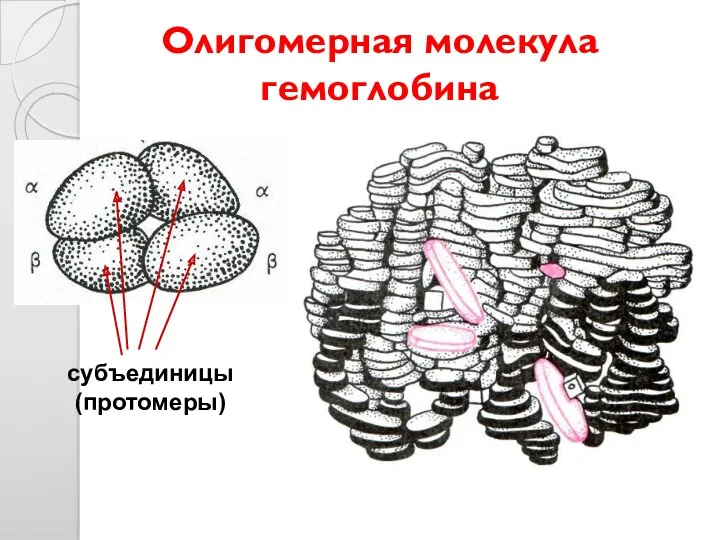
- 35. Олигомерная молекула гемоглобина субъединицы (протомеры)
- 36. Важнейшие свойства белков: Способность к специфическим взаимодействиям (образование белково-лигандных комплексов) Способность к самосборке (образование надмолекулярных структур)
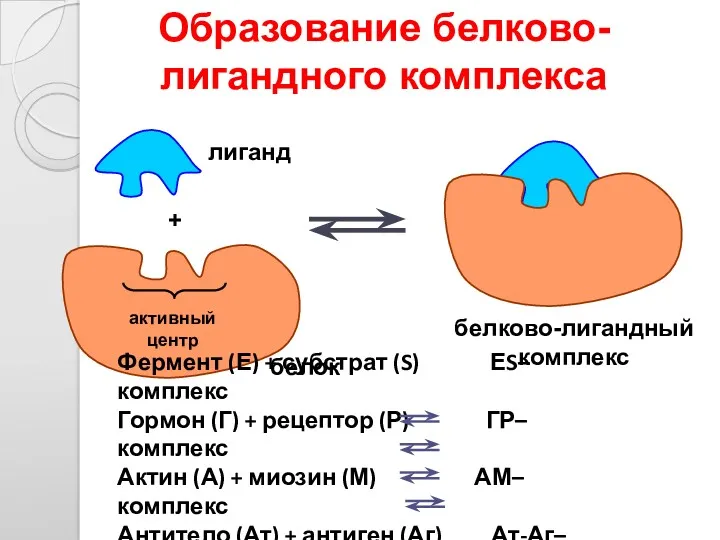
- 37. Образование белково-лигандного комплекса Происходит только в определённом месте белка, который называется центр связывания (или активный центр)
- 38. активный центр лиганд белок белково-лигандный комплекс + Образование белково-лигандного комплекса Фермент (Е) + субстрат (S) ЕS–комплекс
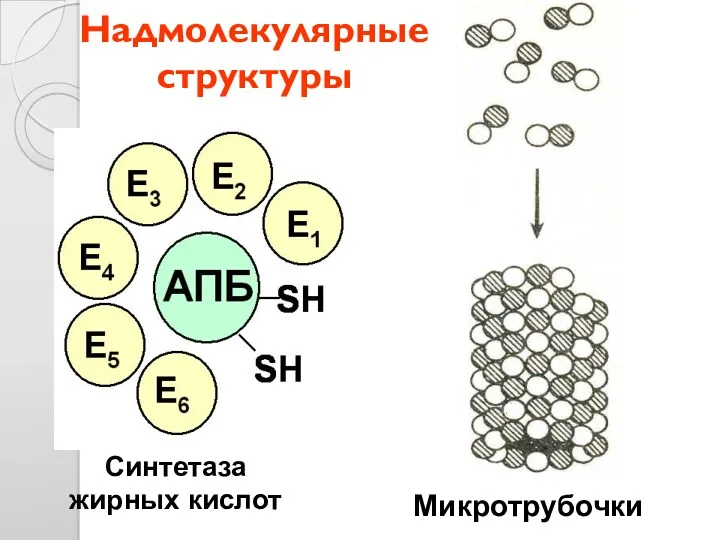
- 39. Надмолекулярные структуры Синтетаза жирных кислот Микротрубочки
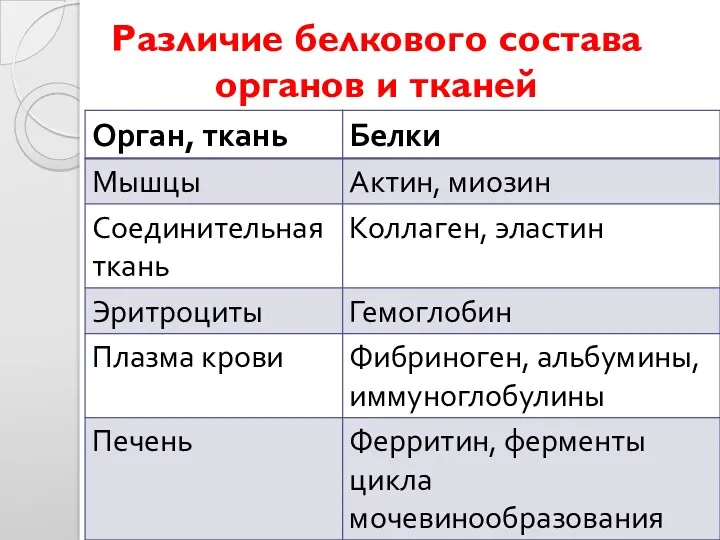
- 40. Различие белкового состава органов и тканей
- 41. Типы классификации белков По форме молекулы. По физико-химическим свойствам. По происхождению. По биологической ценности. По функциям.
- 42. Классификация по функциям Каталитические (ферменты) Регуляторные (гормоны) Транспортные (Нb, трансферрин) Защитные (Ig, шапероны) Сократительные (актин, миозин)
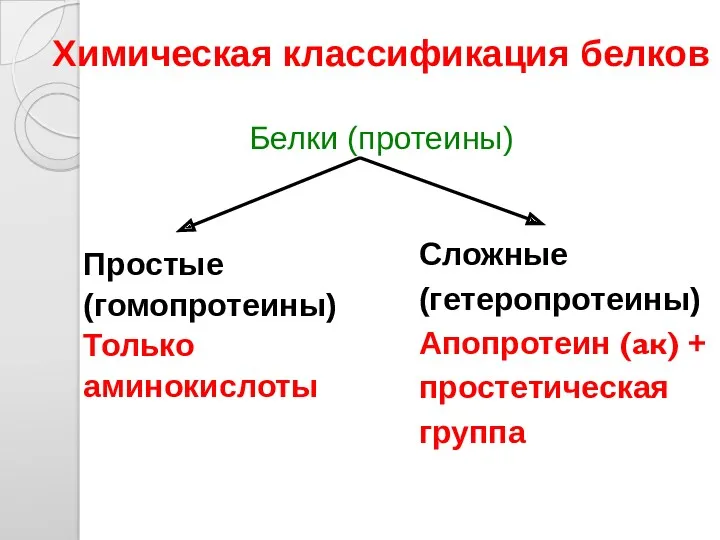
- 43. Химическая классификация белков п Белки (протеины) Простые (гомопротеины) Только аминокислоты Сложные (гетеропротеины) Апопротеин (ак) + простетическая
- 44. Сложные: Нуклеопротеины; Хромопротеины; Гликопротеины; Фосфопротеины; Липопротеины; Металлопротеины Простые: Альбумины; Глобулины; Проламины; Глютелины; Протамины; Гистоны; Склеропротеины Химическая
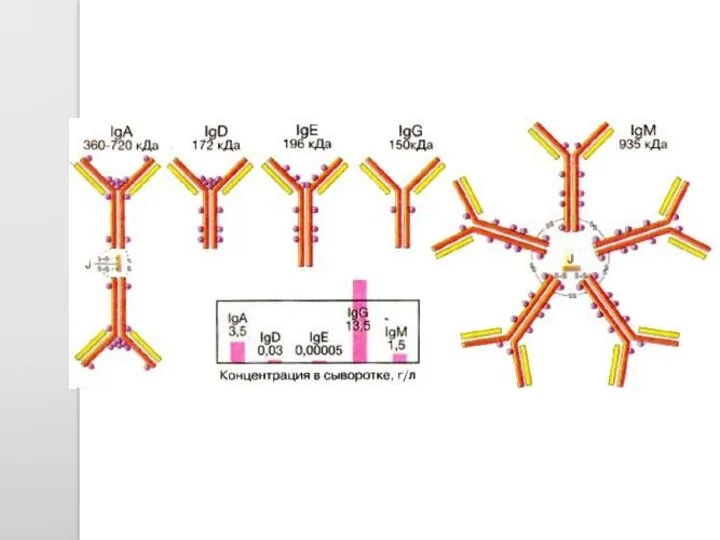
- 45. Классификация белков по семействам Сериновые протеиназы Шапероны Иммуноглобулины
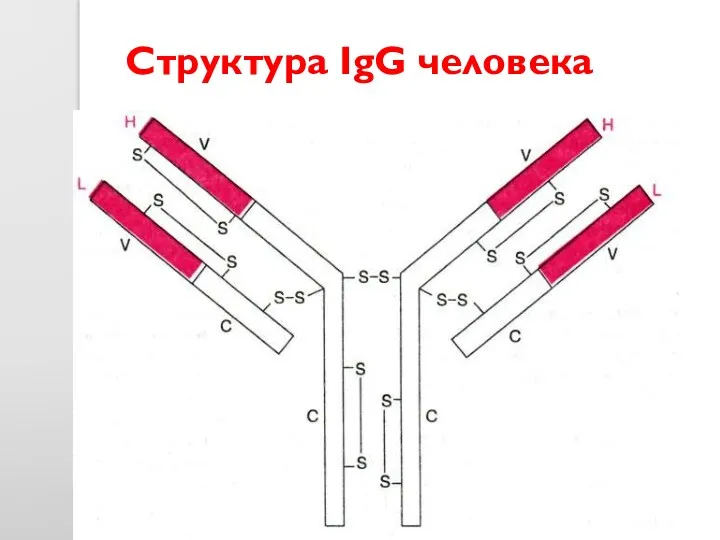
- 46. Структура IgG человека
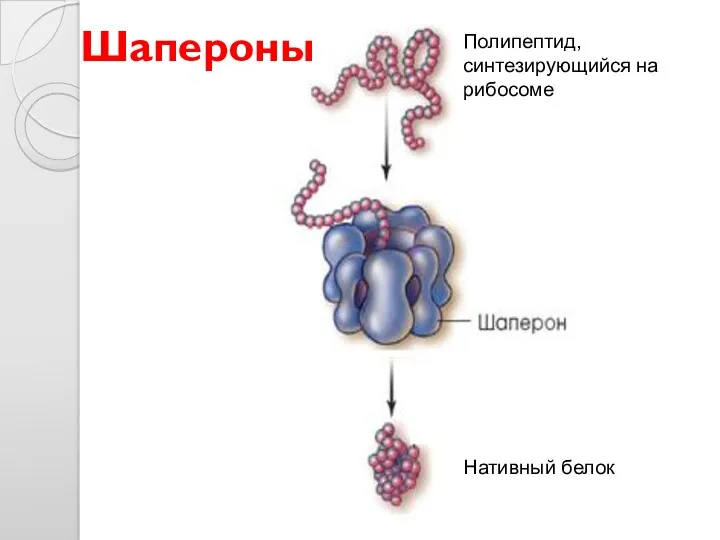
- 48. Шапероны Полипептид, синтезирующийся на рибосоме Нативный белок
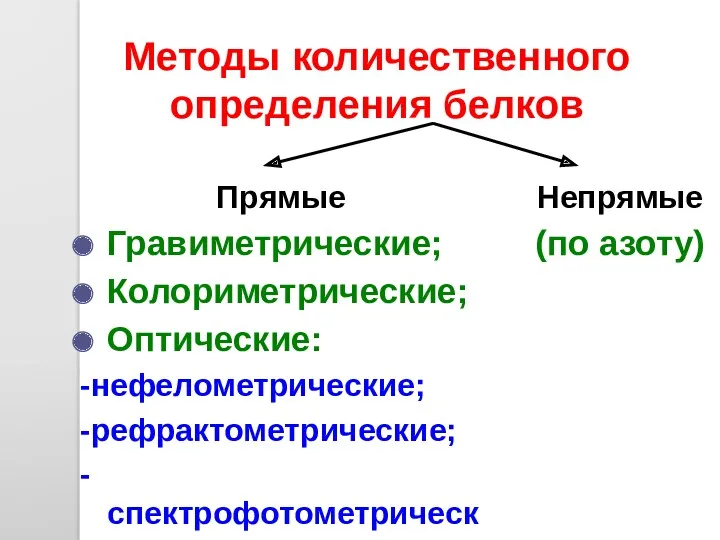
- 49. Методы количественного определения белков Непрямые (по азоту) Прямые Гравиметрические; Колориметрические; Оптические: -нефелометрические; -рефрактометрические; -спектрофотометрические
- 51. Скачать презентацию



















 Биология клетки
Биология клетки Насекомые - стихи
Насекомые - стихи Клеточный цикл и его регуляция. Ключевые признаки рака HALLMARK. Гистологические типы злокачественных новообразований
Клеточный цикл и его регуляция. Ключевые признаки рака HALLMARK. Гистологические типы злокачественных новообразований Роль азота в питании растений. Источники азотного питания
Роль азота в питании растений. Источники азотного питания Екологічна валентність видів
Екологічна валентність видів Эволюция систем органов
Эволюция систем органов Crispr Cas9 Genome Editing
Crispr Cas9 Genome Editing Презентация урока 6 класс ФГОС.
Презентация урока 6 класс ФГОС. Строение почек, расположение их на стебле растений
Строение почек, расположение их на стебле растений Микробы в доме
Микробы в доме Зеленая аптека
Зеленая аптека Вегетативная нервная система
Вегетативная нервная система Виды многолетников
Виды многолетников Строение и жизнедеятельность бактерий
Строение и жизнедеятельность бактерий Растения-паразиты
Растения-паразиты Наши верные друзья - собаки
Наши верные друзья - собаки Движение крови по сосудам. Кровяное давление. Регуляция кровообращения
Движение крови по сосудам. Кровяное давление. Регуляция кровообращения Систематика растений и животных
Систематика растений и животных Визначення особливостей зовнішньої будови хребетних тварин у зв’язку з пристосуванням до різних умов існування. ЛР №2
Визначення особливостей зовнішньої будови хребетних тварин у зв’язку з пристосуванням до різних умов існування. ЛР №2 Отделы нервной системы
Отделы нервной системы Видоизменения побегов
Видоизменения побегов Сообщества живых организмов
Сообщества живых организмов презентация к уроку анатомии
презентация к уроку анатомии Урок_экологии_Экологические_группы_растений_по_отношению_к_воде
Урок_экологии_Экологические_группы_растений_по_отношению_к_воде Анатомия мочеполовой системы мужчин
Анатомия мочеполовой системы мужчин Общая характеристика грибов. Многообразие
Общая характеристика грибов. Многообразие Тип моллюски
Тип моллюски A Leaf
A Leaf