Содержание
- 2. БИОХИМИЯ – наука, изучающая химический состав живых организмов, химические процессы, которые лежат в основе жизнедеятельности и
- 3. ГЛАВНАЯ ЗАДАЧА БИОХИМИИ – ПОЗНАНИЕ ХИМИЧЕСКИХ ОСНОВ ЖИЗНИ, УСЛОВИЙ И МЕХАНИЗМОВ ЕЁ ВОЗНИКНОВЕНИЯ И РАЗВИТИЯ
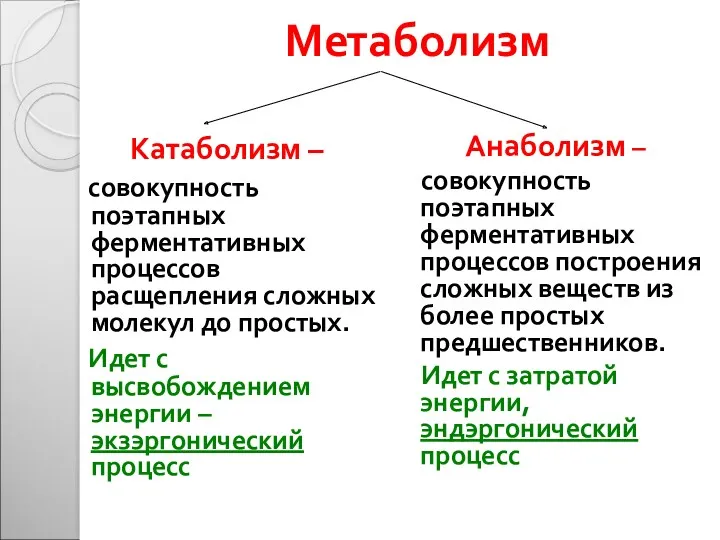
- 4. Метаболизм – совокупность химических превращений веществ от момента поступления их в клетку до выделения конечных продуктов
- 5. Метаболизм Катаболизм – совокупность поэтапных ферментативных процессов расщепления сложных молекул до простых. Идет с высвобождением энергии
- 6. БЕЛКИ (протеины) – ВЫСОКОМОЛЕКУЛЯРНЫЕ АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, МАЛО ОТЛИЧАЮЩИЕСЯ ПО ЭЛЕМЕНТАРНОМУ СОСТАВУ, НО РЕЗКО ОТЛИЧАЮЩИЕСЯ ПО
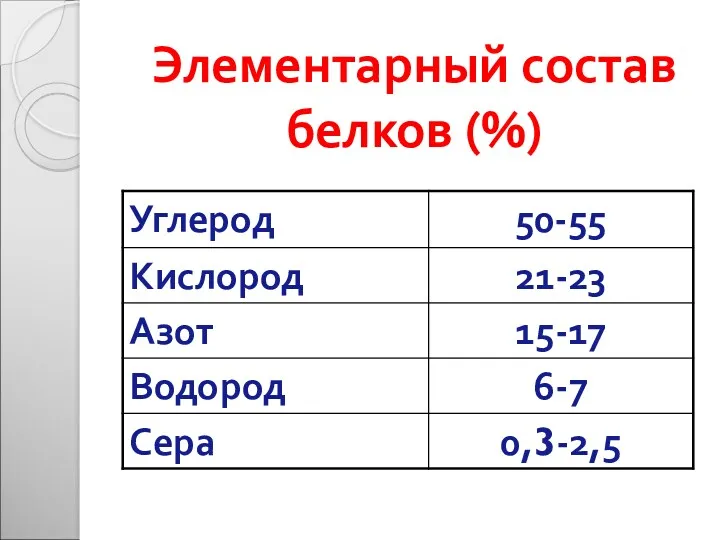
- 7. Элементарный состав белков (%)
- 8. Функции белков Каталитические (ферменты) Регуляторные (гормоны) Рецепторая (мембранные, цитозольные и др. рецепторы) Транспортные (Нb, трансферрин) Защитные
- 9. Теории строения белков Теория Мульдера (1836): белки состоят из «радикалов» («протеинов»), минимальных структурных единиц, обладающих следующим
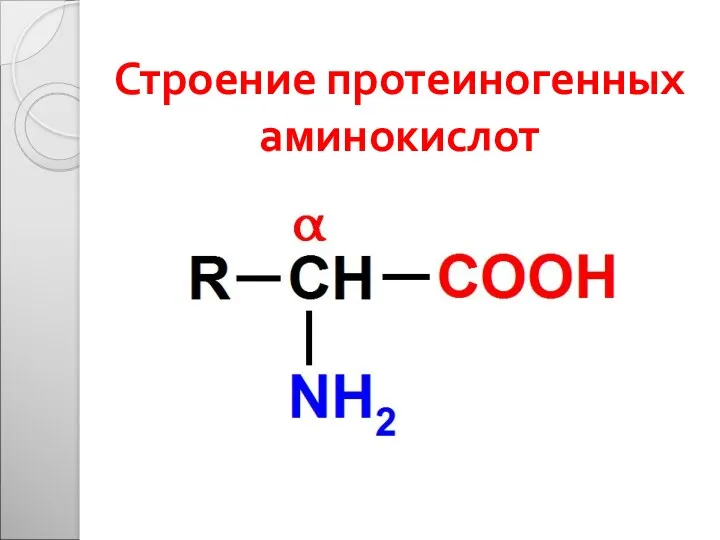
- 10. БЕЛКИ – биополимеры, структурными единицами которых (мономерами) являются α-аминокислоты, соединённые между собой пептидными связями. 20 аминокислот,
- 11. Строение протеиногенных аминокислот
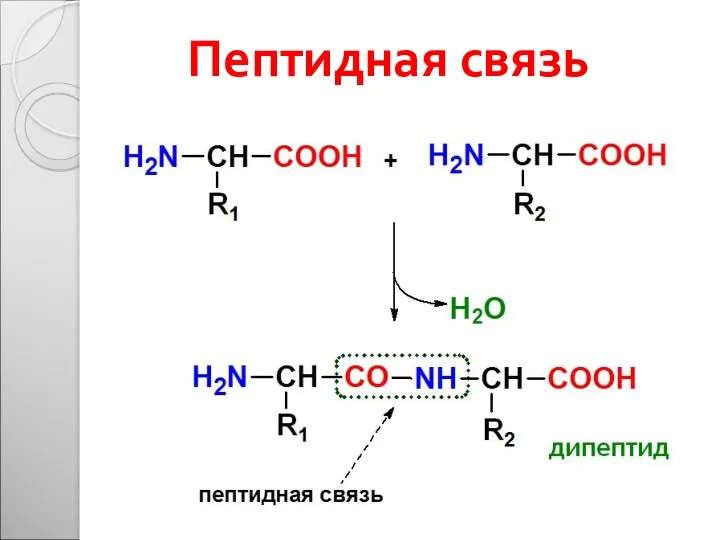
- 12. Пептидная связь
- 13. Классификация производных аминокислот 2-10 аминокислотных остатков – пептид, 10-100 ─" ─ полипептид, > 100 ─" ─
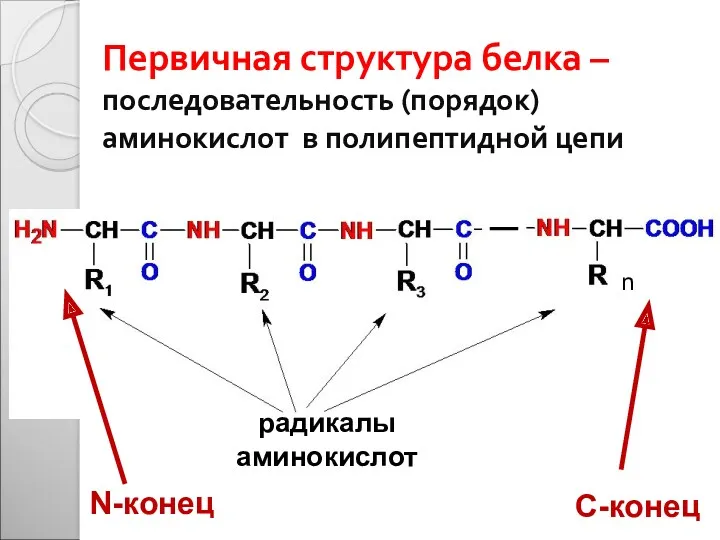
- 14. Первичная структура белка – последовательность (порядок) аминокислот в полипептидной цепи n N-конец С-конец радикалы аминокислот
- 15. Первичная структура определяет: Физико-химические свойства (размер, массу, растворимость, заряд и т.д.) Все последующие уровни структурной организации
- 16. Закономерности первичной стуктуры 1. Чем важнее роль белка в процессах жизнедеятельности, тем разнообразнее его аминокислотный состав
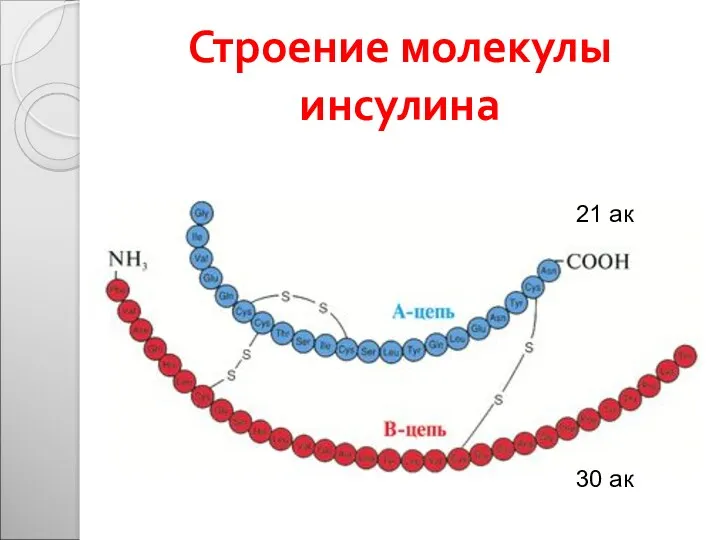
- 17. Строение молекулы инсулина 21 ак 30 ак
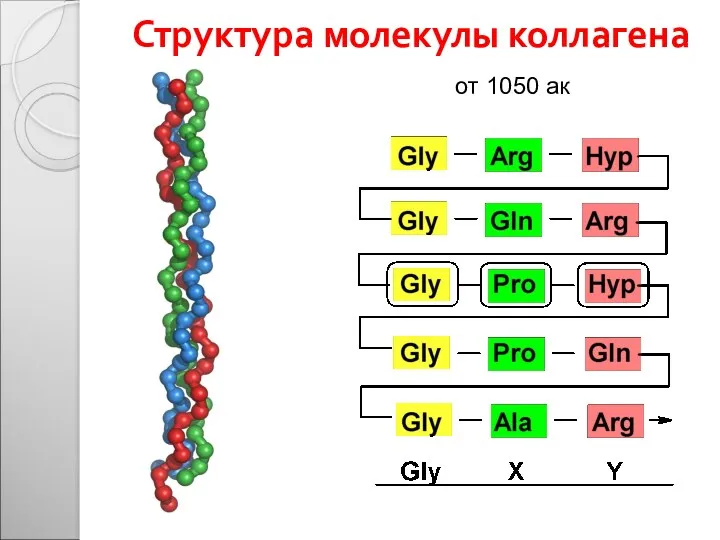
- 18. Структура молекулы коллагена от 1050 ак
- 19. Закономерности первичной стуктуры 2. Чем важнее роль белка в процессах жизнедеятельности, тем больше сходство первичных структур
- 20. Закономерности первичной стуктуры 3. Чем ближе расположены виды на эволюционной лестнице, тем больше сходство первичных структур
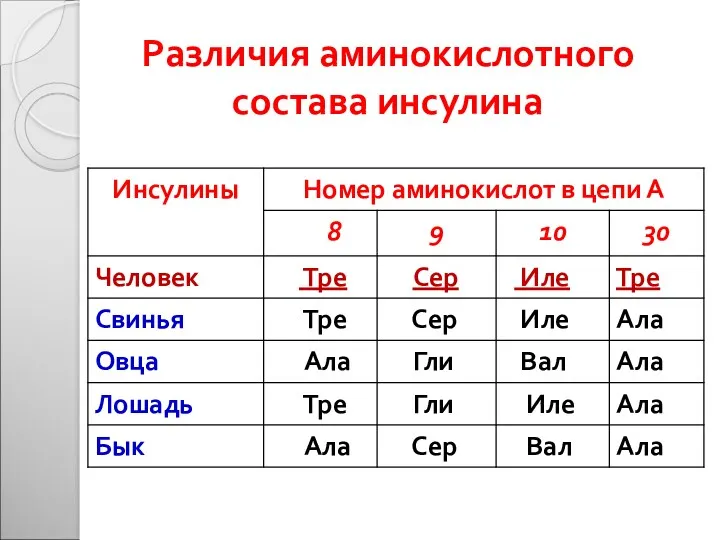
- 21. Различия аминокислотного состава инсулина
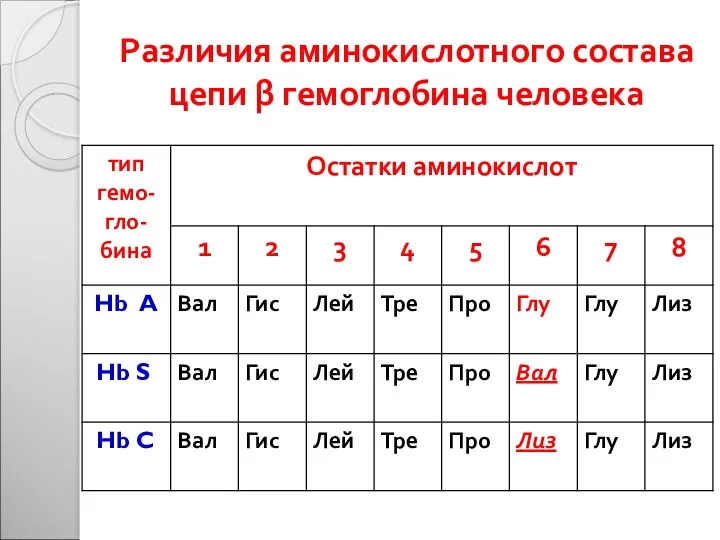
- 22. Различия аминокислотного состава цепи β гемоглобина человека
- 23. Типы первичной структуры Одна длинная полипептидная цепь (связи только пептидные) Две или больше коротких полипептидных цепей
- 24. Методы изучения I структуры белка Методы «меток» – определение концевых аминокислот (методы Сэнджера, Эдмана, Акабори, дансильный)
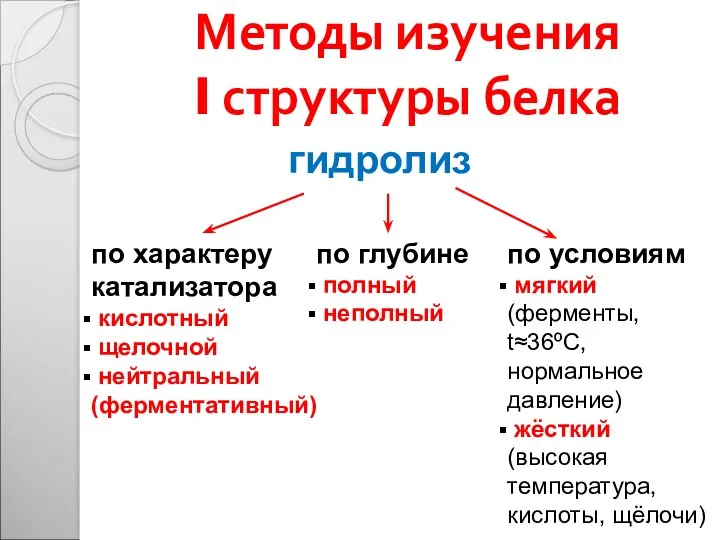
- 25. Методы изучения I структуры белка гидролиз по характеру катализатора кислотный щелочной нейтральный (ферментативный) по глубине полный
- 26. Значение расшифровки первичной структуры: Возможность изучения молекулярных основ наследственных болезней Возможность синтеза белков in vitro
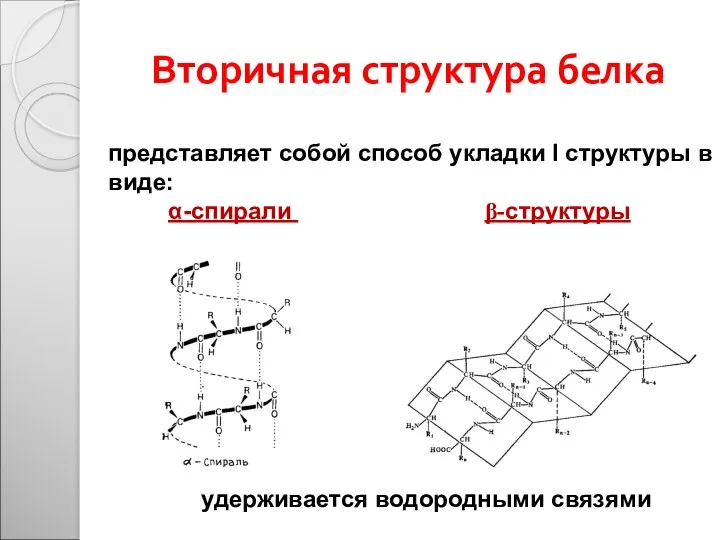
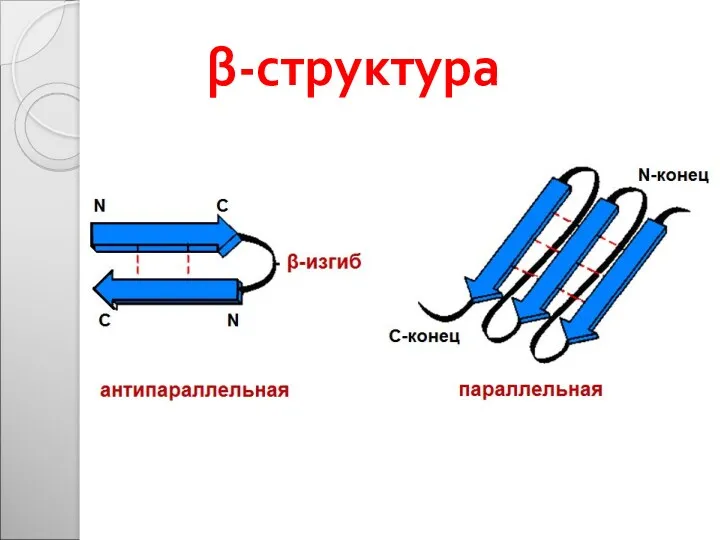
- 27. представляет собой способ укладки I структуры в виде: α-спирали β-структуры удерживается водородными связями Вторичная структура белка
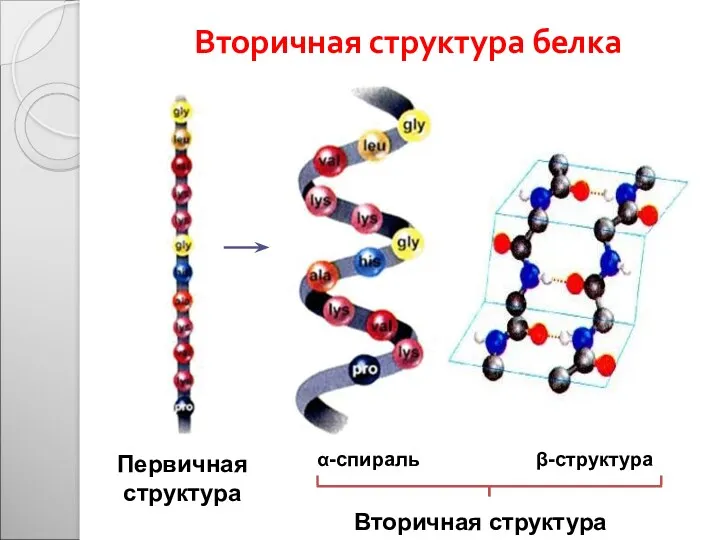
- 28. Вторичная структура белка Первичная структура α-спираль β-структура Вторичная структура
- 29. β-структура
- 30. Вторичная структура α-спираль 57% β-структура 16% неупорядоченная структура 27%
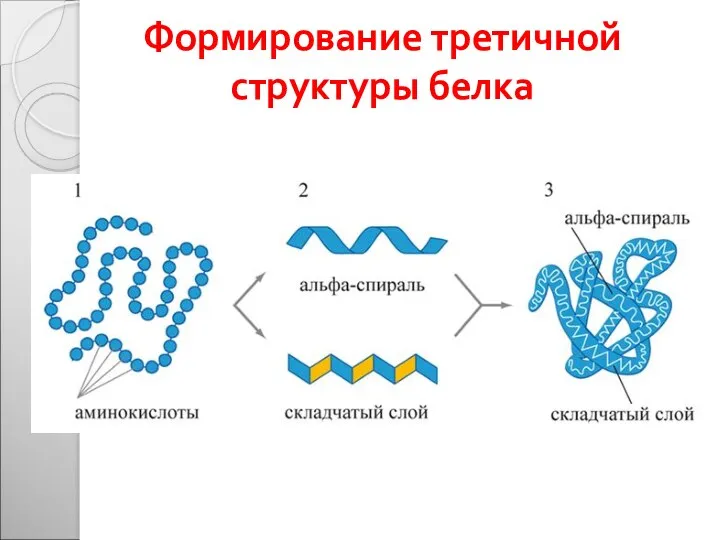
- 31. Формирование третичной структуры белка
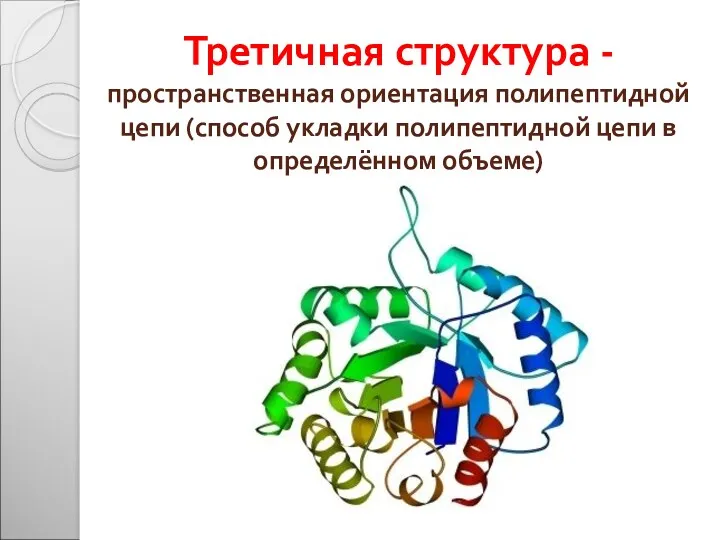
- 32. Третичная структура - пространственная ориентация полипептидной цепи (способ укладки полипептидной цепи в определённом объеме)
- 33. Форма белковых молекул Глобулярные (шарообразные) Фибриллярные (нитевидные) глобула фибрилла
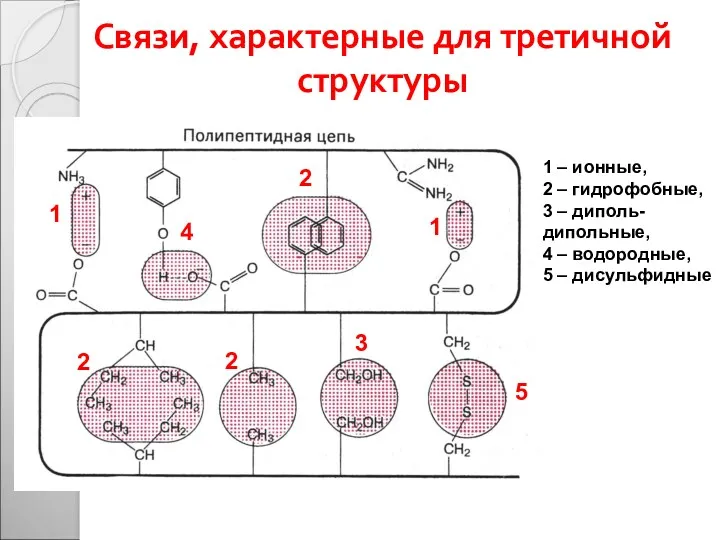
- 34. Связи, характерные для третичной структуры 1 – ионные, 2 – гидрофобные, 3 – диполь-дипольные, 4 –
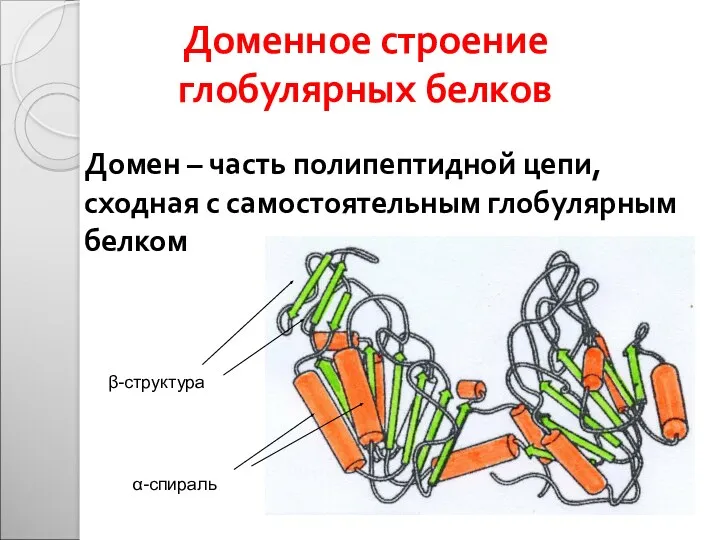
- 35. Доменное строение глобулярных белков Домен – часть полипептидной цепи, сходная с самостоятельным глобулярным белком α-спираль β-структура
- 36. Четвертичная структура – объединение отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой,
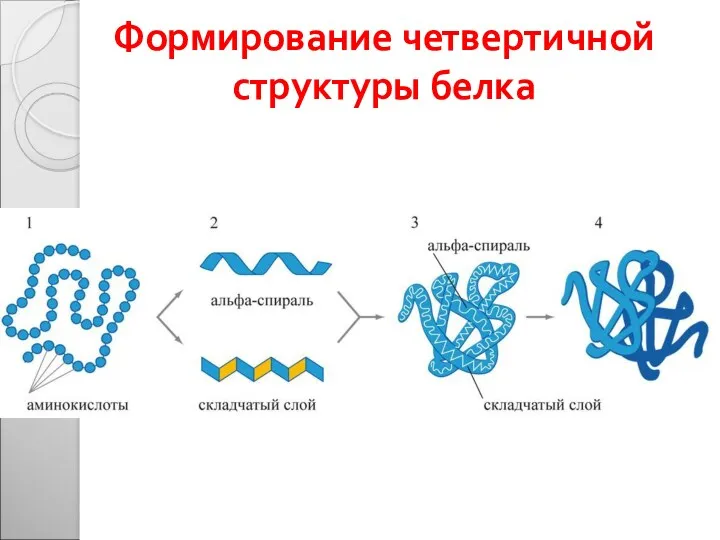
- 37. Формирование четвертичной структуры белка
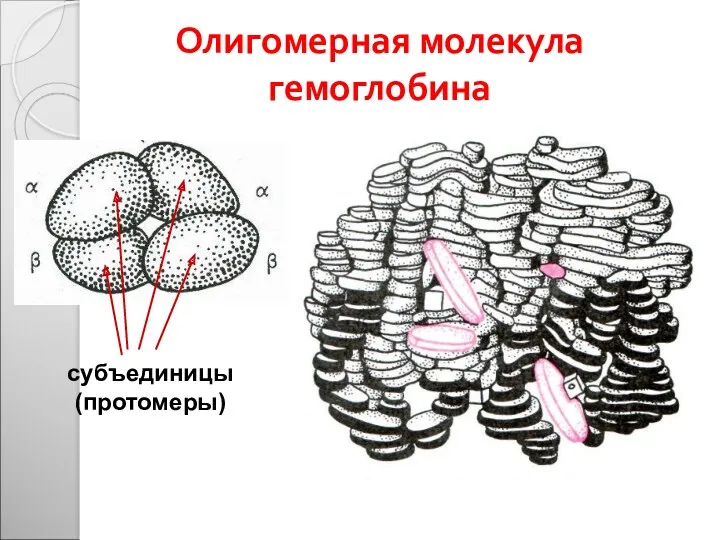
- 38. Олигомерная молекула гемоглобина субъединицы (протомеры)
- 39. Важнейшие свойства белков: Способность к специфическим взаимодействиям (образование белково-лигандных комплексов) Способность к самосборке (образование надмолекулярных структур)
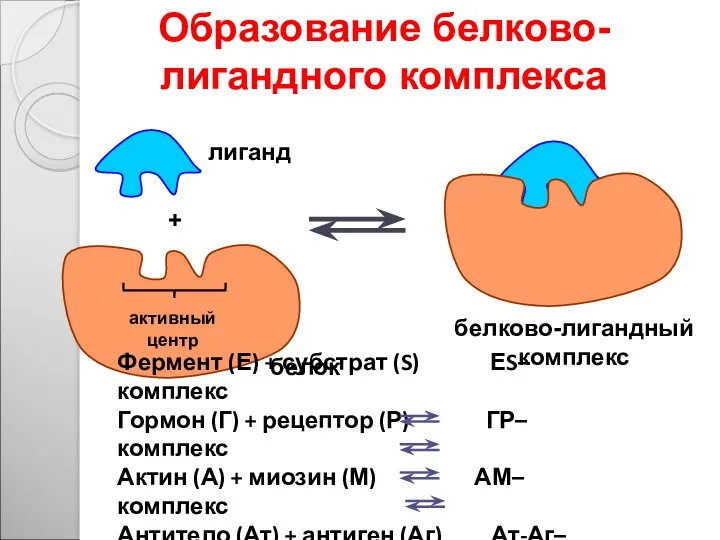
- 40. Образование белково-лигандного комплекса Происходит только в определённом месте белка, который называется центр связывания (или активный центр)
- 41. Лиганд – вещество, с которым взаимодействует белок при выполнении своих биологических функций. Лигандом может быть: неорганическое
- 42. активный центр лиганд белок белково-лигандный комплекс + Образование белково-лигандного комплекса Фермент (Е) + субстрат (S) ЕS–комплекс
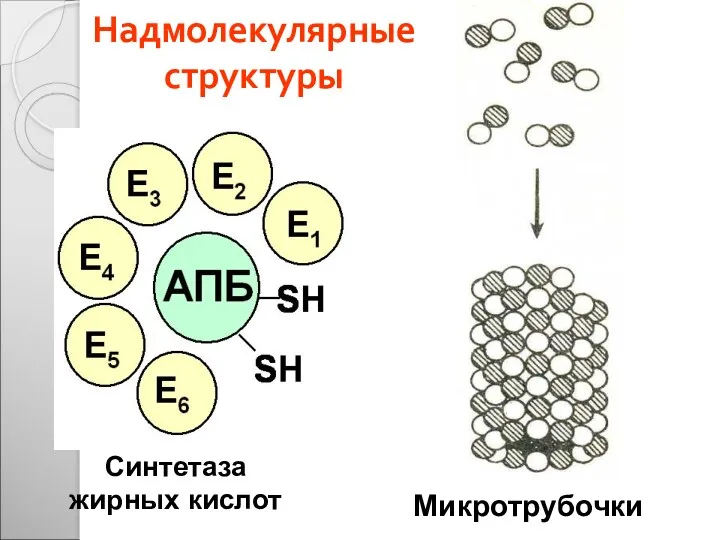
- 43. Надмолекулярные структуры Синтетаза жирных кислот Микротрубочки
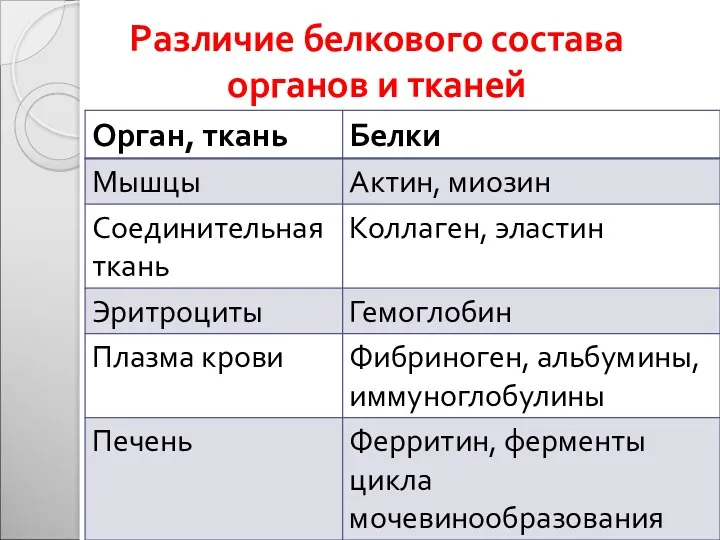
- 44. Различие белкового состава органов и тканей
- 45. Типы классификации белков По форме молекулы. По физико-химическим свойствам. По происхождению. По биологической ценности. По функциям.
- 46. Классификация по функциям Каталитические (ферменты) Регуляторные (гормоны) Транспортные (Нb, трансферрин) Защитные (Ig, шапероны) Сократительные (актин, миозин)
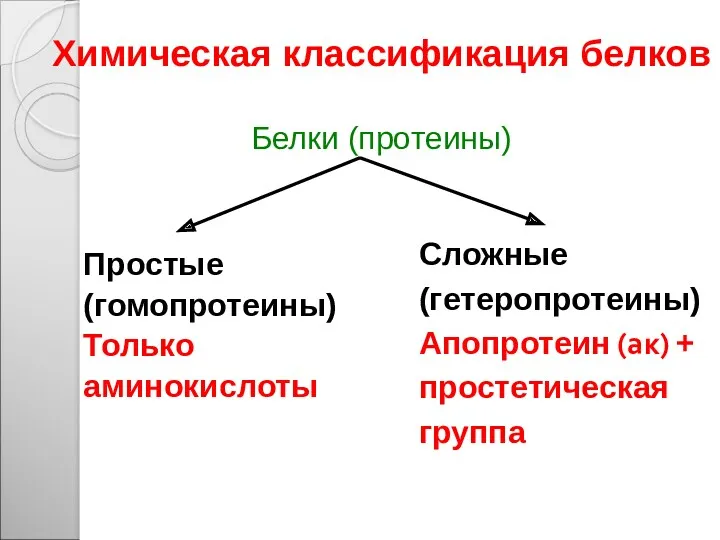
- 47. Химическая классификация белков п Белки (протеины) Простые (гомопротеины) Только аминокислоты Сложные (гетеропротеины) Апопротеин (ак) + простетическая
- 48. Сложные: Нуклеопротеины; Хромопротеины; Гликопротеины; Фосфопротеины; Липопротеины; Металлопротеины Простые: Альбумины; Глобулины; Проламины; Глютелины; Протамины; Гистоны; Склеропротеины Химическая
- 49. Классификация белков по семействам Сериновые протеиназы Шапероны Иммуноглобулины Семейство – группа белков со сходной первичной структурой,
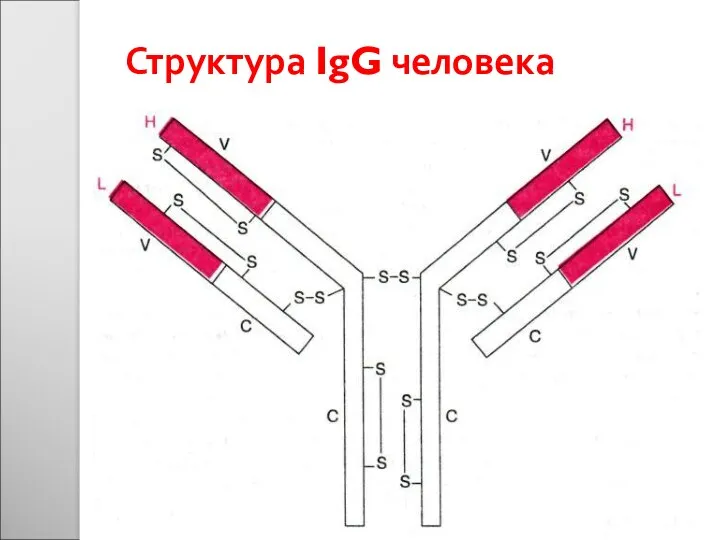
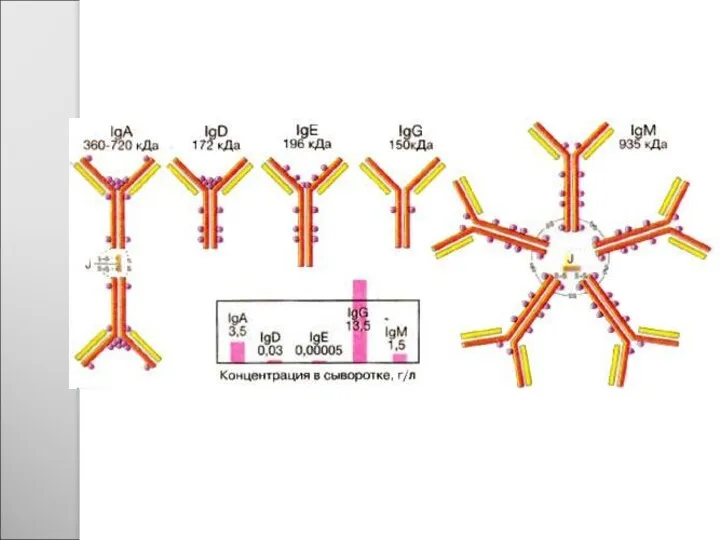
- 50. Структура IgG человека
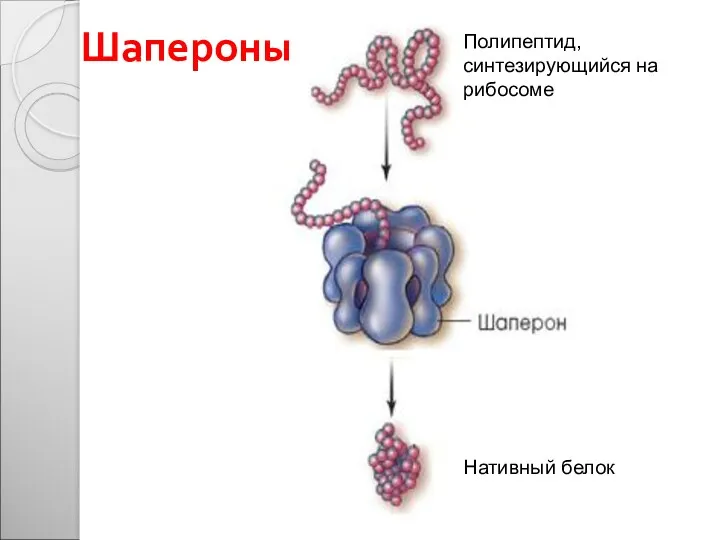
- 52. Шапероны Полипептид, синтезирующийся на рибосоме Нативный белок
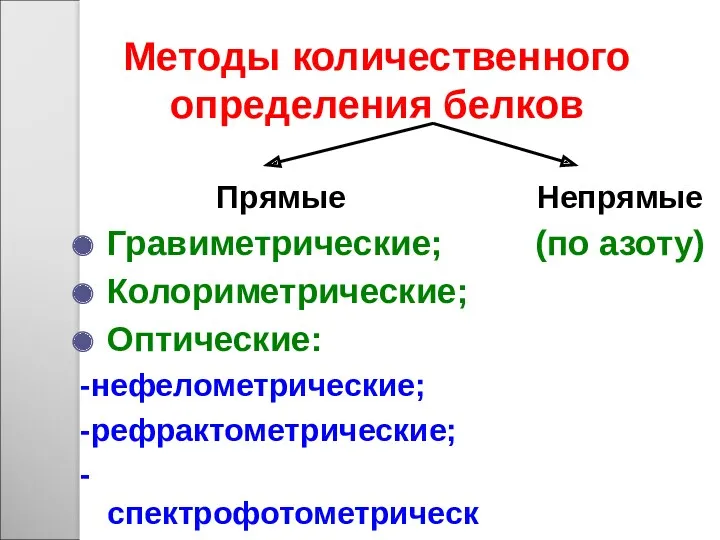
- 53. Методы количественного определения белков Непрямые (по азоту) Прямые Гравиметрические; Колориметрические; Оптические: -нефелометрические; -рефрактометрические; -спектрофотометрические
- 55. Скачать презентацию

























 Головоногие моллюски
Головоногие моллюски Пресмыкающиеся, или рептилии
Пресмыкающиеся, или рептилии Красная книга
Красная книга Млекопитающие отряд приматы
Млекопитающие отряд приматы Генетика человека с основами медицинской генетики
Генетика человека с основами медицинской генетики Хоботные
Хоботные Трюфель – самый вкусный и самый дорогой гриб в мире
Трюфель – самый вкусный и самый дорогой гриб в мире Вегетативный клеточный цикл. (СРС1. Вариант 9)
Вегетативный клеточный цикл. (СРС1. Вариант 9) Концепция здоровья с Атлайф
Концепция здоровья с Атлайф водоросли 7 класс Диск
водоросли 7 класс Диск Растительный мир Дальнего Востока
Растительный мир Дальнего Востока Динозавры (ужасные ящеры)
Динозавры (ужасные ящеры) Трансляция. Генетикалық код
Трансляция. Генетикалық код Биологические фильтры
Биологические фильтры Биологическая роль s-элементов
Биологическая роль s-элементов Презентация Решение задач по энергетическому обмену
Презентация Решение задач по энергетическому обмену Основы теории регулирования биологических систем
Основы теории регулирования биологических систем Биометрияның шығу тарихы
Биометрияның шығу тарихы Спинной мозг
Спинной мозг Происхождение культурных растений. Полевые культуры
Происхождение культурных растений. Полевые культуры Большая панда
Большая панда Особенности высшей нервной деятельности человека
Особенности высшей нервной деятельности человека Презентация: Национальный парк Большой барьерный риф
Презентация: Национальный парк Большой барьерный риф игра-викторина по биологии для учащихся 5-6 классов
игра-викторина по биологии для учащихся 5-6 классов Изолирующие механизмы. Видообразование
Изолирующие механизмы. Видообразование Биологическая систематика
Биологическая систематика Презентация к уроку Жгутиконосцы. Инфузории. 7 класс
Презентация к уроку Жгутиконосцы. Инфузории. 7 класс Дыхание. Внешнее дыхание
Дыхание. Внешнее дыхание