Содержание
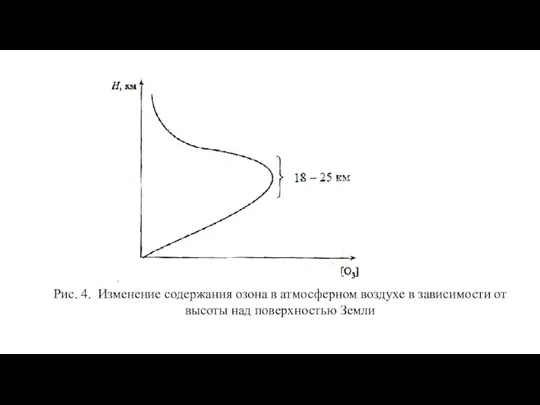
- 2. Рис. 4. Изменение содержания озона в атмосферном воздухе в зависимости от высоты над поверхностью Земли
- 3. Рис. 5. Схема вертикального распределения озона в разных широтных зонах: 1- полярная зона (13-15 км); 2
- 4. В стратосфере, на высотах менее 50 км, происходит образование озона по реакции: 2 + O(3P) →
- 5. Основной вклад в его образование гидроксильного радикала дают реакции с участием тропосферного озона, образующегося в результате
- 6. Впервые цепочку образования и распада озона предложил Сидни Чепмен (1930). Сначала под воздействием солнечной радиации происходит
- 7. Реакции азотного цикла с участием оксида азота (II): NO + O3 → NO2 + O2 O
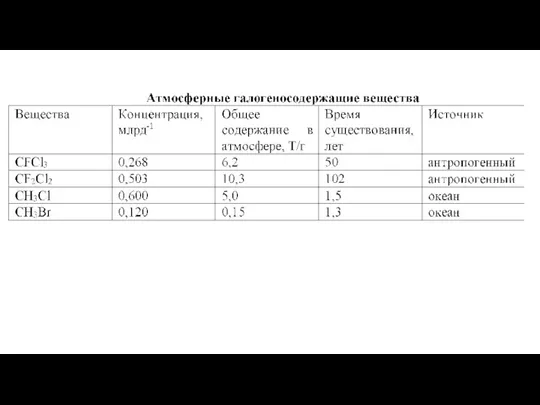
- 8. Взаимодействие хлора и метана приводит к образованию хлороводорода: Cl + CH4 → HCl + CH3 Гидроксил
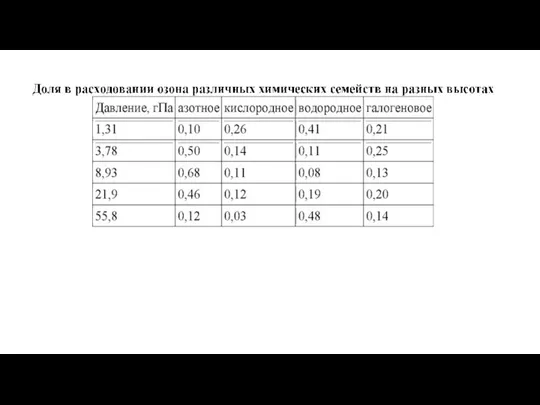
- 11. В загрязненной оксидами азота атмосфере метан вступает в сложную цепочку превращений с участием кислорода и паров
- 12. В 1990 г. Монреальский протокол был вновь пересмотрен. Страны, его подписавшие, взяли на себя следующие обязательства:
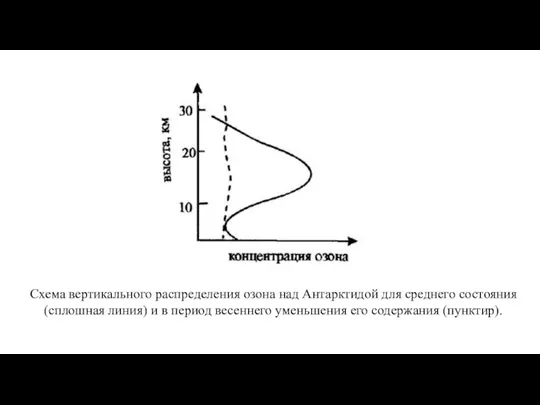
- 13. Схема вертикального распределения озона над Антарктидой для среднего состояния (сплошная линия) и в период весеннего уменьшения
- 14. Причина образования озоновой дыры над Антарктидой комплексная: увеличение поступления хлорфторуглеводородов в атмосферу (антропогенный фактор). специфика движения
- 16. Скачать презентацию









 Экология. Природопользование
Экология. Природопользование Помоги зимующим птицам
Помоги зимующим птицам Экологические проблемы России
Экологические проблемы России Адамзат үшін ядролық сынақтың салдары. Жер бетінде түрлі мутацияға ұшыраған адамдар мен жануарлардың дүниеге келуі
Адамзат үшін ядролық сынақтың салдары. Жер бетінде түрлі мутацияға ұшыраған адамдар мен жануарлардың дүниеге келуі Экологические аспекты рекреационного лесопользования. Воздействие рекреационного лесопользования на лесные экосистемы
Экологические аспекты рекреационного лесопользования. Воздействие рекреационного лесопользования на лесные экосистемы Заповедники Западной Сибири
Заповедники Западной Сибири Aceasta nu este doar catastrofa secolului, este unul din marele dezastre ale omenirii ei
Aceasta nu este doar catastrofa secolului, este unul din marele dezastre ale omenirii ei Подорож туди і назад. Заповідні території
Подорож туди і назад. Заповідні території Законодательное регулирование вторичного сырья и ресурсов. Обзор изменений природоохранного законодательства
Законодательное регулирование вторичного сырья и ресурсов. Обзор изменений природоохранного законодательства Красная книга Казахстана
Красная книга Казахстана Гигиена окружающей среды
Гигиена окружающей среды Красная книга Луганщины
Красная книга Луганщины Көгалдандыру
Көгалдандыру Қалдықсыз және аз қалдықты технологияны өндіріске енгізу принциптері
Қалдықсыз және аз қалдықты технологияны өндіріске енгізу принциптері День Земли
День Земли Экология животных как раздел науки
Экология животных как раздел науки Антропогенний вплив на природне середовище
Антропогенний вплив на природне середовище Глобальные проблемы мира. Экологическая проблема
Глобальные проблемы мира. Экологическая проблема Характеристика сред обитания
Характеристика сред обитания Химическое загрязнение акваторий. Классификация загрязняющих веществ
Химическое загрязнение акваторий. Классификация загрязняющих веществ Отчет о проведенных мероприятиях Зеленая акция. Повышение экологической культуры учащихся
Отчет о проведенных мероприятиях Зеленая акция. Повышение экологической культуры учащихся Всероссийское общество охраны природы. Годовой отчет
Всероссийское общество охраны природы. Годовой отчет Глобальные загрязнения. Факторы глобального экологического кризиса
Глобальные загрязнения. Факторы глобального экологического кризиса Красная книга Украины
Красная книга Украины ВятГУ Челлендж. Команда179. Задание №3
ВятГУ Челлендж. Команда179. Задание №3 Инновационная технология сжигания отходов
Инновационная технология сжигания отходов Исчезновение лесов – мировая проблема
Исчезновение лесов – мировая проблема Краевая экологическая акция Утилизация
Краевая экологическая акция Утилизация