Содержание
- 2. Состояния вещества Любое вещество в зависимости от условий может находиться в трех состояниях: твердом, жидком, газообразном
- 3. Свойства веществ в различных состояниях В различных состояниях вещества обладают разными свойствами.
- 4. Твердые тела Форму твёрдого тела можно изменить, но для этого необходимо приложить усилие. Твёрдое тело имеет
- 5. Жидкости В отличие от твёрдых тел жидкости легко меняют свою форму. Они принимают форму сосуда в
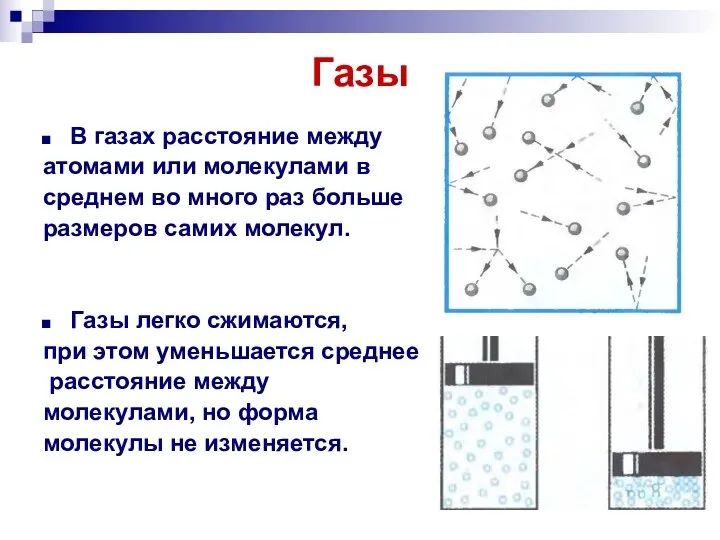
- 6. Газы Газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема.
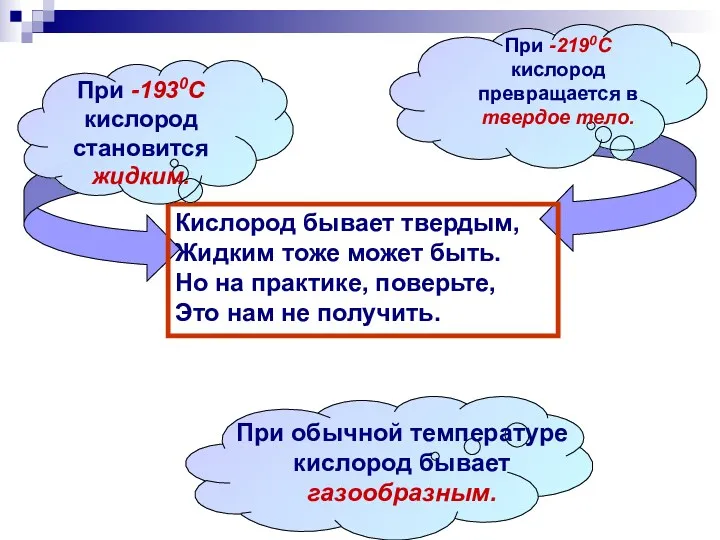
- 7. Кислород бывает твердым, Жидким тоже может быть. Но на практике, поверьте, Это нам не получить. При
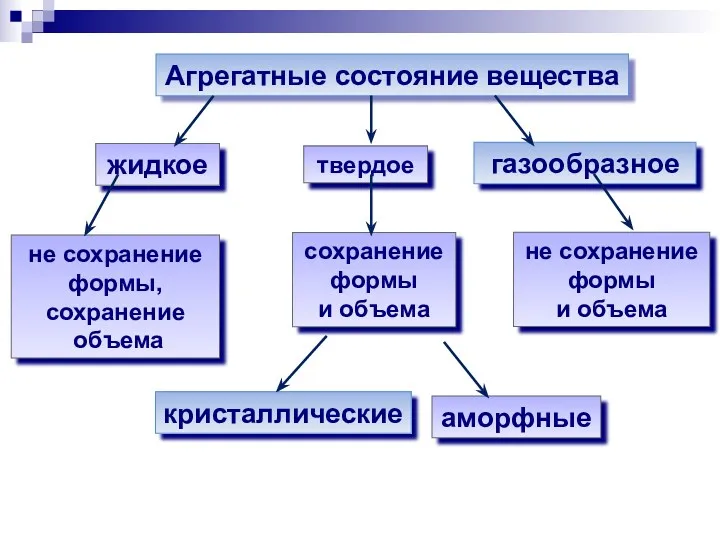
- 8. Агрегатные состояние вещества твердое жидкое газообразное сохранение формы и объема не сохранение формы, сохранение объема не
- 9. Строение твердых, жидких и газообразных тел
- 10. Свойства твердых тел объясняются тем, что молекулы расположены почти вплотную друг к другу, поэтому велико притяжение
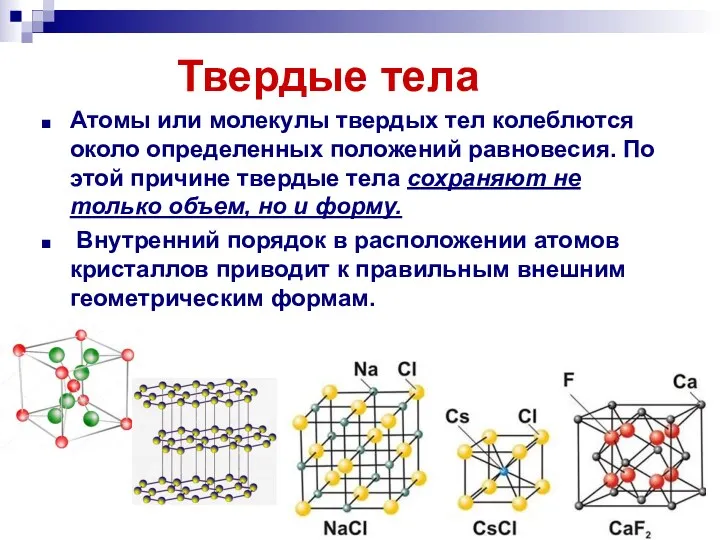
- 11. Твердые тела Атомы или молекулы твердых тел колеблются около определенных положений равновесия. По этой причине твердые
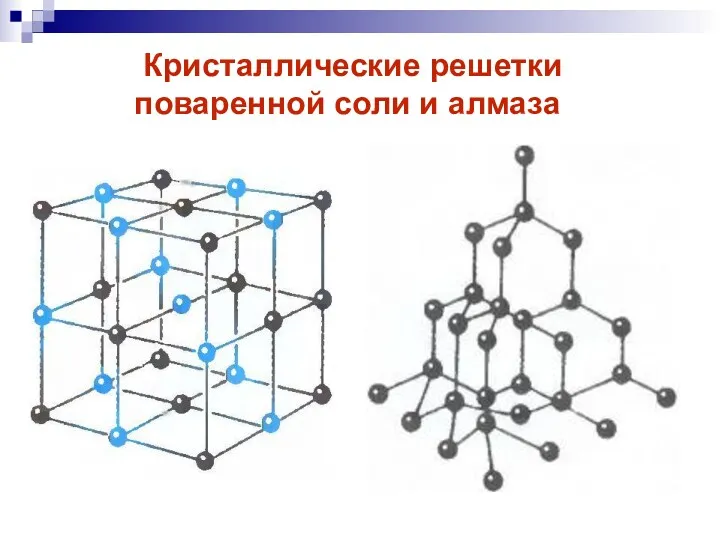
- 12. Кристаллические решетки поваренной соли и алмаза
- 13. Свойства жидкостей объясняются тем, что расстояние между молекулами жидкости меньше размеров молекул, поэтому объём постоянен, но
- 14. Жидкости Молекулы жидкости расположены почти вплотную друг к другу. Молекула колеблется около своего положения равновесия, сталкиваясь
- 15. Свойства газов объясняются тем, что расстояния между молекулами много больше самих молекул, поэтому молекулы слабо притягиваются
- 16. Газы В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих
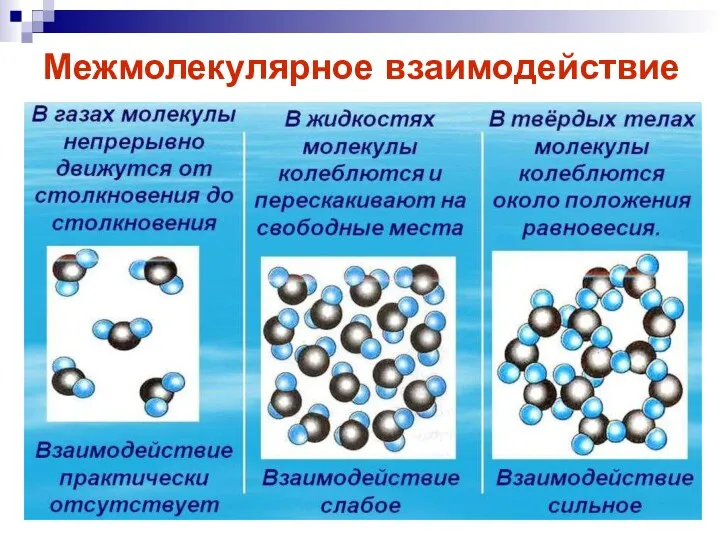
- 17. Межмолекулярное взаимодействие
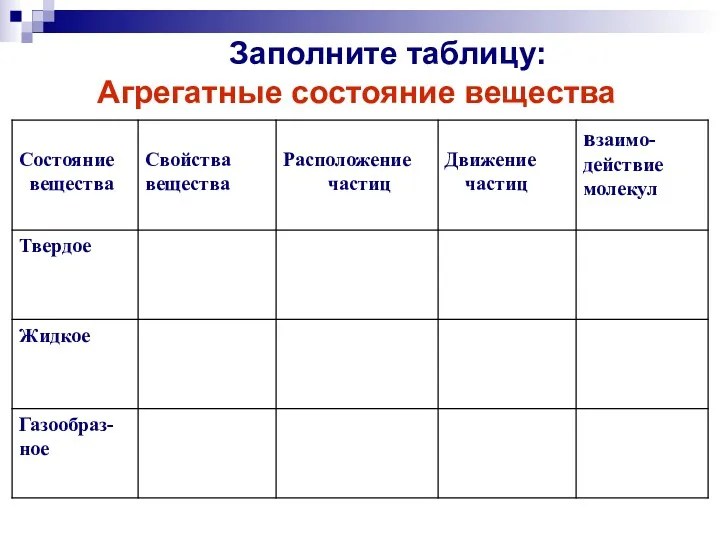
- 18. Заполните таблицу: Агрегатные состояние вещества
- 20. Скачать презентацию










 Закон Ома для полной цепи
Закон Ома для полной цепи Electric Vehicles 101
Electric Vehicles 101 PID controller Design
PID controller Design Плотность вещества
Плотность вещества Тепловое равновесие. Температура и ее измерение.
Тепловое равновесие. Температура и ее измерение. Презентация Использование Использование Excel
Презентация Использование Использование Excel Конструирование элементов ременных и цепных передач
Конструирование элементов ременных и цепных передач Интерференция света. Когерентность
Интерференция света. Когерентность Движение тел под действием силы тяжести
Движение тел под действием силы тяжести Електромагнітні хвилі
Електромагнітні хвилі Организация топливного участка на СТО
Организация топливного участка на СТО Электронные фильтры
Электронные фильтры Взаимодействие ионизирующего излучения с веществом
Взаимодействие ионизирующего излучения с веществом Архимедова сила
Архимедова сила Русские народные игры (презентация)
Русские народные игры (презентация) Готорвимся к ЕГЭ. Физика
Готорвимся к ЕГЭ. Физика Закон инерции. Первый закон Ньютона (7класс)
Закон инерции. Первый закон Ньютона (7класс) Изображения, даваемые линзой
Изображения, даваемые линзой Магнітостатичні хвилі в багатошарових структурах
Магнітостатичні хвилі в багатошарових структурах Тест по теме Магнитное поле 9 класс
Тест по теме Магнитное поле 9 класс Ремонт автомобилей. Ремонт головок цилиндров и распределительных валов. (Тема 4.6)
Ремонт автомобилей. Ремонт головок цилиндров и распределительных валов. (Тема 4.6) Требования к машинам и деталям
Требования к машинам и деталям Қозғалтқыш жалпы түсінік. Қозғалтқыштың құрылысы
Қозғалтқыш жалпы түсінік. Қозғалтқыштың құрылысы Механическая энергия. Кинетическая и потенциальная энергия. Закон сохранения энергии
Механическая энергия. Кинетическая и потенциальная энергия. Закон сохранения энергии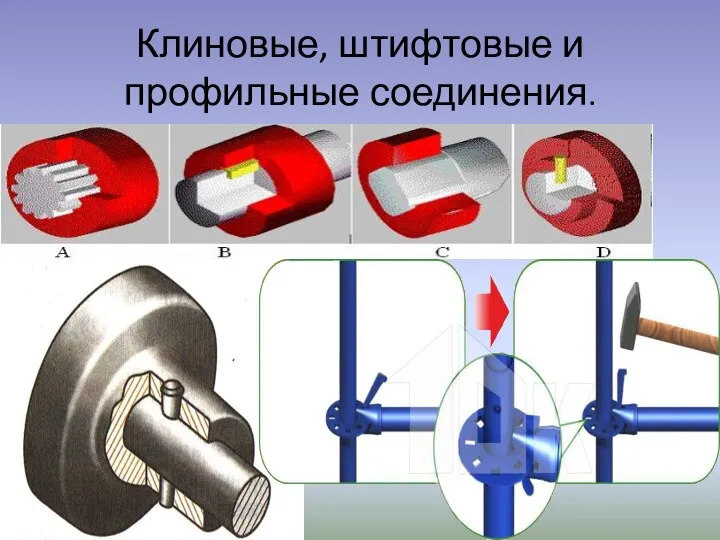 Клиновые, штифтовые и профильные соединения
Клиновые, штифтовые и профильные соединения Электрический ток в вакууме
Электрический ток в вакууме Введение в физику
Введение в физику Формула Мора. Правило Верещагина
Формула Мора. Правило Верещагина