Слайд 2

ЭКСЕРГИЯ
(греч. ex-высокая степень; ergon-работа)
- максимальная работа, которую может совершить ТД система
при переходе из данного состояния в состояние термодинамического равновесия с окружающей средой при отсутствии иных, кроме окружающей среды источников теплоты (РАБОТОСПОСОБНОСТЬ)
Слайд 3

Максимальная работа – работа равновесного цикла Карно:
Полезная работа цикла:
Полученная теплота
Отданная теплота
холодному источнику
Слайд 4

При равновесности:
Но при неравновесном процессе!!!
Потеря эксергии
Слайд 5

Обозначив:
Получим уравнение Гюи-Стодолы (1889):
Рассеивание энергии!
француз-физик
словацкий теплотехник
Слайд 6

Термодинамические процессы
обратимые
необратимые
Процессы, после совершения которых в прямом, а потом в обратном
направлении вся система тел, принимающих участие в процессе, возвращается в свое первоначальное состояние…
Слайд 7
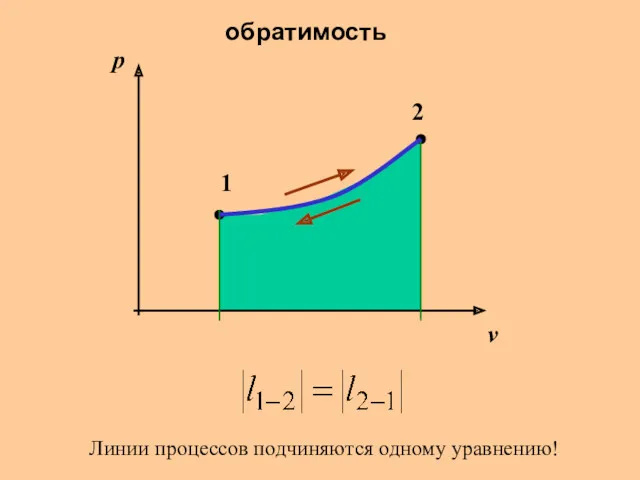
обратимость
1
2
p
v
Линии процессов подчиняются одному уравнению!
Слайд 8

Термодинамические процессы
равновесные
неравновесные
Равновесный процесс - процесс, в котором все параметры системы при
его протекании меняются достаточно медленно по сравнению с процессом релаксации.
Слайд 9

Термодинамические процессы
Введение понятия обратимых равновесных процессов
упрощает расчеты и дает возможность получить
приближенные результаты.
Слайд 10

Основные термодинамические процессы
Изохорный (v=const)
Изобарный (p=const)
Изотермический (T=const)
Адиабатный (S=const)
Политропный (n=const)
(Греч.)
«изос» - равный
«терме» -
теплота
«адиабатос» -
непроницаемый
«поли» - много
«тропос» - путь
Слайд 11

План исследования термодинамических процессов
Закономерность изменения состояния газа (уравнение процесса, графическое отображение)
q
Δu
l
Запись 1 закона ТД для процесса
Δi
Δs
Слайд 12
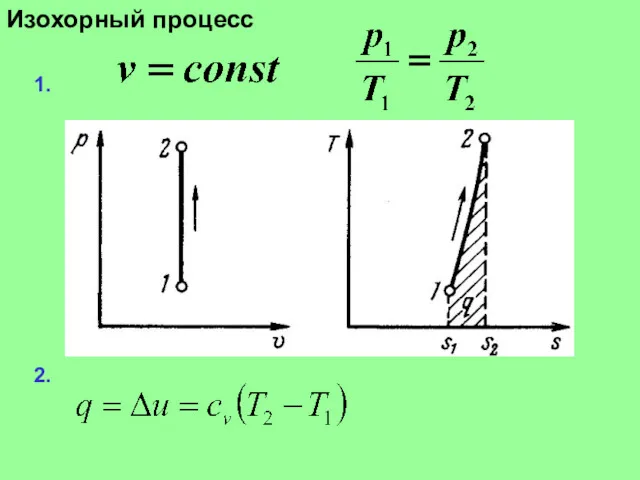
Слайд 13

Изохорный процесс
3.
4.
5.
6
7.
Слайд 14
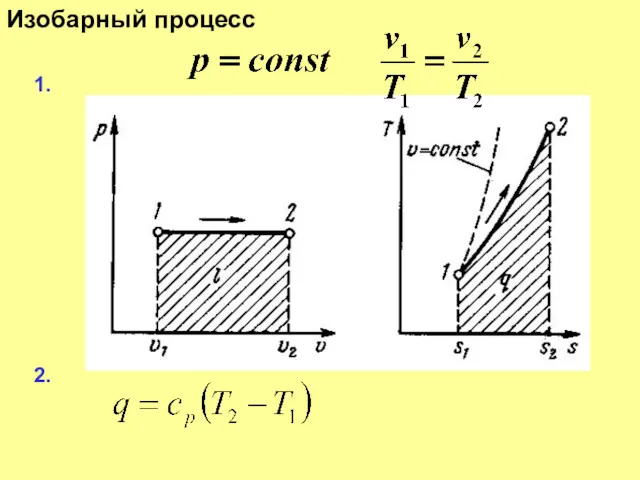
Слайд 15

Изобарный процесс
3.
4.
5.
6
7.
Слайд 16
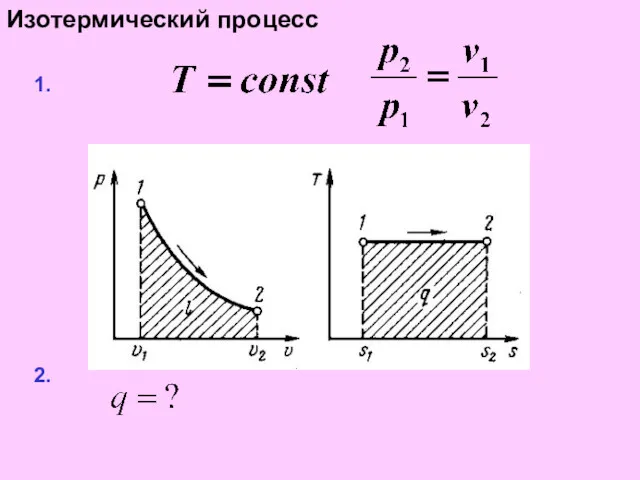
Изотермический процесс
1.
2.
Слайд 17

Изотермический процесс
3.
4.
5.
6
7.
Слайд 18
Слайд 19

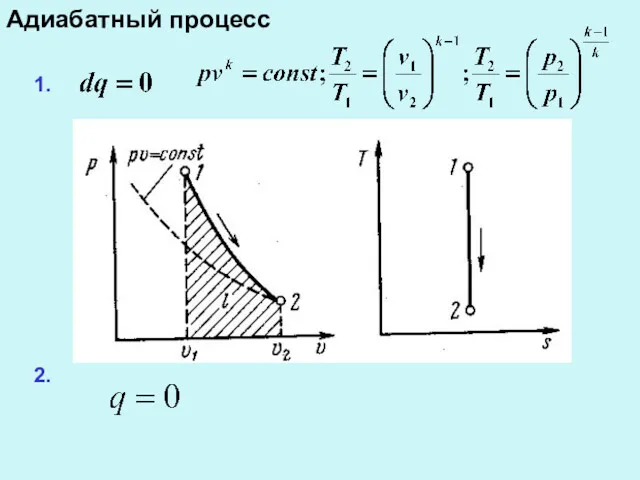
Адиабатный процесс
3.
4.
5.
6
7.
Слайд 20
Слайд 21

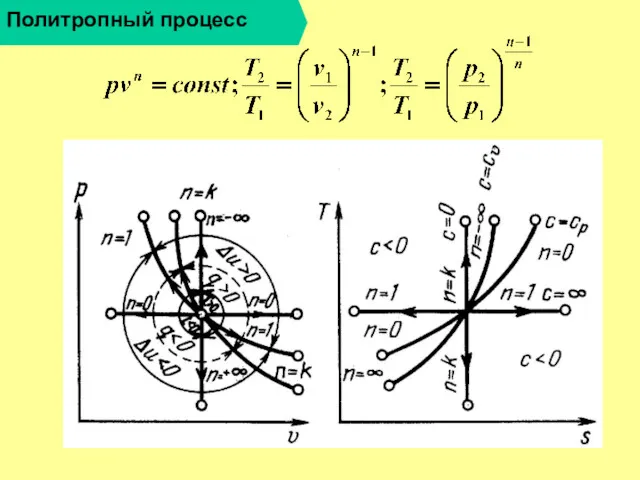
Политропный процесс
3.
4.
5.
6
7.




















 Ньютон Apple
Ньютон Apple Решение задач. Закон всемирного тяготения
Решение задач. Закон всемирного тяготения Игра Звёздный час по физике
Игра Звёздный час по физике 9 кл - Физический диктант Механические колебания
9 кл - Физический диктант Механические колебания Умови плавання тіл
Умови плавання тіл Модель малого космического аппарата, движимого солнечным парусом
Модель малого космического аппарата, движимого солнечным парусом Аккумулятор. Применение аккумуляторов в жизни
Аккумулятор. Применение аккумуляторов в жизни Центральное растяжение-сжатие
Центральное растяжение-сжатие Презентация Сила трения
Презентация Сила трения Открытый урок по физике в 7 классе Первоначальные сведения о веществе
Открытый урок по физике в 7 классе Первоначальные сведения о веществе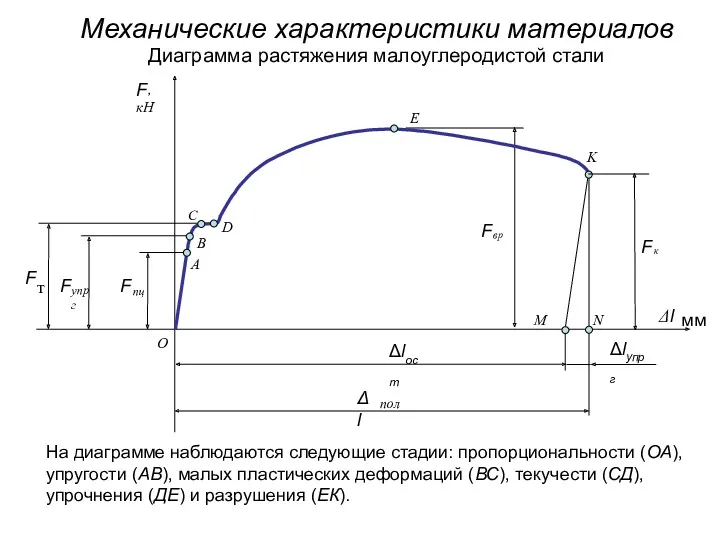 Механические характеристики материалов
Механические характеристики материалов Фотоэффект құбылысын түсіндіру. Эйнштейн формуласы. Фотоэффекет құбылысын техникада қолдану
Фотоэффект құбылысын түсіндіру. Эйнштейн формуласы. Фотоэффекет құбылысын техникада қолдану Теория механизмов и машин. Кинематический анализ механизмов
Теория механизмов и машин. Кинематический анализ механизмов Разработка установки для измерения магнитострикции
Разработка установки для измерения магнитострикции Законы Ньютона
Законы Ньютона Презентация к интегрированному уроку по теме: Кристаллические и аморфные тела
Презентация к интегрированному уроку по теме: Кристаллические и аморфные тела Bbs wheels range 1999 ilustrated catalog
Bbs wheels range 1999 ilustrated catalog Слайд презентация для урока по физике Закон Всемирного тяготения
Слайд презентация для урока по физике Закон Всемирного тяготения Магнитное поле и его графическое изображение. Неоднородное и однородное магнитное поле
Магнитное поле и его графическое изображение. Неоднородное и однородное магнитное поле Идеальный газ. Основное уравнение МКТ
Идеальный газ. Основное уравнение МКТ Устройство крышки бензобака
Устройство крышки бензобака Ионизирующие излучения
Ионизирующие излучения открытый урок тепловые машины
открытый урок тепловые машины Ремонт автомобилей. Технология восстановления деталей, узлов и приборов. (Тема 4.1)
Ремонт автомобилей. Технология восстановления деталей, узлов и приборов. (Тема 4.1) Электрическая цепь. Последовательное и параллельное соединение проводников
Электрическая цепь. Последовательное и параллельное соединение проводников Закон сохранения энергии. Адиабатический процесс
Закон сохранения энергии. Адиабатический процесс Определение поверхностного натяжения жидкостей
Определение поверхностного натяжения жидкостей Эксплуатация, диагностика и организация ремонта прокатного оборудования
Эксплуатация, диагностика и организация ремонта прокатного оборудования