Содержание
- 2. ВОПРОСЫ: Электролитическая диссоциация Электрический ток в электролитах. Электролиз Законы электролиза Применение электролиза
- 3. Электролитическая диссоциация Вопрос 1
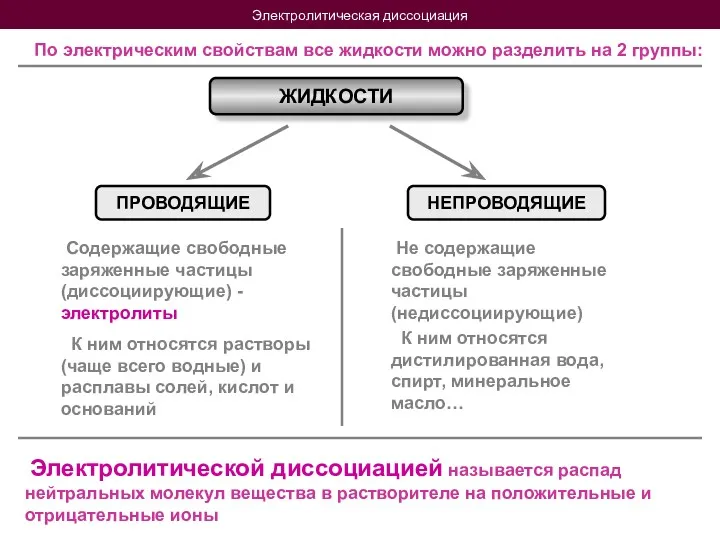
- 4. Электролитическая диссоциация По электрическим свойствам все жидкости можно разделить на 2 группы: ЖИДКОСТИ ПРОВОДЯЩИЕ НЕПРОВОДЯЩИЕ Содержащие
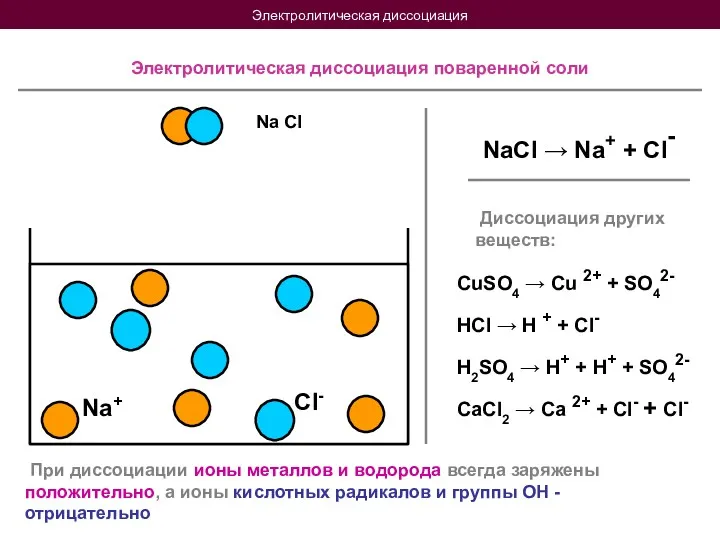
- 5. Электролитическая диссоциация Na Cl Na+ Cl- Электролитическая диссоциация поваренной соли NaCl → Na+ + Cl- Диссоциация
- 6. Электрический ток в электролитах. Электролиз Вопрос 2
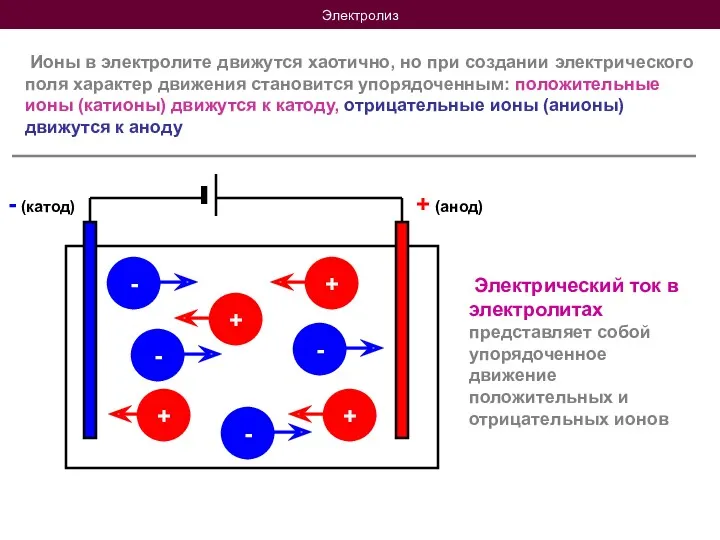
- 7. Электролиз Ионы в электролите движутся хаотично, но при создании электрического поля характер движения становится упорядоченным: положительные
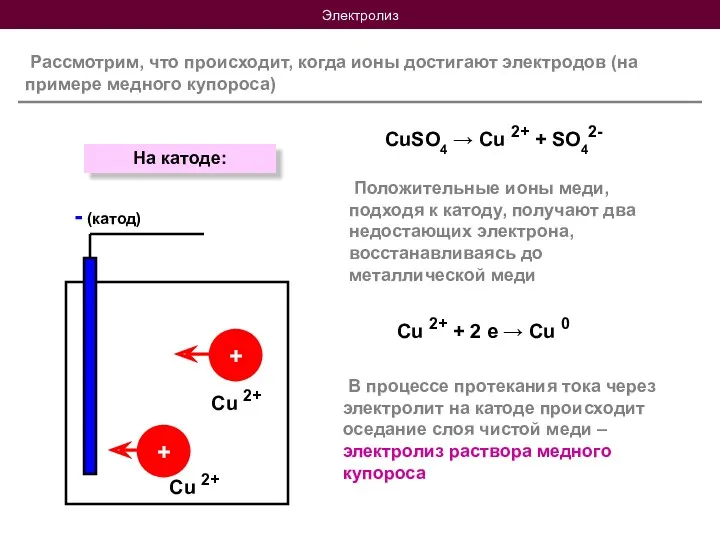
- 8. Электролиз Рассмотрим, что происходит, когда ионы достигают электродов (на примере медного купороса) CuSO4 → Cu 2+
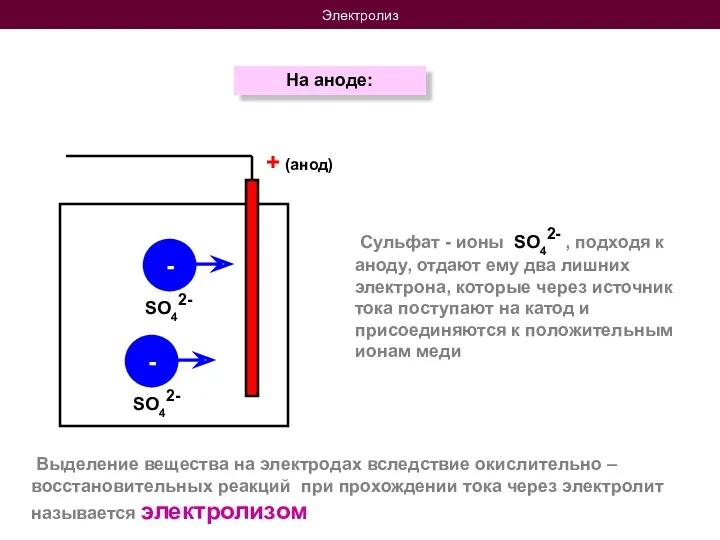
- 9. Электролиз На аноде: + (анод) - - Выделение вещества на электродах вследствие окислительно – восстановительных реакций
- 10. Законы электролиза Вопрос 3
- 11. Законы электролиза Исследовал электролиз и открыл его законы английский физик Майкл Фарадей в 1834 году Майкл
- 12. Законы электролиза Второй закон электролиза При одинаковом количестве электричества (электрическом заряде, прошедшем через электролит) масса вещества,
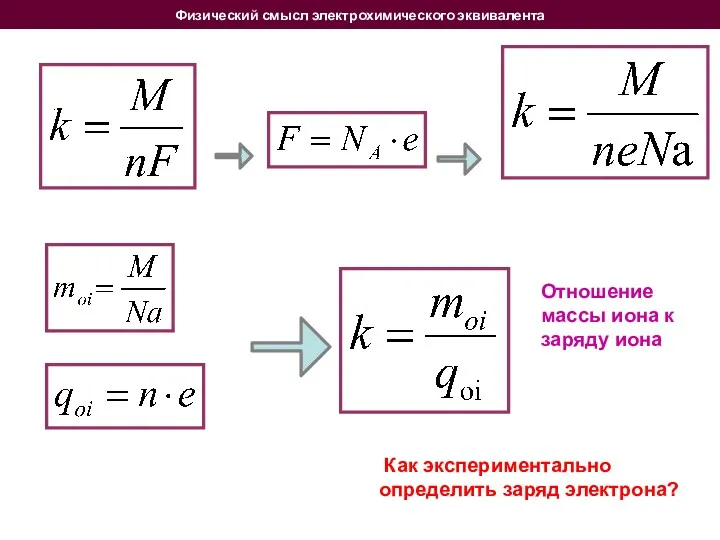
- 13. Физический смысл электрохимического эквивалента Как экспериментально определить заряд электрона? Отношение массы иона к заряду иона
- 14. Заряд электрона 1874 г
- 15. Зависимость сопротивления электролита от температуры Температурная зависимость сопротивления электролита объясняется в основном изменением удельного сопротивления. ,где
- 16. Применение электролиза Вопрос 4
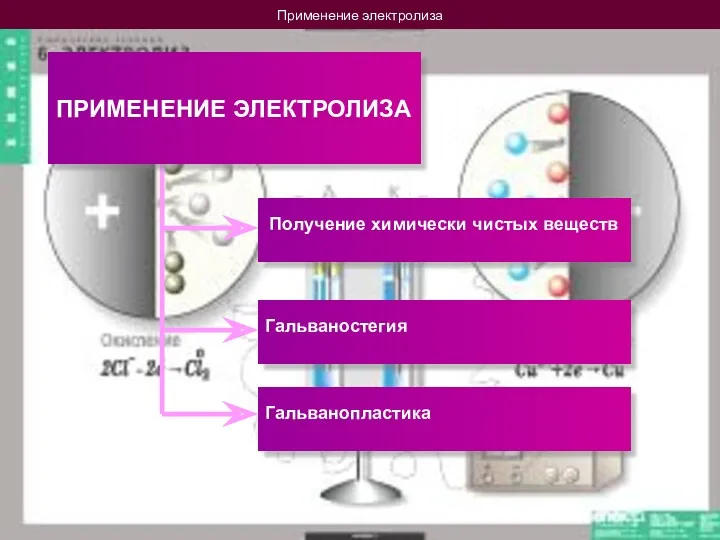
- 17. Применение электролиза ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА Получение химически чистых веществ Гальваностегия Гальванопластика
- 18. Применение электролиза Основателем гальванотехники и ее широчайшего применения является Б. С. Якоби, который изобрел в 1836
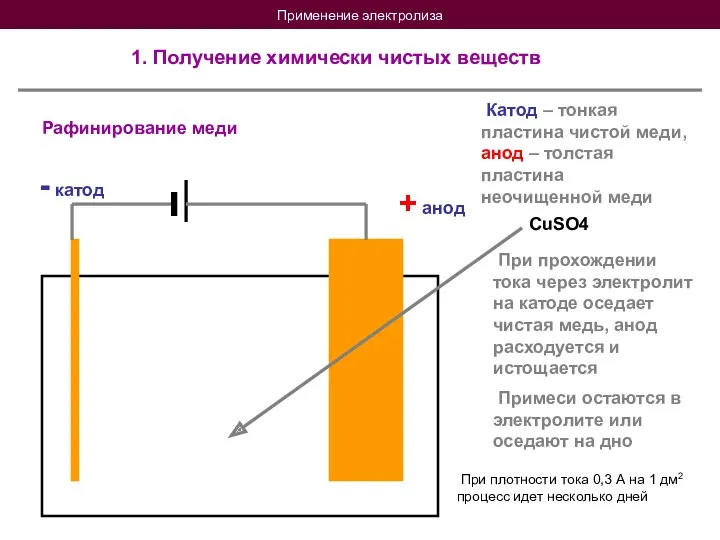
- 19. Применение электролиза 1. Получение химически чистых веществ Рафинирование меди + анод - катод Катод – тонкая
- 20. Применение электролиза 1. Получение химически чистых веществ Получение алюминия Алюминий получают электролитическим способом из глинозема (вспомните
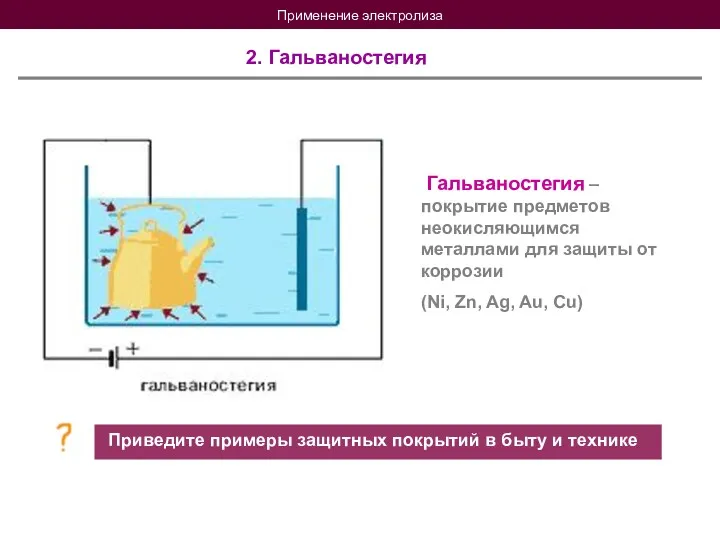
- 21. Применение электролиза 2. Гальваностегия Гальваностегия – покрытие предметов неокисляющимся металлами для защиты от коррозии (Ni, Zn,
- 22. Применение электролиза 3. Гальванопластика Копия барельефа, полученная методом гальванопластики Гальванопластика – получение отслаиваемых копий предмета, полученных
- 23. Применение электролиза Кроме указанных выше, электролиз нашел применение и в других областях: получение оксидных защитных пленок
- 25. Скачать презентацию













 Проектирование фрагментов учебного занятия с использованием ЦОР на уроках физики
Проектирование фрагментов учебного занятия с использованием ЦОР на уроках физики Синергетика. Предмет, методы и школы синергетики
Синергетика. Предмет, методы и школы синергетики Строительная механика энергетических установок
Строительная механика энергетических установок Разработка урока физики по теме Магнитное поле и его свойства 9 класс
Разработка урока физики по теме Магнитное поле и его свойства 9 класс Теплоизмерительные приборы
Теплоизмерительные приборы Деформация и механические свойства материалов
Деформация и механические свойства материалов Постоянный электрический ток
Постоянный электрический ток Плотность. Решение задач
Плотность. Решение задач Внедрение ФГОС общего образования второго поколения по физике
Внедрение ФГОС общего образования второго поколения по физике Особливості функціонування лінійних та нелінійних кіл. Зворотні зв'язки в електричних колах
Особливості функціонування лінійних та нелінійних кіл. Зворотні зв'язки в електричних колах Презентация Законы Ньютона
Презентация Законы Ньютона 090ee86581854a8e900ae9f90b8772bc
090ee86581854a8e900ae9f90b8772bc Цепи постоянного тока
Цепи постоянного тока Проектная деятельность, как важнейший фактор деятельностной педагогики
Проектная деятельность, как важнейший фактор деятельностной педагогики Атом ядросының модельдерінің түрлерІ
Атом ядросының модельдерінің түрлерІ Турнир юных физиков среди учащихся 7 класса
Турнир юных физиков среди учащихся 7 класса Internal combustion engine
Internal combustion engine решение задач на давление в жидкости
решение задач на давление в жидкости Физические свойства горных пород
Физические свойства горных пород Плавание судов. Воздухоплавание
Плавание судов. Воздухоплавание Техническое обслуживание и ремонт автомобильного транспорта
Техническое обслуживание и ремонт автомобильного транспорта Презентация игры Любите ли вы физику?
Презентация игры Любите ли вы физику? Кинематика. Лекция 1-1
Кинематика. Лекция 1-1 Тепловые процессы. Теплообменники. Нагрев острым паром
Тепловые процессы. Теплообменники. Нагрев острым паром Муфты. Механические муфты. Лекция № 16. Тема 6
Муфты. Механические муфты. Лекция № 16. Тема 6 Изготовление столярного соединения УС-1
Изготовление столярного соединения УС-1 Поверхностное натяжение жидкости. Смачивание, капиллярные явления
Поверхностное натяжение жидкости. Смачивание, капиллярные явления Развитие технологии полупроводников. Методы исследования и контроля наноструктур
Развитие технологии полупроводников. Методы исследования и контроля наноструктур