Содержание
- 2. Электролитическая диссоциация
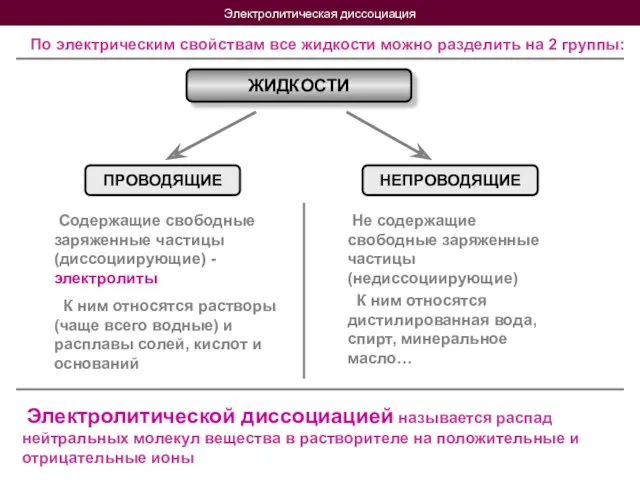
- 3. Электролитическая диссоциация По электрическим свойствам все жидкости можно разделить на 2 группы: ЖИДКОСТИ ПРОВОДЯЩИЕ НЕПРОВОДЯЩИЕ Содержащие
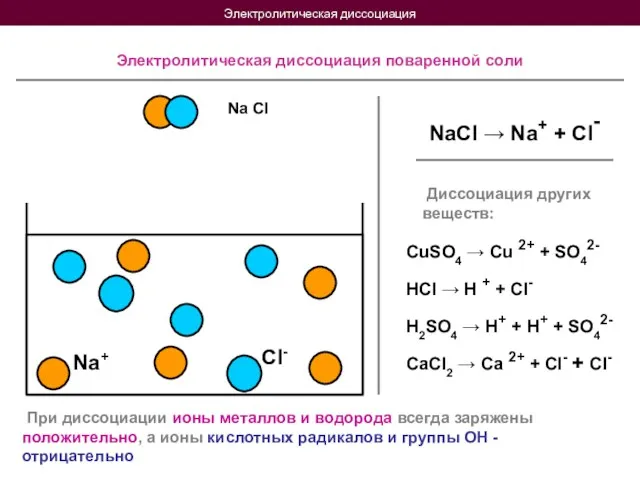
- 4. Электролитическая диссоциация Na Cl Na+ Cl- Электролитическая диссоциация поваренной соли NaCl → Na+ + Cl- Диссоциация
- 5. Электрический ток в электролитах. Электролиз
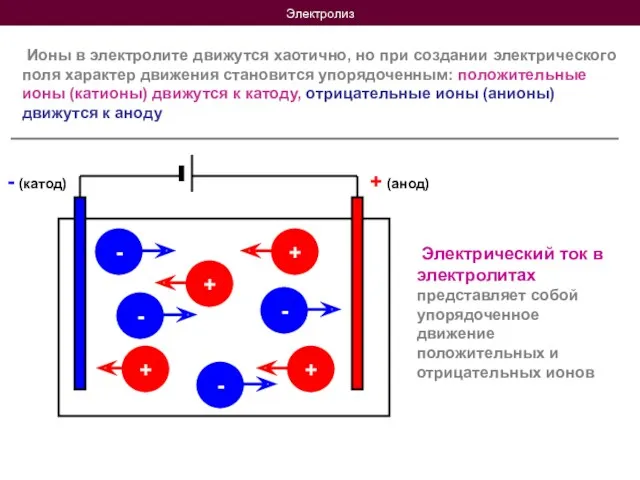
- 6. Электролиз Ионы в электролите движутся хаотично, но при создании электрического поля характер движения становится упорядоченным: положительные
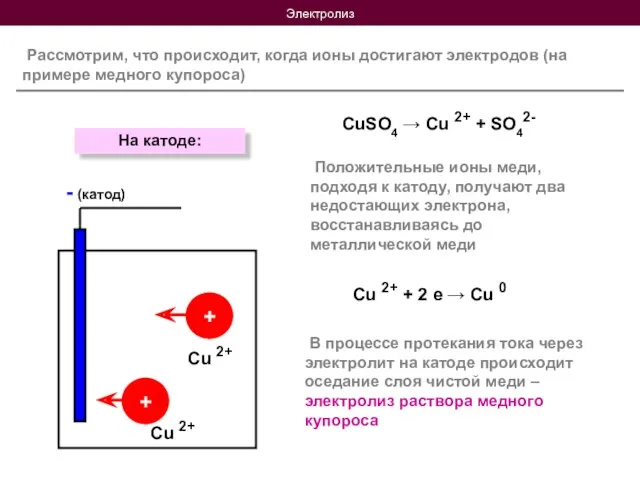
- 7. Электролиз Рассмотрим, что происходит, когда ионы достигают электродов (на примере медного купороса) CuSO4 → Cu 2+
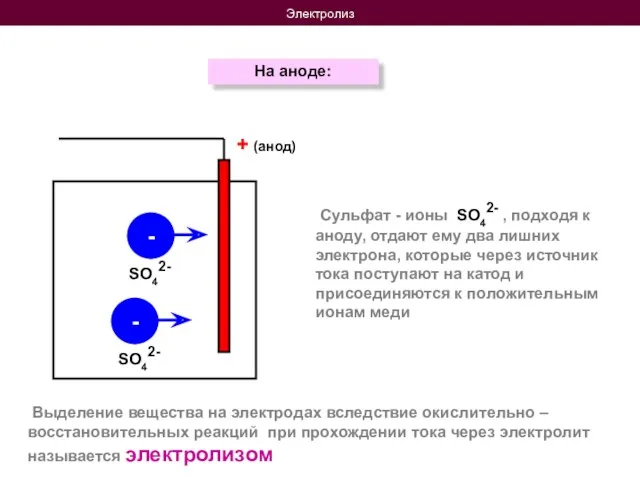
- 8. Электролиз На аноде: + (анод) - - Выделение вещества на электродах вследствие окислительно – восстановительных реакций
- 9. Законы электролиза
- 10. Законы электролиза Исследовал электролиз и открыл его законы английский физик Майкл Фарадей в 1834 году Майкл
- 11. Законы электролиза Второй закон электролиза При одинаковом количестве электричества (электрическом заряде, прошедшем через электролит) масса вещества,
- 12. Зависимость сопротивления электролита от температуры Температурная зависимость сопротивления электролита объясняется в основном изменением удельного сопротивления. ,где
- 13. Применение электролиза
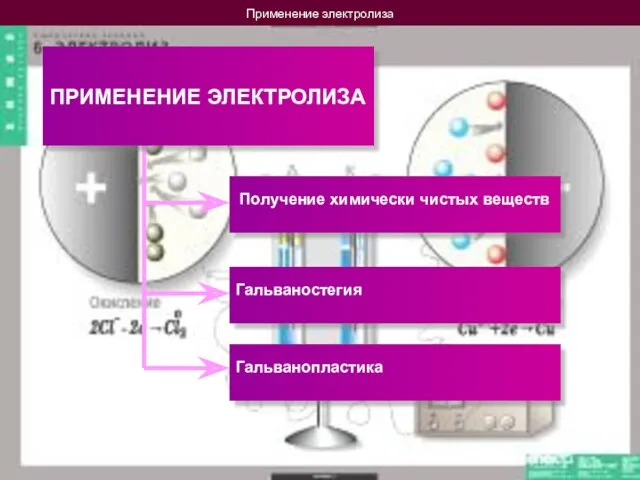
- 14. Применение электролиза ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА Получение химически чистых веществ Гальваностегия Гальванопластика
- 15. Применение электролиза Основателем гальванотехники и ее широчайшего применения является Б. С. Якоби, который изобрел в 1836
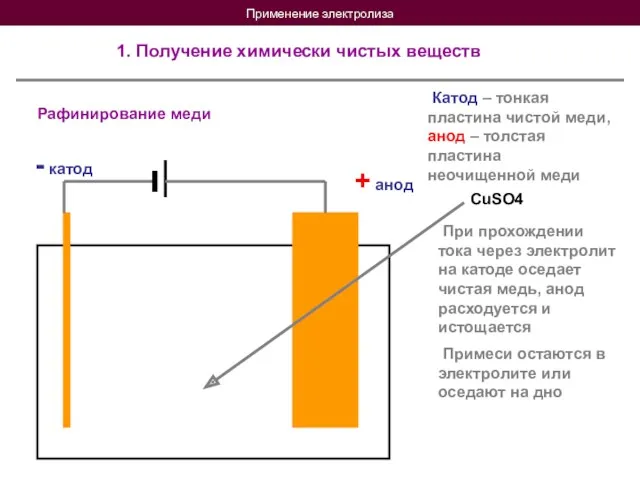
- 16. Применение электролиза 1. Получение химически чистых веществ Рафинирование меди + анод - катод Катод – тонкая
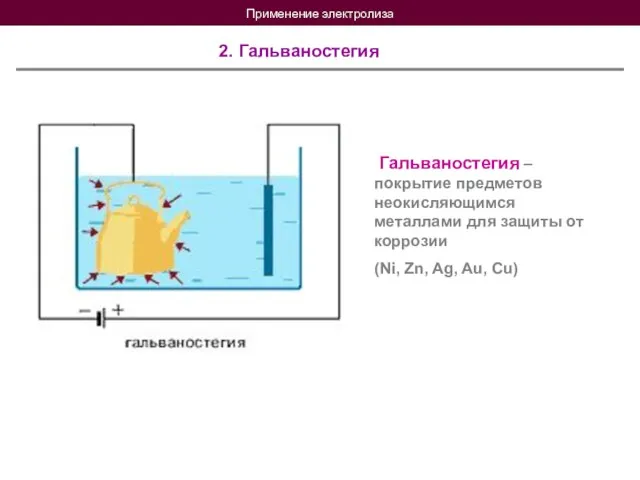
- 17. Применение электролиза 2. Гальваностегия Гальваностегия – покрытие предметов неокисляющимся металлами для защиты от коррозии (Ni, Zn,
- 18. Применение электролиза 2. Гальваностегия
- 19. Применение электролиза 3. Гальванопластика Копия барельефа, полученная методом гальванопластики Гальванопластика – получение отслаиваемых копий предмета, полученных
- 21. Скачать презентацию










 Оптические явления в природе
Оптические явления в природе Методика решения задач. Конденсаторы в цепи постоянного тока.
Методика решения задач. Конденсаторы в цепи постоянного тока. Сборка модели электролизера для получения водорода
Сборка модели электролизера для получения водорода Полупроводниковые материалы (лекци 7)
Полупроводниковые материалы (лекци 7) Деление ядер урана. Цепная реакция. 9 класс
Деление ядер урана. Цепная реакция. 9 класс Расчет статически неопределимых систем по допускаемым нагрузкам
Расчет статически неопределимых систем по допускаемым нагрузкам Вечный двигатель
Вечный двигатель Парадоксы времени. Путешествия во времени
Парадоксы времени. Путешествия во времени We are trying to make an overview of all developed sensors
We are trying to make an overview of all developed sensors Техническая информация по коммерческим автомобилям NRW 2019. Двигатели
Техническая информация по коммерческим автомобилям NRW 2019. Двигатели Ионизирующее излучение
Ионизирующее излучение Основные понятия нанотехнологий. Оборудование
Основные понятия нанотехнологий. Оборудование Формирование коммуникативных универсальных действий на уроках физики
Формирование коммуникативных универсальных действий на уроках физики Принципы и законы механики
Принципы и законы механики Законы постоянного тока
Законы постоянного тока Расчёт отдельных участков контура циркуляции воды
Расчёт отдельных участков контура циркуляции воды Альфа-распад
Альфа-распад Основные свойства атомных ядер
Основные свойства атомных ядер Эффект Доплера
Эффект Доплера Создание источника тока А.Вольта
Создание источника тока А.Вольта Электромагнитные волны. основные понятия
Электромагнитные волны. основные понятия Тема урока: повторение и обобщение знаний по теме Давление
Тема урока: повторение и обобщение знаний по теме Давление Подвеска в автомобиле. Типы подвесок
Подвеска в автомобиле. Типы подвесок презентация 8класс Лабораторная работа №1 Сравнение количеств теплоты при смешивании воды разной температуры
презентация 8класс Лабораторная работа №1 Сравнение количеств теплоты при смешивании воды разной температуры Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Разработка урока по теме: Деление ядер урана. Цепная ядерная реакция. Термоядерные реакции.
Разработка урока по теме: Деление ядер урана. Цепная ядерная реакция. Термоядерные реакции. Презентация к внеклассному занятию-игра по физике для 8 класса Физический бой.
Презентация к внеклассному занятию-игра по физике для 8 класса Физический бой.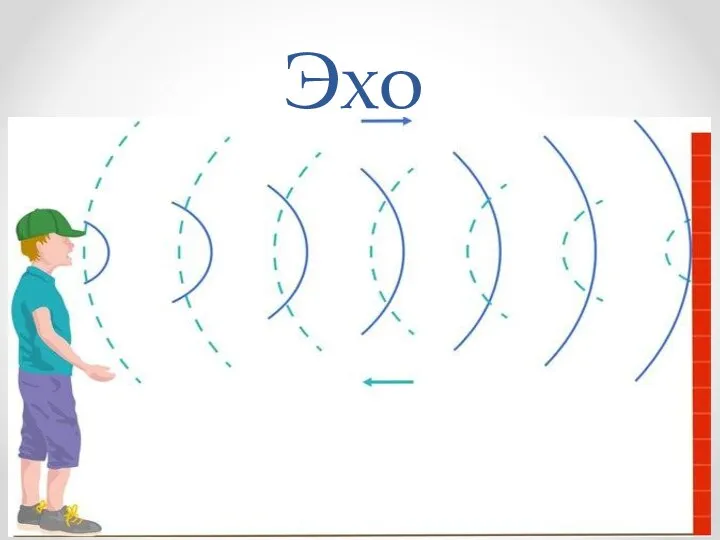 Эхо. Световое эхо
Эхо. Световое эхо