Содержание
- 2. Преимущества ЭХ методов Высокая чувствительность (пределы определения до 10-9 г), воспроизводимость, возможностью автоматизации измерений, доступность измерительных
- 3. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ потенциометрические методы (измерение напряжения между электродами), полярография (измерение силы тока в процессе электролиза), кондуктометрия
- 4. Сущность потенциометрического метода. Типы электродов Уравнение Нернста Электрод сравнения хлорсеребряный: 1 - серебряная проволока 1 -
- 5. серебряный, ртутный, и водородный электроды Е = 0,059 lg аH+, откуда Е = -0,059paH+ (или -0,059
- 6. Стеклянный электрод: Водород, растворенный в металле, образует с катионами Н+ окислительно-восстановительную систему: 1 – стеклянная мембрана
- 7. Потенциометрическое титрование точка стехиометричности устанавливается по изменению потенциала индикаторного электрода, обусловленному изменением концентрации одного из реагирующих
- 8. Схема потенциометрической установки для определения ионов натрия в анализируемом растворе 1 - полый шарик из электродного
- 9. Кулонометрия q/nF = т/М, (4) где q - количество электричества, (А·с) (вычисляется по произведению силы тока
- 10. прямая кулонометрия Если исследуемый компонент восстанавливается на катоде, выбирается потенциал на 0,05-0,2В отрицательнее, чем потенциал полуволны.
- 11. ПОЛЯРОГРАФИЯ Рисунок 6.1 - Схема полярографической установки: I - гальванический элемент; II - приспособление для поляризации
- 12. Основы полярографического метода анализа Eа - Eк = U, где Еа и Ек - потенциалы анода
- 13. Общая характеристика полярографической волны Восстановление Сd2+ происходит в несколько стадий: 1) диффузия ионов к поверхности электрода;
- 15. Скачать презентацию






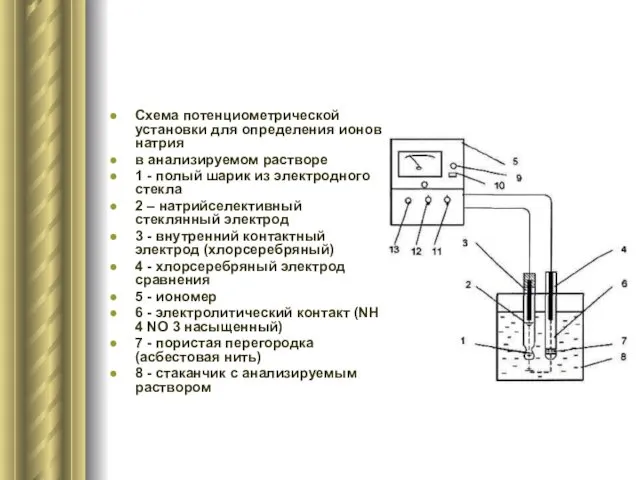


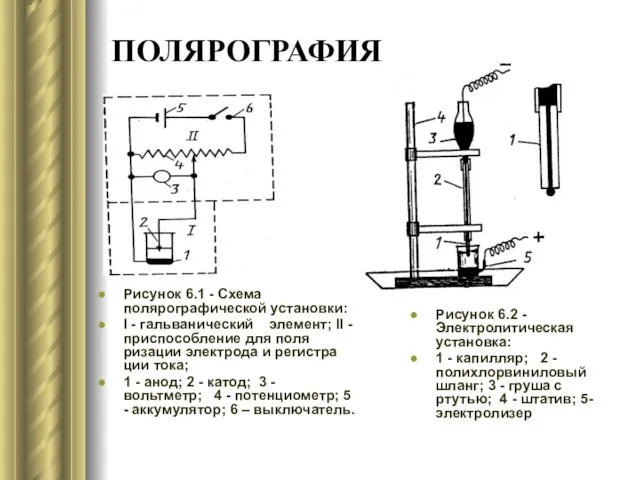

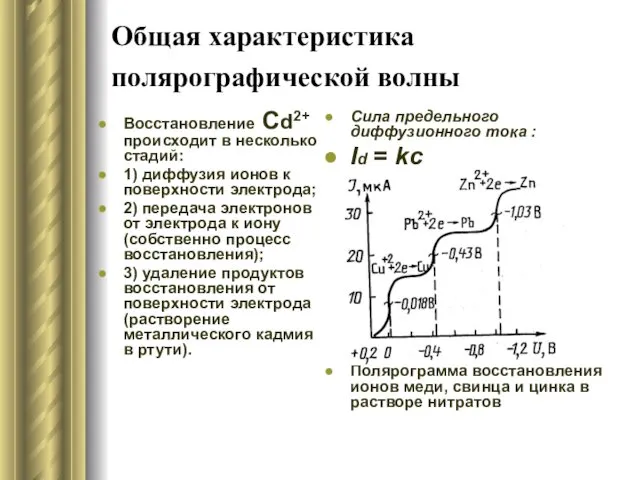
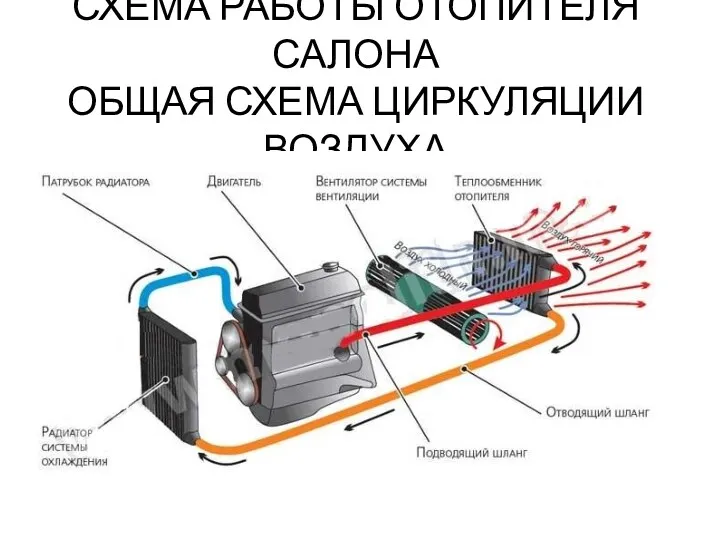 Схема работы отопителя салона автомобиля
Схема работы отопителя салона автомобиля Второе и третье начала термодинамики циклические процессы. Лекция № 13
Второе и третье начала термодинамики циклические процессы. Лекция № 13 Оптико-визуальный метод контроля
Оптико-визуальный метод контроля Основные положения общей теории относительности
Основные положения общей теории относительности Средства для измерения, контроля давления и температуры
Средства для измерения, контроля давления и температуры Проектирование деревообрабатывающего оборудования и инструмента
Проектирование деревообрабатывающего оборудования и инструмента Лекция Баллистическое движение 10 класс
Лекция Баллистическое движение 10 класс През.ЮА.МС11-21
През.ЮА.МС11-21 Урок.Высота, тембр, громкость.
Урок.Высота, тембр, громкость. It’s as an Invention
It’s as an Invention Internal Combustion engine
Internal Combustion engine Механизация и автоматизация в строительстве. (Тема 1.1)
Механизация и автоматизация в строительстве. (Тема 1.1) Динамика
Динамика Средства конвективного нагрева
Средства конвективного нагрева Нахождение механической силы через силу и перемещение
Нахождение механической силы через силу и перемещение Английский язык в механике
Английский язык в механике Техническая эксплуатация машинно-транспортного парка
Техническая эксплуатация машинно-транспортного парка Гидравлические машины. Продолжение. Центробежные насосы. Часть 2. Лекция 12
Гидравлические машины. Продолжение. Центробежные насосы. Часть 2. Лекция 12 Детали машин и основы конструирования. Механические передачи. Фрикционные передачи. (Лекция 5)
Детали машин и основы конструирования. Механические передачи. Фрикционные передачи. (Лекция 5) Ядерные реакторы
Ядерные реакторы Поверхностное натяжение и поверхностная энергия жидкостей
Поверхностное натяжение и поверхностная энергия жидкостей Выемочные машины и оборудование. Проходческие и очистные комбайны ( Практическое задание 2 )
Выемочные машины и оборудование. Проходческие и очистные комбайны ( Практическое задание 2 ) Магнитное поле. Индукция магнитного поля. Закон Био-Савара-Лапласа. Принцип суперпозиции
Магнитное поле. Индукция магнитного поля. Закон Био-Савара-Лапласа. Принцип суперпозиции Домалау мойынтіректері
Домалау мойынтіректері Испарение и конденсация
Испарение и конденсация Коливання
Коливання Механическая работа. Что мы понимаем под словом работа?
Механическая работа. Что мы понимаем под словом работа? Энергия топлива. Удельная теплота сгорания
Энергия топлива. Удельная теплота сгорания