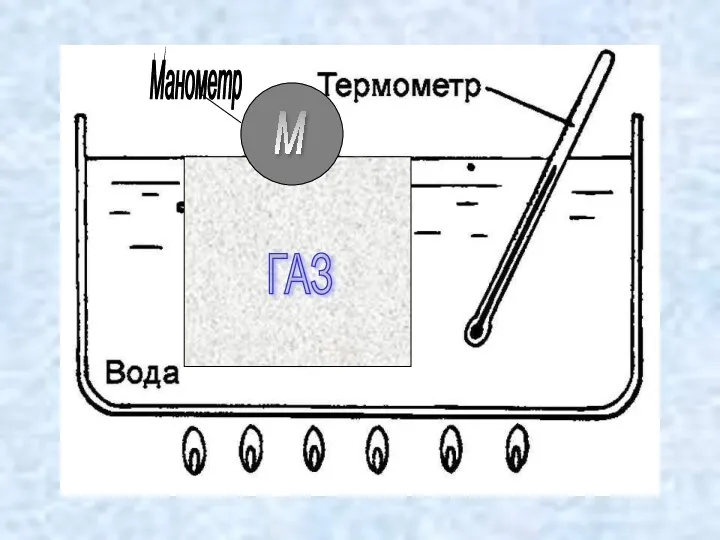
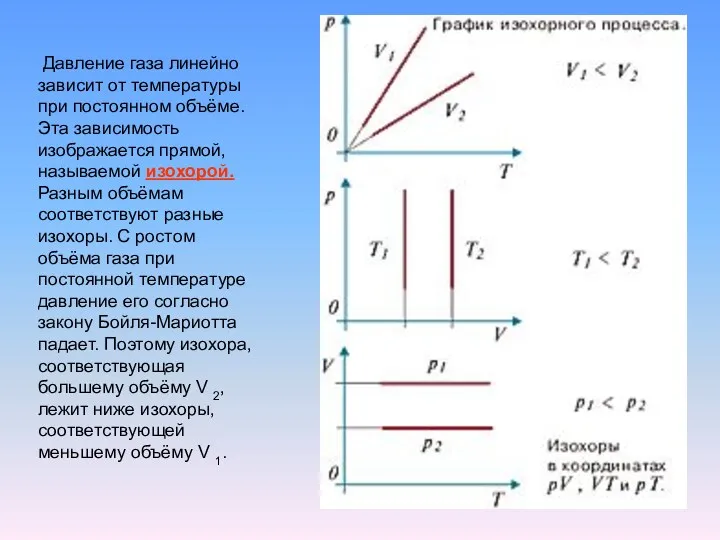
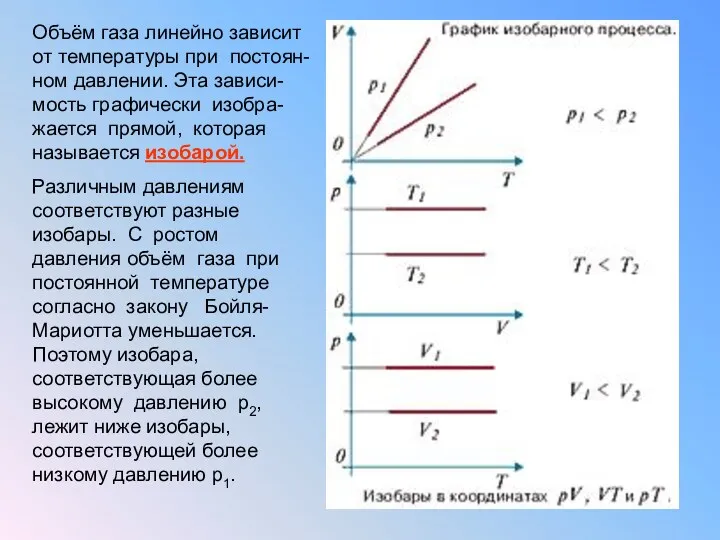
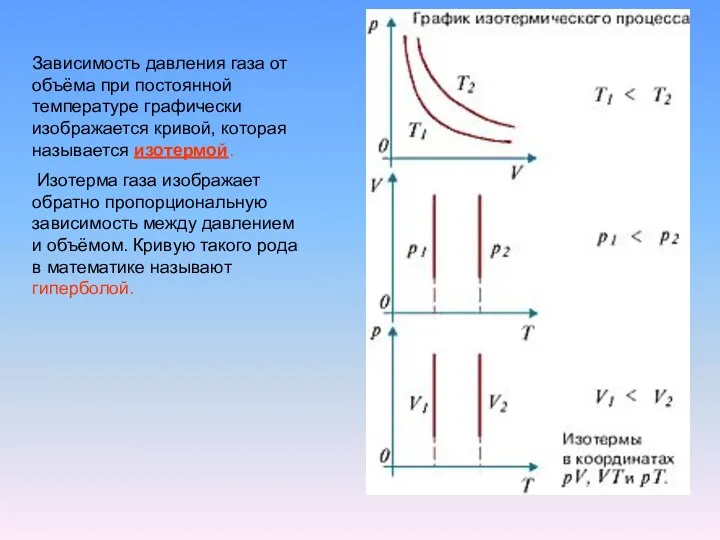
Экспериментально было доказано, что при постоянном давлении объём данной массы газа
линейно зависит от температуры.
Эта зависимость была открыта в 1802 году французским физиком Жозефом Гей-Люссаком и получила название закона Гей-Люссака.
Жозе́ф Луи́ Гей-Люссак— французскийфранцузский химикфранцузский химик и физикфранцузский химик и физик, член Французской Академии наукфранцузский химик и физик, член Французской Академии наук (1806французский химик и физик, член Французской Академии наук (1806). С 1809 годафранцузский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школефранцузский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школе и профессор физики в Сорбоннефранцузский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школе и профессор физики в Сорбонне (Париж), с 1832 годафранцузский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школе и профессор физики в Сорбонне (Париж), с 1832 года профессор химии в Парижском ботаническом саду. В 1831французский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школе и профессор физики в Сорбонне (Париж), с 1832 года профессор химии в Парижском ботаническом саду. В 1831—1839французский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школе и профессор физики в Сорбонне (Париж), с 1832 года профессор химии в Парижском ботаническом саду. В 1831—1839 гг. член палаты депутатов, где выступал только по научным и техническим вопросам. Иностранный почётный член Петербургской Академии наукфранцузский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школе и профессор физики в Сорбонне (Париж), с 1832 года профессор химии в Парижском ботаническом саду. В 1831—1839 гг. член палаты депутатов, где выступал только по научным и техническим вопросам. Иностранный почётный член Петербургской Академии наук (1826французский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школе и профессор физики в Сорбонне (Париж), с 1832 года профессор химии в Парижском ботаническом саду. В 1831—1839 гг. член палаты депутатов, где выступал только по научным и техническим вопросам. Иностранный почётный член Петербургской Академии наук (1826). Его имя внесено в список величайших учёных Франциифранцузский химик и физик, член Французской Академии наук (1806). С 1809 года профессор химии в Политехнической школе и профессор физики в Сорбонне (Париж), с 1832 года профессор химии в Парижском ботаническом саду. В 1831—1839 гг. член палаты депутатов, где выступал только по научным и техническим вопросам. Иностранный почётный член Петербургской Академии наук (1826). Его имя внесено в список величайших учёных Франции, помещённый на первом этаже Эйфелевой башни.













 Распределители с закрытым центром. Описание функционирования
Распределители с закрытым центром. Описание функционирования Углеродные волокна
Углеродные волокна Силы в природе
Силы в природе Inertial Measurement Unit (IMU) Блок инерциальных измерений. IMU, KECS, KCMF, KQS
Inertial Measurement Unit (IMU) Блок инерциальных измерений. IMU, KECS, KCMF, KQS Своя игра по физике
Своя игра по физике Обобщающий урок в 8 классе по теме Электрические явления
Обобщающий урок в 8 классе по теме Электрические явления Рекуррентные оптимальные алгоритмы фильтрации случайных процессов. Фильтр Калмана-Бьюси
Рекуррентные оптимальные алгоритмы фильтрации случайных процессов. Фильтр Калмана-Бьюси Fibrous proteins and their functions. Membrane proteins and their functions
Fibrous proteins and their functions. Membrane proteins and their functions Трёхфазные электрические цепи синусоидального тока. (Лекция 3)
Трёхфазные электрические цепи синусоидального тока. (Лекция 3) Формирование и первичная обработка видеосигналов
Формирование и первичная обработка видеосигналов Адсорбция на твердых телах
Адсорбция на твердых телах Tucson (NX 4). Зависание клапана CVVT
Tucson (NX 4). Зависание клапана CVVT Спектральные приборы и измерения в лазерной физике. Лекция 4
Спектральные приборы и измерения в лазерной физике. Лекция 4 Meranie elektromagnetického poľa v okolí počítačových monitorov
Meranie elektromagnetického poľa v okolí počítačových monitorov Дефектоскопия. Основные виды дефектоскопий
Дефектоскопия. Основные виды дефектоскопий Робота і потужність електричного струму
Робота і потужність електричного струму Презентация соблюдение техники безопасности в кабинете физики.
Презентация соблюдение техники безопасности в кабинете физики. Электромагнитные волны
Электромагнитные волны Главные схемы электрических соединений электроустановок. (Лекция 11)
Главные схемы электрических соединений электроустановок. (Лекция 11) Хроника космической эры
Хроника космической эры Молекулярная физика
Молекулярная физика Законы фотоэффекта. Квантовые свойства вещества и света
Законы фотоэффекта. Квантовые свойства вещества и света Урок - викторина Что? Где? Когда? для 11 класса по теме Оптические явления
Урок - викторина Что? Где? Когда? для 11 класса по теме Оптические явления Техническое обслуживание и ремонт тормозной системы трактора
Техническое обслуживание и ремонт тормозной системы трактора Магнитное поле, свойства поля
Магнитное поле, свойства поля Рентгеновские лучи
Рентгеновские лучи Физико–химические свойства нефти, нефтепродуктов. Качество нефти и нефтепродуктов. Методы их анализа
Физико–химические свойства нефти, нефтепродуктов. Качество нефти и нефтепродуктов. Методы их анализа Виды электрических схем и их компонентов
Виды электрических схем и их компонентов