Содержание
- 2. Правила отбора для электронных переходов 1. Запрет по спину. Запрещены переходы, происходящие с изменением спина электрона.
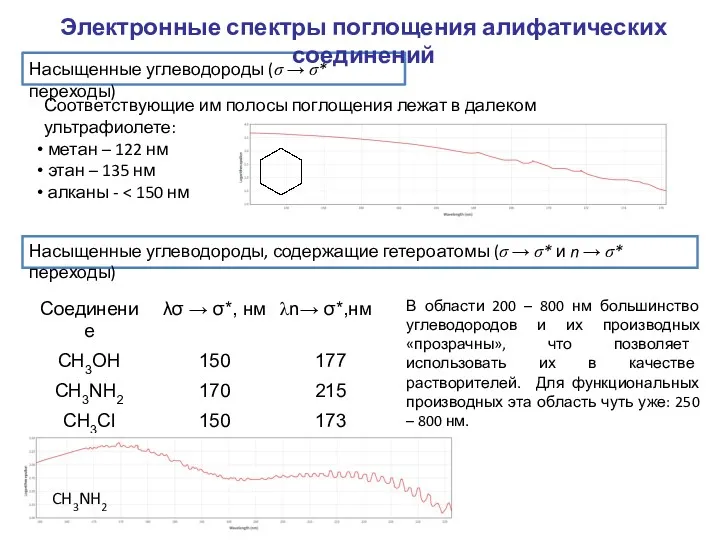
- 3. Насыщенные углеводороды (σ → σ* переходы) Соответствующие им полосы поглощения лежат в далеком ультрафиолете: метан –
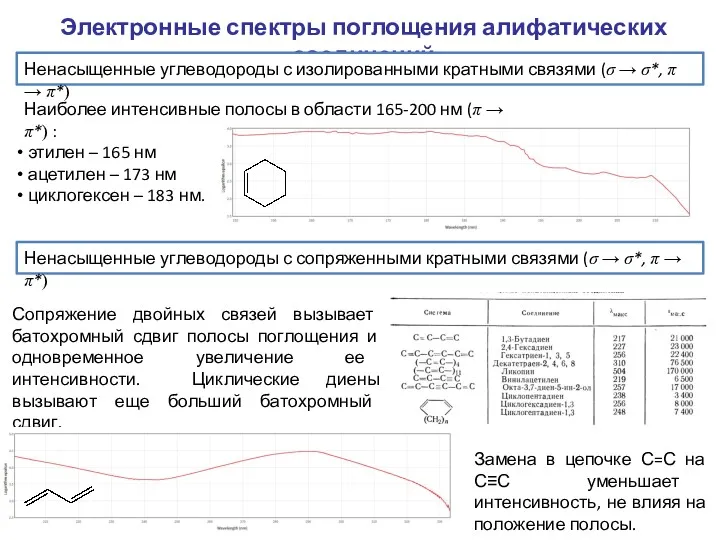
- 4. Электронные спектры поглощения алифатических соединений Ненасыщенные углеводороды с изолированными кратными связями (σ → σ*, π →
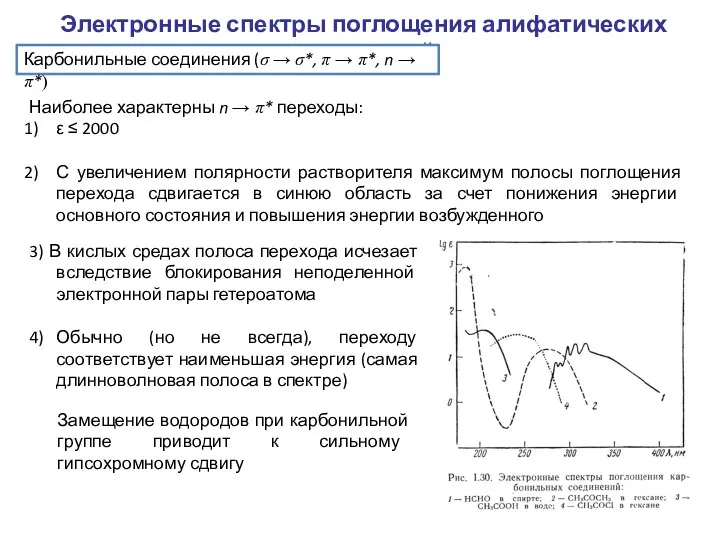
- 5. Электронные спектры поглощения алифатических соединений Карбонильные соединения (σ → σ*, π → π*, n → π*)
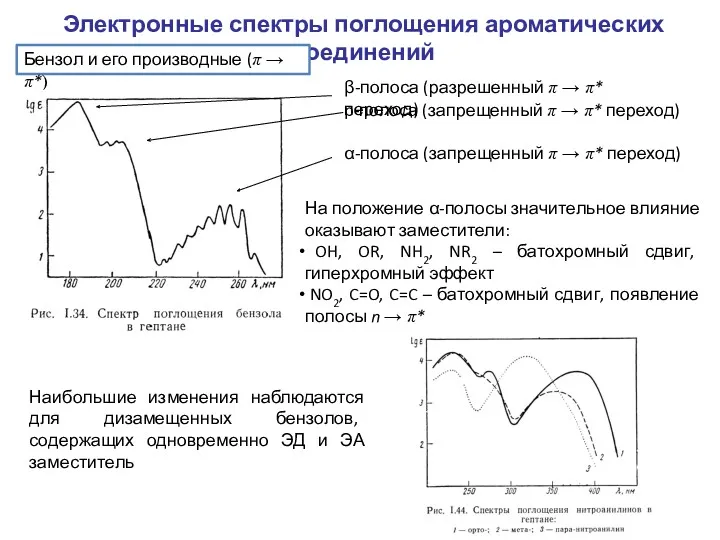
- 6. Электронные спектры поглощения ароматических соединений Бензол и его производные (π → π*) β-полоса (разрешенный π →
- 7. Электронные спектры поглощения ароматических соединений Конденсированные ароматические соединения (π → π*) Линейные (ацены) Ангулярные (фены) p-Полоса
- 8. Электронные спектры поглощения ароматических соединений Влияние геометрии
- 9. Электронные спектры поглощения координационных соединений
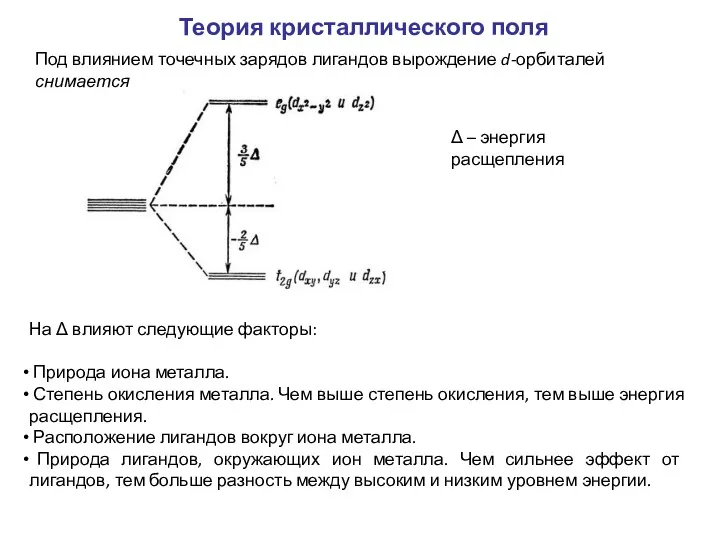
- 10. Теория кристаллического поля Под влиянием точечных зарядов лигандов вырождение d-орбиталей снимается Δ – энергия расщепления На
- 11. Зависимость Δ: Заряд ядра Степень окисления I- H2O Δ Спектрохимический ряд лигандов
- 12. Комплексы с переносом заряда Молекулы-доноры и молекулы-акцепторы электронов могут образовывать межмолекулярные донорно-акцепторные комплексы (комплексы с переносом
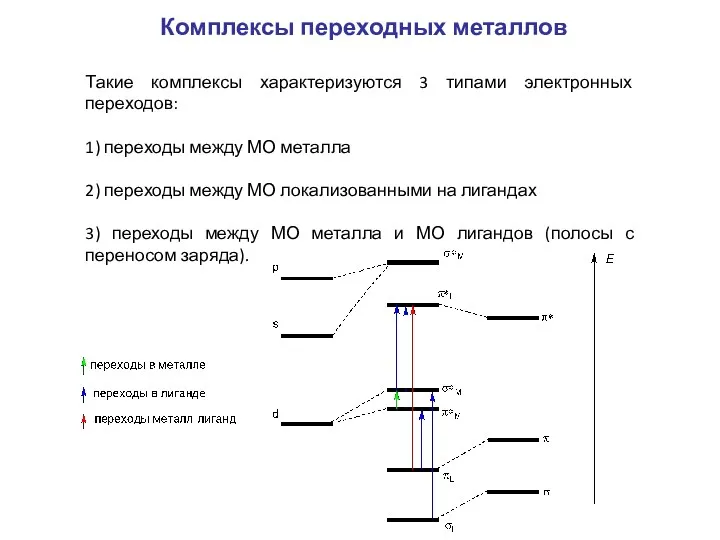
- 13. Комплексы переходных металлов Такие комплексы характеризуются 3 типами электронных переходов: 1) переходы между МО металла 2)
- 14. Применение УФ-спектроскопии
- 15. Определение концентрации, констант равновесия Важно: в интервале возможных концентраций поглощение должно подчиняться закону Бугера-Ламберта-Бэра. Для смеси
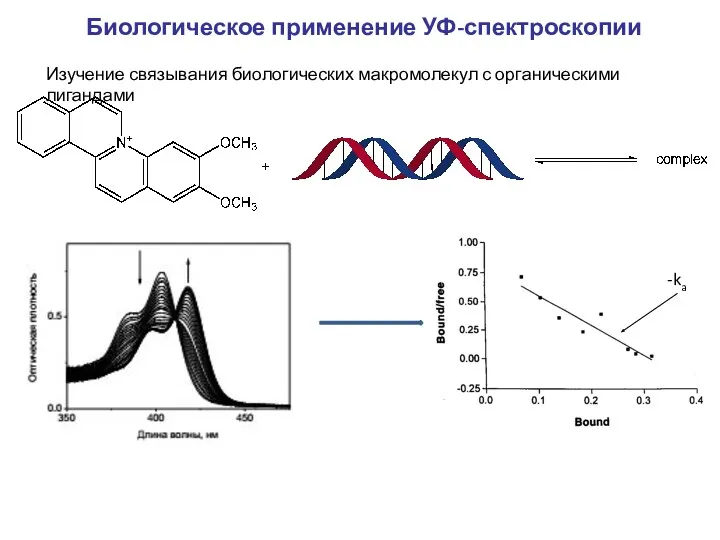
- 16. Биологическое применение УФ-спектроскопии Изучение связывания биологических макромолекул с органическими лигандами -ka
- 17. Эмиссионные спектры Эмиссионный спектр (излучения или испускания) – обратный спектру поглощения. Для атомов в газах и
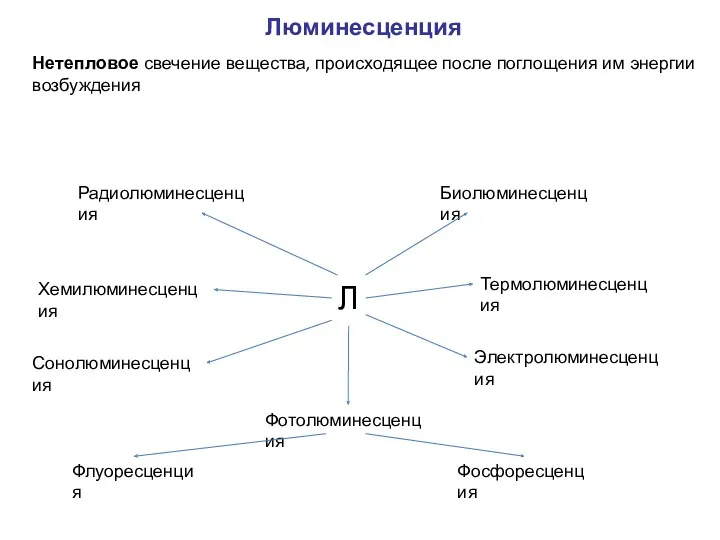
- 18. Люминесценция Л Фотолюминесценция Хемилюминесценция Сонолюминесценция Радиолюминесценция Биолюминесценция Термолюминесценция Электролюминесценция Фосфоресценция Флуоресценция Нетепловое свечение вещества, происходящее после
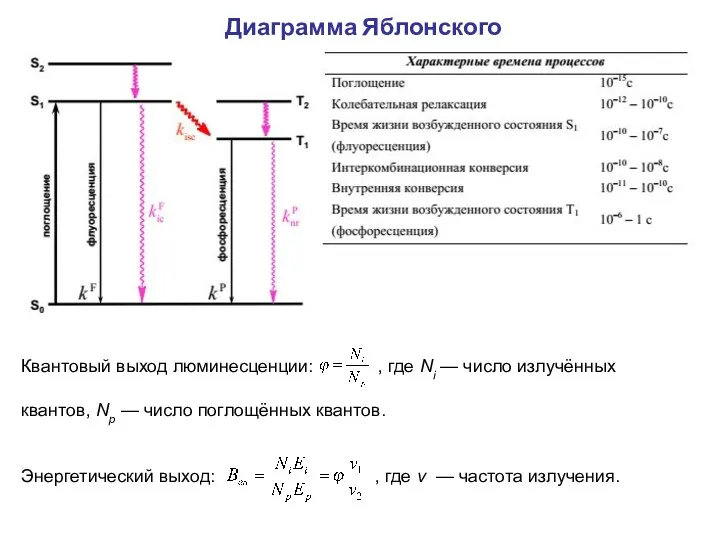
- 19. Диаграмма Яблонского Квантовый выход люминесценции: , где Ni — число излучённых квантов, Np — число поглощённых
- 20. Основные закономерности люминесценции В общем случае, вид спектров люминесценции не зависит от длины волны возбуждающего света,
- 21. Тушение люминесценции M* + Q «продукты»
- 23. Скачать презентацию











 Физика горных пород. Жидкости и газы в горных породах
Физика горных пород. Жидкости и газы в горных породах Количество теплоты. Внутренняя энергия тела
Количество теплоты. Внутренняя энергия тела Презентация по физике для 9 класса
Презентация по физике для 9 класса Сила тяжести. Явление тяготения - презентация к уроку для 8 класса коррекционной школы для детей с ОВЗ
Сила тяжести. Явление тяготения - презентация к уроку для 8 класса коррекционной школы для детей с ОВЗ Интеграция школьного курса физики с дисциплинами гуманитарного цикла
Интеграция школьного курса физики с дисциплинами гуманитарного цикла Система питания дизельного двигателя внутреннего сгорания. (Тема 10.2)
Система питания дизельного двигателя внутреннего сгорания. (Тема 10.2) Кернеу мен потенциалды өлшейтін құралдар
Кернеу мен потенциалды өлшейтін құралдар конспект урока - игры по теме Тепловые явления
конспект урока - игры по теме Тепловые явления Механика. Подготовка к контрольной работе
Механика. Подготовка к контрольной работе Свисты-волны ОНЧ диапазона (1-30 кГц) в магнитосфере
Свисты-волны ОНЧ диапазона (1-30 кГц) в магнитосфере Магнітне поле постійного струму
Магнітне поле постійного струму Вихретоковый неразрушающий контроль
Вихретоковый неразрушающий контроль Особенности распространения радиоволн коротковолнового диапазона
Особенности распространения радиоволн коротковолнового диапазона Гирдромеханические передачи
Гирдромеханические передачи Измерение коэффициента трения скольжения
Измерение коэффициента трения скольжения Работа, мощность, энергия
Работа, мощность, энергия Гидродинамика - это раздел гидравлики, изучающий закономерности движущихся жидкостей (потоков жидкостей)
Гидродинамика - это раздел гидравлики, изучающий закономерности движущихся жидкостей (потоков жидкостей) Современный урок физики в аспекте реализации ФГОС
Современный урок физики в аспекте реализации ФГОС Контрольная работа по теме Механическое движение. Взаимодействие тел
Контрольная работа по теме Механическое движение. Взаимодействие тел Буфера в лифтах
Буфера в лифтах Второй и третий законы Ньютона
Второй и третий законы Ньютона Оптические приборы
Оптические приборы Жидкое агрегатное состояние вещества
Жидкое агрегатное состояние вещества Моделирование физических процессов
Моделирование физических процессов Технологический процесс изготовления детали валик
Технологический процесс изготовления детали валик Презентация к уроку: Удивительный мир кристаллов
Презентация к уроку: Удивительный мир кристаллов Оптичні прилади, та їх застосування
Оптичні прилади, та їх застосування Такты работы ДВС
Такты работы ДВС