Содержание
- 2. АГРЕРАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА. Ежедневно мы наблюдаем как вещество переходит из одного состояния в другое: высыхают лужи
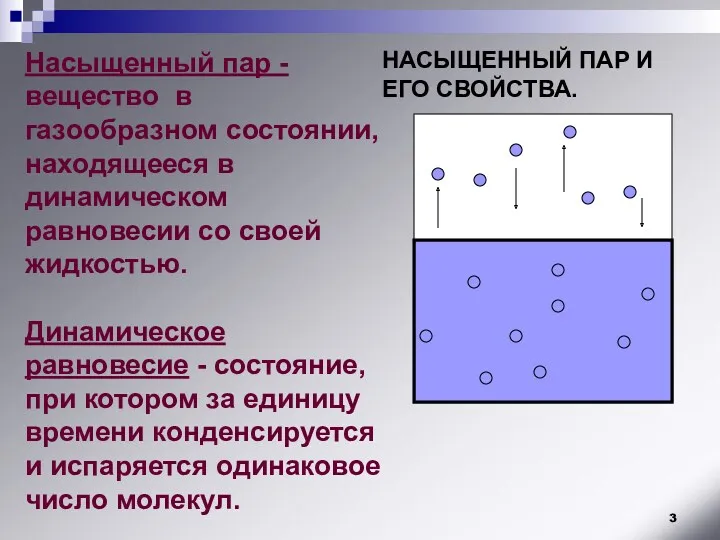
- 3. НАСЫЩЕННЫЙ ПАР И ЕГО СВОЙСТВА. Насыщенный пар - вещество в газообразном состоянии, находящееся в динамическом равновесии
- 4. СВОЙСТВА НАСЫЩЕННОГО ПАРА Давление насыщенного пара при Т = сопst не зависит от V - при
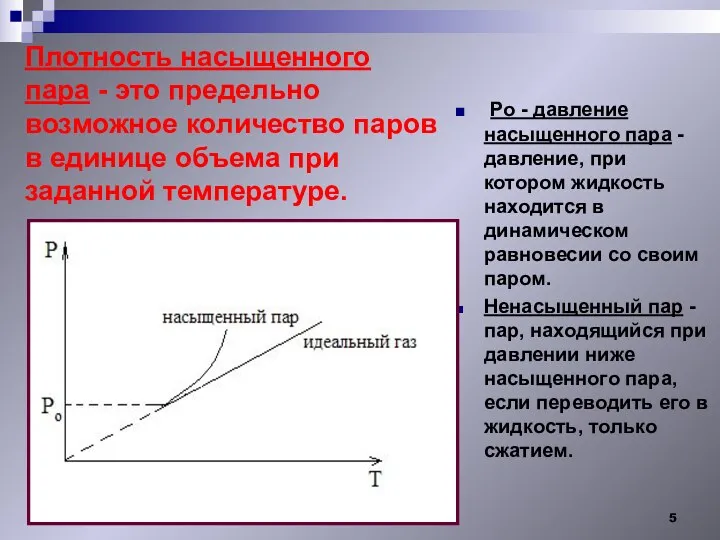
- 5. Плотность насыщенного пара - это предельно возможное количество паров в единице объема при заданной температуре. Ро
- 6. ВЛАЖНОСТЬ ВОЗДУХА. Влажность воздуха- величина, характеризующая наличие водяных паров в атмосфере Земли. Ра - парциальное давление
- 7. Относительная влажность - отношение парциального давления Ра водяного пара, содержащегося в воздухе при данной температуре к
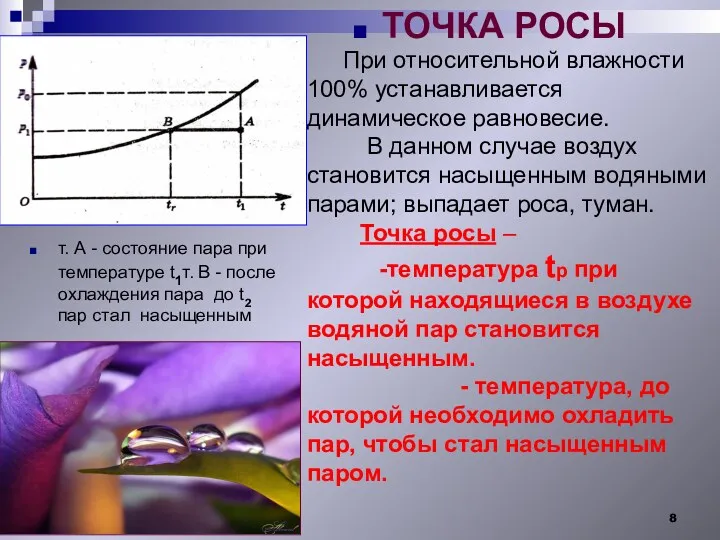
- 8. При относительной влажности 100% устанавливается динамическое равновесие. В данном случае воздух становится насыщенным водяными парами; выпадает
- 9. Приборы для определения влажности воздуха: Психрометр ("психро" - холод с греческого языка). - состоит из двух
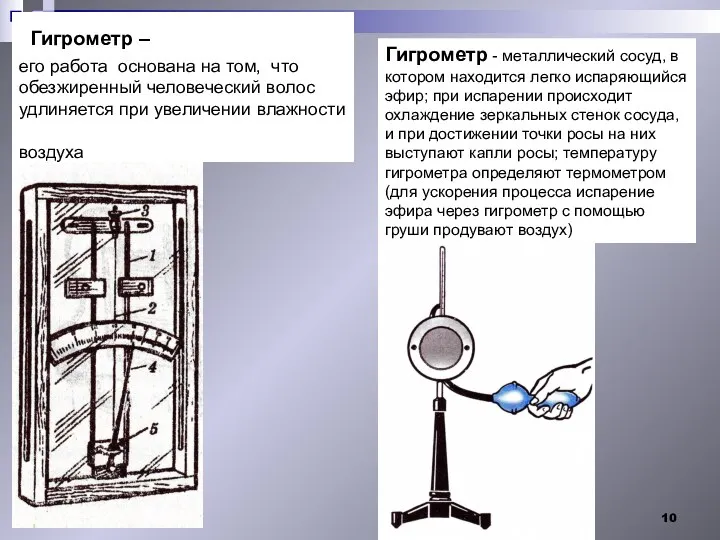
- 10. Гигрометр – его работа основана на том, что обезжиренный человеческий волос удлиняется при увеличении влажности воздуха
- 11. Критическая температура Ткр - температура, при которой исчезают различия между жидкостью и её насыщенным паром (плотности
- 12. ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА. Основные свойства жидкости: На Земле жидкость, предоставленная сама себе принимает форму капли -
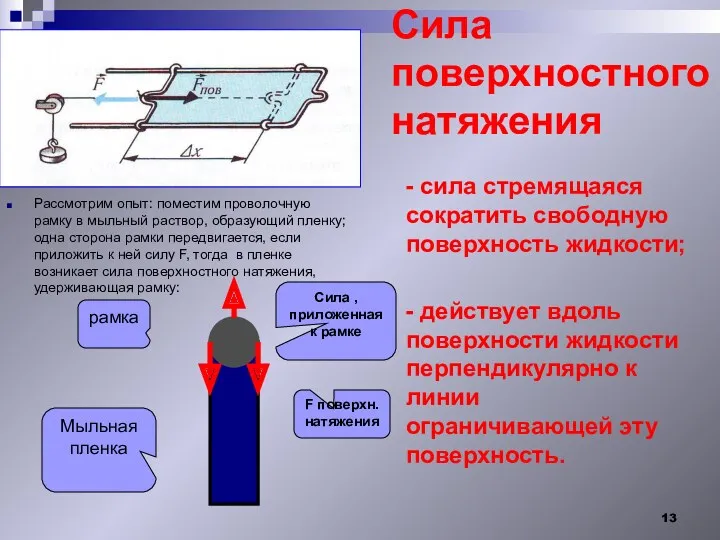
- 13. Сила поверхностного натяжения - сила стремящаяся сократить свободную поверхность жидкости; - действует вдоль поверхности жидкости перпендикулярно
- 14. [ ] = Н/м = Fн / L - зависит от природы жидкости - от t
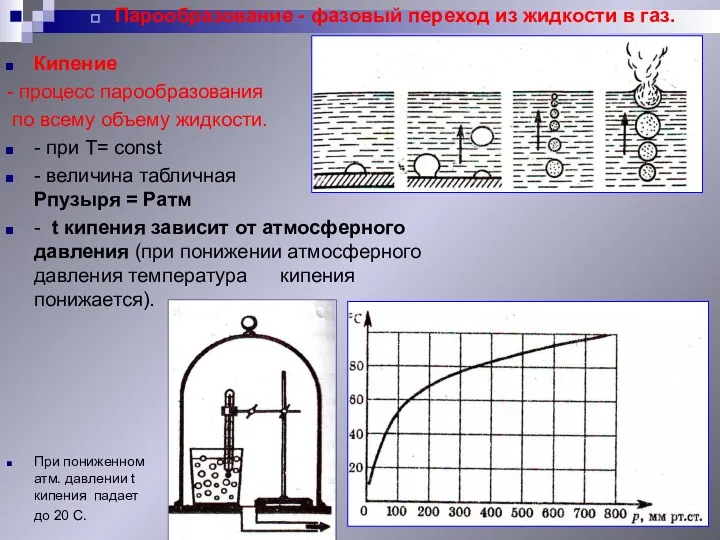
- 15. Парообразование - фазовый переход из жидкости в газ. При пониженном атм. давлении t кипения падает до
- 16. Испарение - - процесс, при котором с поверхности жидкости вылетают молекулы, у которых Е кин больше
- 17. Смачивание и не смачивание твердой поверхности жидкостью. При рассмотрении молекулярной картины поверхностного слоя жидкости выяснили, что
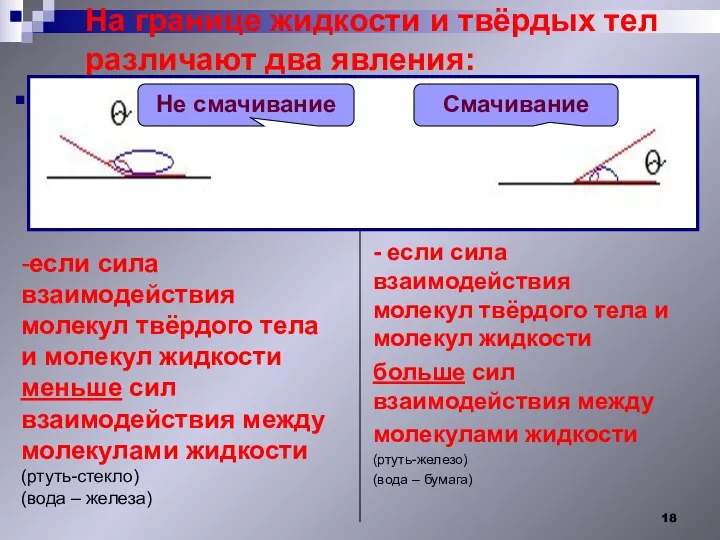
- 18. На границе жидкости и твёрдых тел различают два явления: - если сила взаимодействия молекул твёрдого тела
- 19. Капиллярность. Капилляр - трубка с малым внутренним диаметром. ( латинское слово «волос») Например: марля, почва, кровеносная
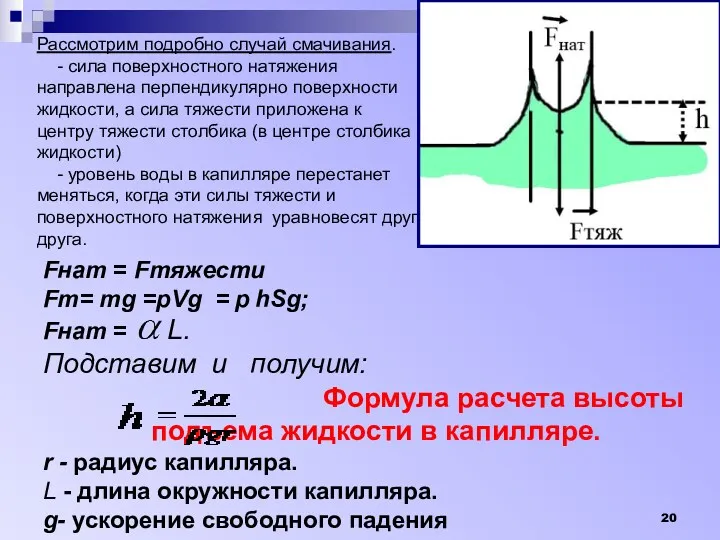
- 20. Fнат = Fтяжести Fт= тg =рVg = р hSg; Fнат = L. Подставим и получим: Формула
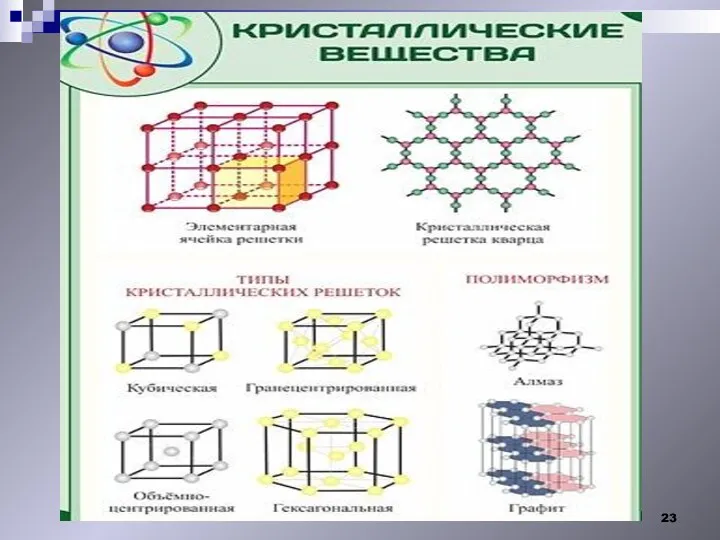
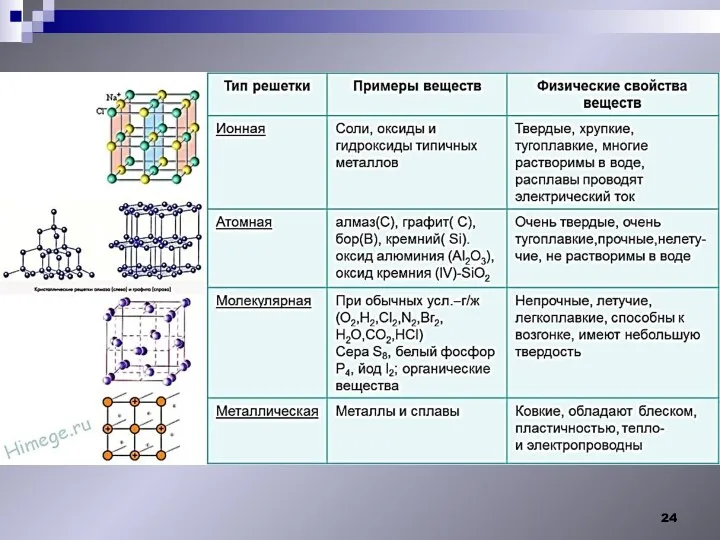
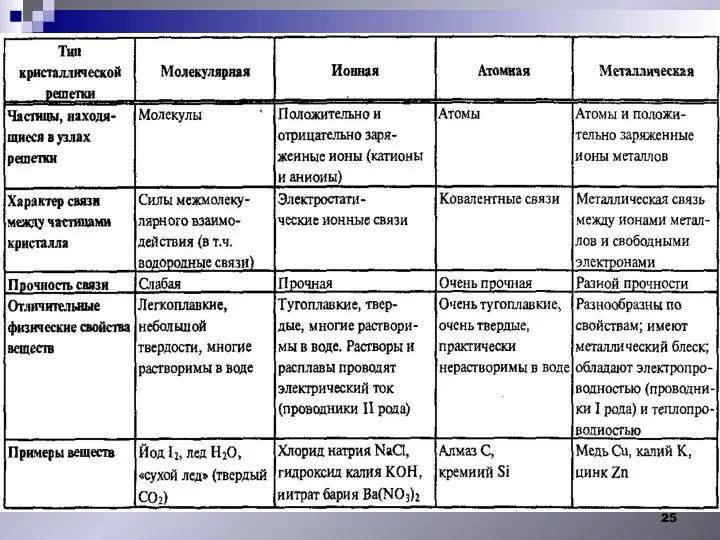
- 21. Свойства твердых тел. I.Строение твердых тел. Монокристалл Анизотропия Алмаз рубин Кристаллические твердые тела. существует «дальний порядок»
- 22. Кристаллы -твердые тела, частицы которых ( атомы, молекулы или ионы) занимают упорядоченное положение в пространстве (кристаллическая
- 26. Механические свойства тел. Свойства твёрдых тел: 1) прочность - способность выдержать нагрузки без разрушения 2) пластичность
- 27. Упругая – исчезает при снятии внешнего воздействия. Пластическая – не исчезает при снятии внешнего воздействия. -
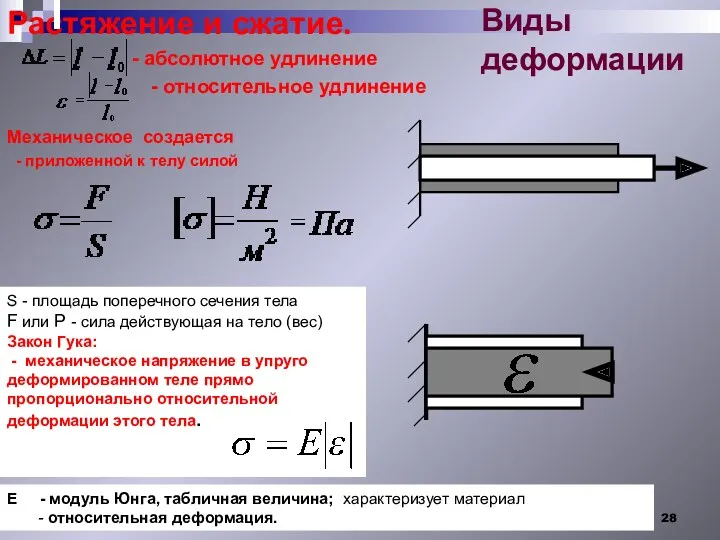
- 28. S - площадь поперечного сечения тела F или Р - сила действующая на тело (вес) Закон
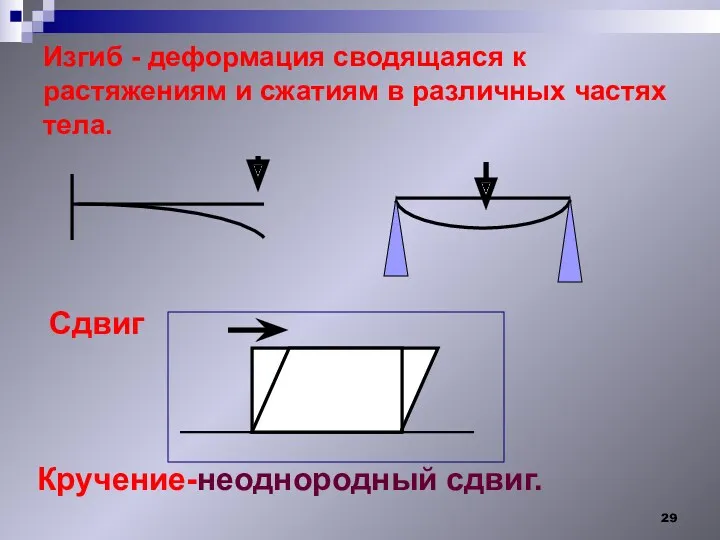
- 29. Изгиб - деформация сводящаяся к растяжениям и сжатиям в различных частях тела. Сдвиг Кручение-неоднородный сдвиг.
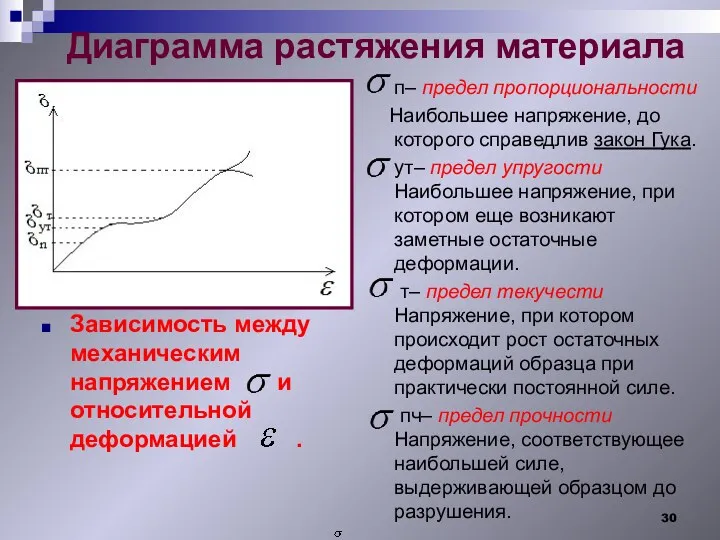
- 30. Диаграмма растяжения материала п– предел пропорциональности Наибольшее напряжение, до которого справедлив закон Гука. ут– предел упругости
- 31. Фаза вещества. Фазовые переходы. Диаграмма состояния вещества. Фаза вещества - равновесное состояние вещества, отличающегося по своим
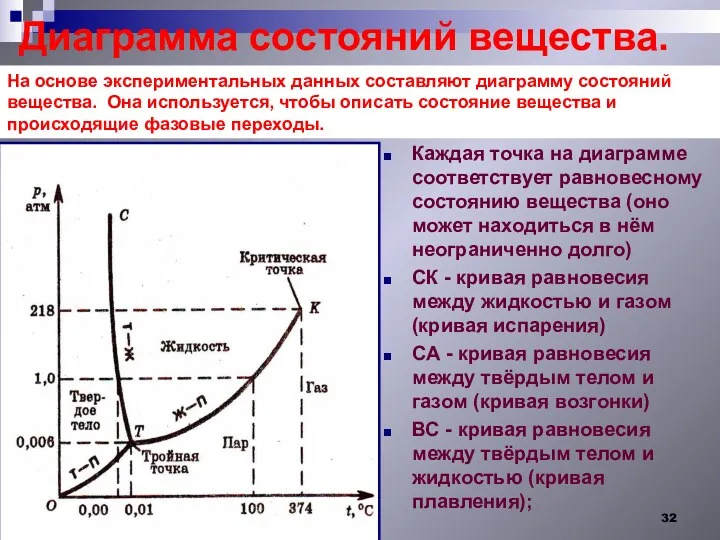
- 32. Диаграмма состояний вещества. Каждая точка на диаграмме соответствует равновесному состоянию вещества (оно может находиться в нём
- 33. Рассмотрим диаграмму - С - тройная точка - точка на диаграмме соответствующая равновесию трёх фаз (вода,
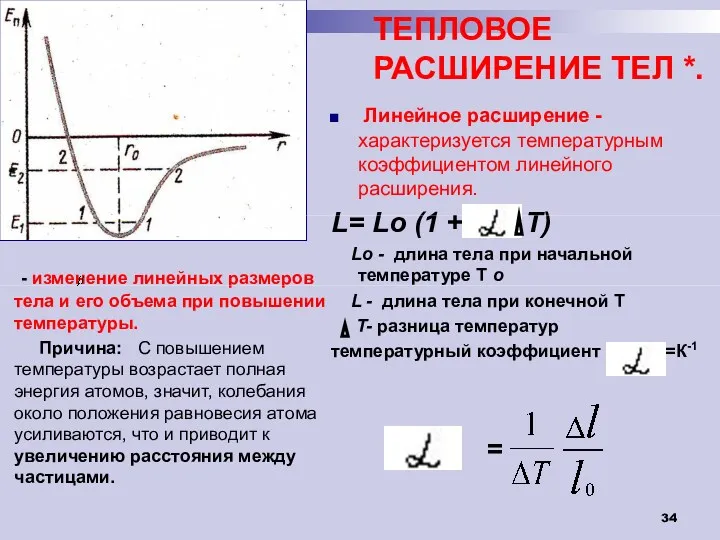
- 34. ТЕПЛОВОЕ РАСШИРЕНИЕ ТЕЛ *. - изменение линейных размеров тела и его объема при повышении температуры. Причина:
- 35. Объемное расширение - характеризуется температурным коэффициентом объемного расширения
- 37. Скачать презентацию







![[ ] = Н/м = Fн / L - зависит](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/599848/slide-13.jpg)










 Электромагнетизм и магнитные цепи
Электромагнетизм и магнитные цепи Закон сохранения энергии в задачах ЕГЭ
Закон сохранения энергии в задачах ЕГЭ Эхо. Звуковой резонанс
Эхо. Звуковой резонанс Передача давления жидкостями и газами. Закон Паскаля
Передача давления жидкостями и газами. Закон Паскаля Основные понятия теории тепломассообмена
Основные понятия теории тепломассообмена Электрические явления, 9 класс
Электрические явления, 9 класс Газовые законы. 10 класс
Газовые законы. 10 класс Демонстрация возможности использования среды PowerPoint как интерактивной презентации
Демонстрация возможности использования среды PowerPoint как интерактивной презентации Сила упругости. Закон Гука
Сила упругости. Закон Гука Простые механизмы в технике, в быту и в природе
Простые механизмы в технике, в быту и в природе Техническое обслуживание и текущий ремонт кузовов
Техническое обслуживание и текущий ремонт кузовов Критичность ограниченных размножающих сред
Критичность ограниченных размножающих сред Электротехника и электроника
Электротехника и электроника Проект дільниці механічної обробки пуансонотримача
Проект дільниці механічної обробки пуансонотримача Измерение силы Архимеда
Измерение силы Архимеда Работа и мощность электрического тока. Закон Джоуля - Ленца
Работа и мощность электрического тока. Закон Джоуля - Ленца Электростатика. Электрическое поле
Электростатика. Электрическое поле Слесарное дело. Техническое обслуживание и ремонт автомобильного транспорта
Слесарное дело. Техническое обслуживание и ремонт автомобильного транспорта Многодисковая муфта с фрикционными дисками
Многодисковая муфта с фрикционными дисками Геометрическая оптика
Геометрическая оптика Законы Ньютона
Законы Ньютона Открытие протона и нейтрона. Состав атомного ядра
Открытие протона и нейтрона. Состав атомного ядра Устройство и принцип действия холодильника
Устройство и принцип действия холодильника Урок решение задач по теме: Сила
Урок решение задач по теме: Сила Прості механізми
Прості механізми Эмальдар, Компаундтар. Клуазоне эмаль-бірегей зергерлік
Эмальдар, Компаундтар. Клуазоне эмаль-бірегей зергерлік Юнг тәжірибесі
Юнг тәжірибесі Импульс. Закон сохранения импульса. Энергия. Закон сохранения механической энергии
Импульс. Закон сохранения импульса. Энергия. Закон сохранения механической энергии