Содержание
- 2. Изопроцессы Изопроцессы–процессы, протекающие при неизменном значении одного из параметров “изо” - постоянство
- 3. Газовые законы Изотермический процесс Изобарный процесс Изохорный процесс
- 4. Изотермический процесс Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим. «термо» -
- 5. Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой – термостатом.
- 6. Роберт БОЙЛЬ (1627-1691), английский химик и физик, один из учредителей Лондонского королевского общества. Сформулировал (1661) первое
- 7. Эдм Мариотт (1620-1684) Французский физик, член Парижской академии наук со дня ее основания (1666). Был настоятелем
- 8. Закон Бойля-Мариотта Роберт Бойль (англ.) – 1662г Э. Мариотт (франц.) – 1676г Для газа данной массы
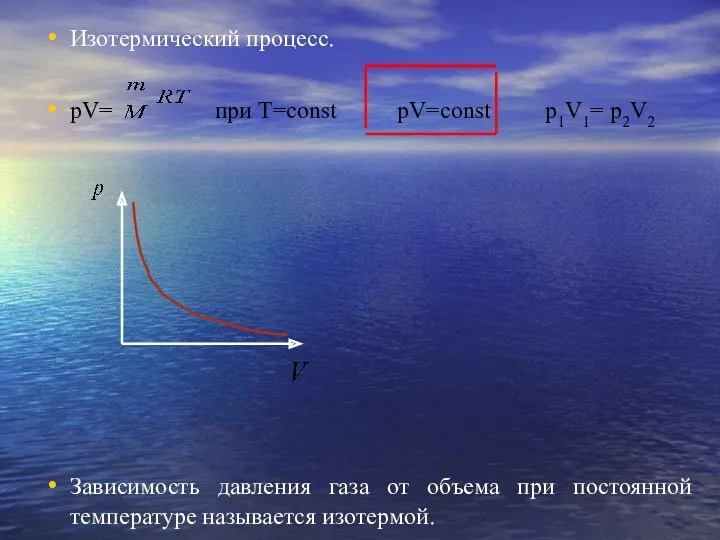
- 9. Изотермический процесс. pV= при T=const pV=const p1V1= p2V2 Зависимость давления газа от объема при постоянной температуре
- 10. Закон справедлив для любых газов и их смесей. Отклонения от этого закона становятся существенными при давлениях
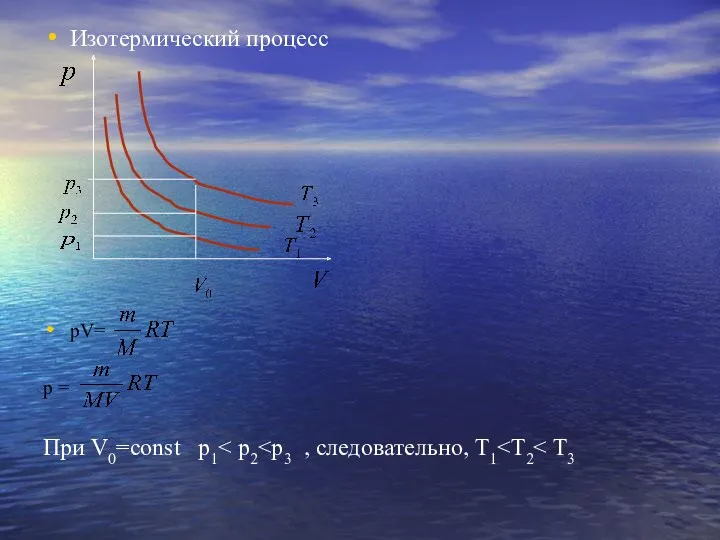
- 11. Изотермический процесс pV= р = При V0=const p1
- 12. Давление газа зависит от числа ударов молекул о стенки сосуда. При сжатии газа объем уменьшается, число
- 13. Изохорный процесс. Процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме называют изотермическим. “хорос”(греч.) -
- 14. Шарль, Жак Александр Сезар ШАРЛЬ Жак Александр Сезар (1746-1823), французский физик. Труды связаны с изучением расширения
- 15. Закон Шарля Для данной массы газа отношение давления к температуре постоянно, если объем не меняется. при
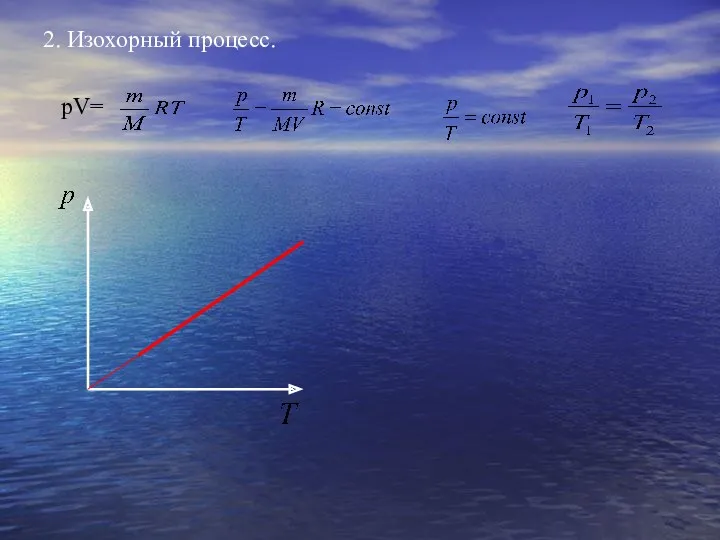
- 16. 2. Изохорный процесс. pV=
- 17. Давление газа зависит от числа ударов молекул о стенки сосуда. При повышении температуры скорость движения молекул
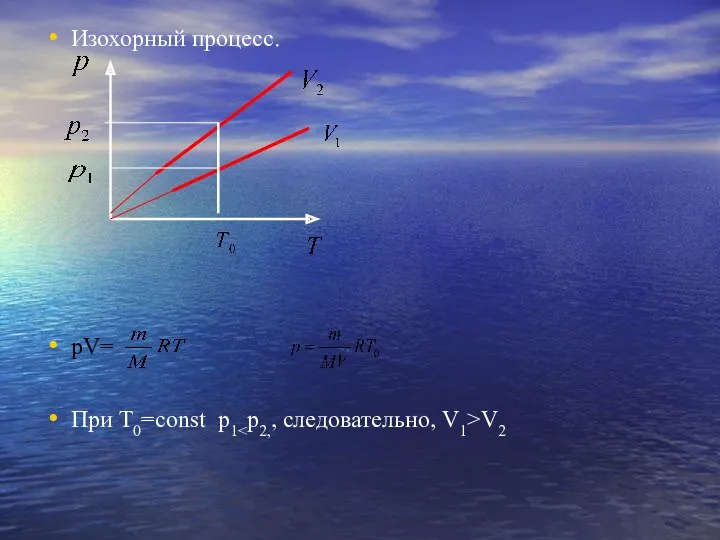
- 18. Изохорный процесс. рV= При Т0=const p1 V2
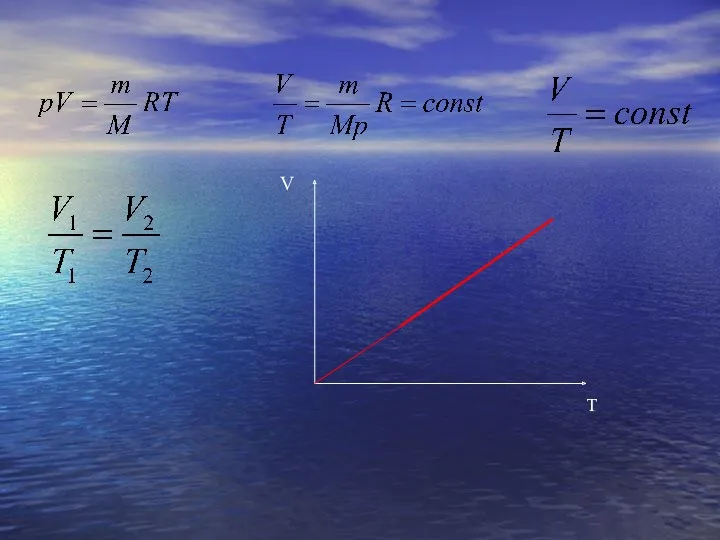
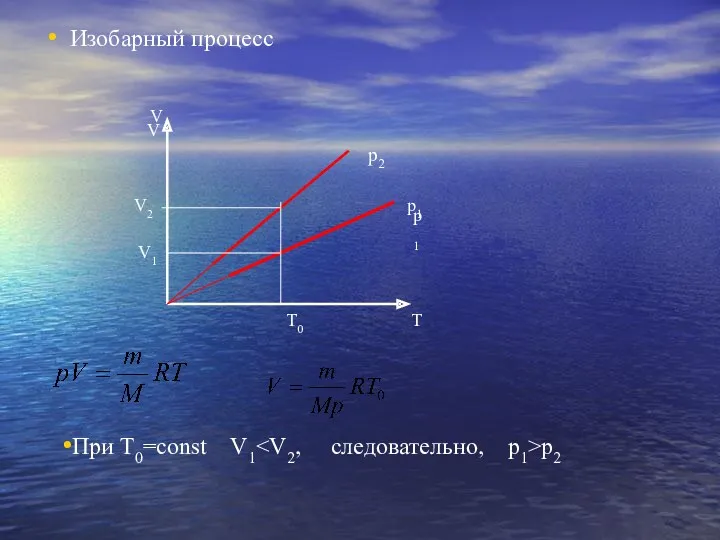
- 19. Изобарный процесс Изобарный процесс – процесс изменения состояния определенной массы газа при постоянном давлении. “барос”(греч.) -
- 20. Гей –Люсак Жозеф Луи Французский химик и физик, член Парижской академии наук (с 1806), её президент
- 21. Закон Гей – Люссака Ж. Гей – Люссак (франц.) 1802 Для данной массы газа при постоянном
- 22. V T
- 23. Изобарный процесс V V T T0 V2 V1 p1 p1 p2 При Т0=const V1 p2
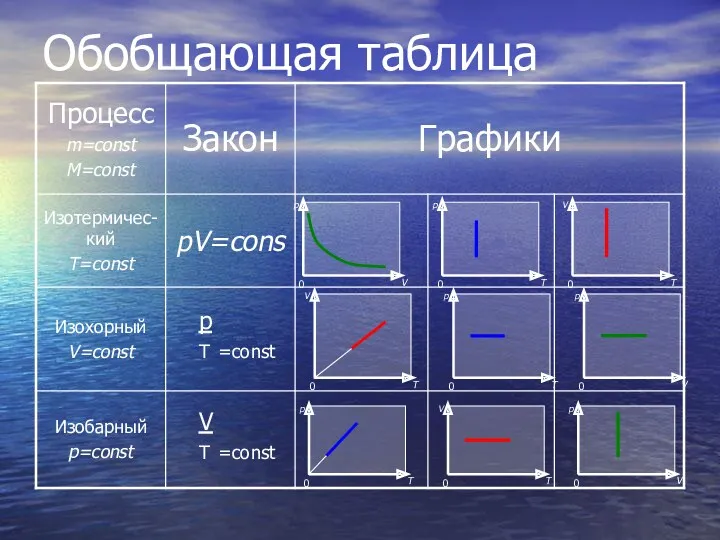
- 24. Обобщающая таблица
- 26. Скачать презентацию
















 Рентгеновские аппараты. Цифровые рентгенодиагностические комплексы. (Лекция 10)
Рентгеновские аппараты. Цифровые рентгенодиагностические комплексы. (Лекция 10) Методический материал к уроку Лазеры
Методический материал к уроку Лазеры Physical optics
Physical optics Основные понятия теории тепломассообмена
Основные понятия теории тепломассообмена Частотный метод синтеза корректирующего звена по ЛАЧХ разомкнутой системы
Частотный метод синтеза корректирующего звена по ЛАЧХ разомкнутой системы подготовка к ЕГЭ
подготовка к ЕГЭ Электромагнитное излучение, космические лучи и гравитационные волны
Электромагнитное излучение, космические лучи и гравитационные волны Отклонения и допуски на размеры деталей
Отклонения и допуски на размеры деталей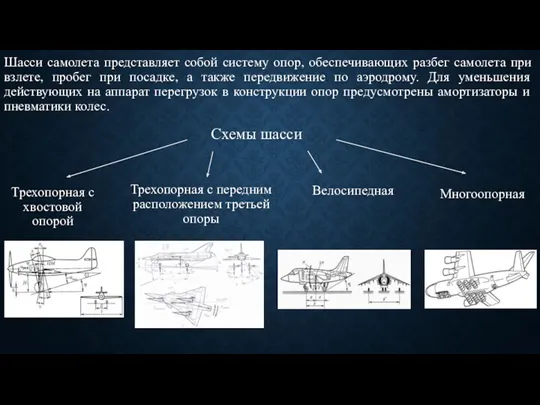 Расчет шасси самолета
Расчет шасси самолета Твердотельная электроника
Твердотельная электроника Шкала электромагнитных излучений
Шкала электромагнитных излучений Оптика
Оптика Introduction to Nuclear Physics
Introduction to Nuclear Physics методическая разработка урока
методическая разработка урока Электрический ток в растворах и расплавах электролитов
Электрический ток в растворах и расплавах электролитов Расчет токов короткого замыкания
Расчет токов короткого замыкания Линзы. Оптические приборы
Линзы. Оптические приборы Помехоустойчивость технических средств
Помехоустойчивость технических средств Лекция №8 (8 ). Электромагнитные волны в гиротропных средах
Лекция №8 (8 ). Электромагнитные волны в гиротропных средах Цветопись класса
Цветопись класса Урок + презентация. Тема: Сила Ампера
Урок + презентация. Тема: Сила Ампера Конспект урока по теме Магнитное поле прямого тока 8 класс
Конспект урока по теме Магнитное поле прямого тока 8 класс Правило Ленца. Явление самоиндукции. Энергия магнитного поля. (11 класс)
Правило Ленца. Явление самоиндукции. Энергия магнитного поля. (11 класс) Турбулентность и турбулентный обмен в океане
Турбулентность и турбулентный обмен в океане Рідкі кристали та їх використання
Рідкі кристали та їх використання Оптика – это раздел физики, в котором изучаются световые явления
Оптика – это раздел физики, в котором изучаются световые явления Молекулярная физика
Молекулярная физика Презентация 10 класса Газовые законы
Презентация 10 класса Газовые законы