Содержание
- 2. ИЗ ИСТОРИИ… Еще в Древней Греции, около 2,5 тысяч лет назад, была выдвинута гипотеза о том,
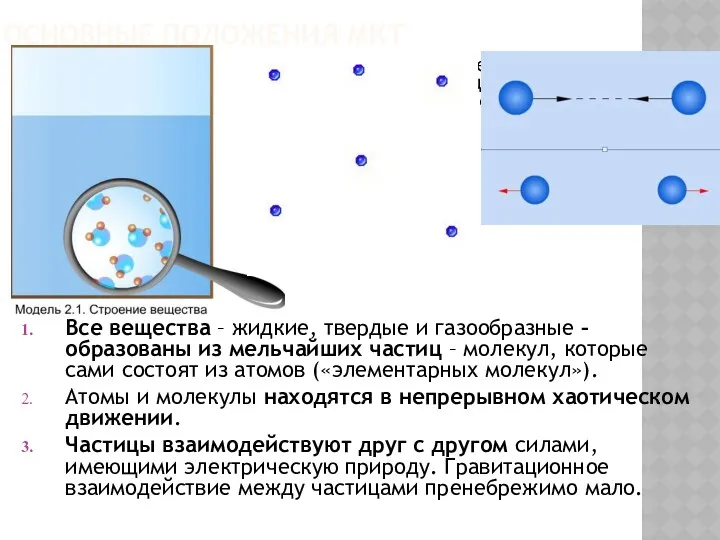
- 3. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о
- 4. АТОМЫ Атомы очень малы. Их невозможно разглядеть не только простым глазом, но и с помощью даже
- 5. МОЛЕКУЛЫ Молекула - это мельчайшая частица вещества, обладающая свойствами этого вещества. Так, молекула сахара - сладкая,
- 6. МОЛЕКУЛЫ Молекулы состоят из атомов. Размеры молекул ничтожно малы.
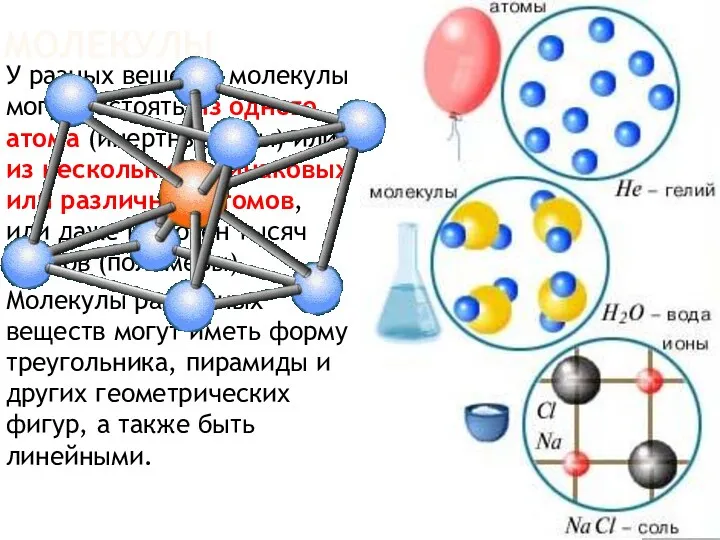
- 7. МОЛЕКУЛЫ У разных веществ молекулы могут состоять из одного атома (инертные газы) или из нескольких одинаковых
- 8. Строение газообразных, жидких и твёрдых тел
- 9. Любое вещество, состоящее из атомов или молекул, может находиться в одном из трех агрегатных состояний: а)
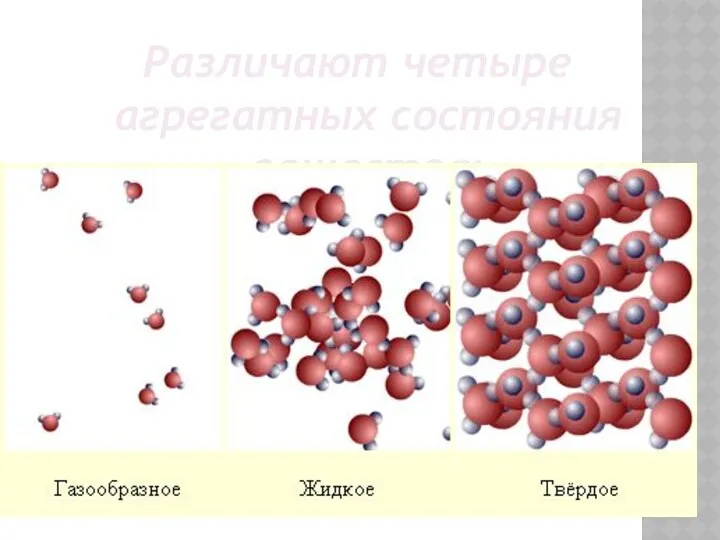
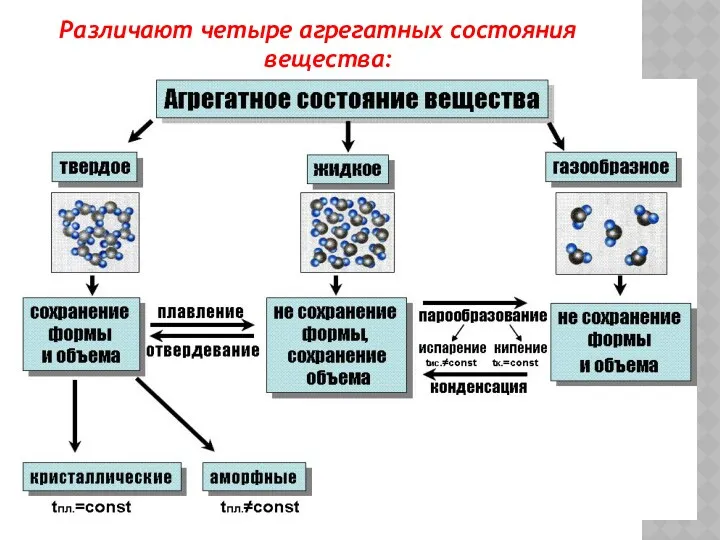
- 10. Различают четыре агрегатных состояния вещества: Твёрдое Жидкое Газообразное Плазменное
- 11. Итак, одно и то же вещество может находится в различных состояниях. Например, вода. Лед, вода, пар
- 12. Различают четыре агрегатных состояния вещества:
- 13. СТРОЕНИЕ ВЕЩЕСТВА Между молекулами в веществе существуют промежутки. Доказательствами существования промежутков служат изменение объема вещества, т.е.
- 16. МОЛЕКУЛЯРНЫЕ СИЛЫ Здесь должен быть видеофрагмент «Молекулярные силы»
- 17. ВЗАИМОДЕЙСТВИЕ ЧАСТИЦ ВЕЩЕСТВА Частицы веществ способны притягиваться друг к другу. Однако это притяжение возникает лишь тогда,
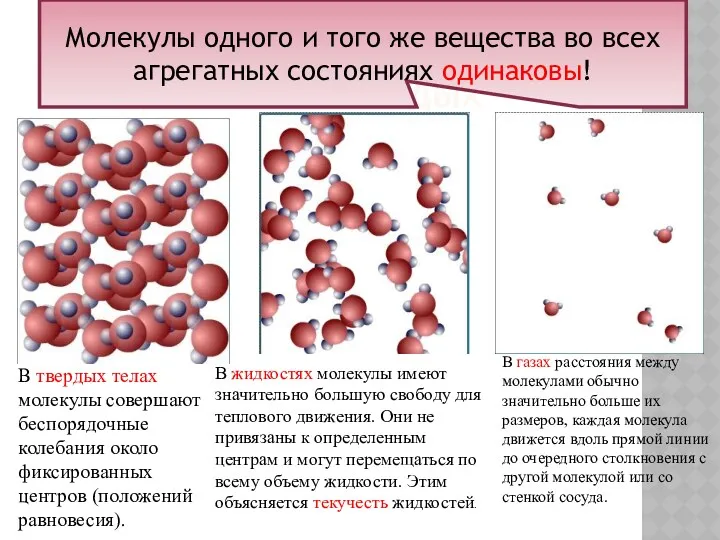
- 18. МОДЕЛИ СТРОЕНИЯ ГАЗОВ, ЖИДКОСТЕЙ И ТВЕРДЫХ В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров
- 19. СТРОЕНИЕ ТВЕРДЫХ, ЖИДКИХ И ГАЗООБРАЗНЫХ ТЕЛ Большая часть вещества на Земле встречается в трех состояниях: твердом,
- 20. Фазовый переход – переход системы из одного агрегатного состояния в другое. При фазовом переходе скачкообразно изменяется
- 21. Различают четыре агрегатных состояния вещества:
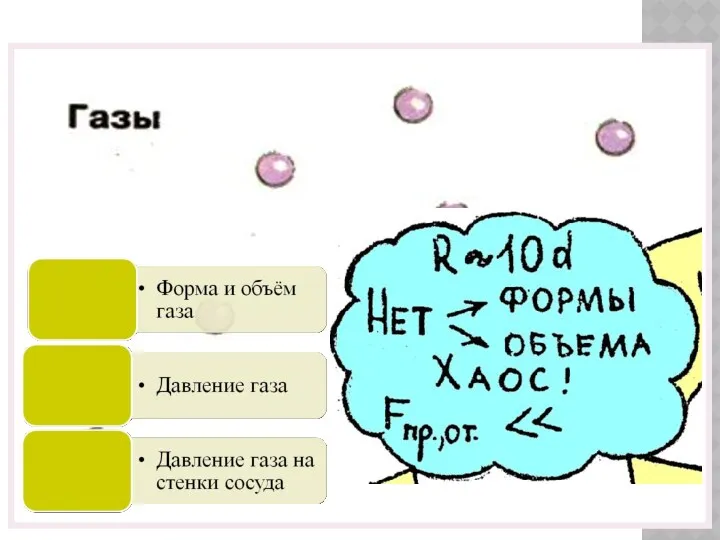
- 24. Газы Легко сжимаются Могут неограниченно расширяться Не сохраняют ни форму ни объём Многочисленные удары молекул о
- 26. Мало сжимаются Сохраняют свой объём Текучи, легко меняют форму Принимают форму сосуда Силы взаимодействия большие Молекулы
- 28. Твёрдые тела Сохраняют объём и форму Молекулы или атомы колеблются около определённых положений равновесия Силы взаимодействия
- 30. Скачать презентацию





















 МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАДИОАКТИВНОСТЬ. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР
МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАДИОАКТИВНОСТЬ. РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР Кристаллооптический анализ
Кристаллооптический анализ Динамика колебаний. (Раздел 2. Тема 8)
Динамика колебаний. (Раздел 2. Тема 8) Презентация Гипотеза о строении вещества
Презентация Гипотеза о строении вещества Ударные волны
Ударные волны Дифракция и рефракция электромагнитных волн. Дифракция электромагнитных волн на препятствиях
Дифракция и рефракция электромагнитных волн. Дифракция электромагнитных волн на препятствиях AGCS (Active Geometry Controlled Suspension) - активная управляемая геометрия подвески
AGCS (Active Geometry Controlled Suspension) - активная управляемая геометрия подвески Рулевое управление тракторов
Рулевое управление тракторов Давление. Атмосфернео давление. Закон паскаля. Закон архимеда
Давление. Атмосфернео давление. Закон паскаля. Закон архимеда Колебательное движение
Колебательное движение Flexible pipelines
Flexible pipelines Тепловые двигатели и нагнетатели. Компрессоры
Тепловые двигатели и нагнетатели. Компрессоры Открытый урок по физике в 7 кл: Выталкивающая сила с использованием ЦОР и ИД
Открытый урок по физике в 7 кл: Выталкивающая сила с использованием ЦОР и ИД Постоянный электрический ток. Решение задач повышенной сложности по физике
Постоянный электрический ток. Решение задач повышенной сложности по физике Прямолинейное равноускоренное движение
Прямолинейное равноускоренное движение Колебания, их виды и характеристики. 11 класс
Колебания, их виды и характеристики. 11 класс Презентация к уроку в 11 классе Строение атома
Презентация к уроку в 11 классе Строение атома Машины переменного тока. Синхронные машины. Реакция якоря. (Лекция 5)
Машины переменного тока. Синхронные машины. Реакция якоря. (Лекция 5) Агрегатные станки. (Тема 11)
Агрегатные станки. (Тема 11) Аналоговые электроизмерительные устройства
Аналоговые электроизмерительные устройства Методы оптической молекулярной спектроскопии (часть1)
Методы оптической молекулярной спектроскопии (часть1) قوة المولد بروفايل
قوة المولد بروفايل Радиоактивность
Радиоактивность Явление смачивания
Явление смачивания Ядерные реакции
Ядерные реакции Динамика поступательного движения
Динамика поступательного движения Электротехника и электроника
Электротехника и электроника Молекулярная физика. Термодинамические системы (лекция 1)
Молекулярная физика. Термодинамические системы (лекция 1)