Содержание
- 2. Фазовые переходы Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком
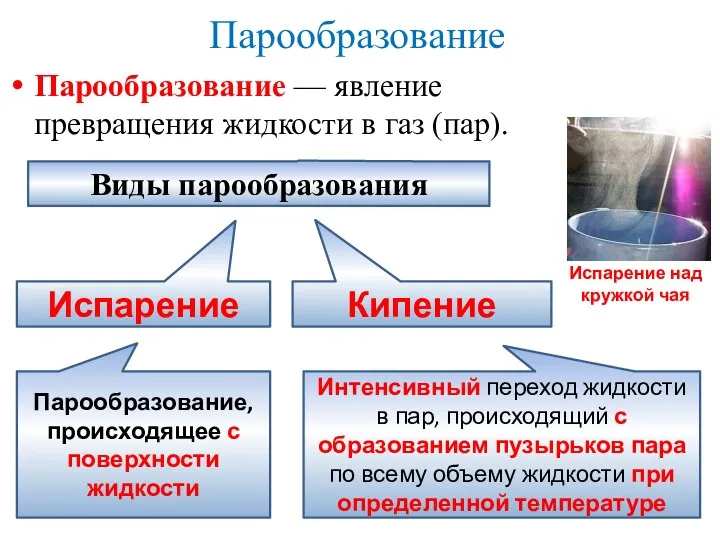
- 3. Парообразование Парообразование — явление превращения жидкости в газ (пар). Испарение над кружкой чая Виды парообразования Испарение
- 4. Испарение - это парообразование с поверхности жидкости. При испарении жидкость покидают более быстрые молекулы, обладающие большей
- 5. От чего зависит скорость испарения? Чем выше температура жидкости, тем больше скорость движения молекул, у которых
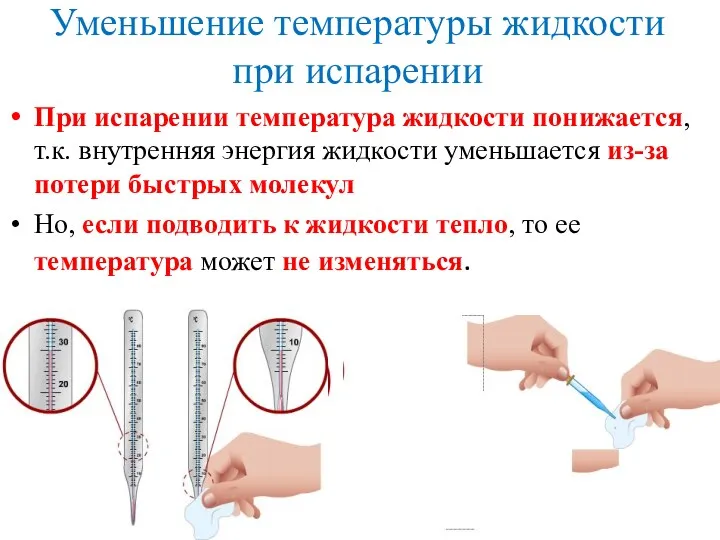
- 6. Уменьшение температуры жидкости при испарении При испарении температура жидкости понижается, т.к. внутренняя энергия жидкости уменьшается из-за
- 7. Возгонка и сублимация Существует ещё один интересный вид парообразования, когда твердое тело, минуя жидкое состояние, превращается
- 8. Пример. Очистка йода возгонкой (сублимацией) На дно стакана помещают технический йод, подлежащий отчистке. Стакан накрывают круглодонной
- 9. Очистка йода возгонкой (сублимацией) В конце возгонки пары йода в стакане бледнеют. На дне остается небольшое
- 10. Конденсация Процесс превращения пара в жидкость называется конденсацией. Конденсация пара сопровождается выделением энергии; Пары воды в
- 11. Кипение жидкости Кипение - это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности,
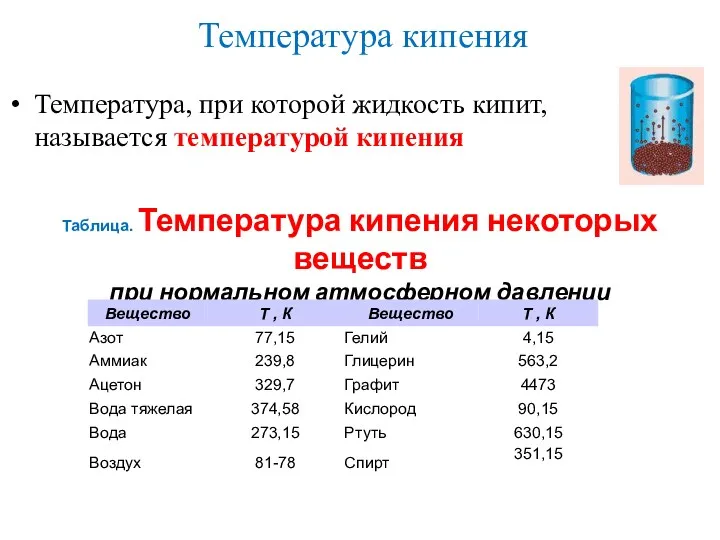
- 12. Температура кипения Температура, при которой жидкость кипит, называется температурой кипения Таблица. Температура кипения некоторых веществ при
- 13. Процесс кипения Кипение происходит с поглощением теплоты. Жидкость КИПЕНИЕ Пар (газ) Q Большая часть подводимой теплоты
- 14. Механизм кипения воды При нагревании испарение с поверхности воды усиливается. Появление в жидкости многочисленных мелких пузырьков
- 15. Удельная теплота парообразования Физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг
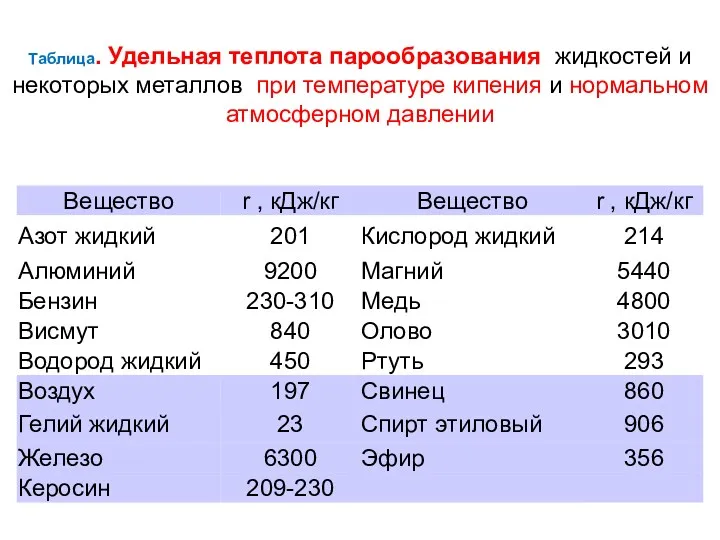
- 16. Таблица. Удельная теплота парообразования жидкостей и некоторых металлов при температуре кипения и нормальном атмосферном давлении
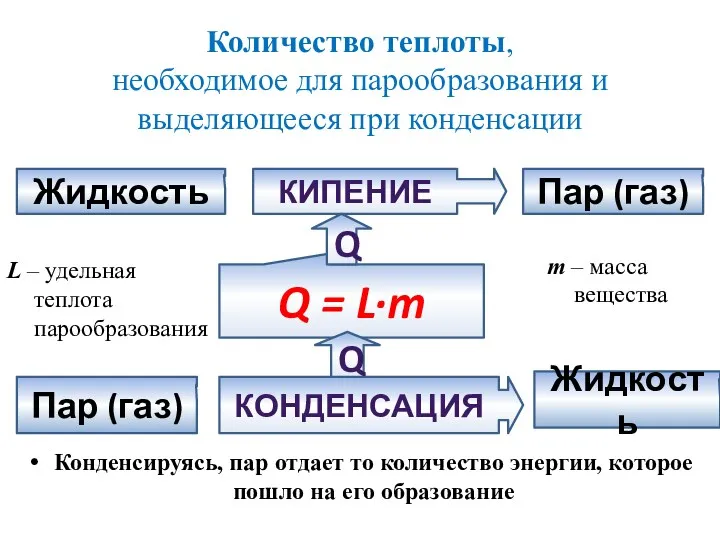
- 17. Количество теплоты, необходимое для парообразования и выделяющееся при конденсации Конденсируясь, пар отдает то количество энергии, которое
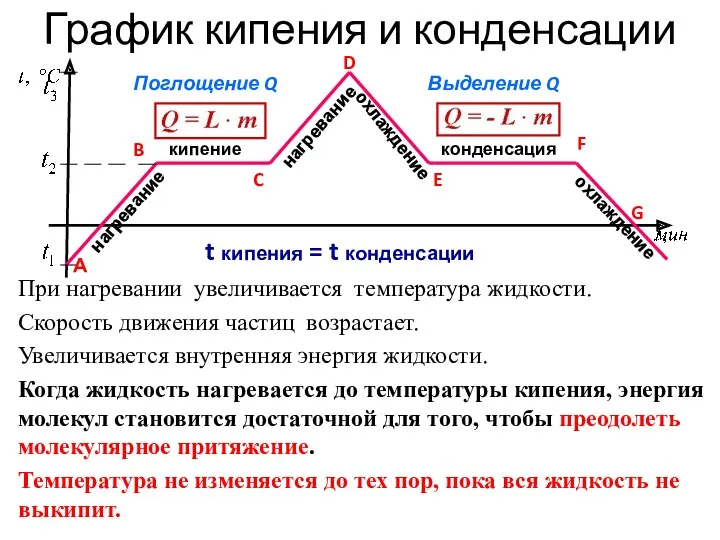
- 18. кипение нагревание конденсация охлаждение Поглощение Q Выделение Q t кипения = t конденсации График кипения и
- 20. Скачать презентацию











 Рычаги в технике, быту и природе
Рычаги в технике, быту и природе Backhoe Loader H200 Level 2 Pt 3 05-2008
Backhoe Loader H200 Level 2 Pt 3 05-2008 Температура. Единицы изменения температуры
Температура. Единицы изменения температуры Постоянные магниты. Магнитное поле. Взаимодействие магнитов
Постоянные магниты. Магнитное поле. Взаимодействие магнитов Полупроводники. Классификация веществ по проводимости
Полупроводники. Классификация веществ по проводимости 2.1 МЕХАНИКА ЖИДКОСТЕЙ И ГАЗОВ
2.1 МЕХАНИКА ЖИДКОСТЕЙ И ГАЗОВ Basic principles of ultrasonic testing
Basic principles of ultrasonic testing Спутниковые системы связи
Спутниковые системы связи 濽á ÒÓÒúßÔ¿ ºá¬¡ âÒ¬á
濽á ÒÓÒúßÔ¿ ºá¬¡ âÒ¬á Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Ускорение свободного падения и вес тела на Земле и других планетах
Ускорение свободного падения и вес тела на Земле и других планетах Давление. Закон Архимеда. Контрольная работа
Давление. Закон Архимеда. Контрольная работа Осуществление метапредметных связей на уроках физики как средство повышения мотивации обучающихся в условиях перехода на новые ФГОС
Осуществление метапредметных связей на уроках физики как средство повышения мотивации обучающихся в условиях перехода на новые ФГОС Лабораторная работа Исследование зависимости силы Архимеда от объема
Лабораторная работа Исследование зависимости силы Архимеда от объема Задачи на уравнения теплового баланса
Задачи на уравнения теплового баланса Давление газа. Уравнение состояния идеального газа. Изопроцессы
Давление газа. Уравнение состояния идеального газа. Изопроцессы Выставка удивительных вещей (Шуточная экспозиция на физическую тему)
Выставка удивительных вещей (Шуточная экспозиция на физическую тему) Автомобильдер мен тракторлардың тежеуіш жүйелері
Автомобильдер мен тракторлардың тежеуіш жүйелері Магнитное поле. Электромагниты. Применение электромагнитов
Магнитное поле. Электромагниты. Применение электромагнитов Магнитный поток. Работа по перемещению проводника с током в магнитном поле
Магнитный поток. Работа по перемещению проводника с током в магнитном поле Основы электродинамики
Основы электродинамики Кинематическая схема станка СТД-120 м
Кинематическая схема станка СТД-120 м Элементы релятивистской механики. Специальная теория относительности. (Лекция 4.2)
Элементы релятивистской механики. Специальная теория относительности. (Лекция 4.2) Источники и приемники оптического излучения
Источники и приемники оптического излучения Колебания-1. Гармоническое колебание и его характеристики. Модель гармонического осциллятора
Колебания-1. Гармоническое колебание и его характеристики. Модель гармонического осциллятора Тігін машинасының шығу тарихы
Тігін машинасының шығу тарихы Вертолет Ми-8МТВ. Масляная система двигателя
Вертолет Ми-8МТВ. Масляная система двигателя Механическое движение
Механическое движение