Слайд 2

ДАВЛЕНИЕ ГАЗА ВОЗНИКАЕТ В РЕЗУЛЬТАТЕ СТОЛКНОВЕНИЙ МОЛЕКУЛ СО СТЕНКАМИ СОСУДА (
И НА ПОМЕЩЕННОЕ В ГАЗ ТЕЛО ), В КОТОРОМ НАХОДИТСЯ БЕСПОРЯДОЧНО ДВИЖУЩИЕСЯ МОЛЕКУЛЫ ГАЗА. ЧЕМ ЧАШЕ УДАРЫ, ТЕМ ОНИ СИЛЬНЕЕ – ТЕМ ВЫШЕ ДАВЛЕНИЕ. ДАВЛЕНИЕ ЗАВИСИТ И ОТ СКОРОСТИ ПОСТУПАТЕЛЬНО ДВИЖУЩИХСЯ ГАЗОВЫХ МОЛЕКУЛ. ЕДИНИЦА ИЗМЕРЕНИЯ ДАВЛЕНИЯ — ПАСКАЛЬ P(ПА). ИЗМЕРЯЮТ ДАВЛЕНИЕ ГАЗА МАНОМЕТРОМ.
Слайд 3

Слайд 4

Слайд 5

Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа
устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
можно записать:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT
Слайд 6

ИДЕАЛЬНЫЙ ГАЗ – ЭТО МОДЕЛЬ РЕАЛЬНОГО ГАЗА. ЗА ИДЕАЛЬНЫЙ ГАЗ ПРИНИМАЮТ
ГАЗ В СОСУДЕ, КОГДА МОЛЕКУЛА, ПРОЛЕТАЯ ОТ СТЕНКИ ДО СТЕНКИ СОСУДА НЕ ИСПЫТЫВАЕТ СТОЛКНОВЕНИЯ С ДРУГИМИ МОЛЕКУЛАМИ. ТОЧНЕЕ, ИДЕАЛЬНЫЙ ГАЗ – ЭТО ГАЗ, ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ КОТОРОГО ПРЕНЕБРЕЖИМО МАЛО ⇒ EК >> EР .
Слайд 7

УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА — ФОРМУЛА, УСТАНАВЛИВАЮЩАЯ ЗАВИСИМОСТЬ МЕЖДУ ДАВЛЕНИЕМ, ОБЪЁМОМ
И АБСОЛЮТНОЙ ТЕМПЕРАТУРОЙ ИДЕАЛЬНОГО ГАЗА, ХАРАКТЕРИЗУЮЩЕЕ СОСТОЯНИЕ ДАННОЙ СИСТЕМЫ ГАЗА. УРАВНЕНИЕ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА— УРАВНЕНИЕ МЕНДЕЛЕЕВА — КЛАПЕЙРОНА (ДЛЯ ПРОИЗВОЛЬНОЙ МАССЫ ГАЗА). R = 8,31 ДЖ/МОЛЬ·К — УНИВЕРСАЛЬНАЯ ГАЗОВАЯ ПОСТОЯННАЯ. PV = RT – (ДЛЯ 1 МОЛЯ).
Слайд 8

ИЗОПРОЦЕССЫ – ЭТО ПРОЦЕССЫ, КОТОРЫЕ СОВЕРШАЮТСЯ ПРИ ОДИНАКОВОМ ПАРАМЕТРЕ ИЛИ Т-ТЕМПЕРАТУРЕ,
ИЛИ V-ОБЪЕМЕ, ИЛИ Р-ДАВЛЕНИИ.
Слайд 9
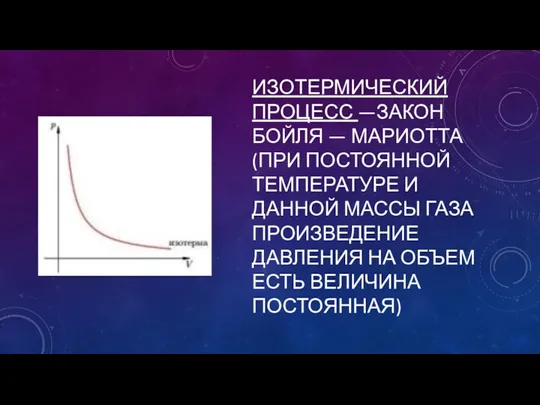
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС —ЗАКОН БОЙЛЯ — МАРИОТТА (ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ И ДАННОЙ
МАССЫ ГАЗА ПРОИЗВЕДЕНИЕ ДАВЛЕНИЯ НА ОБЪЕМ ЕСТЬ ВЕЛИЧИНА ПОСТОЯННАЯ)
Слайд 10
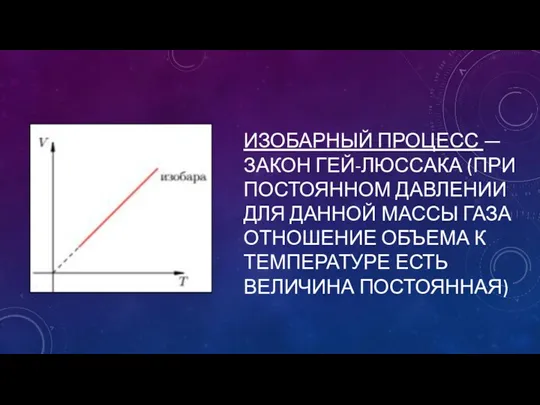
ИЗОБАРНЫЙ ПРОЦЕСС —ЗАКОН ГЕЙ-ЛЮССАКА (ПРИ ПОСТОЯННОМ ДАВЛЕНИИ ДЛЯ ДАННОЙ МАССЫ ГАЗА
ОТНОШЕНИЕ ОБЪЕМА К ТЕМПЕРАТУРЕ ЕСТЬ ВЕЛИЧИНА ПОСТОЯННАЯ)
Слайд 11
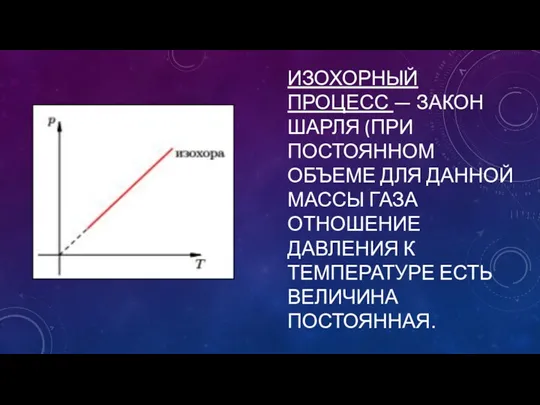
ИЗОХОРНЫЙ ПРОЦЕСС — ЗАКОН ШАРЛЯ (ПРИ ПОСТОЯННОМ ОБЪЕМЕ ДЛЯ ДАННОЙ МАССЫ
ГАЗА ОТНОШЕНИЕ ДАВЛЕНИЯ К ТЕМПЕРАТУРЕ ЕСТЬ ВЕЛИЧИНА ПОСТОЯННАЯ.










 Назначение и устройство ходовой части автомобиля
Назначение и устройство ходовой части автомобиля Принцип неопределённости Гейзенберга 1927
Принцип неопределённости Гейзенберга 1927 Детали машин. Выполнение рабочих чертежей
Детали машин. Выполнение рабочих чертежей Обобщающий урок-игра по физике, 9 класс
Обобщающий урок-игра по физике, 9 класс Колебательное движение.
Колебательное движение. Переменный ток. Итоговый тест
Переменный ток. Итоговый тест Бытовая швейная машина
Бытовая швейная машина Танцующая монета
Танцующая монета Магнитное поле и его графическое изображение. Направление тока и направление линий его магнитного поля
Магнитное поле и его графическое изображение. Направление тока и направление линий его магнитного поля Темір жол жылжымалы құрам тежеуішінің принципиалды сұлбасы және тағайындалуы
Темір жол жылжымалы құрам тежеуішінің принципиалды сұлбасы және тағайындалуы Решение задач на ускорение (9 класс)
Решение задач на ускорение (9 класс) Аэродинамика и летно-технические данные вертолёта. Тема №1. Аэродинамические силы и их коэффициенты. Лекция №3
Аэродинамика и летно-технические данные вертолёта. Тема №1. Аэродинамические силы и их коэффициенты. Лекция №3 Идеальный газ. Основное уравнение МКТ идеального газа
Идеальный газ. Основное уравнение МКТ идеального газа Роз'ємні та нероз'ємні з'єднання
Роз'ємні та нероз'ємні з'єднання Bernoulli’s equation
Bernoulli’s equation Превращение энергии в колебательном движении. Гармонические колебания
Превращение энергии в колебательном движении. Гармонические колебания Квантова фізика
Квантова фізика Сила трения
Сила трения Gas Dynamics (Introduction to Compressible Flow) Lecture 6a and 6b
Gas Dynamics (Introduction to Compressible Flow) Lecture 6a and 6b Температура. Шкала Реомюра
Температура. Шкала Реомюра презентация Масса
презентация Масса Вплив теплових двигунів на навколишнє середовище
Вплив теплових двигунів на навколишнє середовище Рентгеновское излучение. Открытие рентгеновских лучей
Рентгеновское излучение. Открытие рентгеновских лучей Уравнения строительной механики. Вариационные принципы строительной механики
Уравнения строительной механики. Вариационные принципы строительной механики Презентация по физике 8 класс Зависимость силы тока от напряжения. Электрическое сопротивление
Презентация по физике 8 класс Зависимость силы тока от напряжения. Электрическое сопротивление Дисперсия света
Дисперсия света Нанотехнології в нашому житті. Загроза цивілізації, або стрибок у майбутнє
Нанотехнології в нашому житті. Загроза цивілізації, або стрибок у майбутнє Закон сохранения энергии. Работа и кинетическая энергия
Закон сохранения энергии. Работа и кинетическая энергия