Содержание
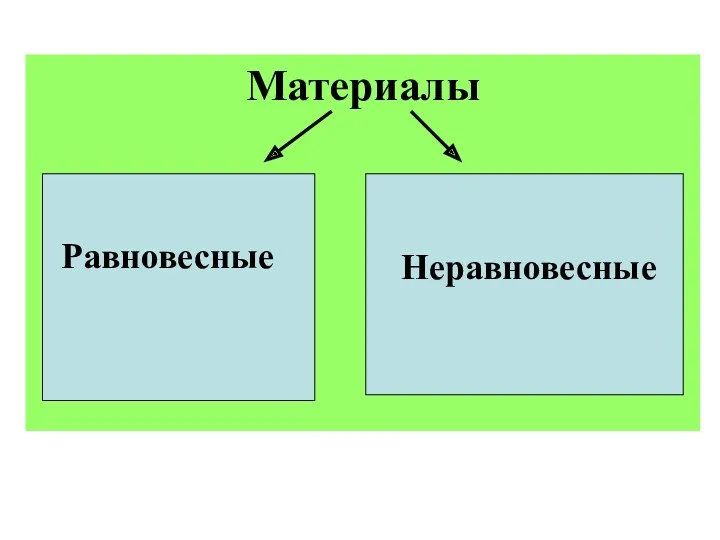
- 2. Материалы Равновесные Неравновесные
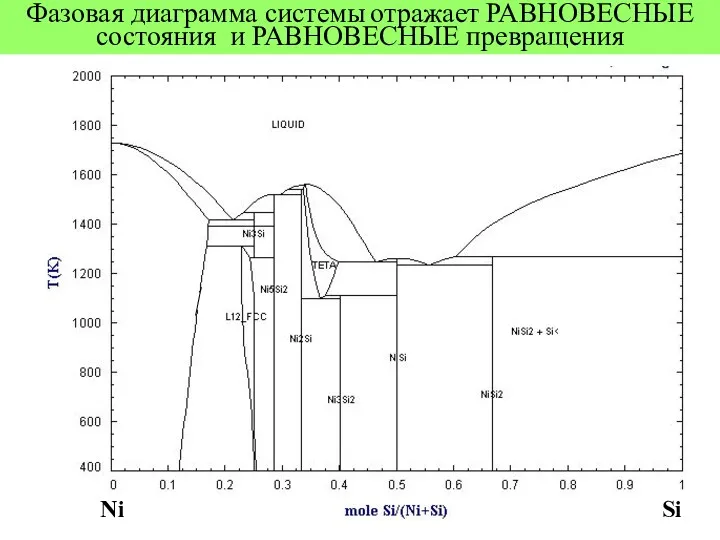
- 3. Фазовая диаграмма системы отражает РАВНОВЕСНЫЕ состояния и РАВНОВЕСНЫЕ превращения Ni Si
- 4. Правило Таммана: Диффузионные взаимодействия в твердофазных системах становятся возможными при Т ~> 0,6 Тпл
- 5. Фазовая диаграмма физико-химической системы - ключ к пониманию особенностей материала и его технологии 3Al2O3•2SiO2 третичный муллит
- 6. Физико-химическая система – совокупность выделенных из окружающей среды материальных объектов, между которыми возможен обмен энергией и
- 7. Гетерогенная система – физико-химическая система, содержащая поверхности раздела, на которых происходит скачкообразное изменение какого-либо свойства.
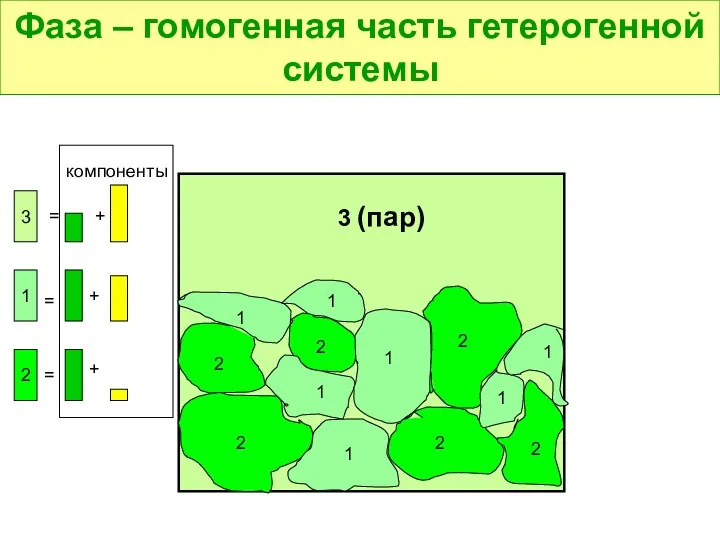
- 8. Фаза – гомогенная часть гетерогенной системы 1 1 1 1 1 1 1 2 2 2
- 9. Компоненты – индивидуальные вещества, составляющие систему. Число компонентов – минимальное число индивидуальных веществ , из которых
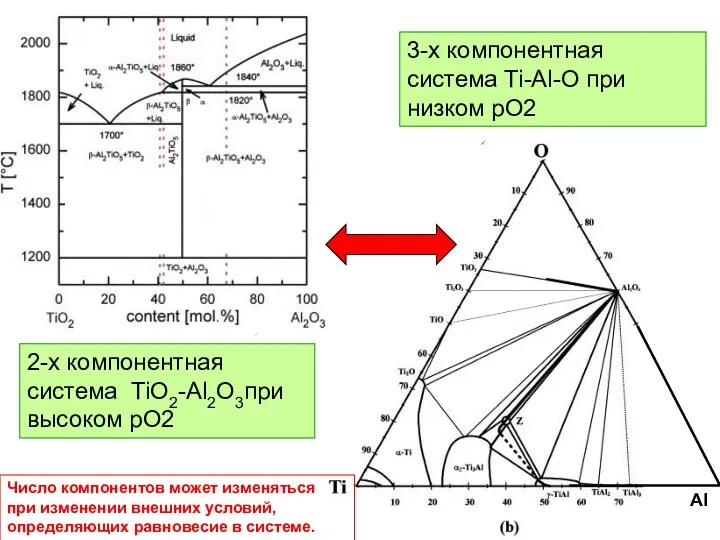
- 10. Al 2-х компонентная система TiO2-Al2O3при высоком рО2 3-х компонентная система Ti-Al-O при низком рО2 Число компонентов
- 11. Определение химического потенциала компонента μj = μjo + RTlnaj aj = γjcj Свободная энергия системы Число
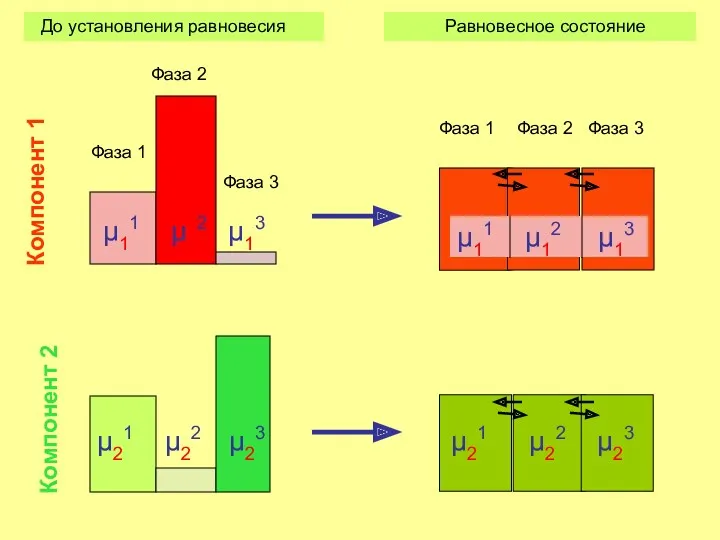
- 12. Химическое равновесие гетерогенной системы достигается тогда, когда химические потенциалы каждого из компонентов равны во всех фазах
- 13. μ11 μ12 μ13 μ11 μ12 μ13 Фаза 1 Фаза 2 Фаза 3 Фаза 1 Фаза 2
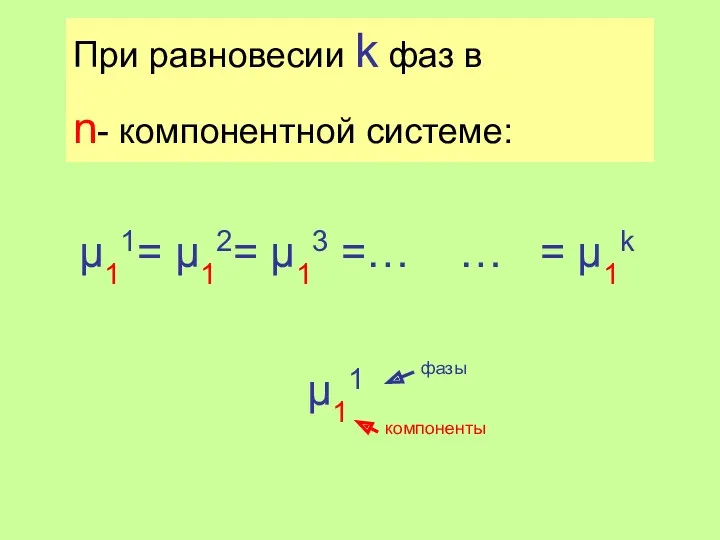
- 14. μ11= μ12= μ13 =… … = μ1k При равновесии k фаз в n- компонентной системе: μ11
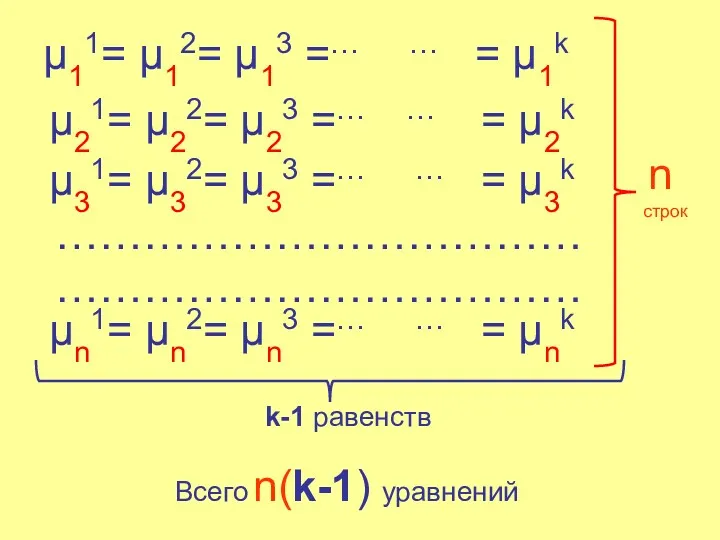
- 15. μ11= μ12= μ13 =… … = μ1k μ21= μ22= μ23 =… … = μ2k μ31= μ32=
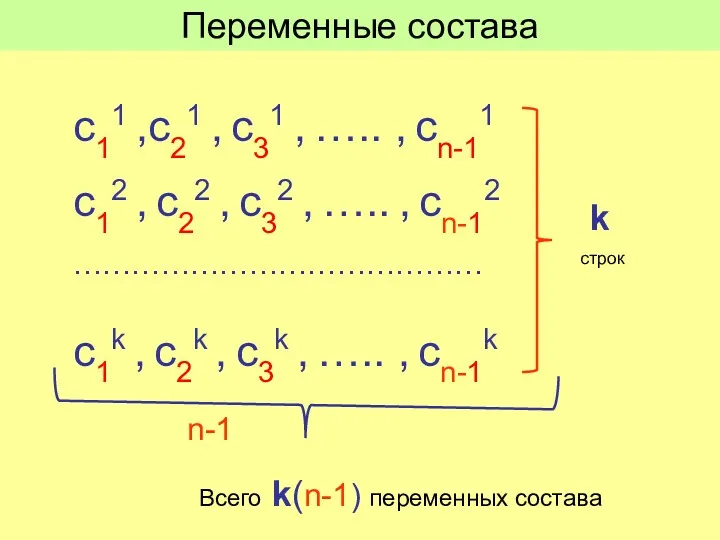
- 16. Система уравнений имеет определенное решение, если число уравнений равно числу переменных. Переменные: Состав равновесных фаз Температура
- 17. с11 ,с21 , с31 , ….. , cn-11 с12 , с22 , с32 , ….. ,
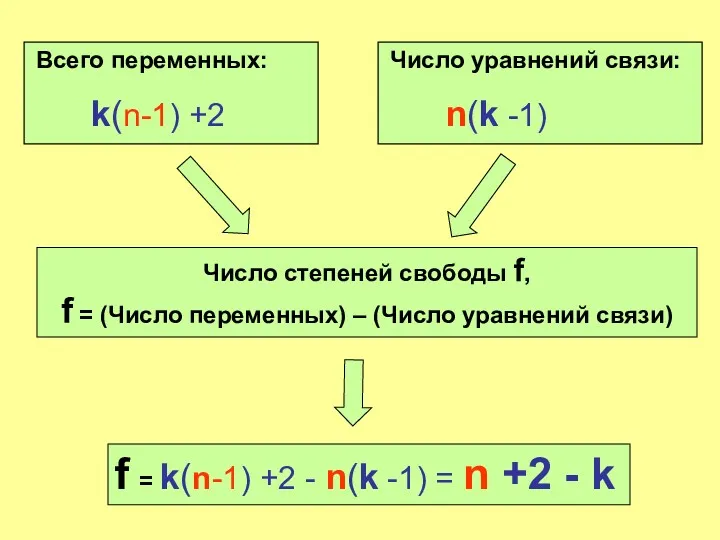
- 18. Всего переменных: k(n-1) +2 Число уравнений связи: n(k -1) Число степеней свободы f, f = (Число
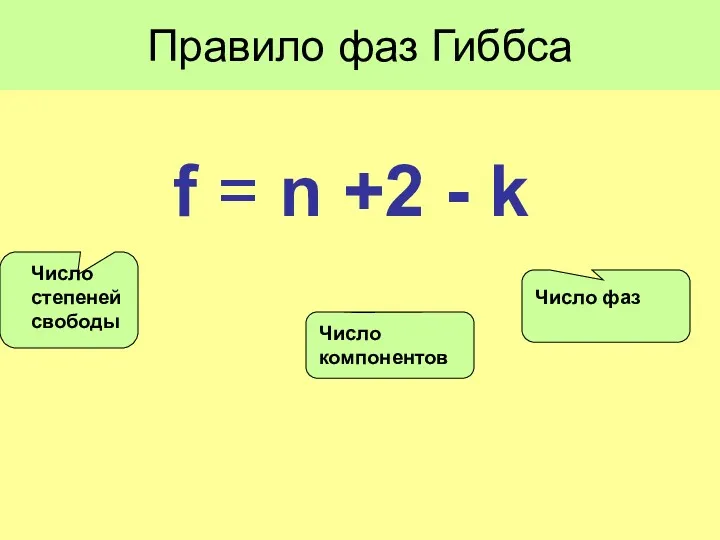
- 19. Правило фаз Гиббса f = n +2 - k Число фаз Число компонентов Число степеней свободы
- 20. Принцип соответствия Всякому комплексу фаз на диаграмме состояния соответствует свой геометрический образ, причем мерность этого образа
- 21. Фазовые диаграммы однокомпонентных систем
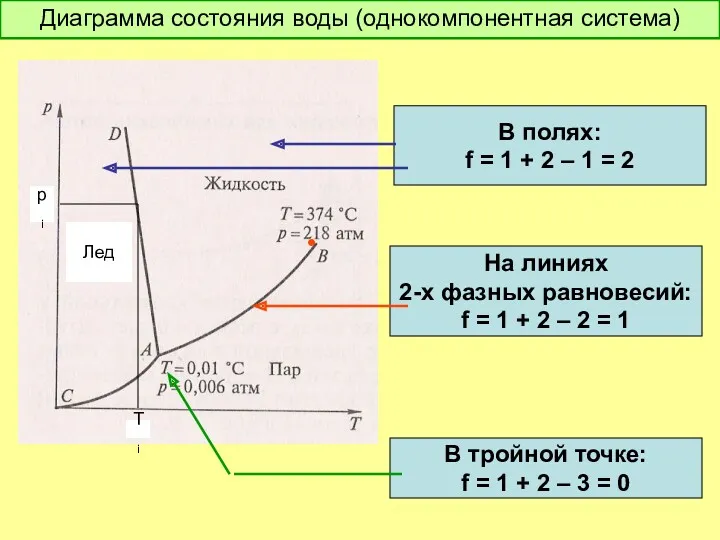
- 22. Диаграмма состояния воды (однокомпонентная система) • Лед pi Ti В полях: f = 1 + 2
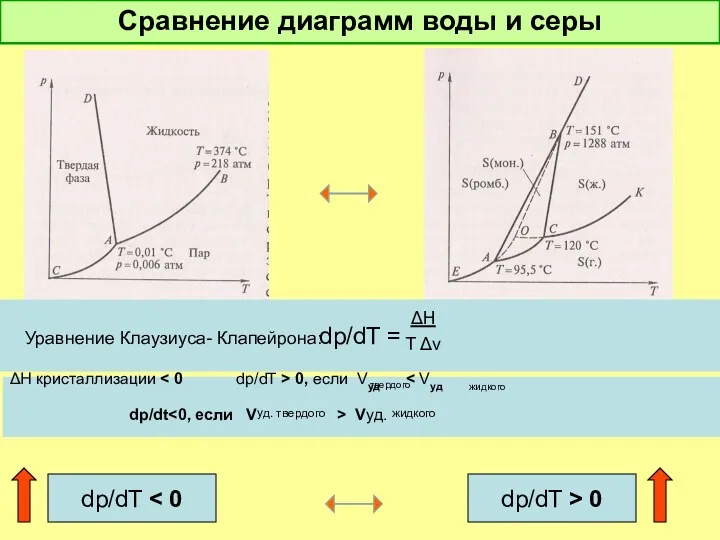
- 23. Сравнение диаграмм воды и серы dp/dT = Уравнение Клаузиуса- Клапейрона: ΔH T Δv ΔH кристаллизации 0,
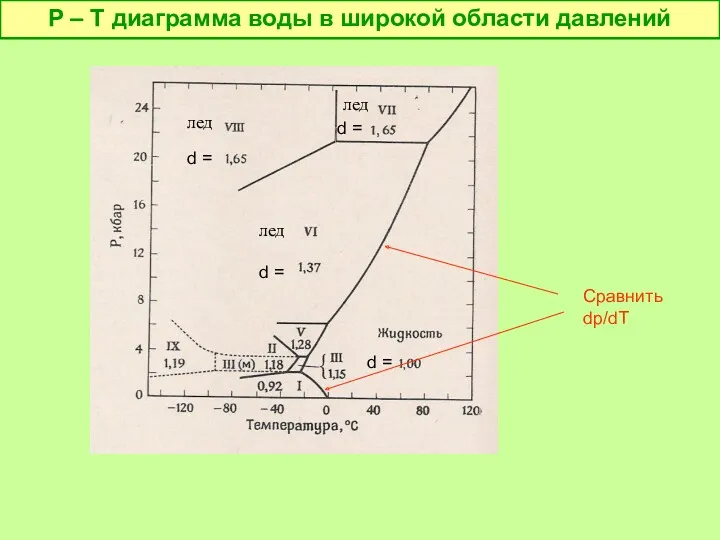
- 24. P – T диаграмма воды в широкой области давлений Сравнить dp/dT лед лед лед d =
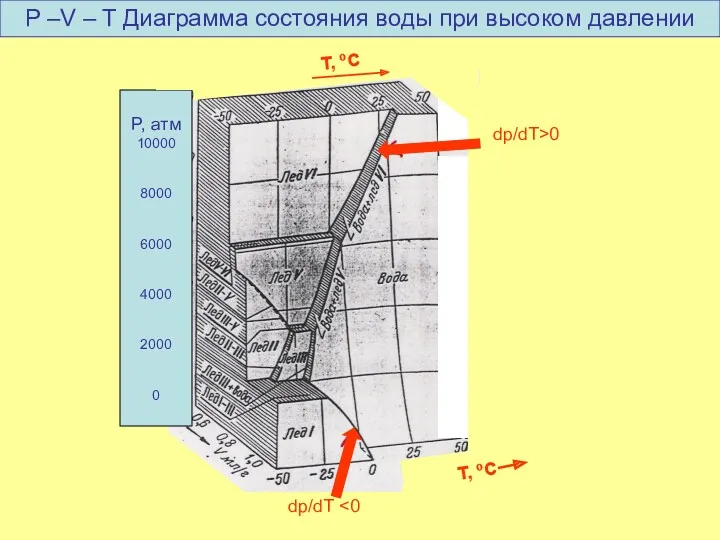
- 25. dp/dT T, oC P, атм 10000 8000 6000 4000 2000 0 T, oC dp/dT>0 P –V
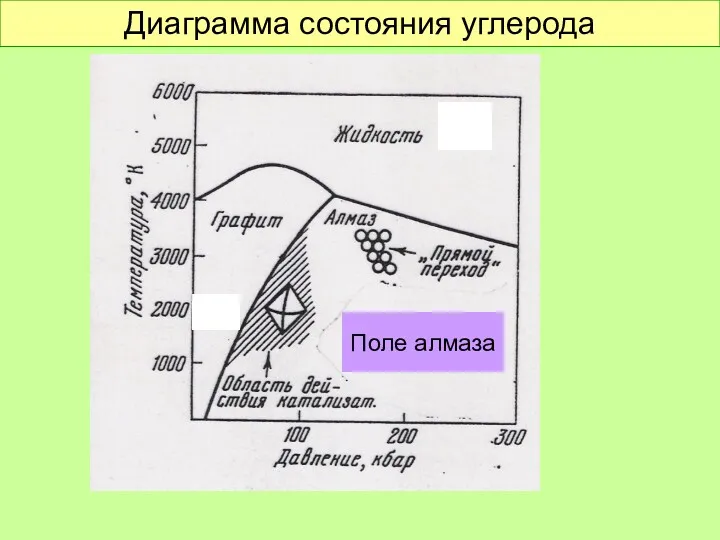
- 26. Диаграмма состояния углерода Поле алмаза
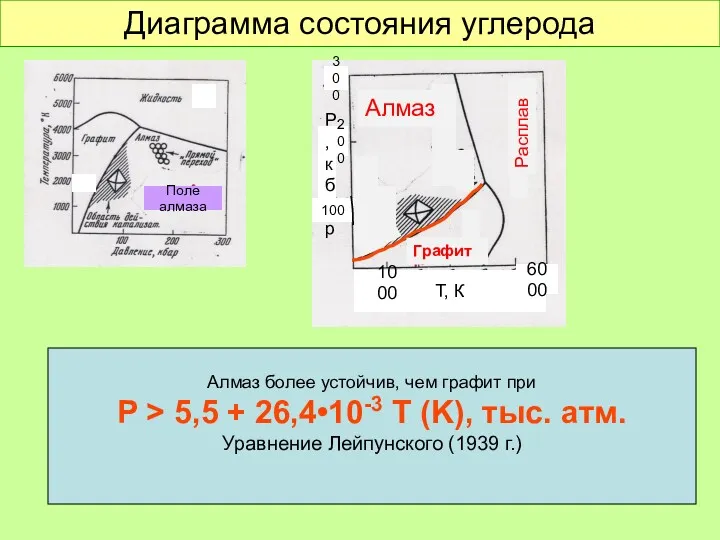
- 27. Диаграмма состояния углерода Поле алмаза Т, К 1000 6000 Р, кбар 300 200 100 Алмаз более
- 28. Цех установок роста алмазов Установка роста алмазов
- 29. Искусственные алмазы ювелирного качества
- 30. Синтетические алмазы используются в бурении горных пород, металлообработке. Алмазные полировочные пасты
- 31. Разновидности графитовых материалов
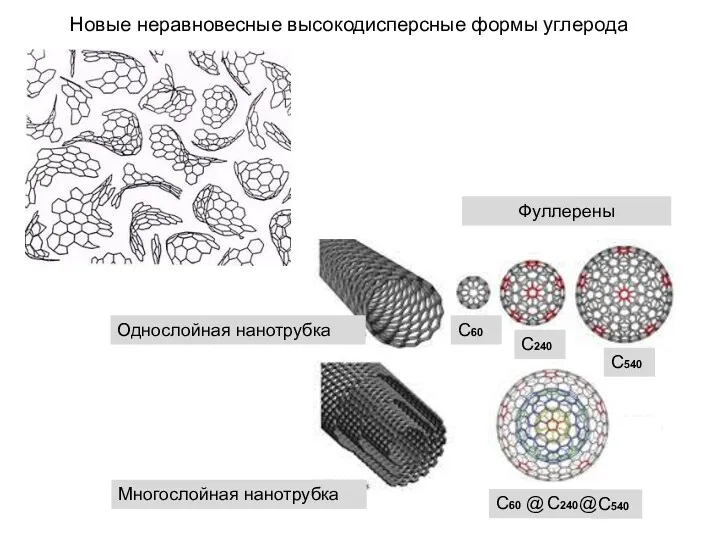
- 32. Новые неравновесные высокодисперсные формы углерода Однослойная нанотрубка Многослойная нанотрубка Фуллерены С60 С240 С540 С60 С240 С540
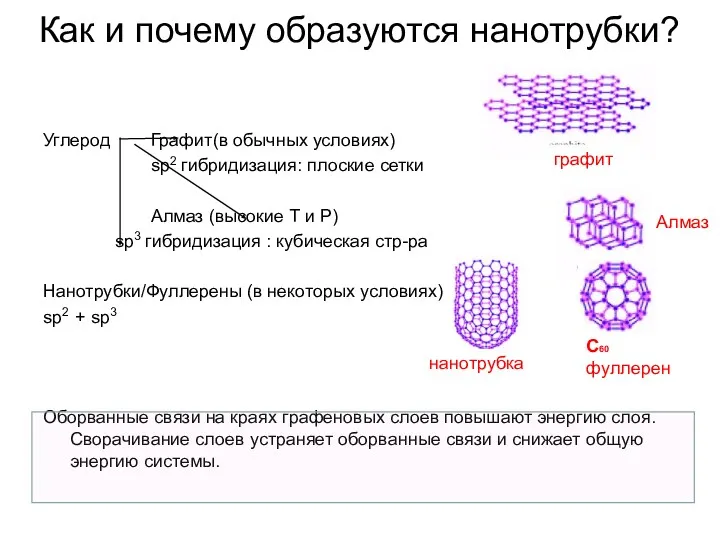
- 33. Как и почему образуются нанотрубки? Углерод Графит(в обычных условиях) sp2 гибридизация: плоские сетки Алмаз (высокие Т
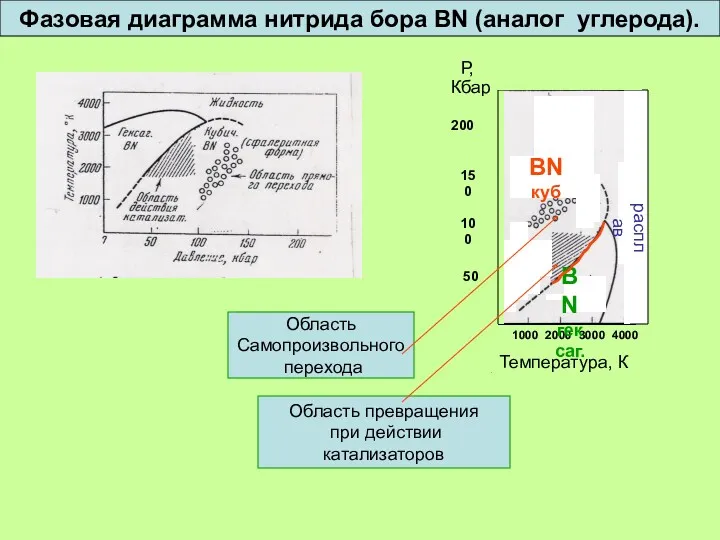
- 34. 1000 2000 3000 4000 Температура, К Р, Кбар 200 150 100 50 BN куб BN гексаг.
- 35. Кубический нитрид бора – высокотвердый материал для режущих инструментов BN, в отличие от алмаза, инертен по
- 36. Двухкомпонентные (бинарные) системы
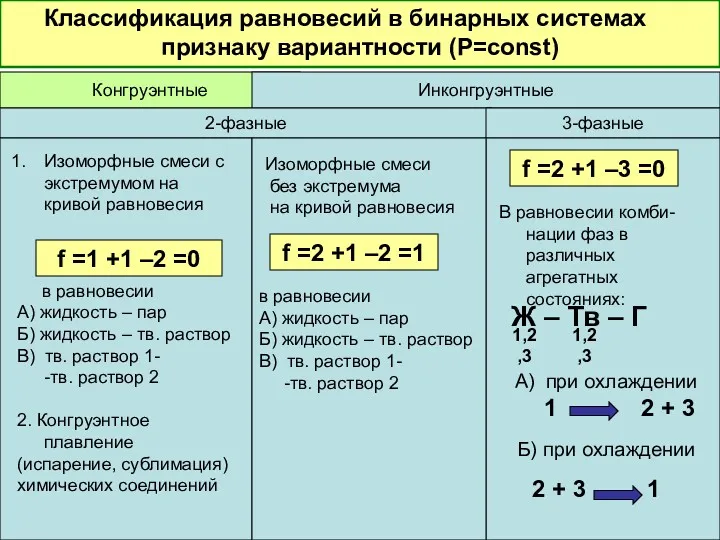
- 37. Классификация равновесий в бинарных системах по признаку вариантности (Р=const) Конгруэнтные Инконгруэнтные 2-фазные 3-фазные в равновесии А)
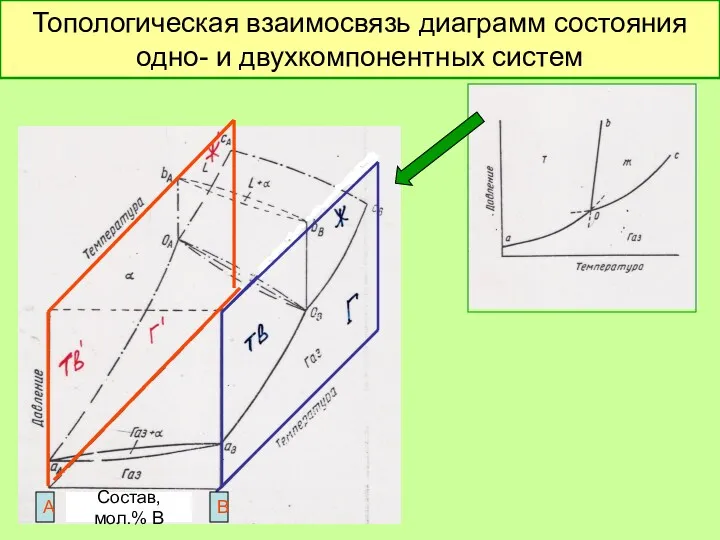
- 38. Топологическая взаимосвязь диаграмм состояния одно- и двухкомпонентных систем Состав, мол.% В А В
- 39. А Мол.% компонента В В Т, оС Расплав Твердый раствор А Мол.% компонента В В Т,
- 40. 0 10 20 30 40 50 60 70 80 90 100 А Мол.% компонента В В
- 41. 0 10 20 30 40 50 60 70 80 90 100 А Мол.% компонента В В
- 42. 0 10 20 30 40 50 60 70 80 90 100 А Мол.% компонента В В
- 43. 0 10 20 30 40 50 60 70 80 90 100 А Мол.% компонента В В
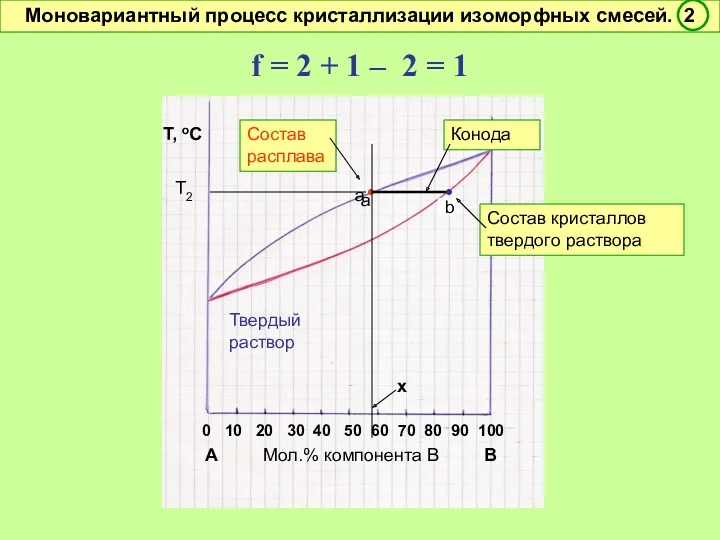
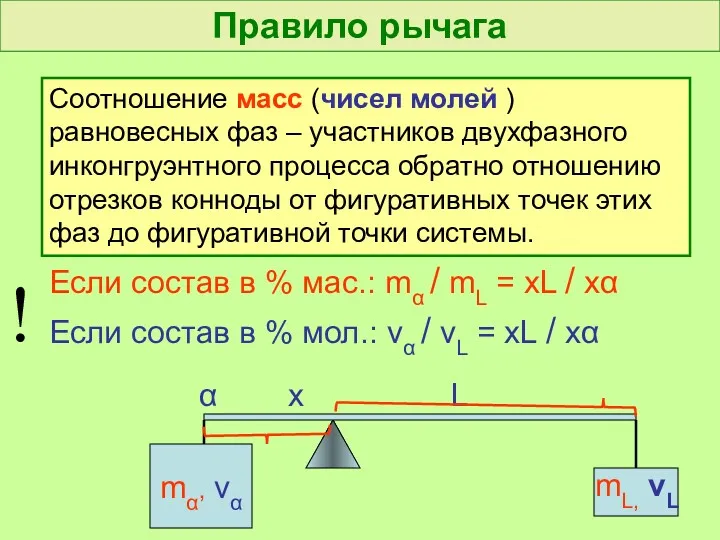
- 44. Правило рычага Соотношение масс (чисел молей ) равновесных фаз – участников двухфазного инконгруэнтного процесса обратно отношению
- 45. 0 10 20 30 40 50 60 70 80 90 100 А Мол.% компонента В В
- 46. 0 10 20 30 40 50 60 70 80 90 100 А Мол.% компонента В В
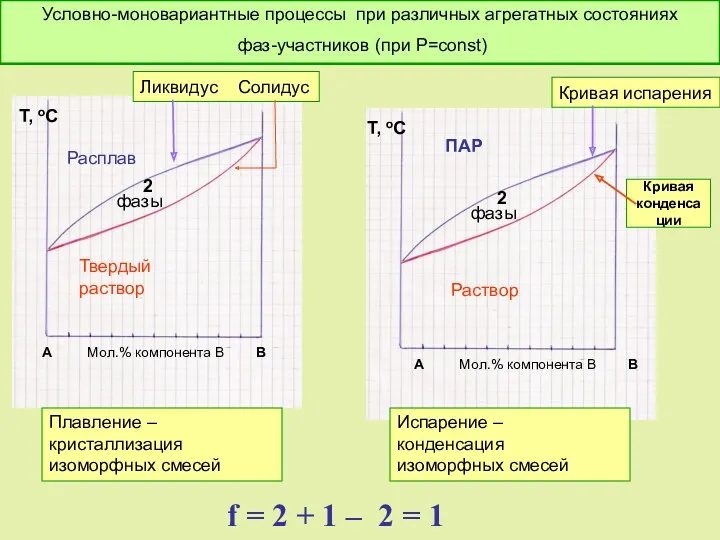
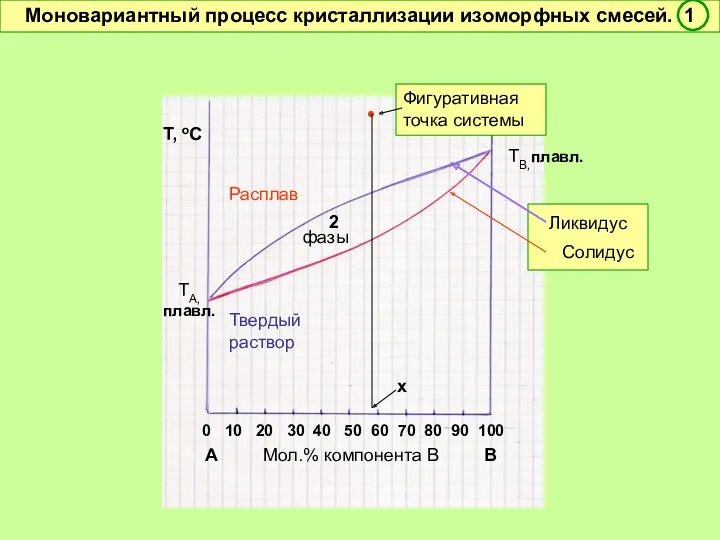
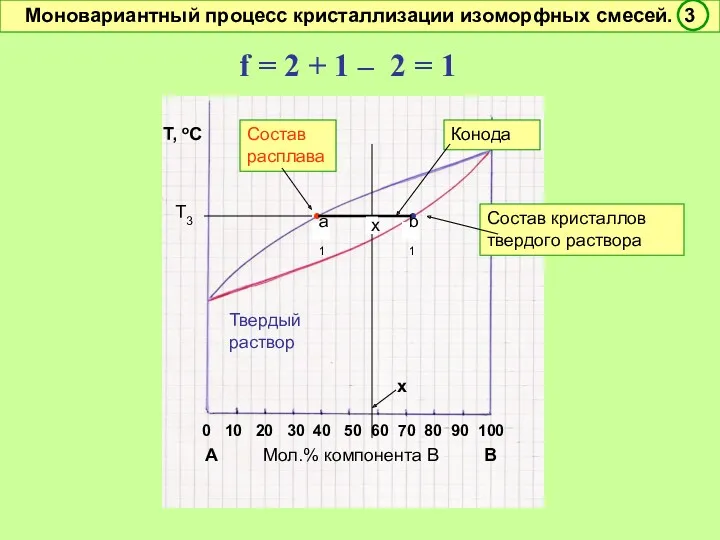
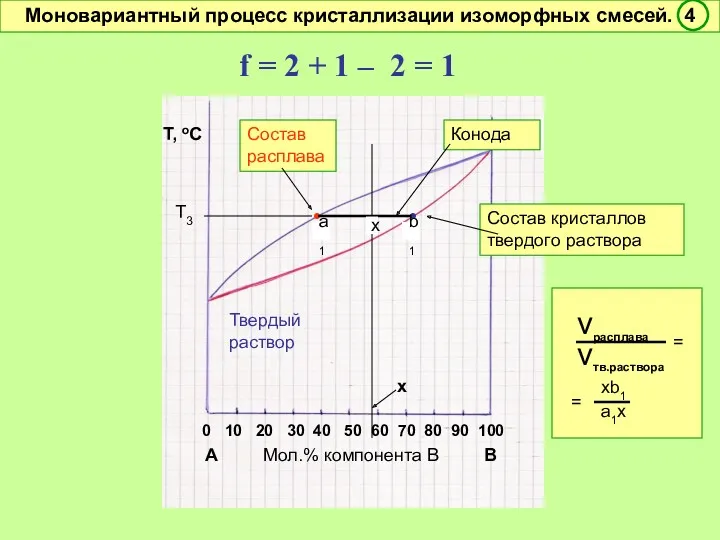
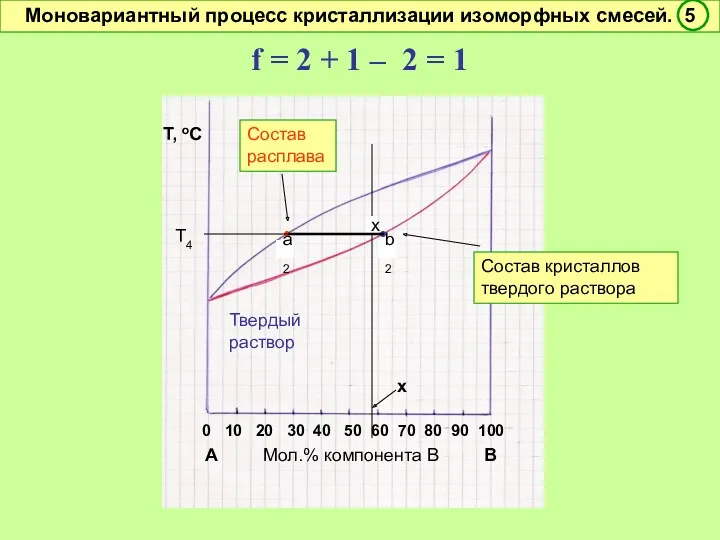
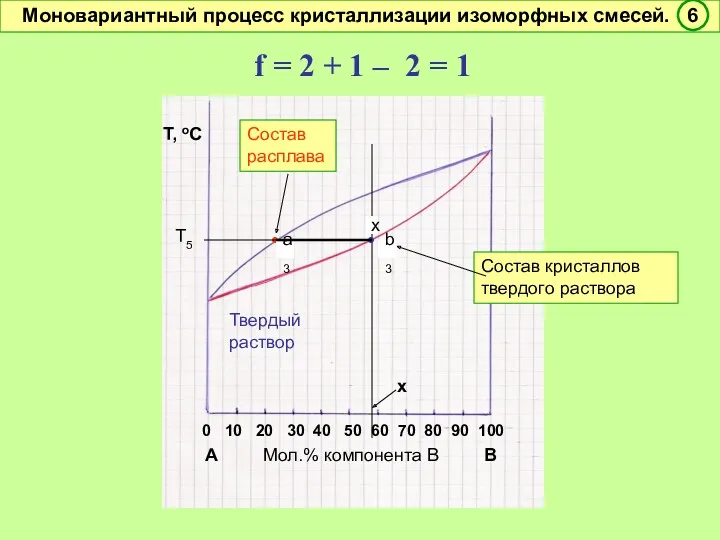
- 47. f = 2 + 1 – 2 = 1 Условно моновариантное превращение. Смысл моновариантности (f =
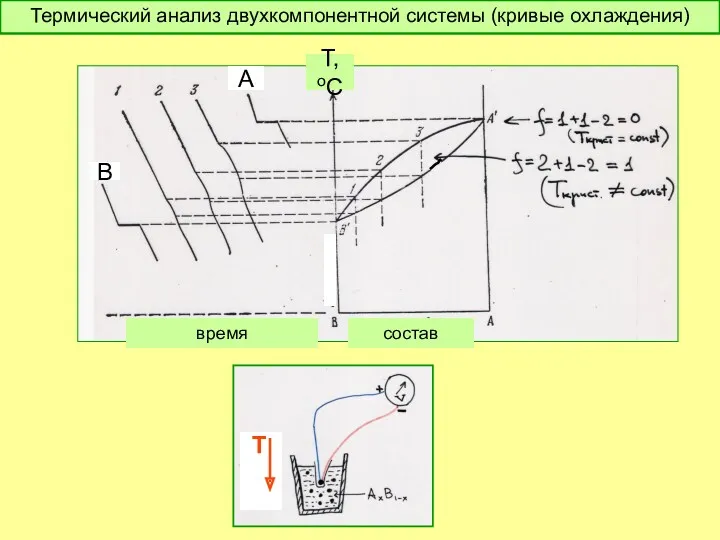
- 48. время В А состав Т,оС Термический анализ двухкомпонентной системы (кривые охлаждения) Т
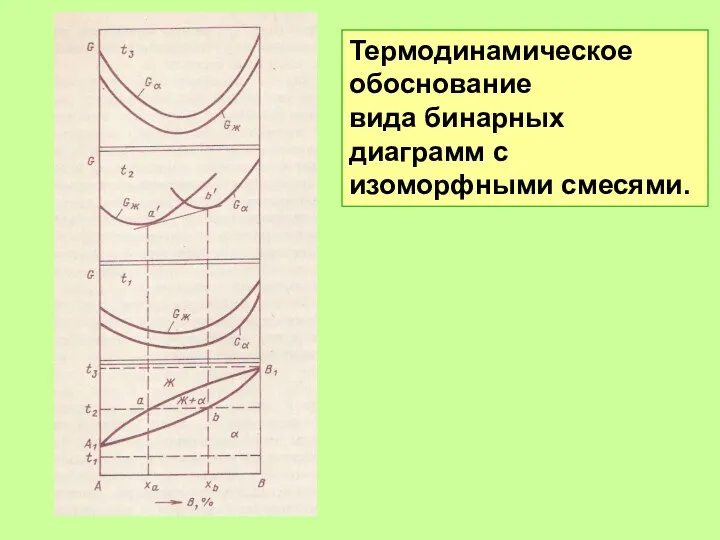
- 49. Термодинамическое обоснование вида бинарных диаграмм с изоморфными смесями.
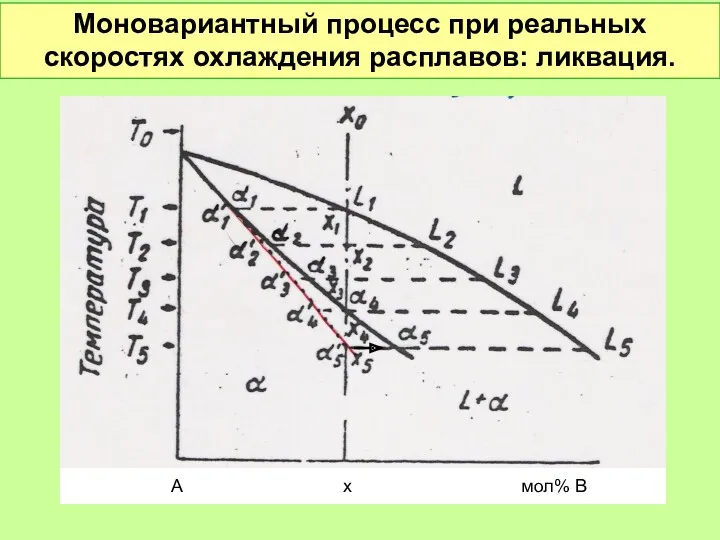
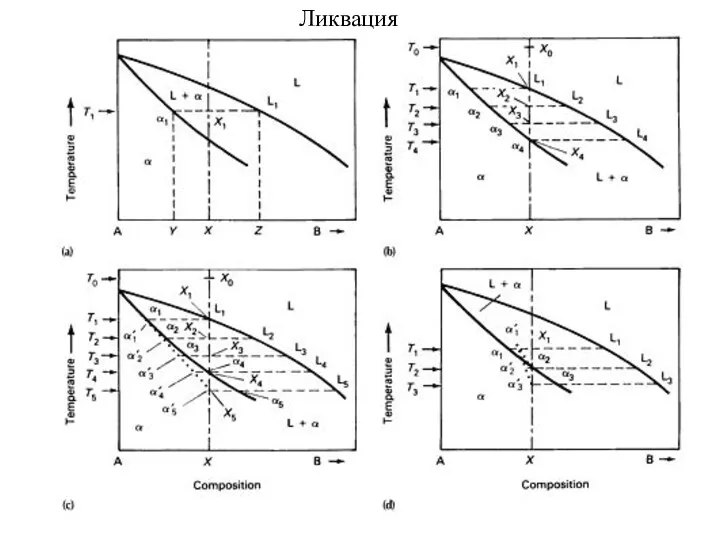
- 50. Моновариантный процесс при реальных скоростях охлаждения расплавов: ликвация. А х мол% В
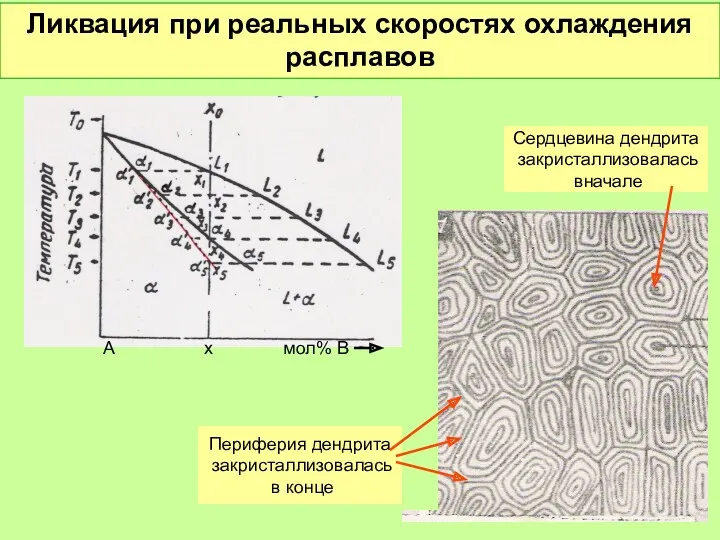
- 51. Ликвация при реальных скоростях охлаждения расплавов А х мол% В Сердцевина дендрита закристаллизовалась вначале Периферия дендрита
- 52. Диффузионный отжиг ликвидирует последствия ликвации Микроструктура сплава Ni0,7Cu0,3 . Увеличение 100 До отжига После отжига Обогащено
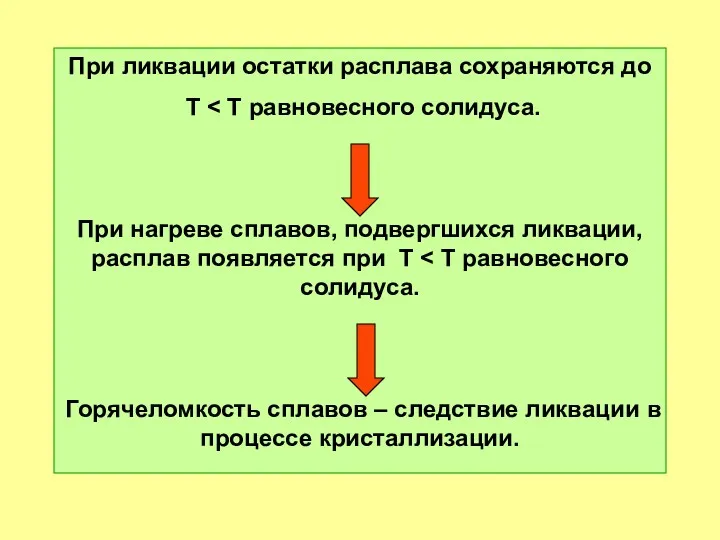
- 53. При ликвации остатки расплава сохраняются до T При нагреве сплавов, подвергшихся ликвации, расплав появляется при T
- 54. Ликвация
- 56. Скачать презентацию


















 Свойства уравнений Максвелла
Свойства уравнений Максвелла Физика – это интересно! Внеклассное мероприятие по физике. 7 класс
Физика – это интересно! Внеклассное мероприятие по физике. 7 класс Механическое движение. Что называют механическим движением?
Механическое движение. Что называют механическим движением? Основные понятия твердотельной электроники
Основные понятия твердотельной электроники Ходовая часть гусеничного трактора
Ходовая часть гусеничного трактора Электрическое явление
Электрическое явление Кинематическая схема станка СТД-120 м
Кинематическая схема станка СТД-120 м Лекция 3: Волновая оптика. Дифракция. Фурье оптика
Лекция 3: Волновая оптика. Дифракция. Фурье оптика Сила тяжести, вес тела
Сила тяжести, вес тела Управляемый термоядерный синтез (УТС)
Управляемый термоядерный синтез (УТС) Вечный двигатель
Вечный двигатель Паровая машина
Паровая машина Последние достижения в области нанотехнологий
Последние достижения в области нанотехнологий Lektsia_16_Fotoeffekt
Lektsia_16_Fotoeffekt Презентация по теме Сила трения
Презентация по теме Сила трения Зачем физика повару?
Зачем физика повару? Лазеры: строение, свойства, основные виды
Лазеры: строение, свойства, основные виды Hot charging area elevator chains
Hot charging area elevator chains Потенциал электростатического поля. Разность потенциалов
Потенциал электростатического поля. Разность потенциалов Статика. Равновесие тел
Статика. Равновесие тел Презентация Параллельное и последовательное соединение
Презентация Параллельное и последовательное соединение Теплообмен при омывании труб
Теплообмен при омывании труб Презентация-игра, 7-8 класс
Презентация-игра, 7-8 класс Импульсные сигналы и переходные процессы. Общие сведения об импульсных сигналах
Импульсные сигналы и переходные процессы. Общие сведения об импульсных сигналах Солнечная энергетика
Солнечная энергетика Подшипники качения
Подшипники качения КАБИНЕТ ФИЗИКИ
КАБИНЕТ ФИЗИКИ Сплошная среда
Сплошная среда