Содержание
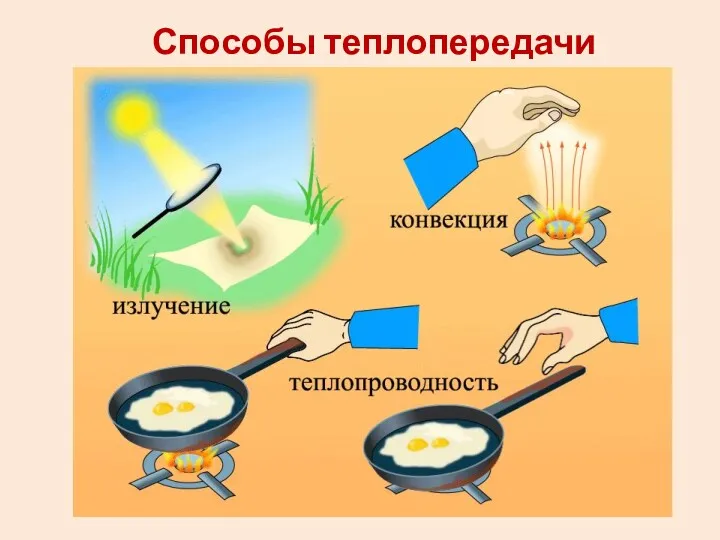
- 2. Способы теплопередачи
- 3. Теплоемкость тела - это количество теплоты, необходимое для нагревания тела на 1 К. Молярная теплоемкость –
- 4. Удельная теплоемкость - это количество теплоты, необходимое для нагревания единицы массы вещества (1 кг) на 1
- 5. Первое начало термодинамики В интегральной форме: Количество теплоты, сообщенное системе, идет на увеличение внутренней энергии системы
- 6. Расчет молярных теплоемкостей в изопроцессах 1. Изотермический процесс. I НТД
- 7. В изохорном процессе 2. Изохорный процесс.
- 8. 3. Изобарный процесс работа моля газа при нагревании на 1 К
- 9. Из уравнения М-К: Уравнение Майера
- 10. Отношение теплоемкостей : - коэффициент Пуассона
- 11. Адиабатический процесс Адиабатический процесс происходит без теплообмена с внешней средой. Газ совершает работу за счет своей
- 12. Уравнение Пуассона для адиабатного процесса или
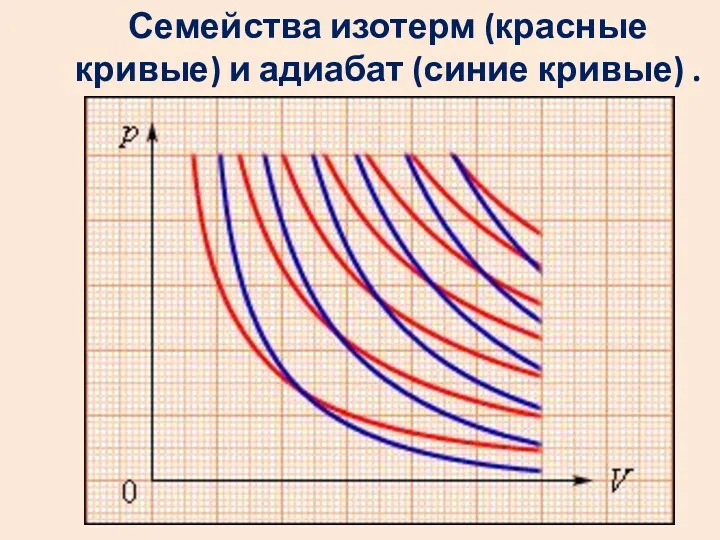
- 13. Семейства изотерм (красные кривые) и адиабат (синие кривые) .
- 14. Работа в адиабатическом процессе
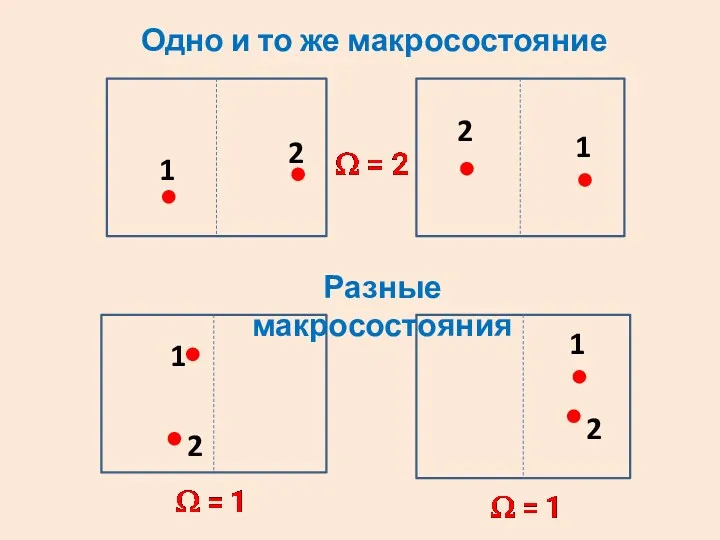
- 15. Макро- и микросостояния Макросостояние – это состояние, заданное с помощью величин, характеризующих всю систему в целом
- 16. 1 1 1 1 2 2 2 2 Одно и то же макросостояние Разные макросостояния
- 17. Число микросостояний , соответст-вующих данному макросостоянию, называют термодинамической вероятностью или статистическим весом этого макросостояния.
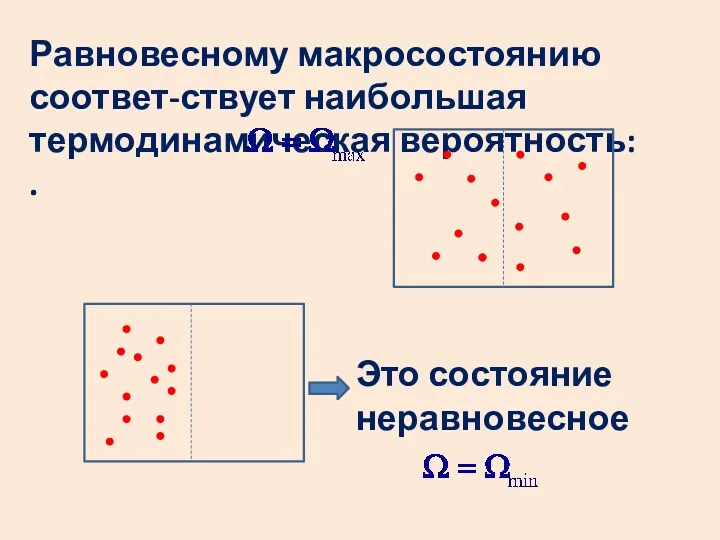
- 18. Равновесному макросостоянию соответ-ствует наибольшая термодинамическая вероятность: . Это состояние неравновесное
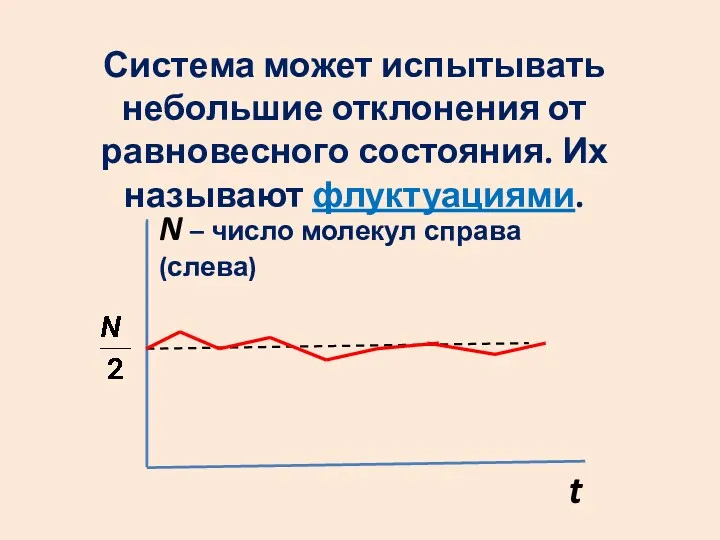
- 19. Система может испытывать небольшие отклонения от равновесного состояния. Их называют флуктуациями. t N – число молекул
- 20. Обратимый процесс может происходить как в прямом, так и в обратном направлении через те же промежуточные
- 21. К обратимым процессам относятся процессы, представляющие собой непрерывную последовательность равновесных состояний, например, очень медленно протекающие процессы.
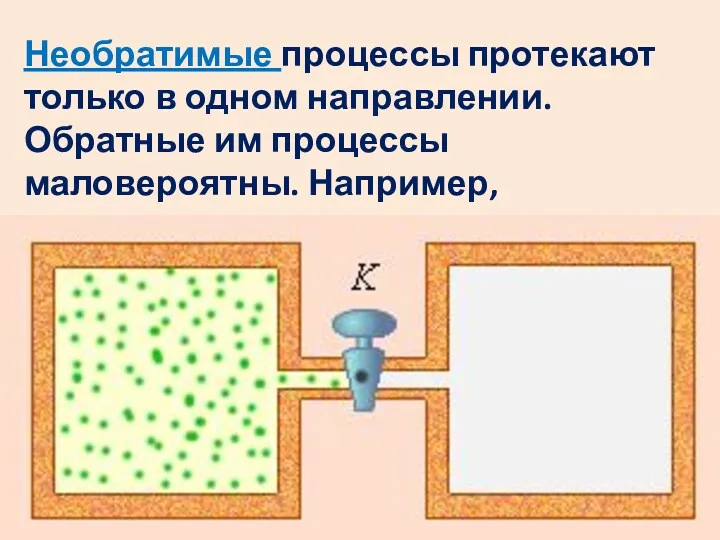
- 22. Необратимые процессы протекают только в одном направлении. Обратные им процессы маловероятны. Например, расширение газа в пустоту.
- 23. Энтропия Величину называют энтропией. Энтропия характеризует степень молекулярного беспорядка. Упорядоченные состояния реализуются малым числом способов –
- 24. Второе начало термодинамики В изолированной системе энтропия не убывает. Она увеличивается при необратимом процессе и остается
- 25. Вычисление энтропии Отношение называют приведенной теплотой. В обратимом процессе
- 26. Для адиабатического процесса . S = const. Это изоэнтропный процесс.
- 27. Выразим давление из ур-я М-К:
- 28. Третье начало термодинамики (теорема Нернста ) 1. Любая теплоемкость системы при T 0 стремится к нулю.
- 29. Круговые процессы (циклы) Круговым процессом или циклом называется такой процесс, по завершении которого система возвращается в
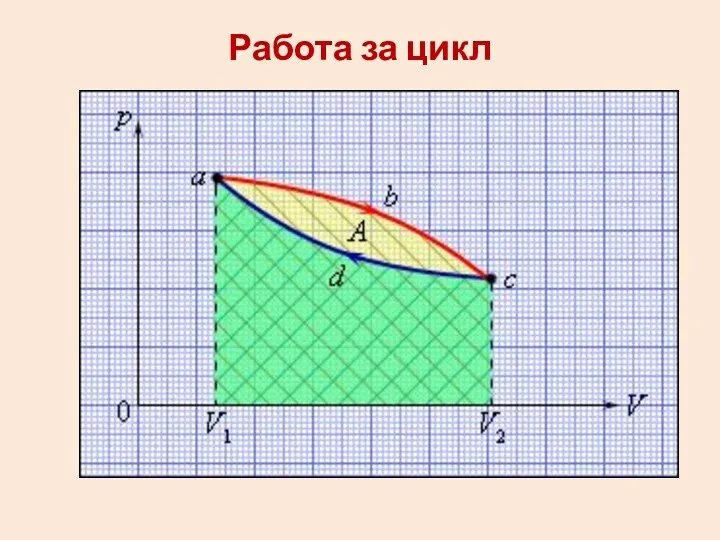
- 30. Работа за цикл
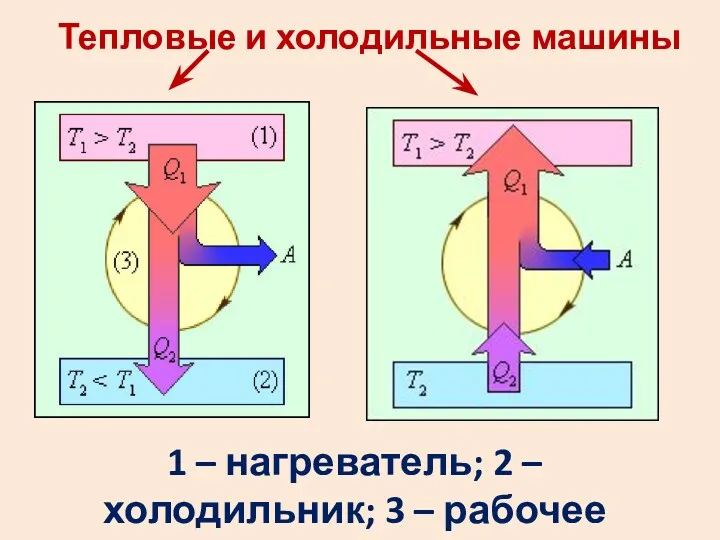
- 31. Тепловые и холодильные машины 1 – нагреватель; 2 – холодильник; 3 – рабочее тело
- 32. КПД тепловой машины прямой цикл
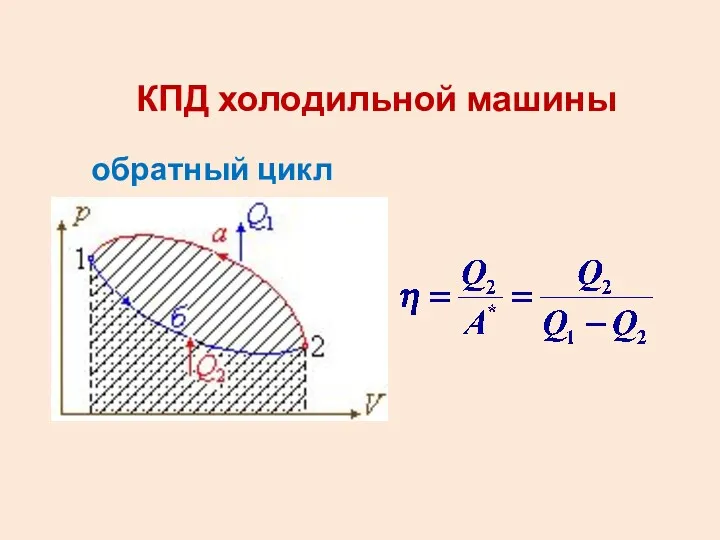
- 33. КПД холодильной машины обратный цикл
- 35. Скачать презентацию























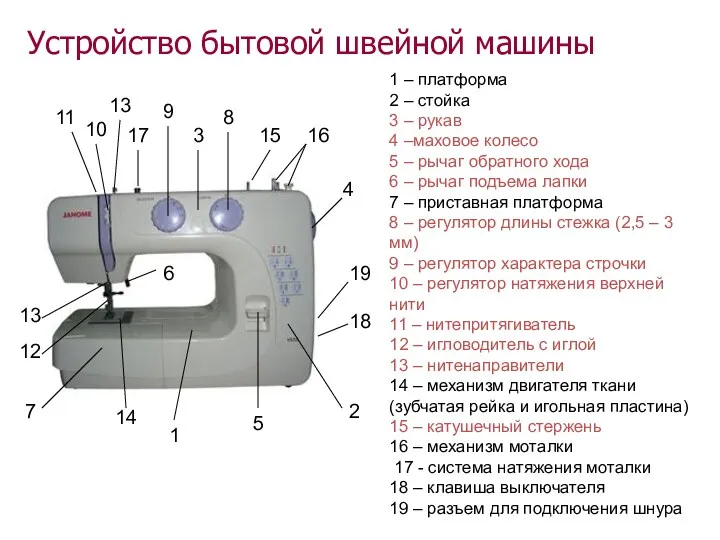 Устройство шв_маш (2)
Устройство шв_маш (2) Амперметр. Измерение силы тока
Амперметр. Измерение силы тока Архимедова сила
Архимедова сила Расчет системы общего искусственного освещения
Расчет системы общего искусственного освещения Автосцепное устройство
Автосцепное устройство Каталитические нейтрализаторы отработавших газов бензиновых двигателей внутреннего сгорания
Каталитические нейтрализаторы отработавших газов бензиновых двигателей внутреннего сгорания Ультрадыбыстық өңдеу (УДӨ)
Ультрадыбыстық өңдеу (УДӨ) Радиациялық сәулелену
Радиациялық сәулелену Ремонт генератора
Ремонт генератора Притяжение Земли
Притяжение Земли Дозиметрія та радіометрія
Дозиметрія та радіометрія Проект производственного участка по ТО и ремонту приборов системы питания автомобилей с дизельными двигателями
Проект производственного участка по ТО и ремонту приборов системы питания автомобилей с дизельными двигателями Другий закон Ньютона
Другий закон Ньютона Урок по теме Расчёт пути и времени движения 7 класс
Урок по теме Расчёт пути и времени движения 7 класс Фотометрия. Виды источников света
Фотометрия. Виды источников света Alternating Current motors
Alternating Current motors Квантовая теория. Лекция V
Квантовая теория. Лекция V Открытый урок по физике 7 класс. Плавание тел
Открытый урок по физике 7 класс. Плавание тел МЕТОДИКА ИЗУЧЕНИЯ СВОЙСТВ ВЕЩЕСТВА В КУРСЕ ФИЗИКИ В СИСТЕМЕ СРЕДНЕГО ОБРАЗОВАНИЯ ПРИ РЕАЛИЗАЦИИ ФГОС
МЕТОДИКА ИЗУЧЕНИЯ СВОЙСТВ ВЕЩЕСТВА В КУРСЕ ФИЗИКИ В СИСТЕМЕ СРЕДНЕГО ОБРАЗОВАНИЯ ПРИ РЕАЛИЗАЦИИ ФГОС пРЕЗЕНТАЦИЯ: нАНО ТЕХНОЛОГИИ В ФИЗИКЕ
пРЕЗЕНТАЦИЯ: нАНО ТЕХНОЛОГИИ В ФИЗИКЕ Обобщающий урок по физике в 7 классе по теме: Давление
Обобщающий урок по физике в 7 классе по теме: Давление Применение БИК-спектроскопии при производстве, контроле качества лс и выявлении недоброкачественных и фальсифицированных лс
Применение БИК-спектроскопии при производстве, контроле качества лс и выявлении недоброкачественных и фальсифицированных лс Теплопроводность
Теплопроводность Capacitors
Capacitors Презентация к уроку физики по теме Сила тяжести.Вес тела
Презентация к уроку физики по теме Сила тяжести.Вес тела Измерительные приборы в физике
Измерительные приборы в физике Презентация к уроку по физике на тему Агрегатные состояния вещества для 7 класса
Презентация к уроку по физике на тему Агрегатные состояния вещества для 7 класса Решение задач на расчет массы и объёма тела по его плотности. Физика. 7 класс
Решение задач на расчет массы и объёма тела по его плотности. Физика. 7 класс