Содержание
- 2. Бор Нильс Хенрик Давид (7.10.1885—18.11.1962) Датский физик, один из создателей современной физики. Основатель (1920) и руководитель
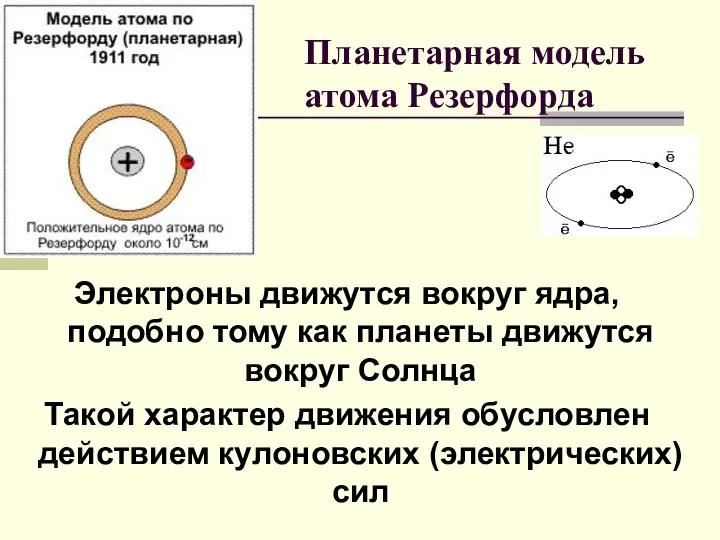
- 3. Электроны движутся вокруг ядра, подобно тому как планеты движутся вокруг Солнца Такой характер движения обусловлен действием
- 4. Модель Резерфорда 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома
- 5. явилась крупным шагом в развитии знаний о строении атома. оказалась очень наглядной и полезной для объяснения
- 6. Модель атома Резерфорда не смогла объяснить все свойства атомов. По законам классической физики атом должен излучать
- 7. Никаких доказательств того, что атомы непрерывно исчезают, не было, отсюда следовало, что модель Резерфорда в чем-то
- 8. В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных на модели Резерфорда, возникла потому,
- 9. Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения
- 10. Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная
- 11. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам.
- 12. ПОСТУЛАТЫ БОРА I I постулат При движении по стационарным орбитам электрон не излучает и не поглощает
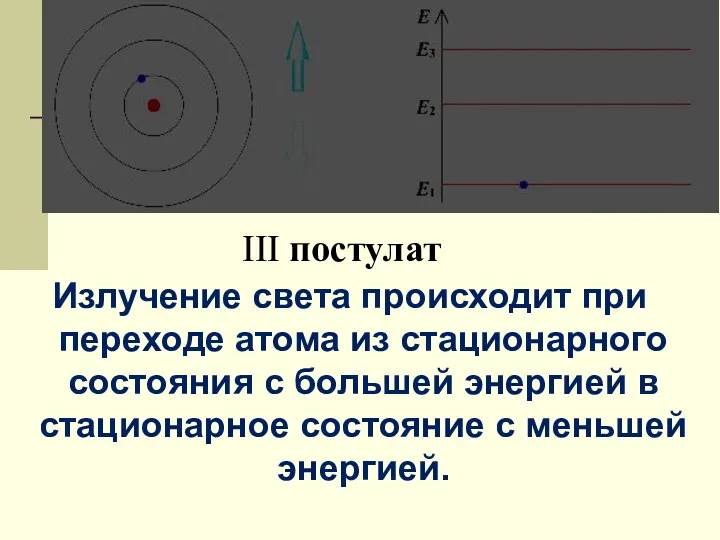
- 13. III постулат Излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное
- 14. энергия испущенного атомом фотона равна разности энергий стационарных состояний, а частота излучения определяется по формуле: Ek
- 15. Таким образом, Бор предположил, что электрон в атоме не подчиняется законам классической физики. ПОСТУЛАТЫ БОРА
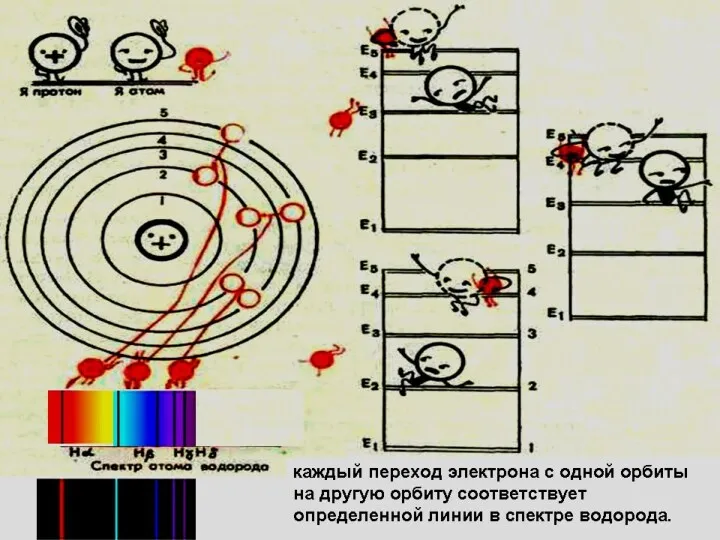
- 16. Свои постулаты Бор применил для объяснения излучения и поглощения света атомом водорода. Третий постулат позволяет вычислить
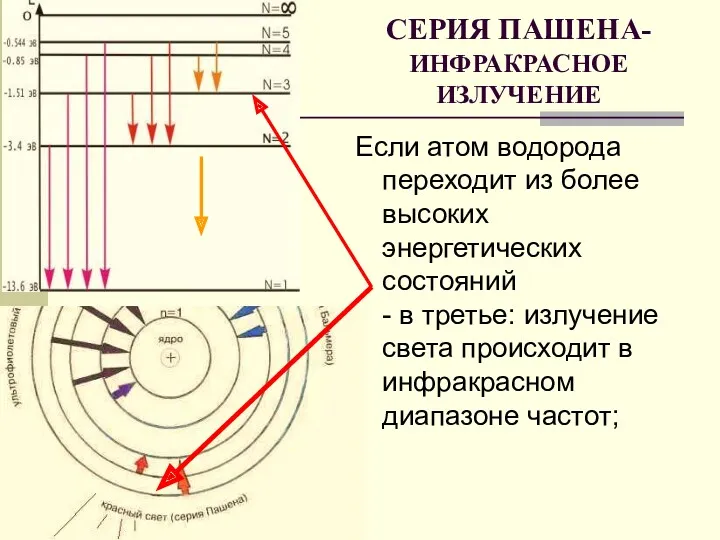
- 18. Если атом водорода переходит из более высоких энергетических состояний - в третье: излучение света происходит в
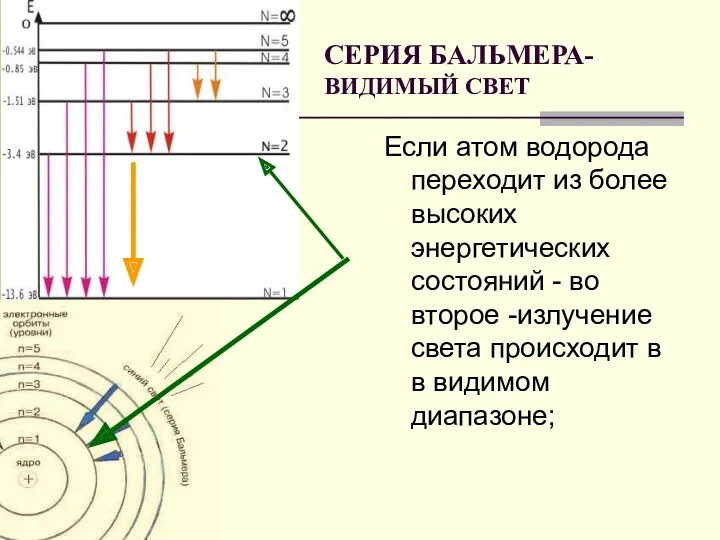
- 19. Если атом водорода переходит из более высоких энергетических состояний - во второе -излучение света происходит в
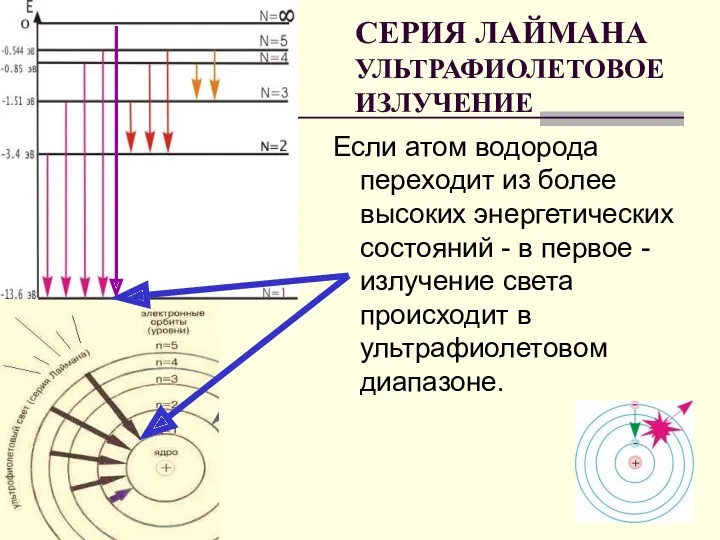
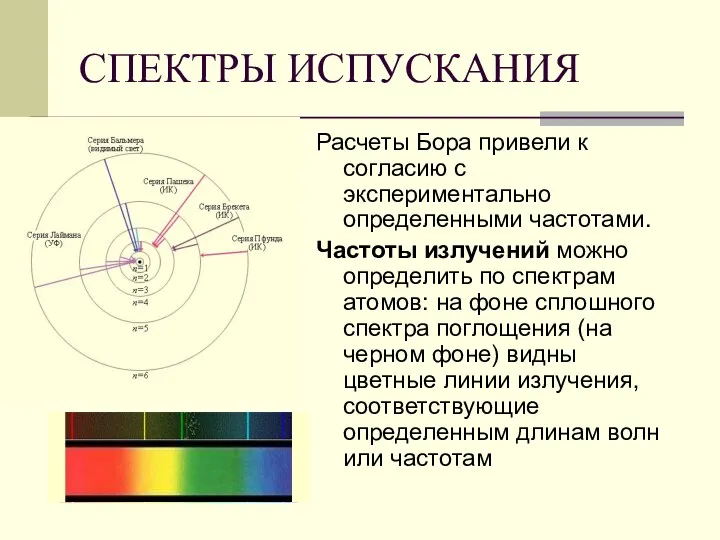
- 20. СЕРИЯ ЛАЙМАНА УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ Если атом водорода переходит из более высоких энергетических состояний - в первое
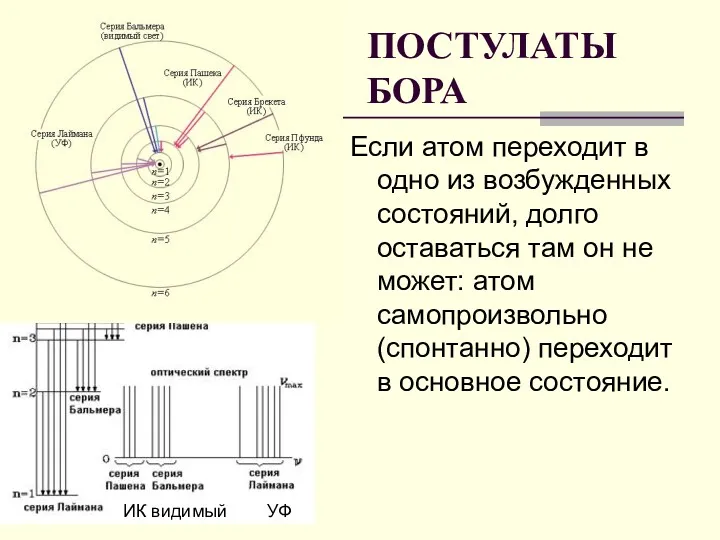
- 21. Если атом переходит в одно из возбужденных состояний, долго оставаться там он не может: атом самопроизвольно
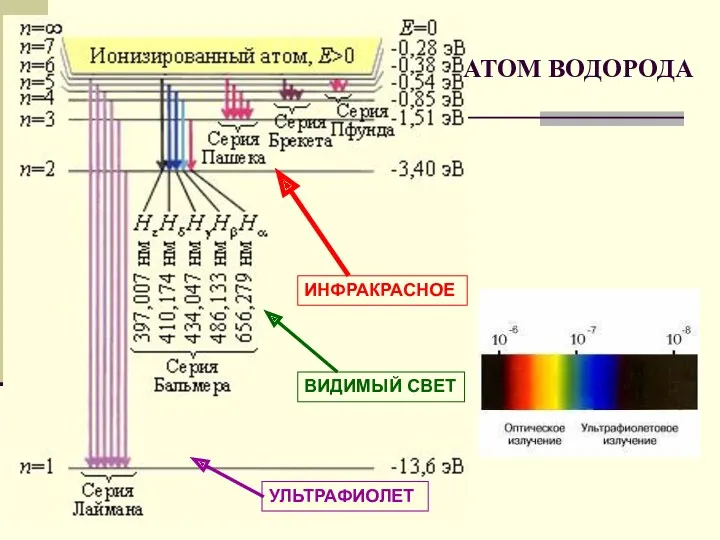
- 22. УЛЬТРАФИОЛЕТ ВИДИМЫЙ СВЕТ АТОМ ВОДОРОДА ИНФРАКРАСНОЕ
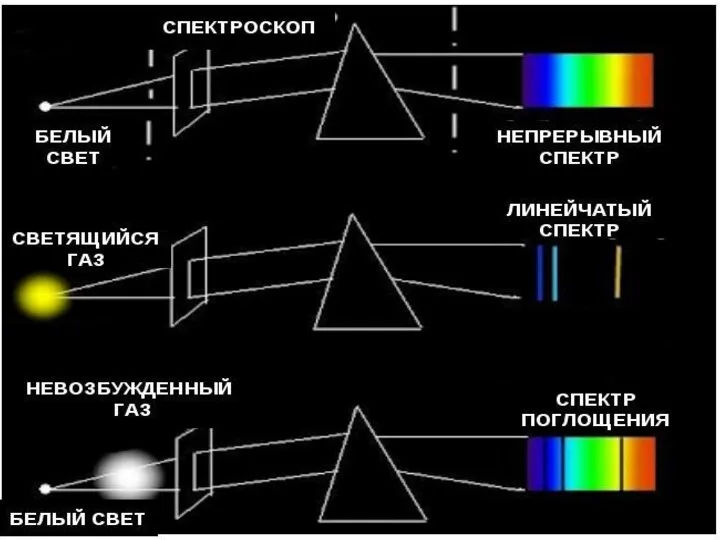
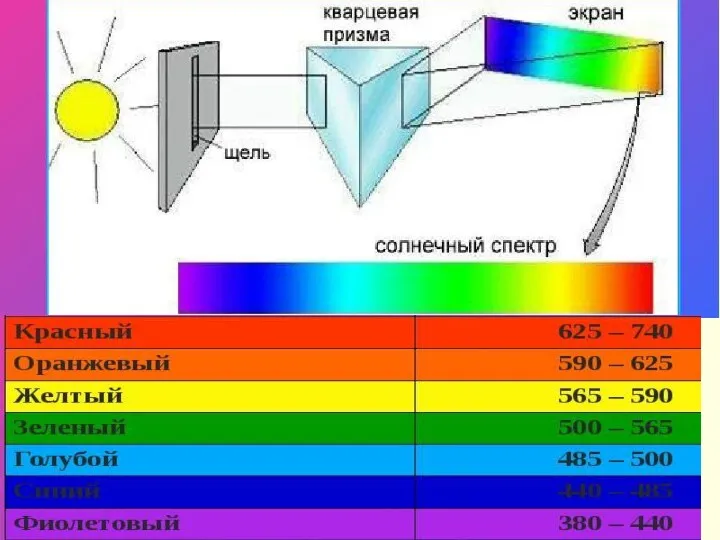
- 23. Для получения спектров используют специальные приборы СПЕКТРОСКОПЫ Исследование спектров испускания и поглощения позволяет установить качественный состав
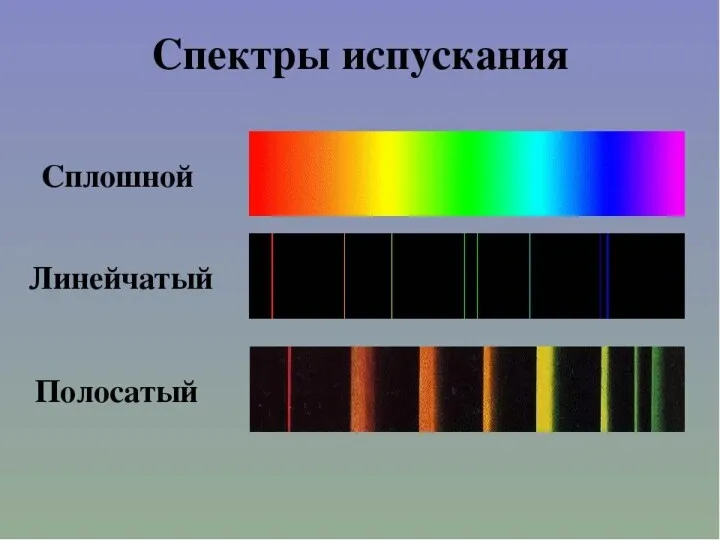
- 25. Виды спектров Непрерывные или сплошные Излучают нагретые тела в твёрдом и жидком состоянии, сильно сжатые газы,
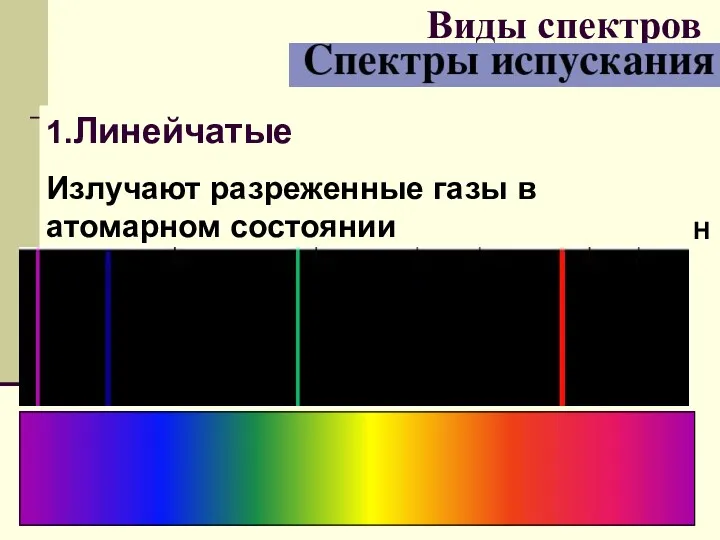
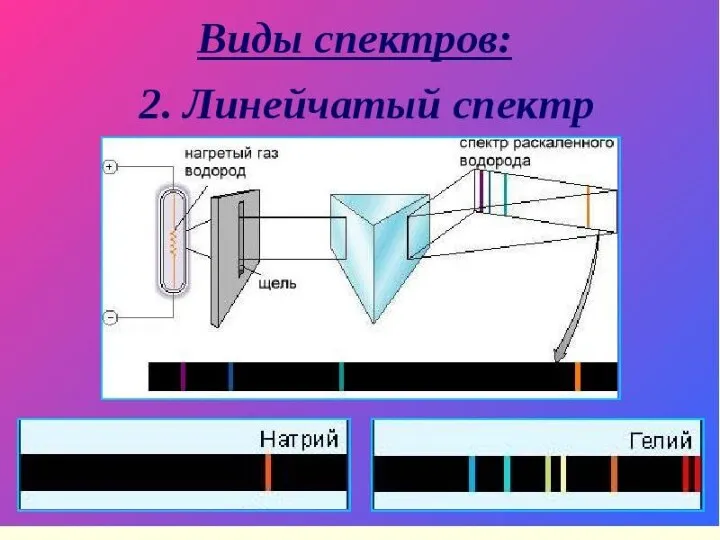
- 28. 1.Линейчатые Излучают разреженные газы в атомарном состоянии Виды спектров Н
- 29. спектры излучения состоит из узких линий разного цвета. Такой спектр называется линейчатым спектром излучения. Для получения
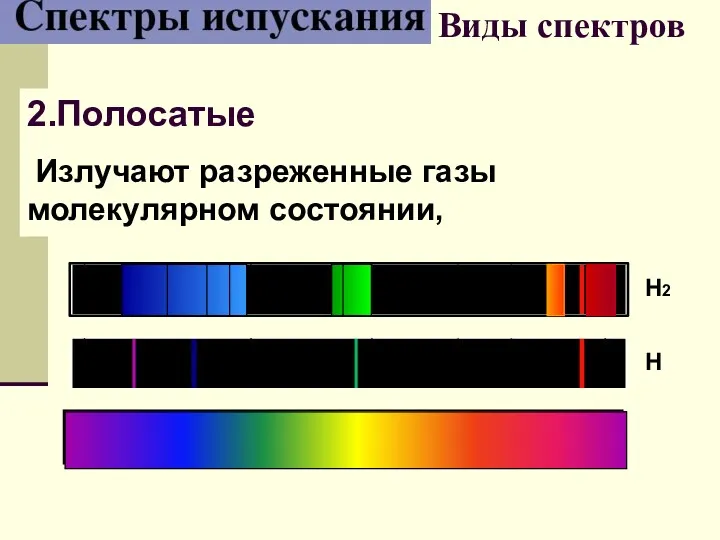
- 32. Виды спектров 2.Полосатые Излучают разреженные газы молекулярном состоянии, Н Н2
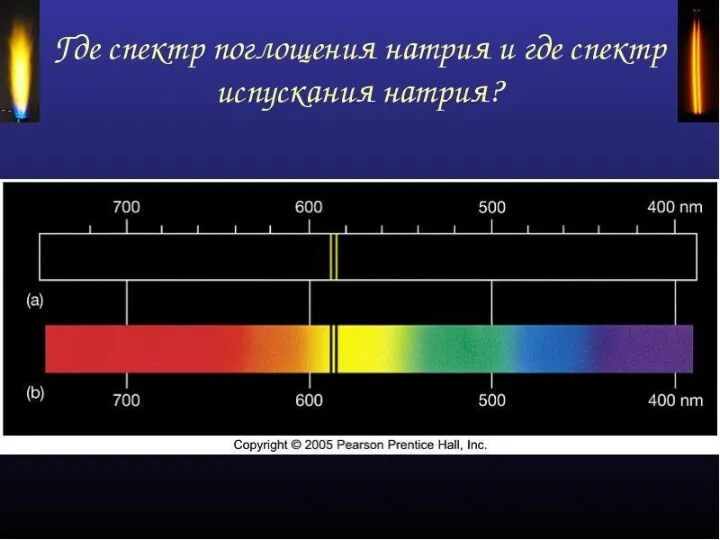
- 35. СПЕКТРЫ ПОГЛОЩЕНИЯ Поглощение света- процесс, обратный излучению: атом переходит из низших энергетических состояний в высшие. При
- 36. Спектры поглощения Спектры поглощения получают, пропуская свет от источника. дающего сплошной спектр, через вещество, атомы которого
- 37. получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы которого находятся в невозбужденном, состоянии
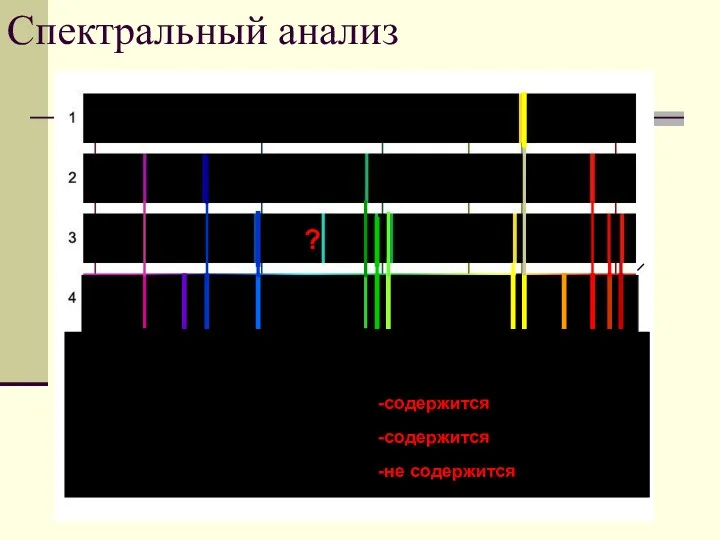
- 39. Метод определения качественного и количественного состава вещества по его спектру называется спектральным анализом. Зная длины волн,
- 40. Спектральный анализ ? Содержится ли в смеси газов (спектр4): А) натрий (спектр1) Б) водород (спектр 2)
- 43. СПЕКТРЫ ИСПУСКАНИЯ Расчеты Бора привели к согласию с экспериментально определенными частотами. Частоты излучений можно определить по
- 44. СПЕКТРЫ ИСПУСКАНИЯ СПЕКТРЫ ПОГЛОЩЕНИЯ 1-сплошной 2-натрия 3-водорода 4-гелия 5-солнечный 6-натрия 7-водорода 8-гелия
- 46. Построить количественную теорию уже следующего за водородом атома гелия на основе боровских представлений оказалось затруднительным
- 47. Исследование линейчатого спектра вещества позволяет определить, из каких химических элементов оно состоит и в каком количестве
- 48. С помощью спектрального анализа можно обнаружить в пробе присутствие золота; Определение марки стали методом спектрального анализа
- 50. Скачать презентацию






























 Закон всемирного тяготения
Закон всемирного тяготения Основные положения МКТ
Основные положения МКТ презентация проектно-исследовательская деятельность
презентация проектно-исследовательская деятельность Потенциальная энергия заряженного тела в однородном электростатическом поле. Потенциал поля и разность потенциалов
Потенциальная энергия заряженного тела в однородном электростатическом поле. Потенциал поля и разность потенциалов Да здравствует физика!
Да здравствует физика! Тепловые двигатели
Тепловые двигатели Устройство, техническое обслуживание и ремонт системы питания двигателя ВАЗ 2110 Калина (инжектор)
Устройство, техническое обслуживание и ремонт системы питания двигателя ВАЗ 2110 Калина (инжектор) Lasers in scientific research
Lasers in scientific research Температура тел. Шкалы и приборы измерения температуры
Температура тел. Шкалы и приборы измерения температуры Radiation-induced desorption of excited atoms from solid nitrogen
Radiation-induced desorption of excited atoms from solid nitrogen Электродинамика
Электродинамика Электр қауіпсіздігі
Электр қауіпсіздігі Электрооборудование автомобилей. Сигнальное оборудование. (Урок 8)
Электрооборудование автомобилей. Сигнальное оборудование. (Урок 8) Отражение в горизонтальном зеркале
Отражение в горизонтальном зеркале Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Гидравлическая система трактора Белорус МТЗ 1221
Гидравлическая система трактора Белорус МТЗ 1221 Реактивное движение. Потенциальная и кинетическая энергия. Закон сохранения энергии
Реактивное движение. Потенциальная и кинетическая энергия. Закон сохранения энергии Методи аналізу лінійних електронних кіл
Методи аналізу лінійних електронних кіл Сложение сил. Равнодействующая сил
Сложение сил. Равнодействующая сил Агрегатные состояния вещества: твердые тела, жидкости, газы
Агрегатные состояния вещества: твердые тела, жидкости, газы Масса тела. Измерение массы тела на весах
Масса тела. Измерение массы тела на весах Апарати для дослідження океанічних глибин
Апарати для дослідження океанічних глибин Сказка о волшебном ящичке
Сказка о волшебном ящичке Металлы. Носители заряда
Металлы. Носители заряда Решение задач на движение тела, брошенного под углом к горизонту
Решение задач на движение тела, брошенного под углом к горизонту Напряжение шага
Напряжение шага Схемотехника телекоммуникационных устройств
Схемотехника телекоммуникационных устройств Механізація подрібнення стеблових кормів
Механізація подрібнення стеблових кормів