Содержание
- 2. ТЕОРИЯ АТОМА ВОДОРОДА 1.1. МОДЕЛИ ТОМСОНА И РЕЗЕРФОРДА 1.2. ПОСТУЛАТЫ БОРА 1.3. РАДИУС ОРБИТЫ, СКОРОСТЬ И
- 3. Модель Томсона Модель Томсона: «Пудинг с изюмом» После открытия электрона Томсоном стало ясно, что электроны входят
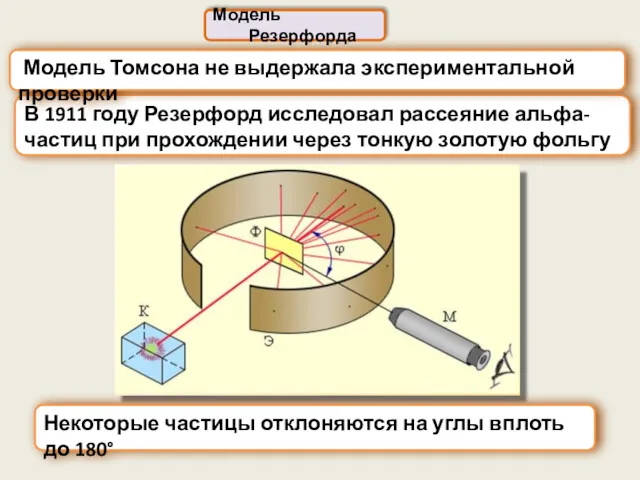
- 4. Модель Резерфорда В 1911 году Резерфорд исследовал рассеяние альфа-частиц при прохождении через тонкую золотую фольгу Модель
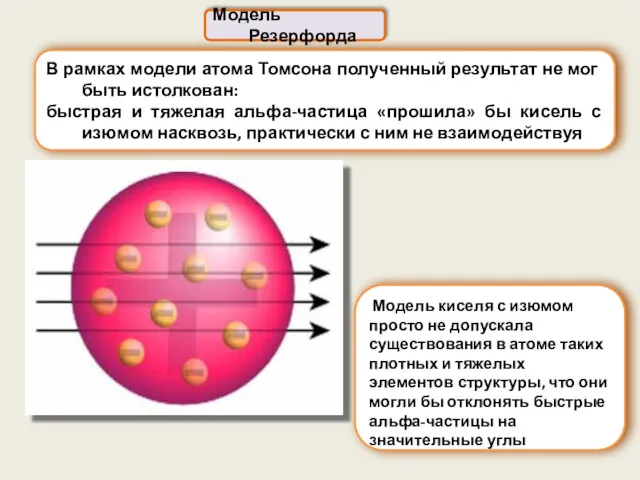
- 5. В рамках модели атома Томсона полученный результат не мог быть истолкован: быстрая и тяжелая альфа-частица «прошила»
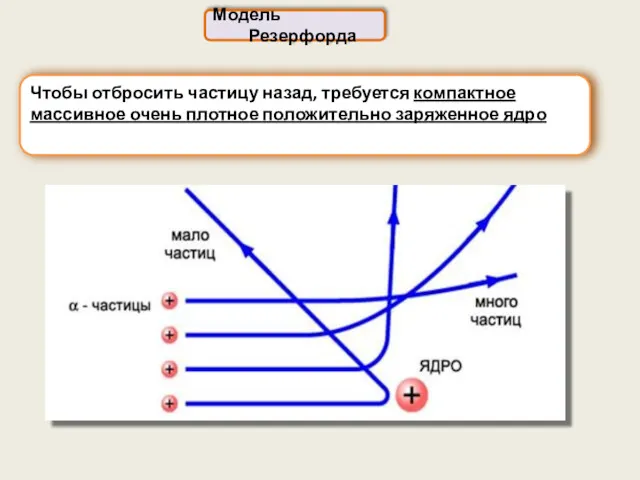
- 6. Модель Резерфорда Чтобы отбросить частицу назад, требуется компактное массивное очень плотное положительно заряженное ядро
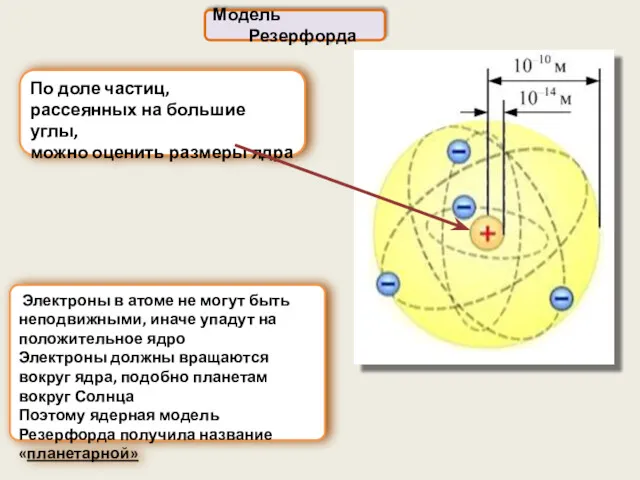
- 7. По доле частиц, рассеянных на большие углы, можно оценить размеры ядра Модель Резерфорда Электроны в атоме
- 8. Трудности планетарной модели Резерфорда Неустойчивость атомов Электрон движется вокруг ядра, следовательно, имеет центростремительное ускорение Любая заряженная
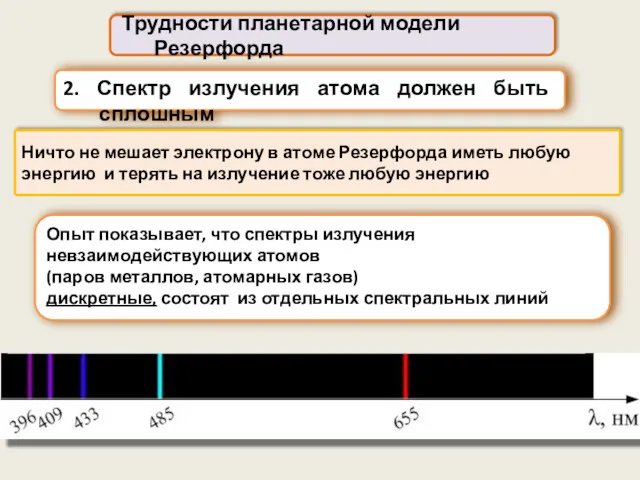
- 9. Трудности планетарной модели Резерфорда 2. Спектр излучения атома должен быть сплошным Ничто не мешает электрону в
- 10. Опыт: спектры излучения атомов дискретные Для водорода: m=3 m=4 m=5 m=6 m=7 R=1.1.107 м-1 – постоянная
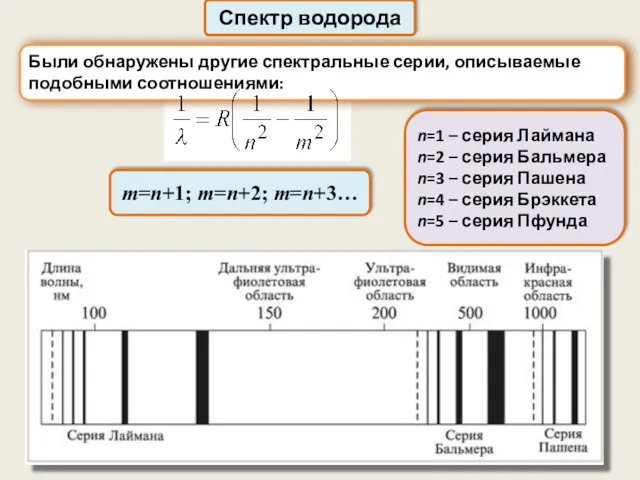
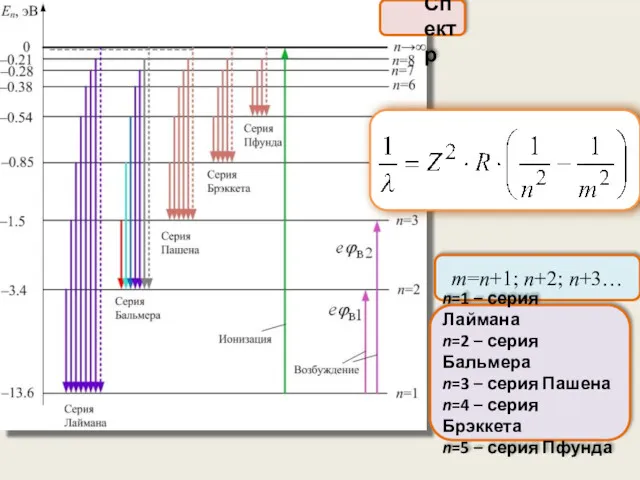
- 11. Спектр водорода Были обнаружены другие спектральные серии, описываемые подобными соотношениями: m=n+1; m=n+2; m=n+3… n=1 – серия
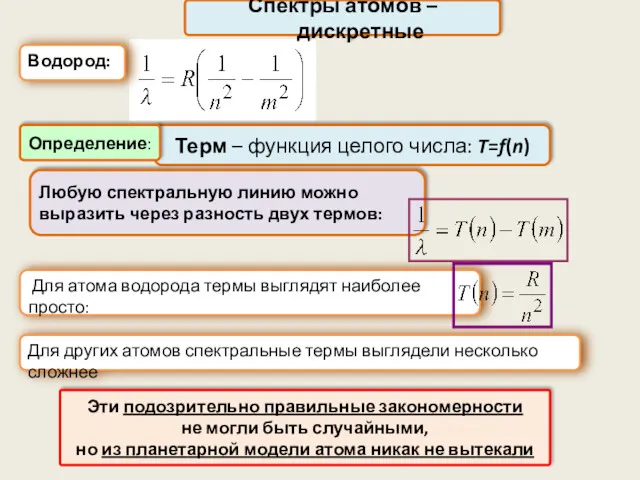
- 12. Спектры атомов –дискретные Водород: Терм – функция целого числа: T=f(n) Любую спектральную линию можно выразить через
- 13. Постулаты Бора Экспериментальных закономерностях в атомных спектрах Квантовом характере излучения и поглощения света Ядерной модели атома
- 14. Постулаты Бора I. Постулат стационарных состояний Электрон в атоме может находиться только на стационарной орбите; при
- 15. Постулаты Бора II. Правило частот Энергия излучается или поглощается атомом только при переходе электрона между стационарными
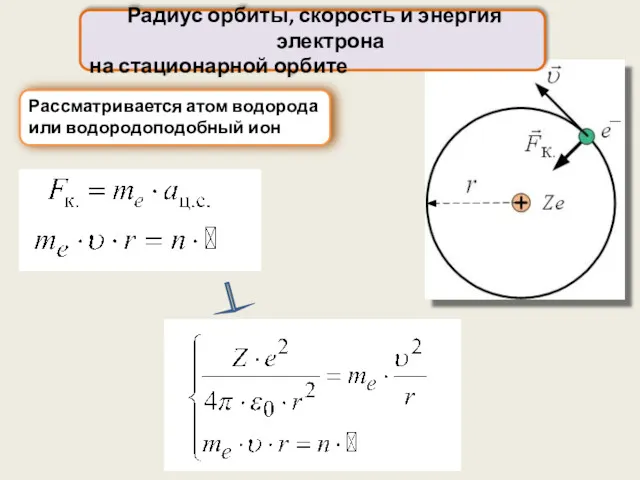
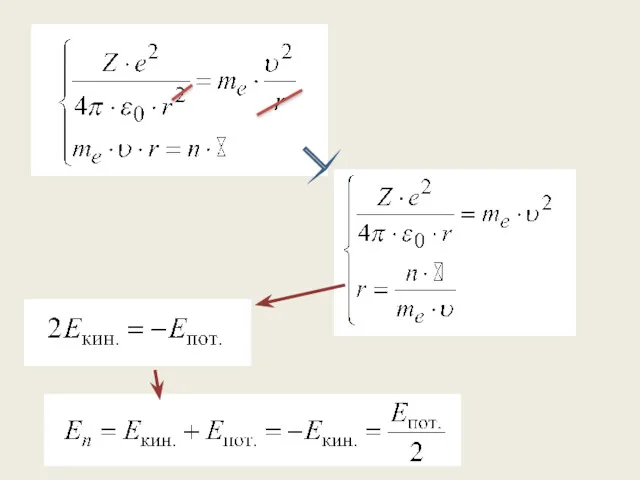
- 16. Радиус орбиты, скорость и энергия электрона на стационарной орбите Рассматривается атом водорода или водородоподобный ион
- 18. Скорость электрона на стационарной орбите 2
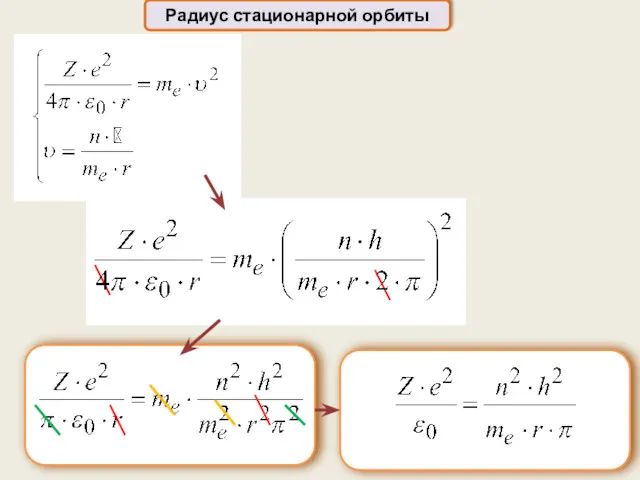
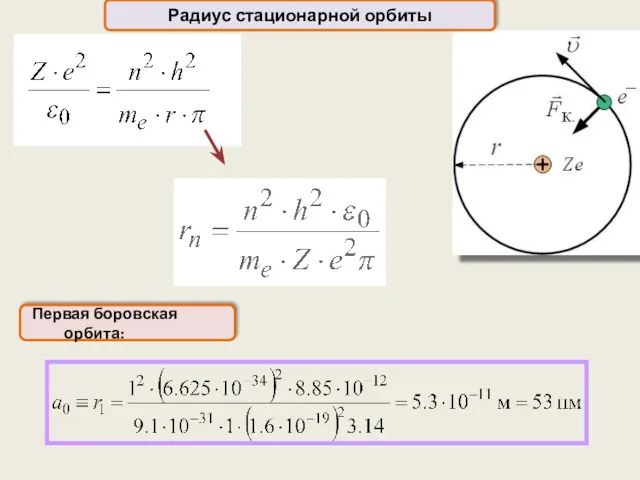
- 19. Радиус стационарной орбиты
- 20. Радиус стационарной орбиты Первая боровская орбита:
- 21. Энергия электрпона на стационарной орбите Обозначение:
- 22. Схема уровней энергии атома водорода
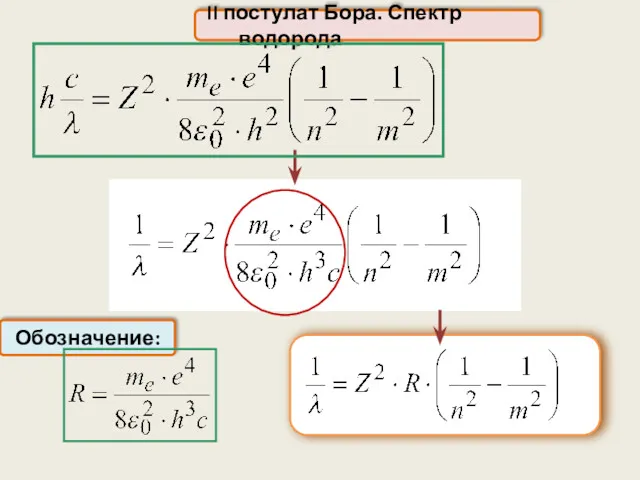
- 23. II постулат Бора
- 24. II постулат Бора. Спектр водорода Обозначение:
- 25. Спектр m=n+1; n+2; n+3… n=1 – серия Лаймана n=2 – серия Бальмера n=3 – серия Пашена
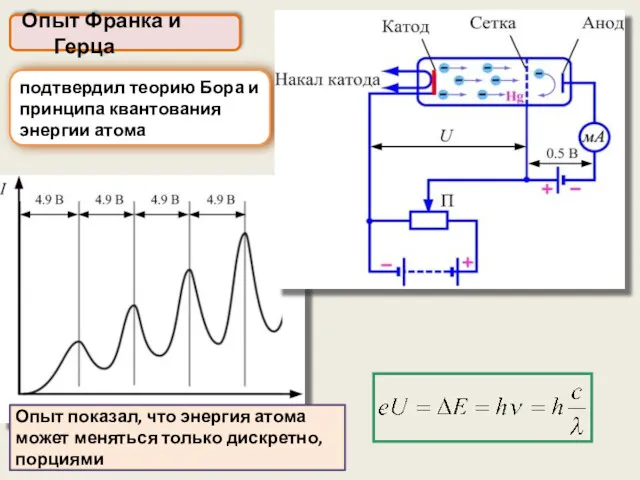
- 26. Опыт Франка и Герца подтвердил теорию Бора и принципа квантования энергии атома Опыт показал, что энергия
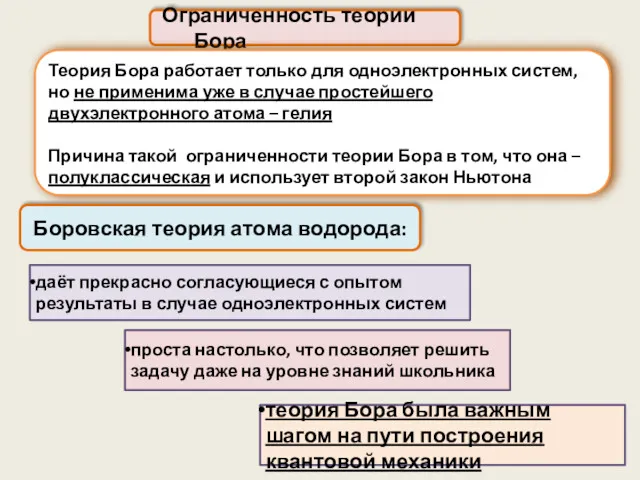
- 27. Ограниченность теории Бора Теория Бора работает только для одноэлектронных систем, но не применима уже в случае
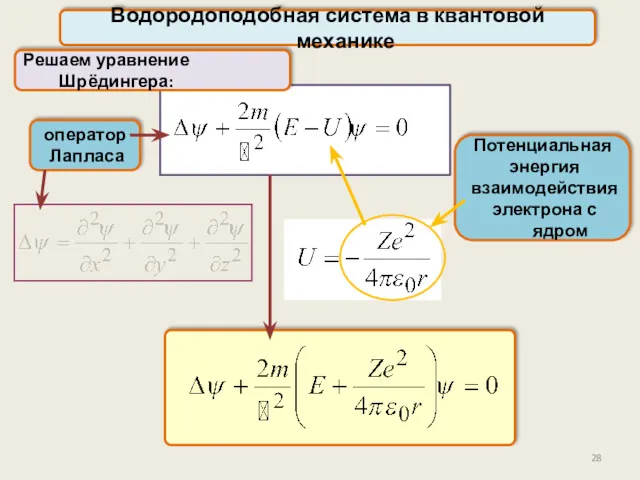
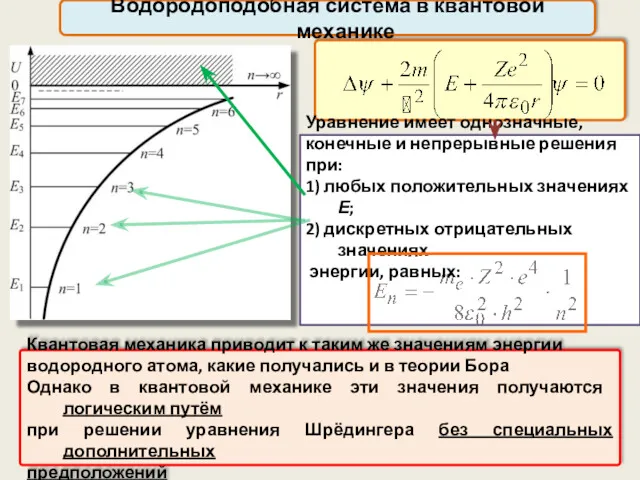
- 28. Водородоподобная система в квантовой механике Решаем уравнение Шрёдингера: оператор Лапласа Потенциальная энергия взаимодействия электрона с ядром
- 29. Водородоподобная система в квантовой механике Квантовая механика приводит к таким же значениям энергии водородного атома, какие
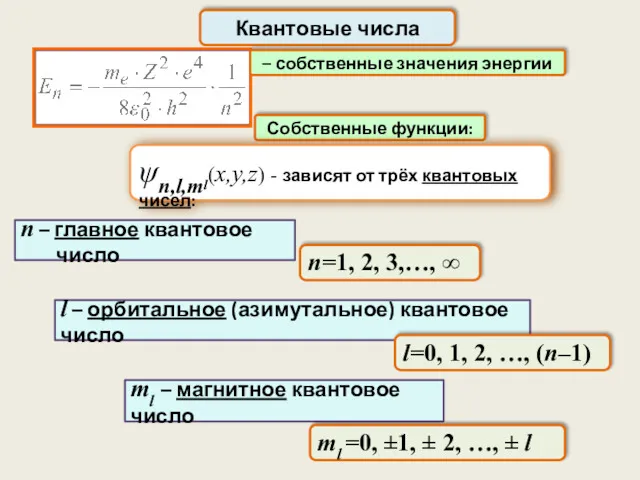
- 30. Квантовые числа – собственные значения энергии Собственные функции: ψn,l,ml(x,y,z) - зависят от трёх квантовых чисел: n
- 31. n – главное квантовое число n=1, 2, 3,…, ∞ определяет энергию водородоподобной системы и размеры электронного
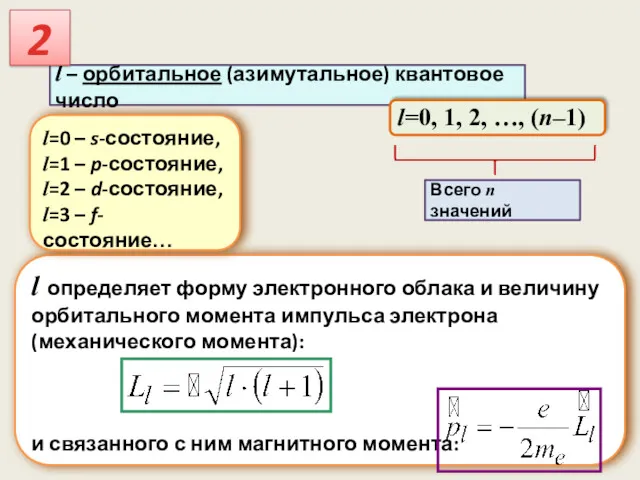
- 32. l – орбитальное (азимутальное) квантовое число l=0, 1, 2, …, (n–1) l определяет форму электронного облака
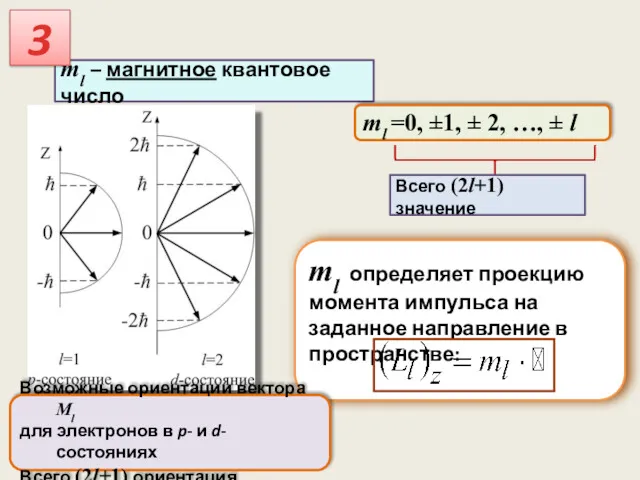
- 33. ml определяет проекцию момента импульса на заданное направление в пространстве: Всего (2l+1) значение ml – магнитное
- 34. Каждому En, кроме E1, соответствует несколько волновых функций ψnlm, отличающихся значениями квантовых чисел l и ml
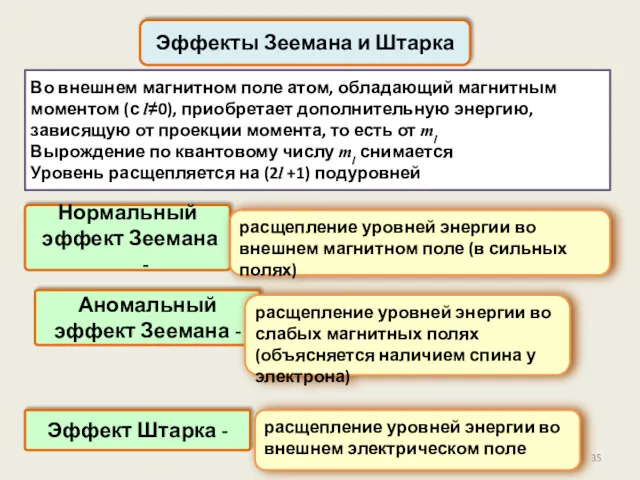
- 35. Во внешнем магнитном поле атом, обладающий магнитным моментом (с l≠0), приобретает дополнительную энергию, зависящую от проекции
- 36. Эффекты Зеемана и Штарка Спектры усложняются
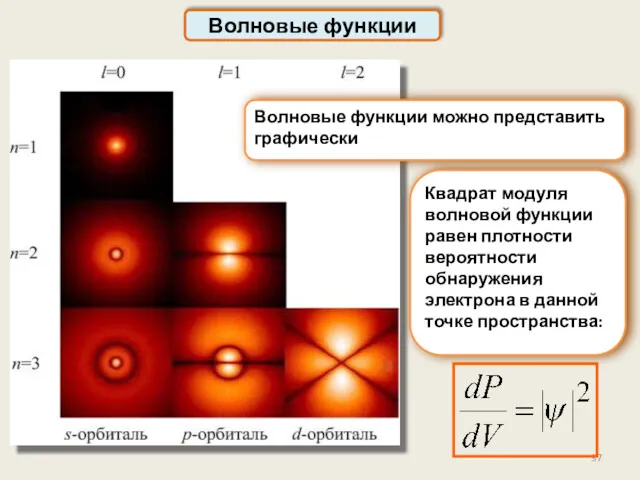
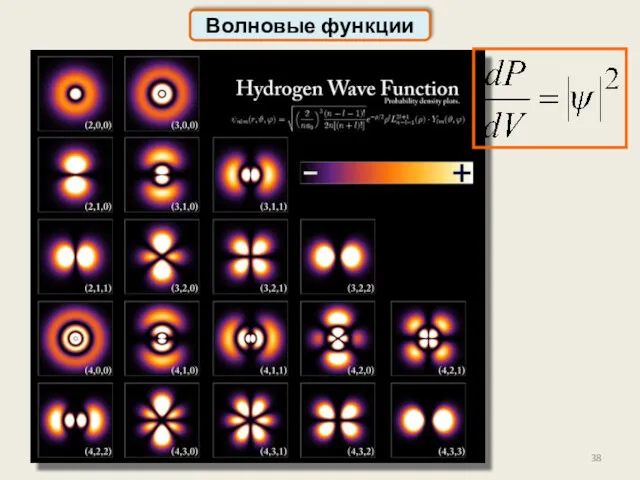
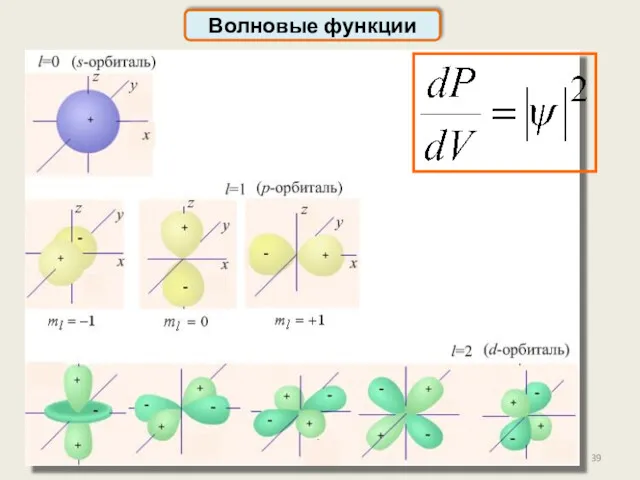
- 37. Волновые функции Волновые функции можно представить графически Квадрат модуля волновой функции равен плотности вероятности обнаружения электрона
- 38. Волновые функции
- 39. Волновые функции
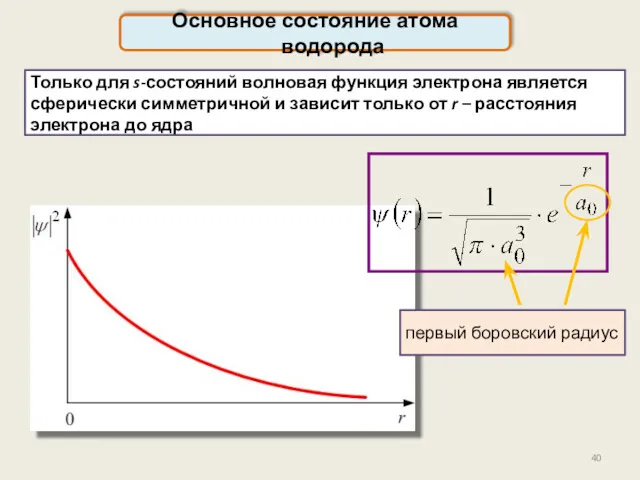
- 40. Основное состояние атома водорода Только для s-состояний волновая функция электрона является сферически симметричной и зависит только
- 41. Основное состояние атома водорода Найдём вероятность того, что электрон находится на расстоянии r от ядра, точнее
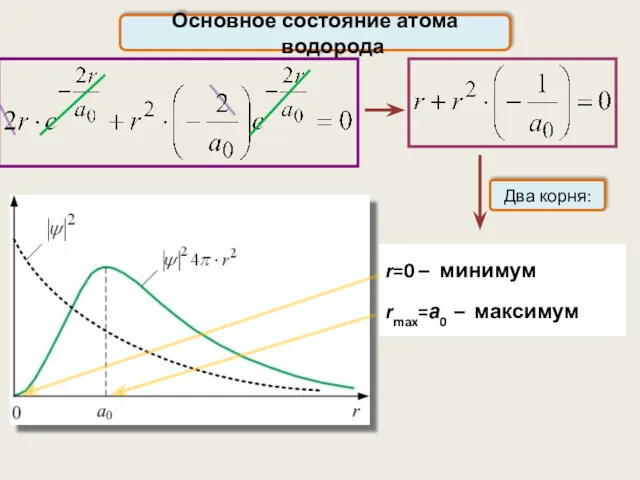
- 42. Основное состояние атома водорода Находим положение максимума функции f(r):
- 43. Основное состояние атома водорода Находим максимальное значение функции f(r):
- 44. Основное состояние атома водорода
- 45. Основное состояние атома водорода Два корня: r=0 – минимум rmax=а0 – максимум
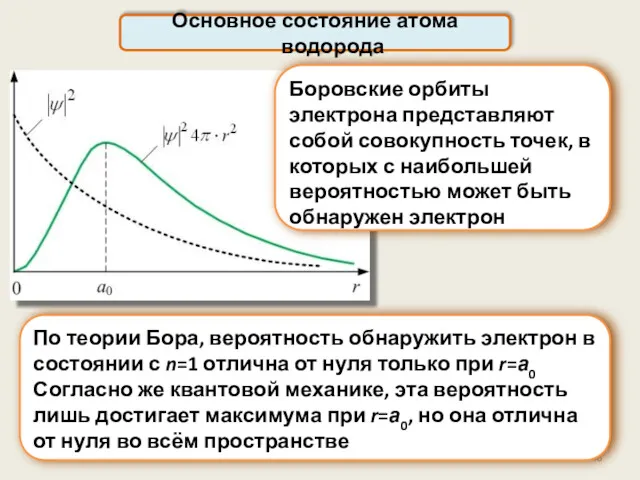
- 46. Основное состояние атома водорода Боровские орбиты электрона представляют собой совокупность точек, в которых с наибольшей вероятностью
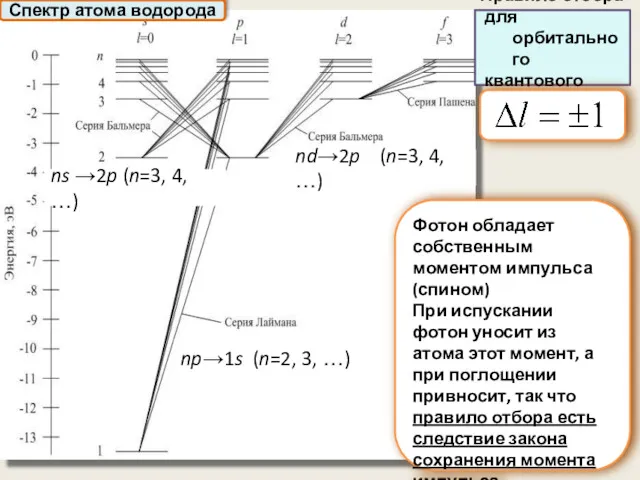
- 47. Спектр атома водорода Правило отбора для орбитального квантового числа: Фотон обладает собственным моментом импульса (спином) При
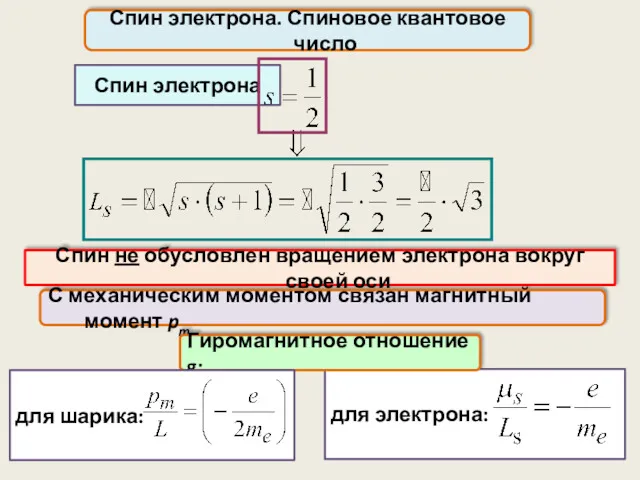
- 48. Спин электрона. Спиновое квантовое число Электрон обладает собственным (спиновым) моментом импульса Ls, не связанным с орбитальным
- 49. Спин электрона. Спиновое квантовое число С механическим моментом связан магнитный момент pm Спин не обусловлен вращением
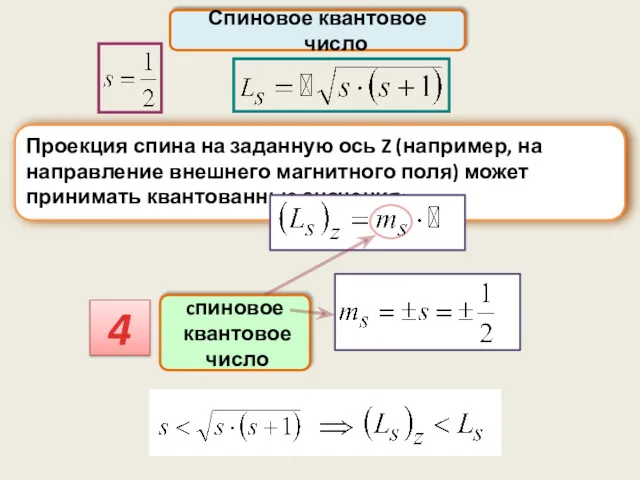
- 50. Спиновое квантовое число Проекция спина на заданную ось Z (например, на направление внешнего магнитного поля) может
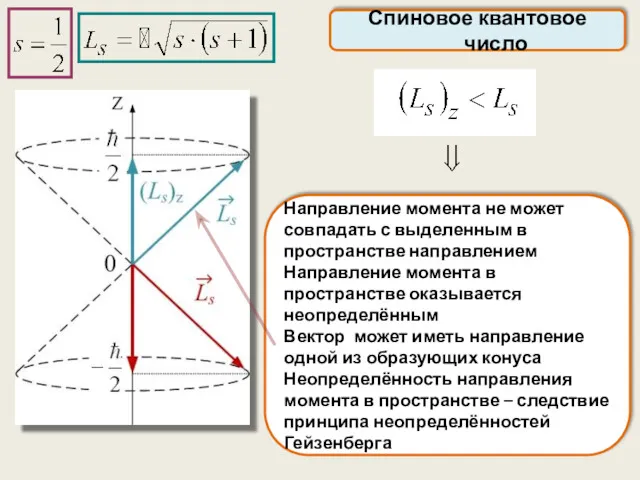
- 51. Спиновое квантовое число Направление момента не может совпадать с выделенным в пространстве направлением Направление момента в
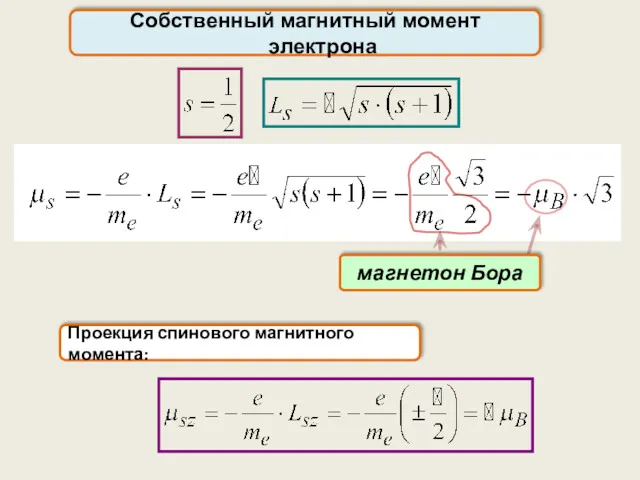
- 52. Собственный магнитный момент электрона Проекция спинового магнитного момента: магнетон Бора
- 53. Полный момент электрона Полный момент электрона слагается из двух моментов – орбитального Ll и спинового Ls
- 55. Скачать презентацию




















 Электродинамика. Задачи
Электродинамика. Задачи Goorui Company Introduction
Goorui Company Introduction Биологическое действие радиации. Закон радиоактивного распада
Биологическое действие радиации. Закон радиоактивного распада Представления об атоме в разных концепциях
Представления об атоме в разных концепциях Динамика кулисного механизма
Динамика кулисного механизма Взаимная индукция и трансформаторы. Энергия магнитного поля
Взаимная индукция и трансформаторы. Энергия магнитного поля 20230211_fizika_7_klass_plotnost_veshchestva._zadachi
20230211_fizika_7_klass_plotnost_veshchestva._zadachi Буксы. Общие сведения
Буксы. Общие сведения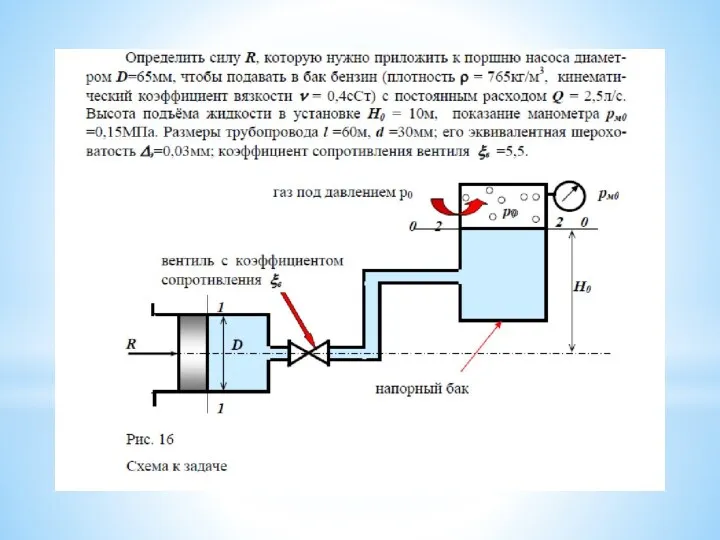 Сила R
Сила R Аналіз лінійних кіл постійного струму при безпосередньому застосуванні законів Кірхгофа
Аналіз лінійних кіл постійного струму при безпосередньому застосуванні законів Кірхгофа Расчет частотных характеристик простейших электрических цепей
Расчет частотных характеристик простейших электрических цепей Уравнение Пуассона. Электростатическое поле в вакууме
Уравнение Пуассона. Электростатическое поле в вакууме Реферат вол.гравит. Сидоров1РФ41
Реферат вол.гравит. Сидоров1РФ41 Кернеу мен потенциалды өлшейтін құралдар
Кернеу мен потенциалды өлшейтін құралдар Разработка участка тормозной системы на предприятии Гринлайт
Разработка участка тормозной системы на предприятии Гринлайт Изучение сцепок и направляющих устройств
Изучение сцепок и направляющих устройств Учебные презентации по физике по темам Электромагнитные волны и Строение атома
Учебные презентации по физике по темам Электромагнитные волны и Строение атома Искусственные спутники Земли
Искусственные спутники Земли Презентация урока по электротехнике
Презентация урока по электротехнике Хроматографические методы анализа и их применение для контроля качества лекарственных средств
Хроматографические методы анализа и их применение для контроля качества лекарственных средств Electricity
Electricity 61f4bb8105f047b8922e06e3e916ed53
61f4bb8105f047b8922e06e3e916ed53 Апарати для дослідження океанічних глибин
Апарати для дослідження океанічних глибин Internal Combustion engine
Internal Combustion engine Разработка установки для измерения магнитострикции
Разработка установки для измерения магнитострикции Транспортная энергетика. Общие понятия энергетики
Транспортная энергетика. Общие понятия энергетики Презентация Применение радиолокации в годы Великой Отечественной войны, урок физики 11 кл.
Презентация Применение радиолокации в годы Великой Отечественной войны, урок физики 11 кл. Диэлектрики и проводники в электрическом поле
Диэлектрики и проводники в электрическом поле