Содержание
- 2. Основные понятия молекулярно-кинетической теории – Относительная молекулярная масса; – количество вещества; – постоянная Авогадро; – молярная
- 3. Так как массы молекул очень малы, удобно использовать в расчётах не абсолютные значения масс, а относительные.
- 4. Основные понятия молекулярно-кинетической теории Массу частицы, измеренную в а.е.м. (атомная единица массы), принято называть относительной атомной
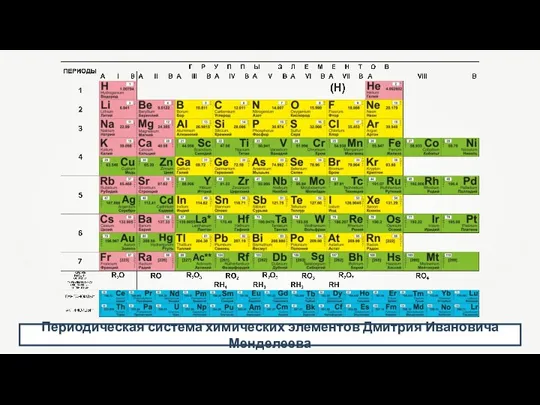
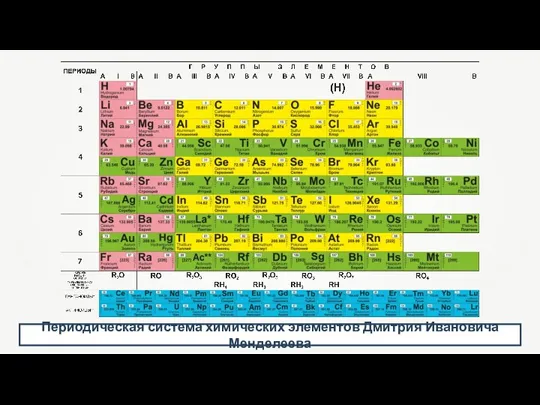
- 5. Периодическая система химических элементов Дмитрия Ивановича Менделеева
- 6. Основные понятия молекулярно-кинетической теории Относительная молекулярная масса молекулы вещества равна сумме относительных атомных масс атомов, составляющих
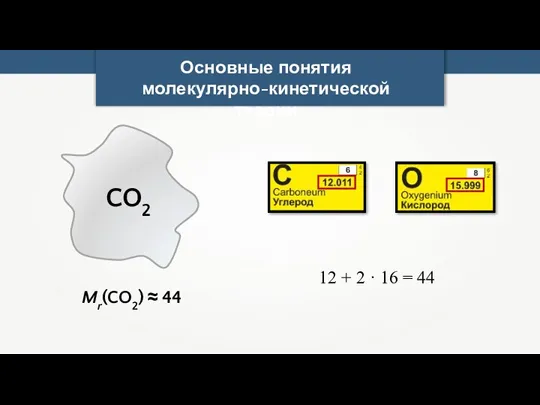
- 8. Основные понятия молекулярно-кинетической теории CO2 Mr(CO2) ≈ 44 12 + 2 · 16 = 44
- 10. 1 моль равен количеству вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится
- 11. Амедео Авогадро 1776–1856 гг. Число Авогадро — число молекул в одном моле любого вещества или число
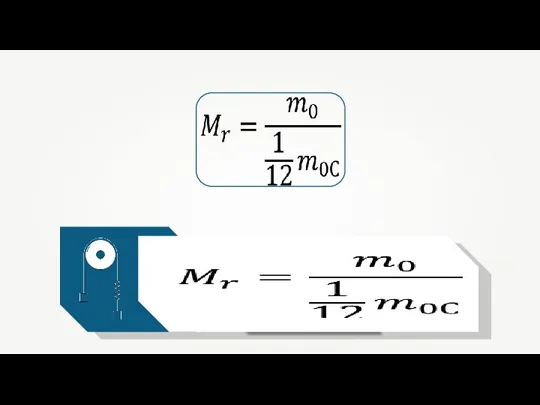
- 12. Масса одного атома углерода: m0C = 1,995 · 10-23 кг. Число Авогадро
- 13. Количество вещества равно отношению числа частиц в теле к числу Авогадро (числу молекул в 1 моле
- 14. Если два разных тела состоят из одного и того же числа частиц, то эти тела содержат
- 15. Молярная масса (M) равна массе вещества, взятого в количестве 1 моль.
- 16. Периодическая система химических элементов Дмитрия Ивановича Менделеева
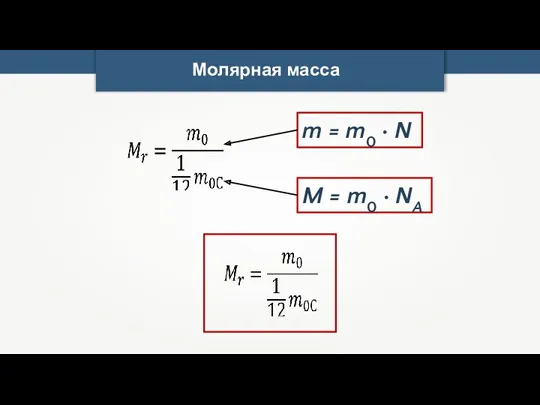
- 17. Молярная масса
- 18. Молярная масса
- 19. Молярная масса Для молекул более сложного состава при расчёте учитывается число атомов всех химических элементов в
- 20. Молярная масса m0 — масса одной молекулы вещества. M = m0 · NA m — масса
- 21. Молярная масса M = m0 · NA m = m0 · N
- 22. Масса молекулы (m0) может быть рассчитана на основе молярной массы (M) и числа Авогадро (NA). Масса
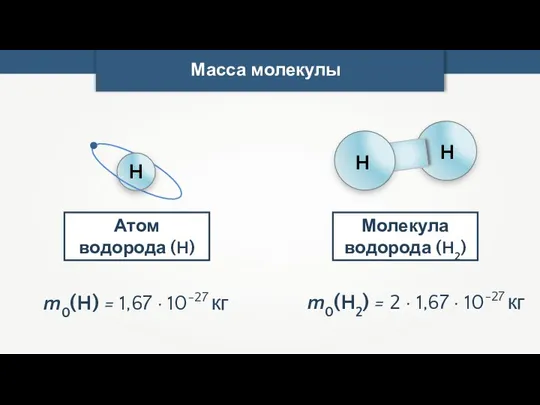
- 23. Масса молекулы Молекула водорода (H2) m0(H) = 1,67 · 10-27 кг H Атом водорода (H) m0(H2)
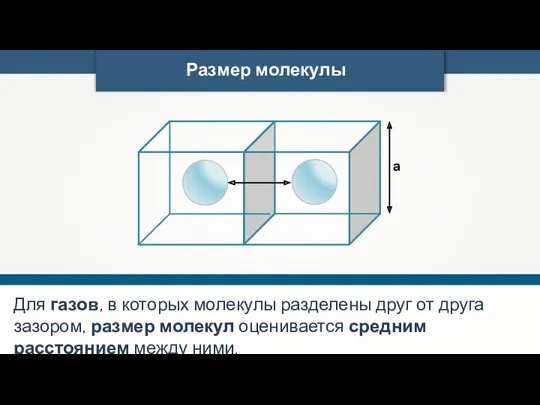
- 24. Размер молекулы а Для воды диаметр а = 3 · 10–10 м.
- 25. Размер молекулы а Для газов, в которых молекулы разделены друг от друга зазором, размер молекул оценивается
- 26. Концентрация (?) показывает, сколько частиц содержится в единице объёма данного вещества.
- 27. Определите молярную массу воды (H2O). Дано: Найти: M(H2O) = ? Решение: Mr(H2O) = 2 · 1
- 29. Скачать презентацию


















 Парогенераторы АЭС. Первичные теплоносители. (Тема 3)
Парогенераторы АЭС. Первичные теплоносители. (Тема 3) Сила трения
Сила трения Синтез наноматериалов золь-гель методом. (Лекция 5)
Синтез наноматериалов золь-гель методом. (Лекция 5) Nanophotonics class 4. Density of states
Nanophotonics class 4. Density of states Изопроцессы
Изопроцессы Сложение скоростей
Сложение скоростей ТРИЗ Электричество
ТРИЗ Электричество Все о ракетах
Все о ракетах Физика в профессии Слесарь по ремонту автомобилей
Физика в профессии Слесарь по ремонту автомобилей Электрооборудование автомобилей. Автоматическая коробка переключения передач с электронным управлением
Электрооборудование автомобилей. Автоматическая коробка переключения передач с электронным управлением Методы оптической молекулярной спектроскопии
Методы оптической молекулярной спектроскопии Types of Forces
Types of Forces Магнітне поле постійного струму
Магнітне поле постійного струму Внутренняя энергия. Первый закон термодинамики
Внутренняя энергия. Первый закон термодинамики Заттың агрегаттық күйлерінің өзгеруі. 8 сынып
Заттың агрегаттық күйлерінің өзгеруі. 8 сынып Тонкостенные оболочки. Основные допущения. Уравнение Лапласа. Лекция 8
Тонкостенные оболочки. Основные допущения. Уравнение Лапласа. Лекция 8 Тяговый расчет автомобиля
Тяговый расчет автомобиля Сообщающие сосуды
Сообщающие сосуды Лампа накаливания
Лампа накаливания Interest in the synthesis of metal nanoparticles by explosion
Interest in the synthesis of metal nanoparticles by explosion Электромагнитные колебания
Электромагнитные колебания Взаимодействие электромагнитных световых волн с веществом. Поляризация света. Виды поляризации
Взаимодействие электромагнитных световых волн с веществом. Поляризация света. Виды поляризации Полевые транзисторы FET (field-effect transistor). Устройство, принципы работы полевых транзисторов различных типов
Полевые транзисторы FET (field-effect transistor). Устройство, принципы работы полевых транзисторов различных типов Физика. Физические основы механики
Физика. Физические основы механики Критерії роботоздатності деталей машин. (Лекція 2)
Критерії роботоздатності деталей машин. (Лекція 2) Дыбыс, кең мағынасында
Дыбыс, кең мағынасында Magnit orici
Magnit orici Законы постоянного тока
Законы постоянного тока