Содержание
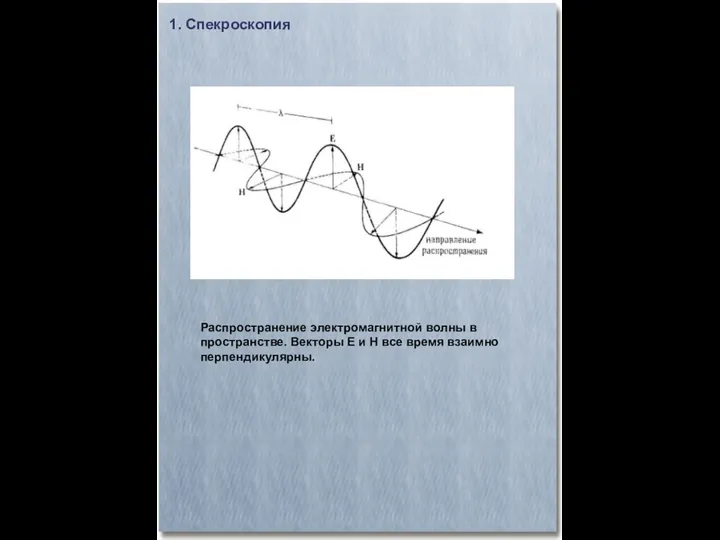
- 2. Распространение электромагнитной волны в пространстве. Векторы Е и Н все время взаимно перпендикулярны. 1. Спекроскопия
- 3. 1. Спекроскопия Спектральный анализ - совокупность методов качественного и количественного определения состава объекта, основанная на изучении
- 4. Шкала электромагнитных излучений, используемая для исследований в области биологии 1. Спекроскопия γ – спектроскопия Рентгеновская спектроскопия
- 5. 1. Спекроскопия
- 6. 1. Спекроскопия
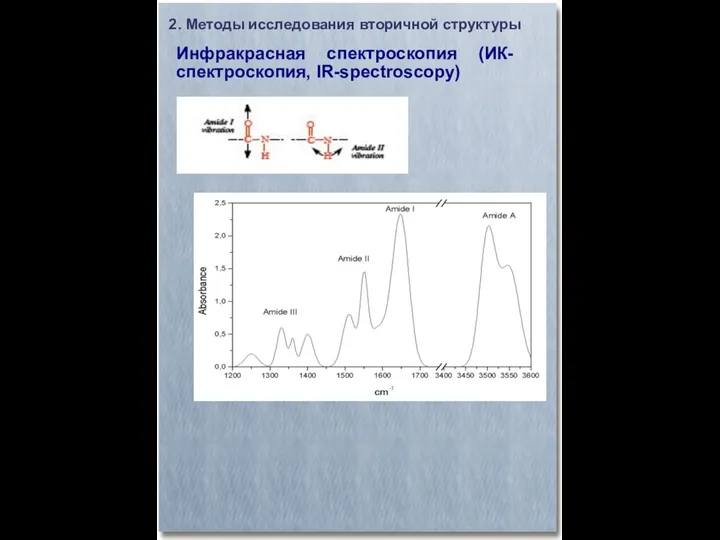
- 7. Инфракрасная спектроскопия (ИК-спектроскопия, IR-spectroscopy) 2. Методы исследования вторичной структуры Исследует колебания атомов в молекуле 2 основных
- 8. Инфракрасная спектроскопия (ИК-спектроскопия, IR-spectroscopy) 2. Методы исследования вторичной структуры ИК-спектр поглощения связан с переходами на различные
- 9. Инфракрасная спектроскопия (ИК-спектроскопия, IR-spectroscopy) 2. Методы исследования вторичной структуры ИК-диапазон электромагнитного излучения – 750-100000 нм
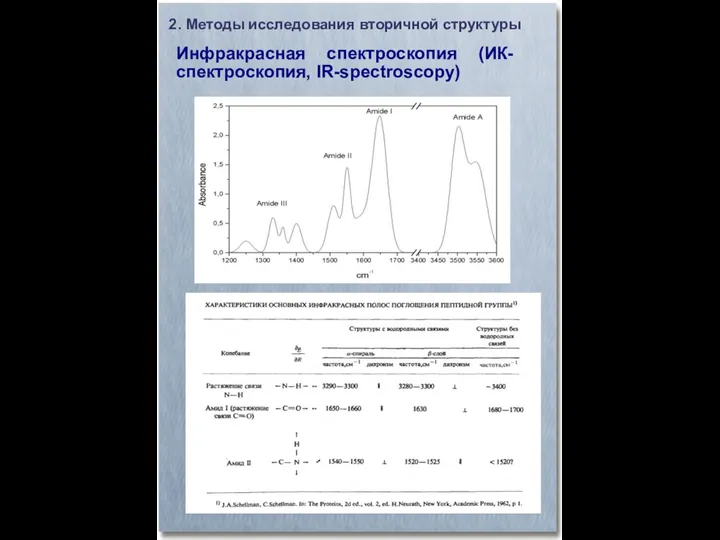
- 10. Инфракрасная спектроскопия (ИК-спектроскопия, IR-spectroscopy) 2. Методы исследования вторичной структуры
- 11. Инфракрасная спектроскопия (ИК-спектроскопия, IR-spectroscopy) 2. Методы исследования вторичной структуры
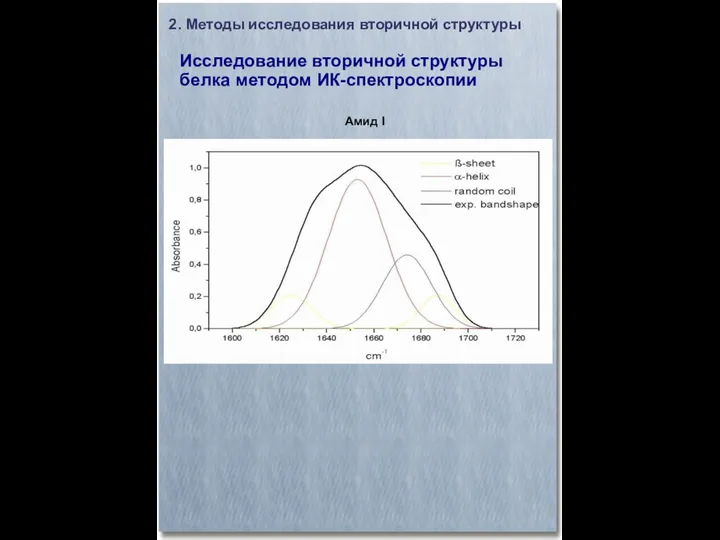
- 12. 2. Методы исследования вторичной структуры Исследование вторичной структуры белка методом ИК-спектроскопии Амид I
- 13. Круговой дихроизм (КД-спектроскопия,CD-spectroscopy) 2. Методы исследования вторичной структуры Исследует взаимодействие плоскополяризованного света с оптически активными молекулами
- 14. Круговой дихроизм (КД-спектроскопия,CD-spectroscopy) 2. Методы исследования вторичной структуры Исследует взаимодействие плоскополяризованного света с оптически активными молекулами
- 15. Круговой дихроизм (КД-спектроскопия,CD-spectroscopy) 2. Методы исследования вторичной структуры Оптически активные вещества – вещества, имеющие хиральный центр
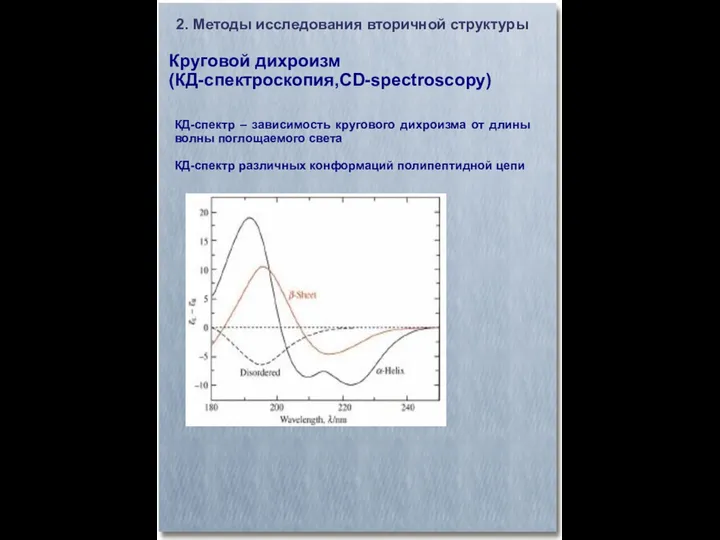
- 16. Круговой дихроизм (КД-спектроскопия,CD-spectroscopy) 2. Методы исследования вторичной структуры КД-спектр – зависимость кругового дихроизма от длины волны
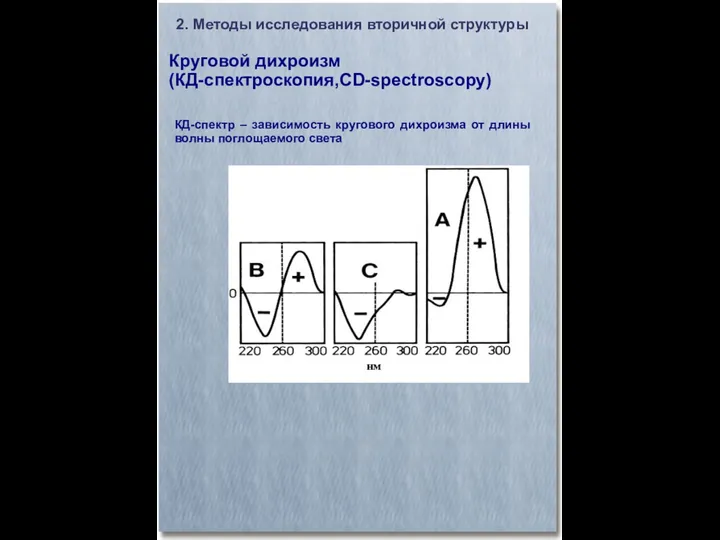
- 17. Круговой дихроизм (КД-спектроскопия,CD-spectroscopy) 2. Методы исследования вторичной структуры КД-спектр – зависимость кругового дихроизма от длины волны
- 18. 3. Методы исследования третичной структуры белка Исследуются ядра атомов, имеющих непарное число протонов и нейтронов. Такие
- 19. 3. Методы исследования третичной структуры белка Химический сдвиг νобр - νэт νэт δ = ⋅106 [м.д.]
- 20. 3. Методы исследования третичной структуры белка
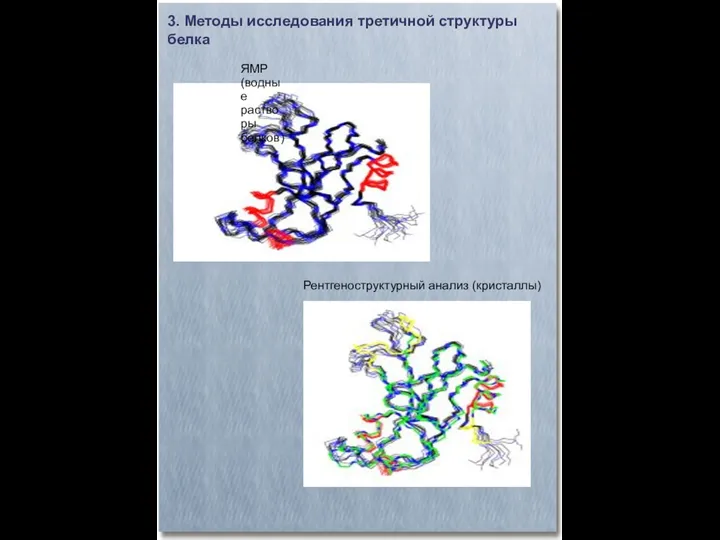
- 21. 3. Методы исследования третичной структуры белка ЯМР (водные растворы белков) Рентгеноструктурный анализ (кристаллы)
- 22. 4. Методы исследования мембран клеток
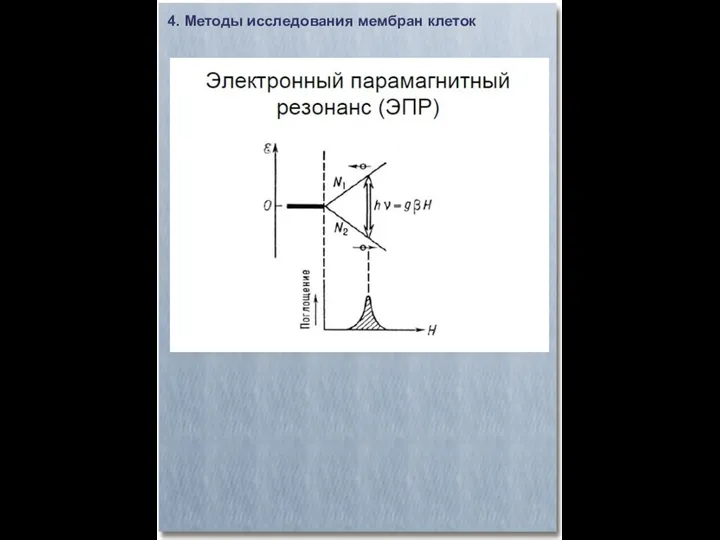
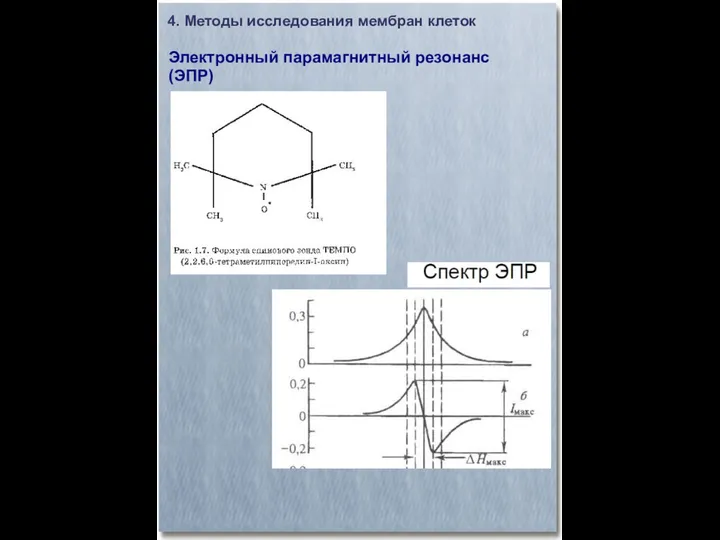
- 23. 4. Методы исследования мембран клеток Электронный парамагнитный резонанс (ЭПР)
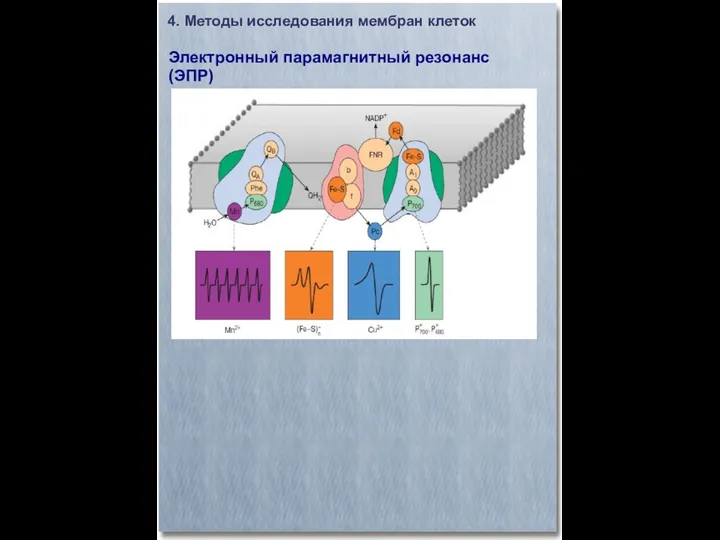
- 24. 4. Методы исследования мембран клеток Электронный парамагнитный резонанс (ЭПР)
- 25. 4. Методы исследования мембран клеток Электронный парамагнитный резонанс (ЭПР)
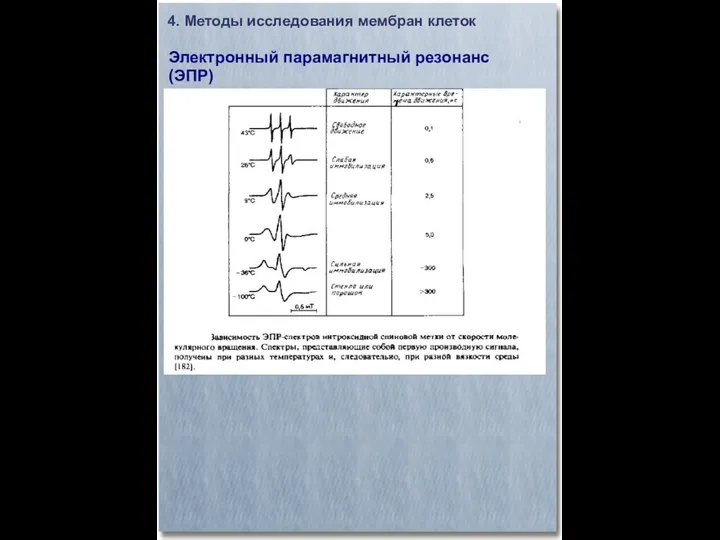
- 26. 4. Методы исследования мембран клеток Электронный парамагнитный резонанс (ЭПР)
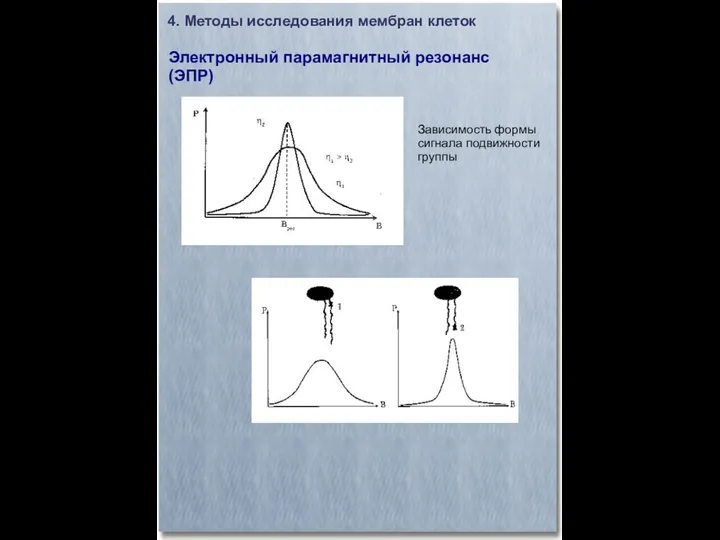
- 27. 4. Методы исследования мембран клеток Электронный парамагнитный резонанс (ЭПР) Зависимость формы сигнала подвижности группы
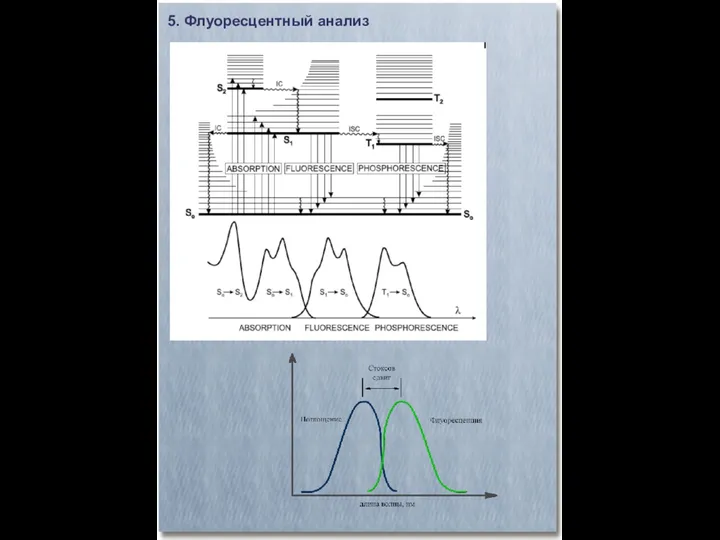
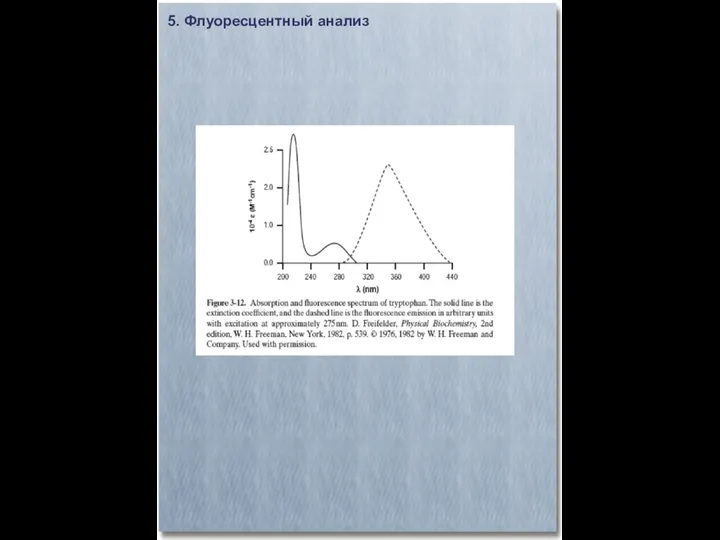
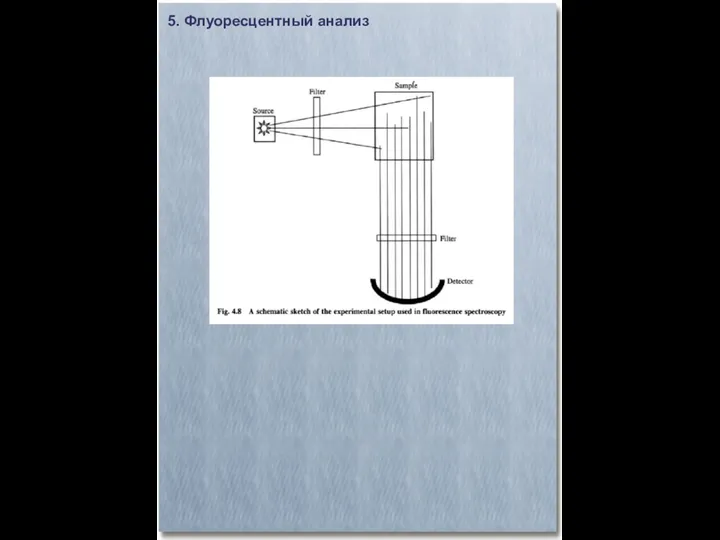
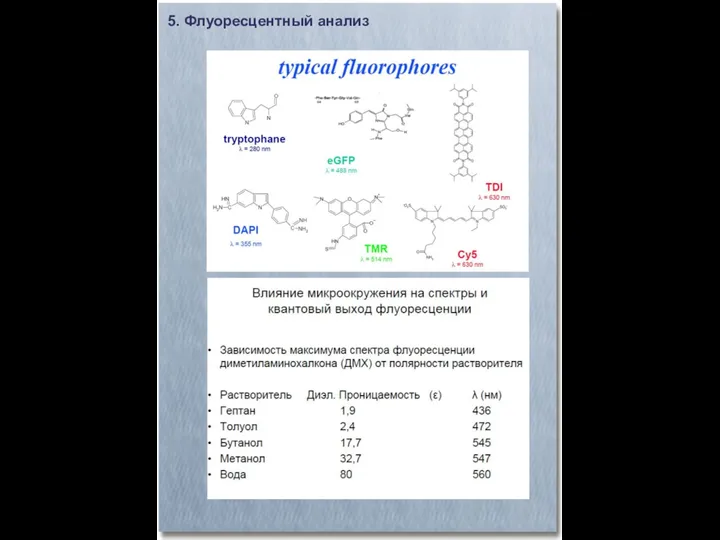
- 28. 5. Флуоресцентный анализ
- 30. 5. Флуоресцентный анализ
- 31. 5. Флуоресцентный анализ
- 32. 5. Флуоресцентный анализ
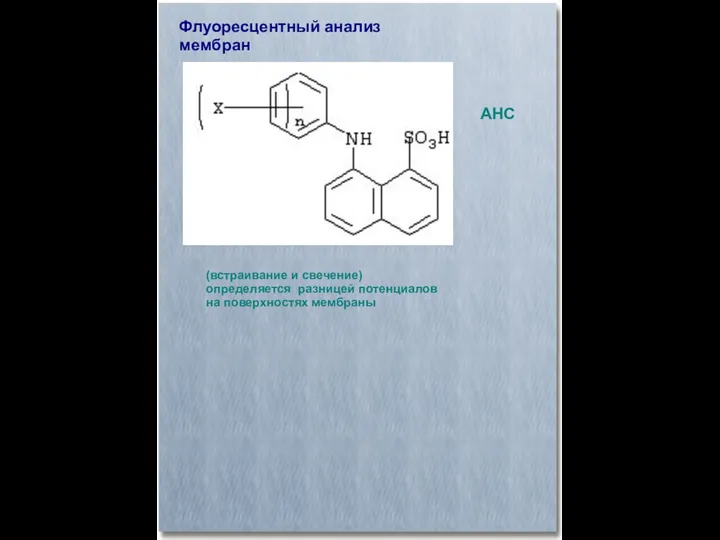
- 33. Флуоресцентный анализ мембран (встраивание и свечение) определяется разницей потенциалов на поверхностях мембраны АНС
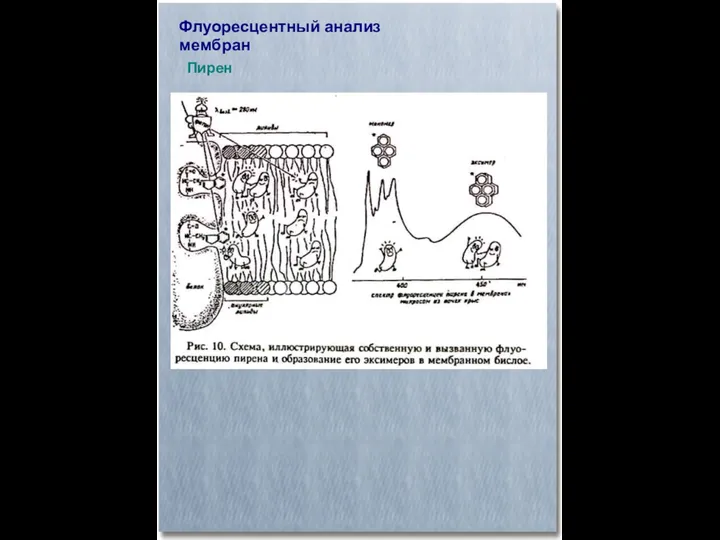
- 34. Флуоресцентный анализ мембран Пирен
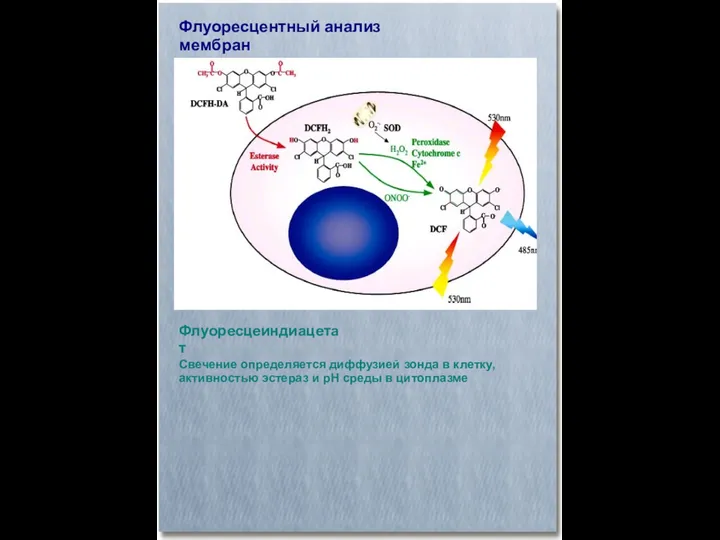
- 35. Флуоресцентный анализ мембран Флуоресцеиндиацетат Свечение определяется диффузией зонда в клетку, активностью эстераз и рН среды в
- 37. БИОЛЮМИНЕСЦЕНЦИЯ Биолюминесценцией называют свечение живых организмов. Оно происходит за счет специфичных химических реакций с выделением света.
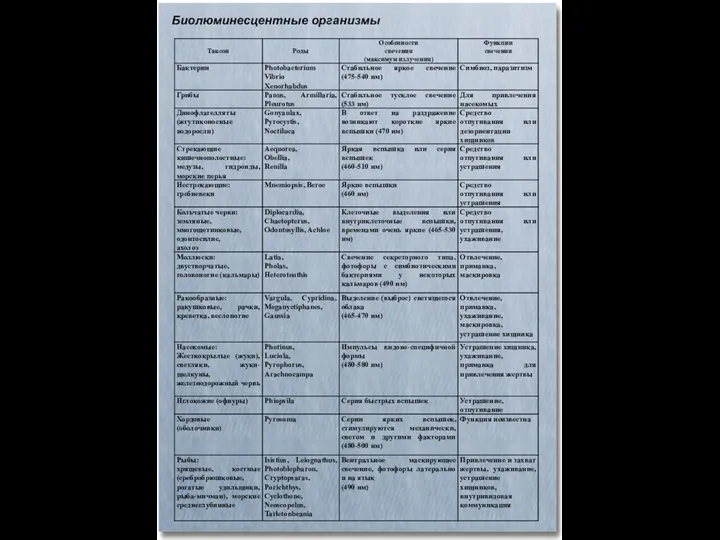
- 38. Биолюминесцентные организмы
- 39. БИОЛЮМИНЕСЦЕНЦИЯ Многоклеточные животные обычно излучают свет не всем телом, а только специальными клетками фотоцитами, часто сгруппированными
- 40. Биолюминесценция наблюдается вследствие дезактивации возбужденных молекул – эмиттеров. Эмиттеры возникают в организмах в ходе биохимических реакций.
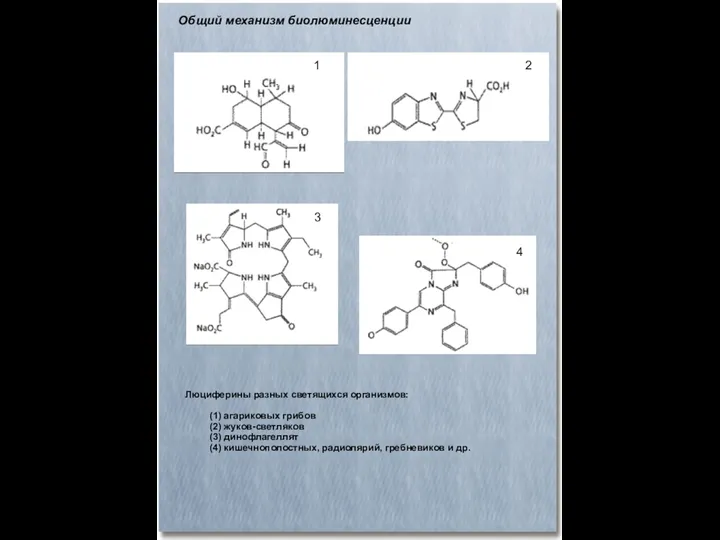
- 41. Общий механизм биолюминесценции Люциферины разных светящихся организмов: (1) агариковых грибов (2) жуков-светляков (3) динофлагеллят (4) кишечнополостных,
- 42. БИОЛЮМИНЕСЦЕНЦИЯ Химически разные биолюминесцентные реакции объединяет несколько характерных черт. 1. Всем этим реакциям абсолютно необходим кислород.
- 43. Биолюминесцентная реакция светляков Различные виды светляков (насекомые семейства Lampyridae) встречаются на юге Северной Америки, в Японии,
- 44. Биолюминесцентная реакция светляков Люцифераза светляков состоит из двух субъединиц с молекулярной массой 50000 каждая и не
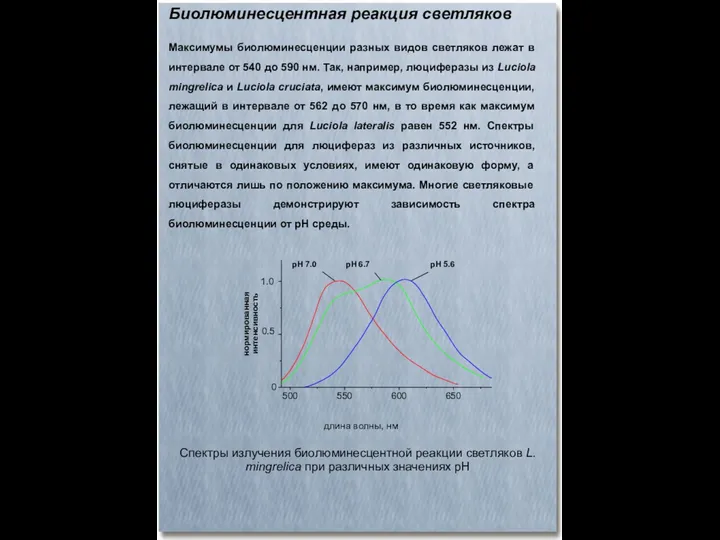
- 45. Биолюминесцентная реакция светляков Максимумы биолюминесценции разных видов светляков лежат в интервале от 540 до 590 нм.
- 46. Биолюминесценция кишечнополостных Биолюминесценция среди кишечнополостных (Coelenterata) распространена довольно широко. Известно несколько десятков видов гидромедуз, излучающих свет
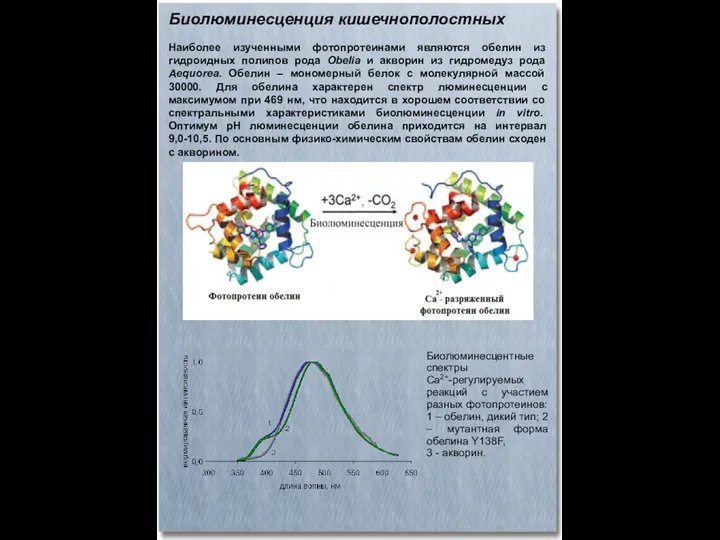
- 47. Биолюминесценция кишечнополостных Наиболее изученными фотопротеинами являются обелин из гидроидных полипов рода Obelia и акворин из гидромедуз
- 48. Биолюминесценция кишечнополостных Для люминесценции морских перьев Renilla характерна стадия предварительной активации люциферина. На этой стадии неактивный
- 49. Биолюминесценция кишечнополостных В 1962 г. О. Шимомура, Ф. Джонсон и Ю. Сайга отметили разницу между цветом
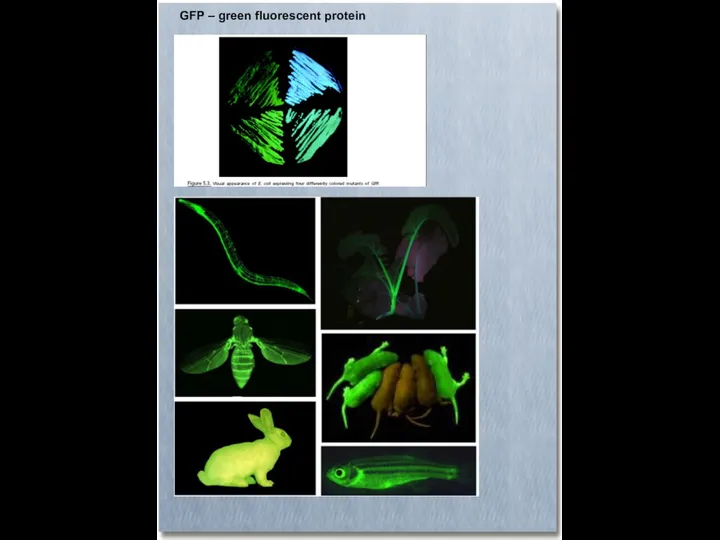
- 52. GFP – green fluorescent protein
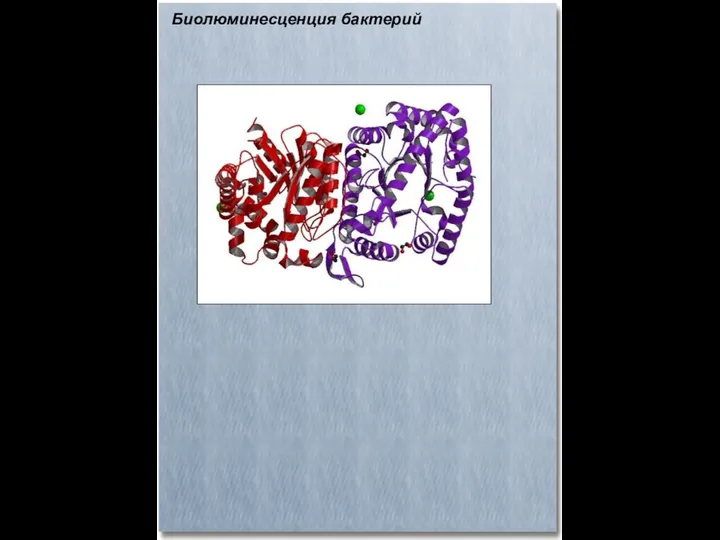
- 53. Биолюминесценция бактерий Все известные в настоящее время светящиеся бактерии делятся на две группы: морские и пресноводные.
- 54. Биолюминесценция бактерий Химической основой свечения бактерий является ферментативное окисление восстановленного флавинмононуклеотида ФМН⋅Н2 и длинноцепочечного альдегида RCHO
- 55. Биолюминесценция бактерий
- 56. Биолюминесценция динофлагеллят Динофлагелляты или жгутиконостцы являются основными продуцентами света в море, по крайней мере в его
- 57. Свечение червей Среди кольчатых червей много биолюминесцентных видов, как морских, так и наземных. Морские полихеты Chaetopterus
- 58. Биолюминесценция грибов К настоящему времени описано более 40 разновидностей люминесцентных грибов. Из них большинство принадлежит ко
- 59. Биолюминесцентный анализ Биолюминесценция in vivo и in vitro нашла широкое применение в качестве аналитических методов и
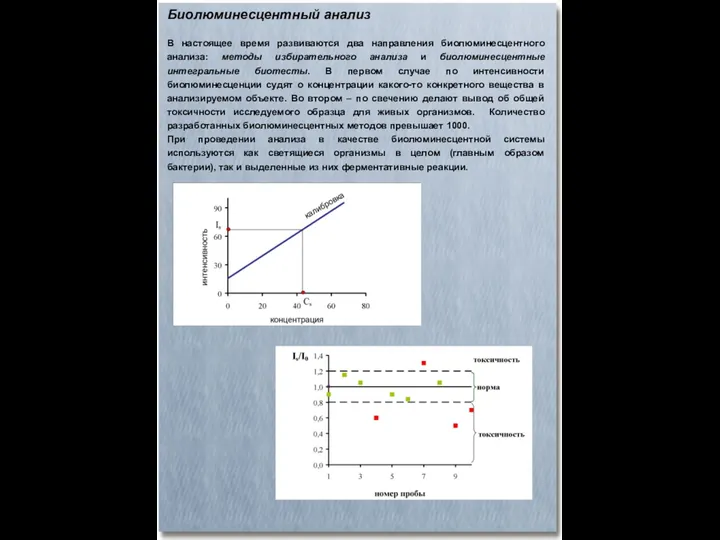
- 60. Биолюминесцентный анализ В настоящее время развиваются два направления биолюминесцентного анализа: методы избирательного анализа и биолюминесцентные интегральные
- 61. Биолюминесцентный анализ Светящиеся бактерии применяются в различных областях в трех основных видах: природном (интактном), мутантном и
- 62. Биолюминесцентный анализ
- 63. Биолюминесцентный анализ Прогресс в области генной инженерии позволил создать новые светящиеся организмы. Было проведено клонирование и
- 64. Биолюминесцентный анализ Можно выделить семь основных направлений применения биолюминесцентных реакций, полученных из различных светящихся организмов: 1.
- 65. Биолюминесцентный анализ Анализ субстратов люцифераз Как уже упоминалось, люциферазы проявляют высокую специфичность к своим субстратам. Интенсивность
- 66. Биолюминесцентный анализ Мониторинг АТФ Биолюминесцентный анализ - наиболее специфичный, чувствительный и быстрый метод определения АТФ. В
- 67. Биолюминесцентный анализ Мониторинг АТФ Области применения АТФ-метрии: 1. Медицина: - обнаружение микробных инфекций в крови, моче
- 68. Биолюминесцентный анализ Определение содержания ионов кальция Концентрация ионов кальция является внутриклеточным сигналом, ответственным за контролирование многочисленных
- 69. Детекция взаимодействия биомолекул. Иммуноанализ Люциферазы применяются в качестве ферментов-маркеров в иммуноанализе наряду с пероксидазой хрена и
- 70. Биолюминесцентный анализ Биолюминесцентные репортерные гены Технология репортерных генов – одно из главных новых достижений молекулярной биологии
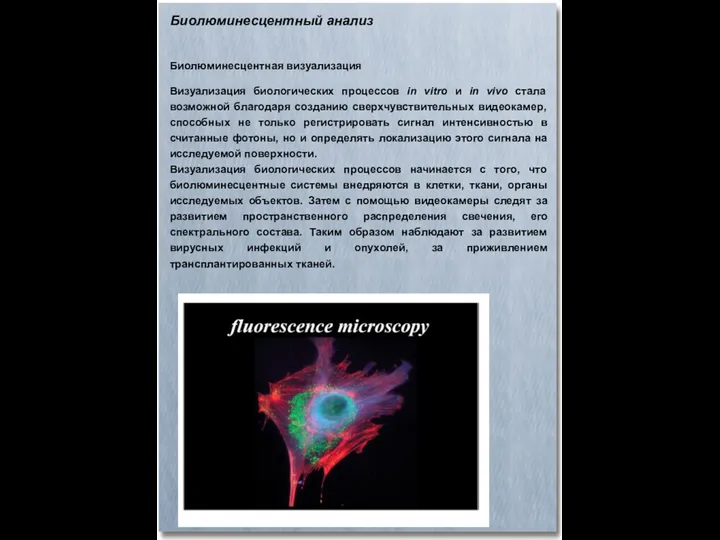
- 71. Биолюминесцентный анализ Биолюминесцентная визуализация Визуализация биологических процессов in vitro и in vivo стала возможной благодаря созданию
- 74. Скачать презентацию











![3. Методы исследования третичной структуры белка Химический сдвиг νобр - νэт νэт δ = ⋅106 [м.д.]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/383537/slide-18.jpg)






























 Сила упругости. Закон Гука (7 класс)
Сила упругости. Закон Гука (7 класс) Условия плавания тел в жидкости
Условия плавания тел в жидкости Основы механики деформации горных пород. Тема 3
Основы механики деформации горных пород. Тема 3 Технология работ по ТО и ремонту механической коробки переключения передач и устройству
Технология работ по ТО и ремонту механической коробки переключения передач и устройству Теоретические основы электротехники
Теоретические основы электротехники Сила трения скольжения
Сила трения скольжения Асинхронный двигатель
Асинхронный двигатель Тепломассообмен
Тепломассообмен Презентация-игра, 7-8 класс
Презентация-игра, 7-8 класс Постоянный электрический ток
Постоянный электрический ток Внутренняя энергия. Температура
Внутренняя энергия. Температура Семей ядролық полигоны
Семей ядролық полигоны Барометр – анероид. Атмосферное давление на различных высотах (7 класс)
Барометр – анероид. Атмосферное давление на различных высотах (7 класс) Перемещение при прямолинейном равноускоренном движении
Перемещение при прямолинейном равноускоренном движении Вертолет Ми-8МТВ. Масляная система двигателя
Вертолет Ми-8МТВ. Масляная система двигателя Решение задач на вычисление силы Ампера
Решение задач на вычисление силы Ампера Устройство железнодорожных вагонов
Устройство железнодорожных вагонов Схемы интерферометров
Схемы интерферометров Электроразведка
Электроразведка Режимы работы и функциональные возможности САРП
Режимы работы и функциональные возможности САРП Магнитное поле катушки с током
Магнитное поле катушки с током Урок по физике на тему: закон Архимеда
Урок по физике на тему: закон Архимеда Урок по физике Реактивное движение
Урок по физике Реактивное движение Основы электротехники и электроники
Основы электротехники и электроники Аэродинамический нагрев
Аэродинамический нагрев Конструкция автомобиля. Сцепление
Конструкция автомобиля. Сцепление Криволинейное движение
Криволинейное движение Модульные технологии как технологии здоровьесбережения.
Модульные технологии как технологии здоровьесбережения.