Содержание
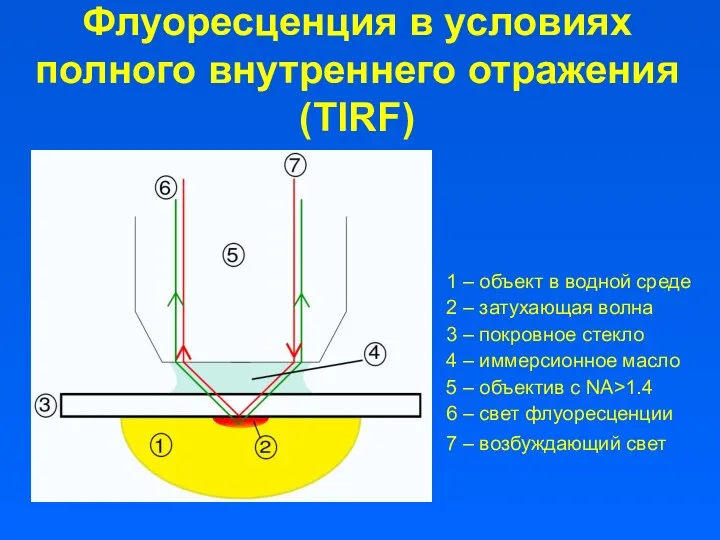
- 2. Флуоресценция в условиях полного внутреннего отражения (TIRF) 1 – объект в водной среде 2 – затухающая
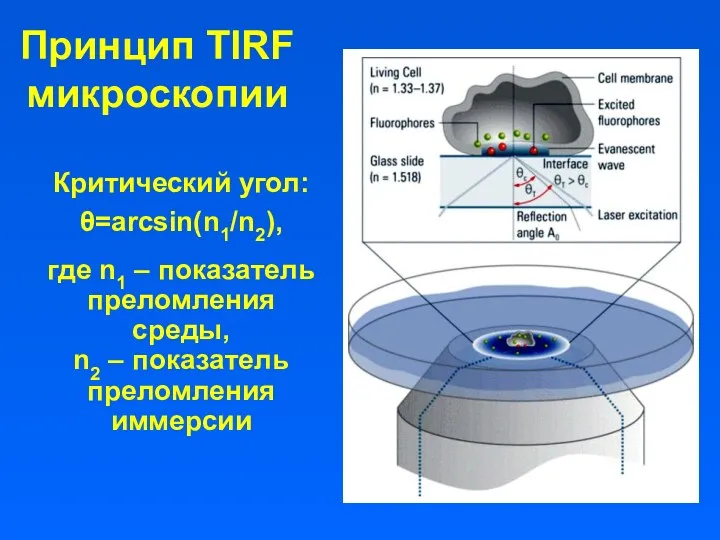
- 3. Принцип TIRF микроскопии Критический угол: θ=arcsin(n1/n2), где n1 – показатель преломления среды, n2 – показатель преломления
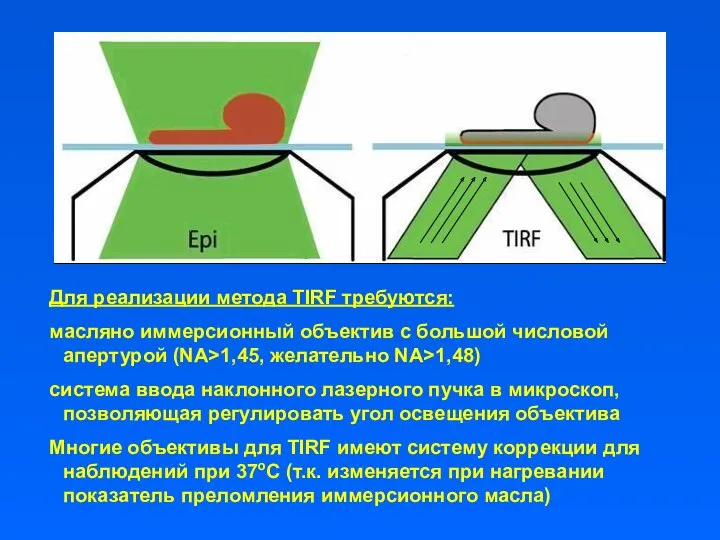
- 4. Для реализации метода TIRF требуются: масляно иммерсионный объектив с большой числовой апертурой (NA>1,45, желательно NA>1,48) система
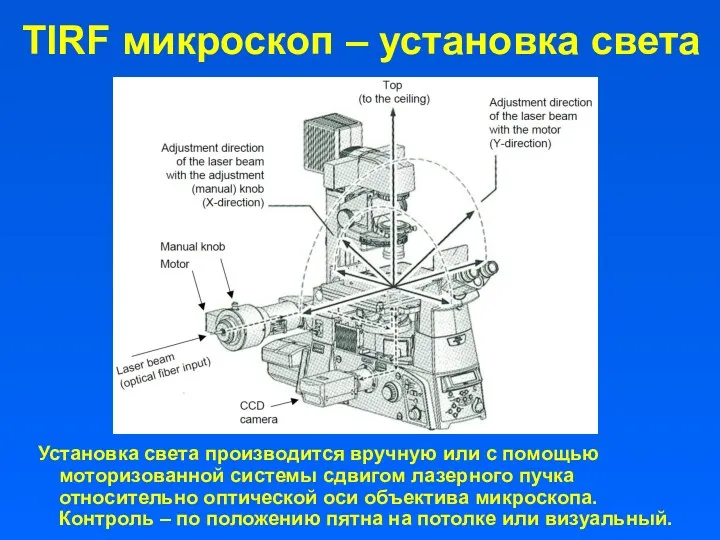
- 5. TIRF микроскоп – установка света Установка света производится вручную или с помощью моторизованной системы сдвигом лазерного
- 6. TIRF При полном внутреннем отражении в среде, куда не проходит луч света, возникает затухающая волна (evanescent
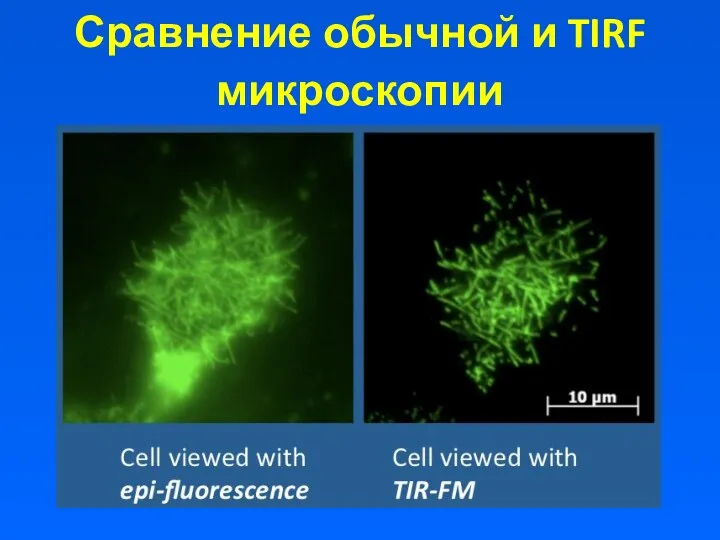
- 7. Сравнение обычной и TIRF микроскопии
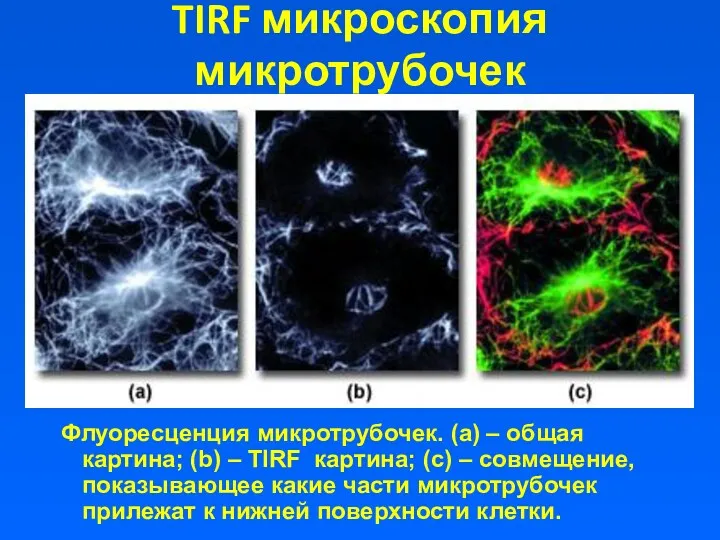
- 8. TIRF микроскопия микротрубочек Флуоресценция микротрубочек. (а) – общая картина; (b) – TIRF картина; (с) – совмещение,
- 9. Зависимость изображения от установки света Угол полного внутреннего отражения (критический угол) для наблюдения живых клеток составляет
- 10. TIRF микроскопия: преимущества и недостатки Преимущества метода: возбуждение флуоресценции происходит в очень тонком слое, его толщина
- 11. FRET – принцип В 1948 г. Ферстер (Förster) описал явление безизлучательного резонансного переноса энергии между двумя
- 12. FRET (Ферстеровский резонансный перенос энергии) Когда две молекулы флуорохромов расположены близко друг от друга и максимум
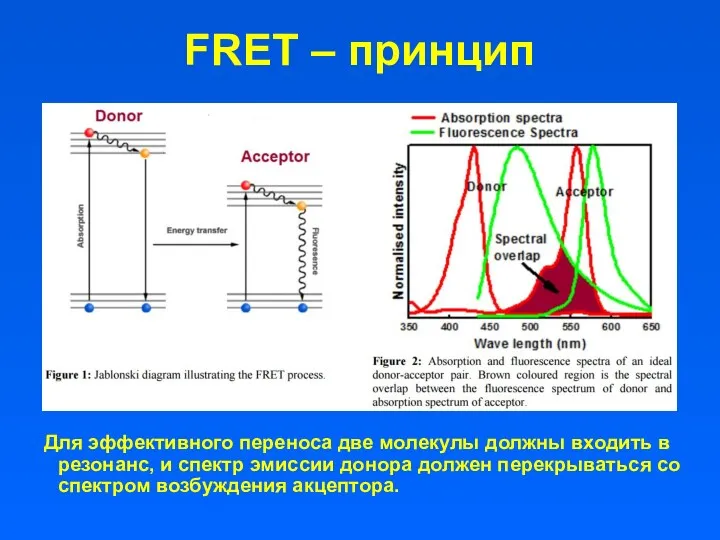
- 13. FRET – принцип Для эффективного переноса две молекулы должны входить в резонанс, и спектр эмиссии донора
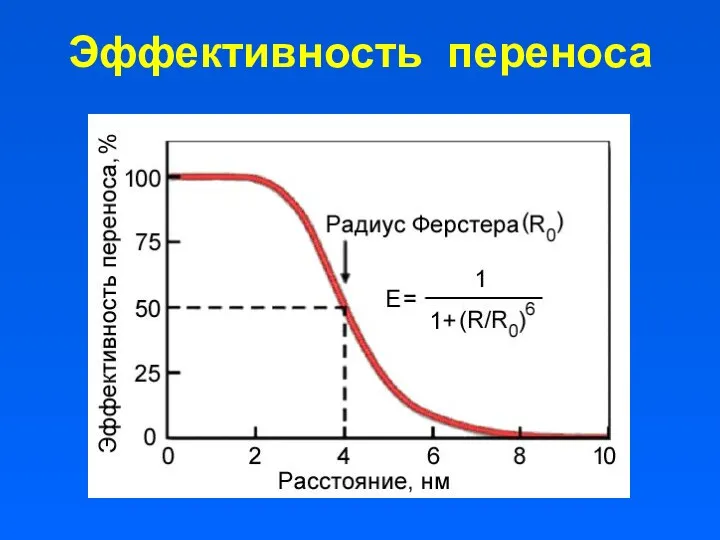
- 14. Эффективность переноса
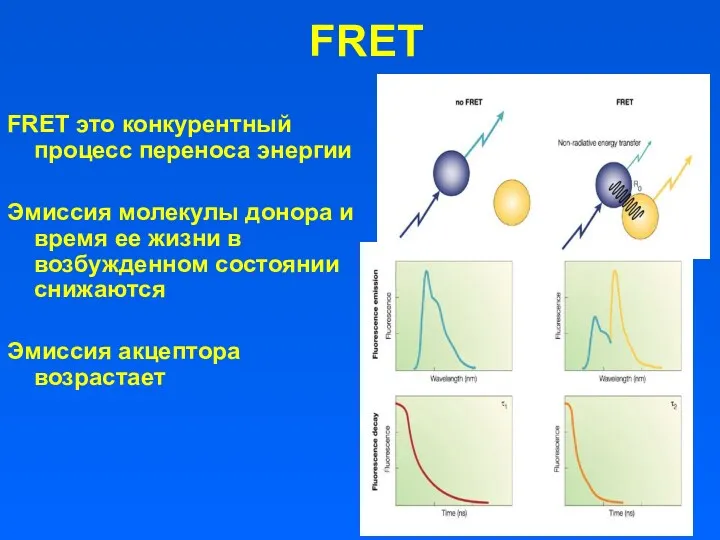
- 15. FRET это конкурентный процесс переноса энергии Эмиссия молекулы донора и время ее жизни в возбужденном состоянии
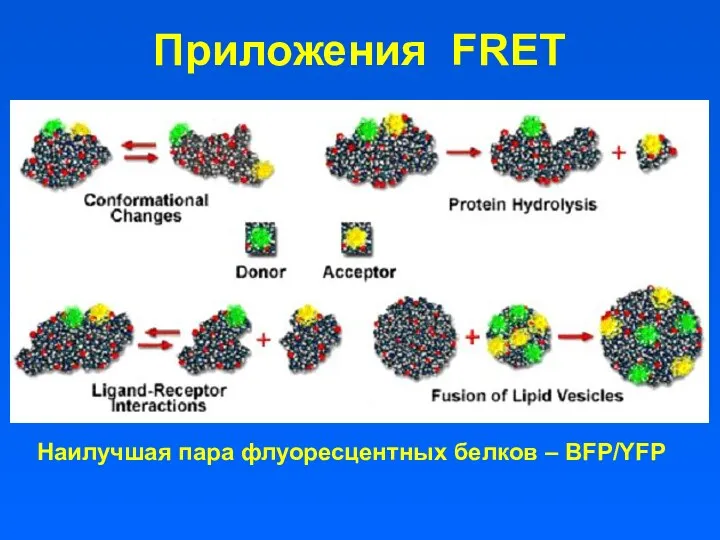
- 16. Приложения FRET Наилучшая пара флуоресцентных белков – BFP/YFP
- 17. Как наблюдать FRET? Стандартные кубики с однополосными светофильтрами для этого явно недостаточны. Поэтому систему флуоресцентного микроскопа
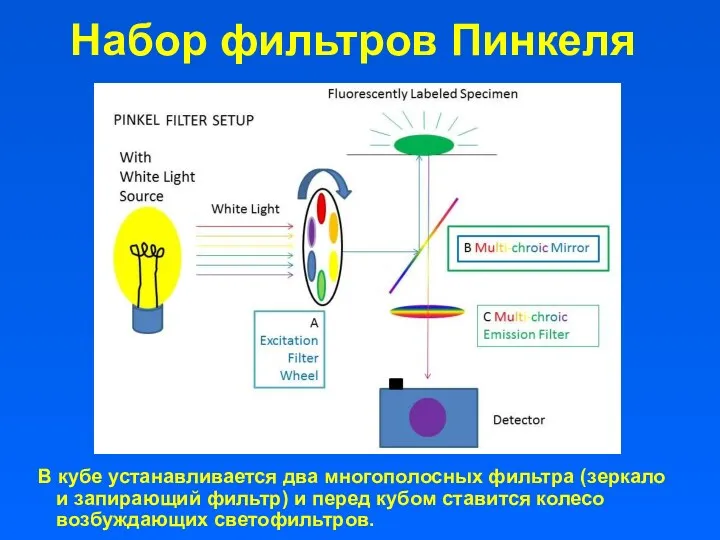
- 18. Набор фильтров Пинкеля В кубе устанавливается два многополосных фильтра (зеркало и запирающий фильтр) и перед кубом
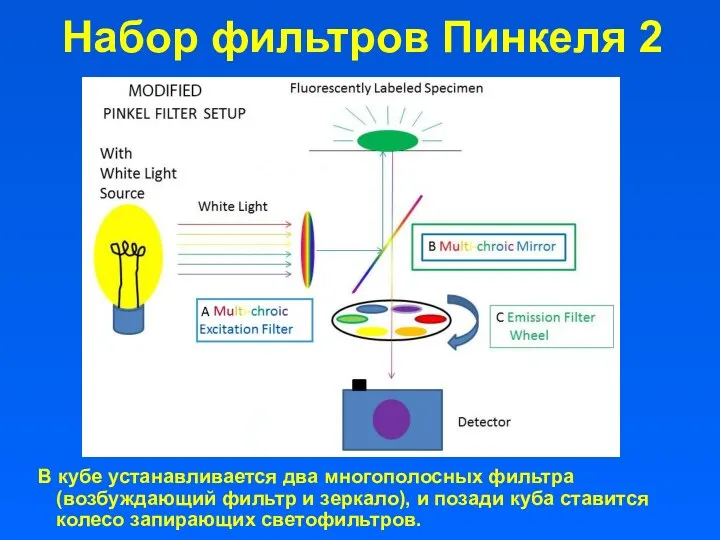
- 19. В кубе устанавливается два многополосных фильтра (возбуждающий фильтр и зеркало), и позади куба ставится колесо запирающих
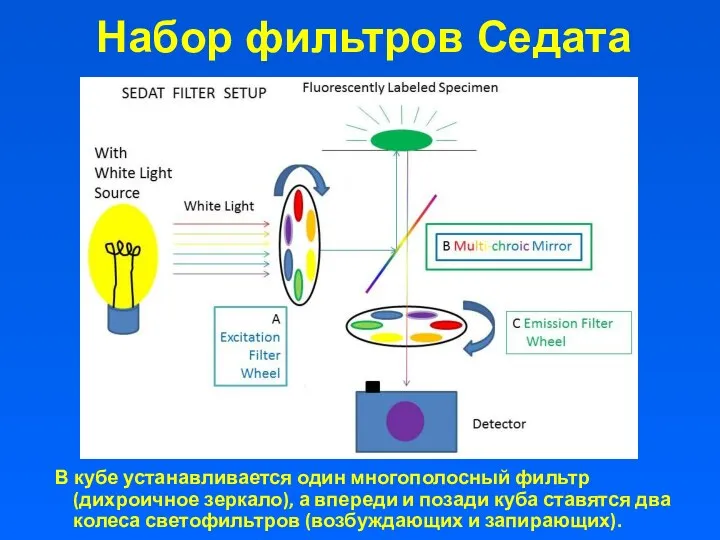
- 20. Набор фильтров Седата В кубе устанавливается один многополосный фильтр (дихроичное зеркало), а впереди и позади куба
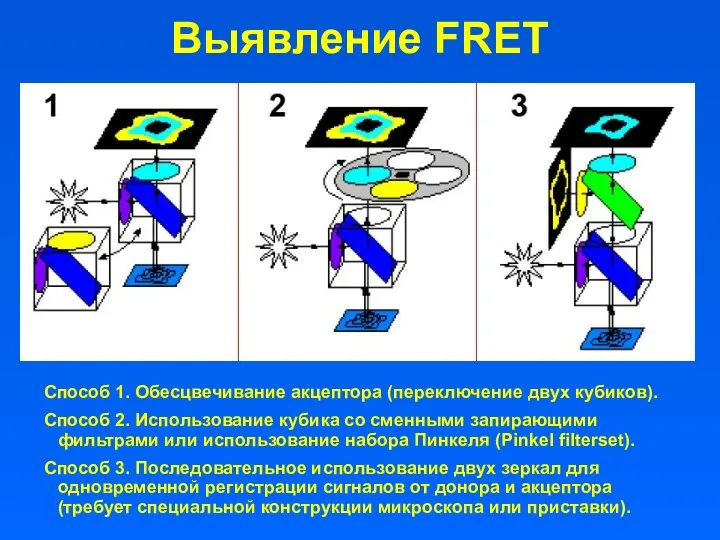
- 21. Выявление FRET Способ 1. Обесцвечивание акцептора (переключение двух кубиков). Способ 2. Использование кубика со сменными запирающими
- 22. Светоделитель Hamamatsu Общий вид устройства Слева – вход в порт микроскопа Справа – выход на камеру
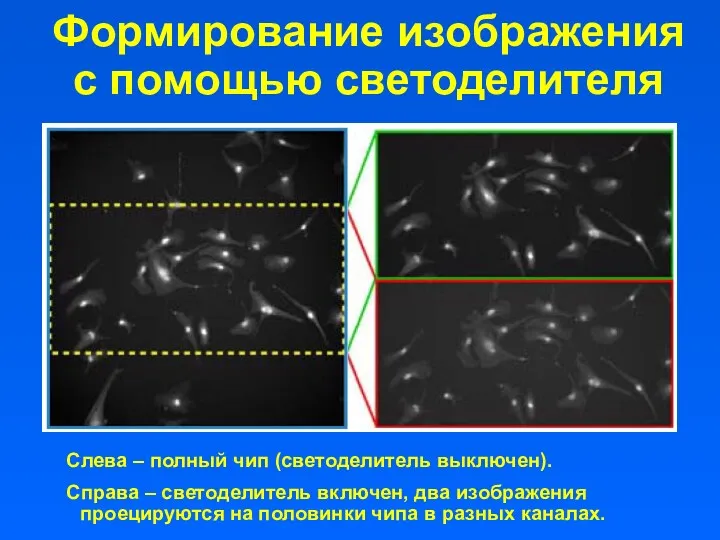
- 23. Формирование изображения с помощью светоделителя Слева – полный чип (светоделитель выключен). Справа – светоделитель включен, два
- 24. 1. Эмиссия акцептора (перенос присутствует). Возбуждается молекула донора (например, GFP при 488 нм или BFP при
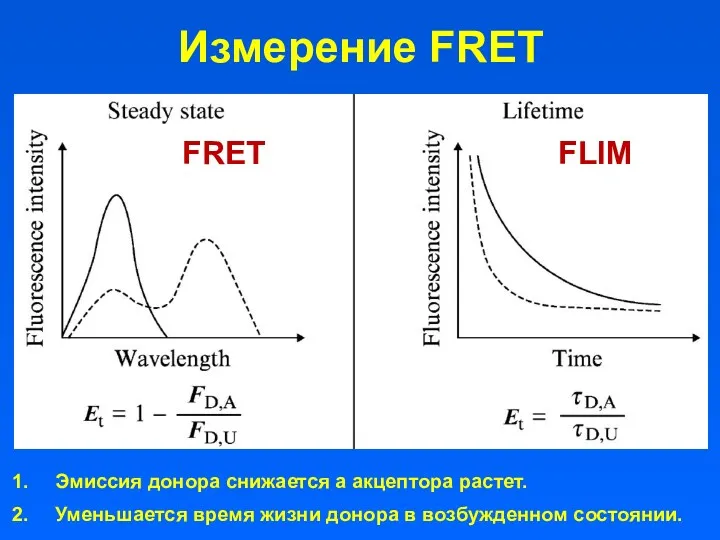
- 25. Измерение FRET Эмиссия донора снижается а акцептора растет. Уменьшается время жизни донора в возбужденном состоянии. FRET
- 26. Измерение времени затухания флуоресценции (Fluorescence Lifetime Imaging Microscopy - FLIM) Измеряется время жизни молекулы в возбужденном
- 27. Лазер с очень короткими импульсами (единицы пикосекунд) возбуждает флуоресценцию. Одновременно индуцируется запись сигнала на ФЭУ (с
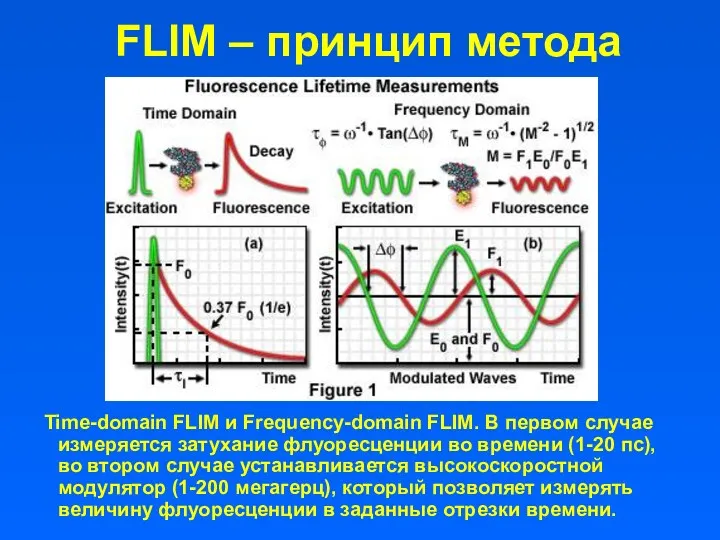
- 28. FLIM – принцип метода Time-domain FLIM и Frequency-domain FLIM. В первом случае измеряется затухание флуоресценции во
- 29. Конфигурация для FLIM – двух- и однофотонный микроскоп
- 30. Конфигурация FLIM для определения многих длин волн Сигнал разбивается 16-канальным детектором, каждый детектор записывает отдельный канал
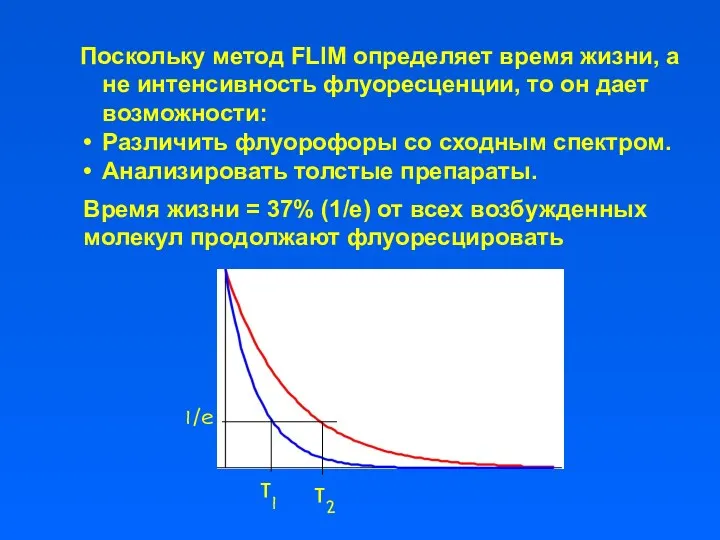
- 31. Поскольку метод FLIM определяет время жизни, а не интенсивность флуоресценции, то он дает возможности: Различить флуорофоры
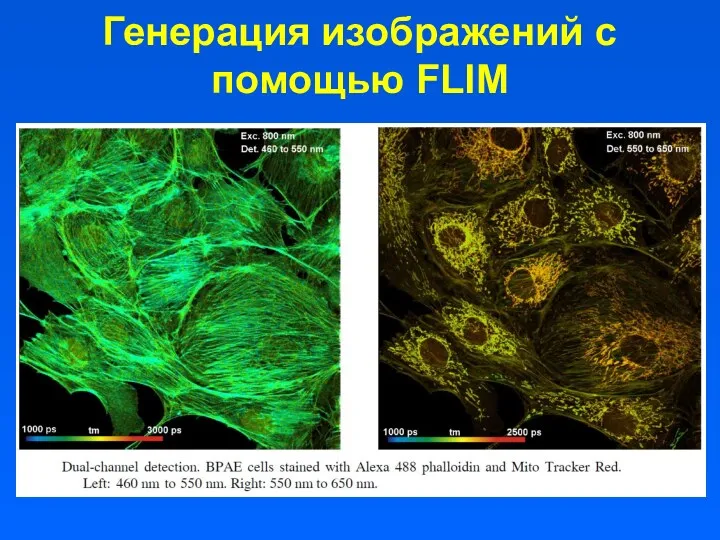
- 32. Генерация изображений с помощью FLIM
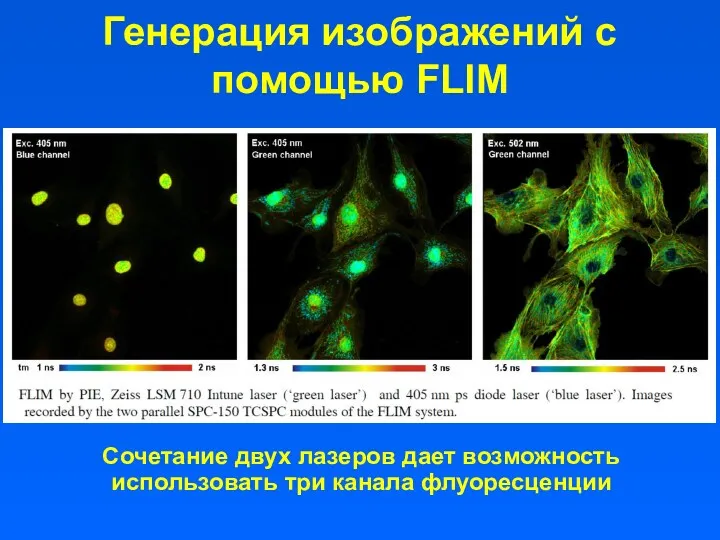
- 33. Генерация изображений с помощью FLIM Сочетание двух лазеров дает возможность использовать три канала флуоресценции
- 34. Двухфотонная система – титан-сапфировый лазер (фемптосекундное возбуждение, продолжительность импульса - 10-13 с) Однофотонная система – пикосекундный
- 36. Скачать презентацию













 Тепловые явления. Изменение агрегатных состояний вещества
Тепловые явления. Изменение агрегатных состояний вещества Вращение твердого тела вокруг неподвижной оси
Вращение твердого тела вокруг неподвижной оси Плотность вещества
Плотность вещества Презентация к уроку на тему: Великий ученый древнего мира – Архимед и его закон
Презентация к уроку на тему: Великий ученый древнего мира – Архимед и его закон разработка урока 11 класс физика Волновые явления
разработка урока 11 класс физика Волновые явления Механическая работа
Механическая работа История развития энергетики. Циклы этногенеза
История развития энергетики. Циклы этногенеза Електрика в житті людини
Електрика в житті людини Измерение затухания
Измерение затухания Sentence simplifucation questions
Sentence simplifucation questions Лампочка. История изобретения
Лампочка. История изобретения Возникновение радио
Возникновение радио Напряженность магнитного поля
Напряженность магнитного поля ”Движение по окружности”
”Движение по окружности” Оптические методы анализа: поляриметрия. Аппартурная схема прибора, область применения в фармацевтическом анализе
Оптические методы анализа: поляриметрия. Аппартурная схема прибора, область применения в фармацевтическом анализе Проектная работа Система подготовки учащихся к ЕГЭ по физике
Проектная работа Система подготовки учащихся к ЕГЭ по физике Излучение
Излучение Поршневой жидкостный насос. Гидравлический пресс
Поршневой жидкостный насос. Гидравлический пресс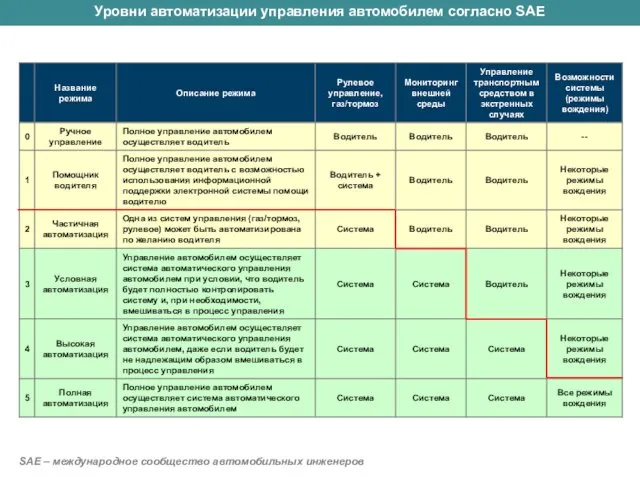 Управление автомобилем
Управление автомобилем Плоске дзеркало. Закони відбивання
Плоске дзеркало. Закони відбивання Механические колебания и волны
Механические колебания и волны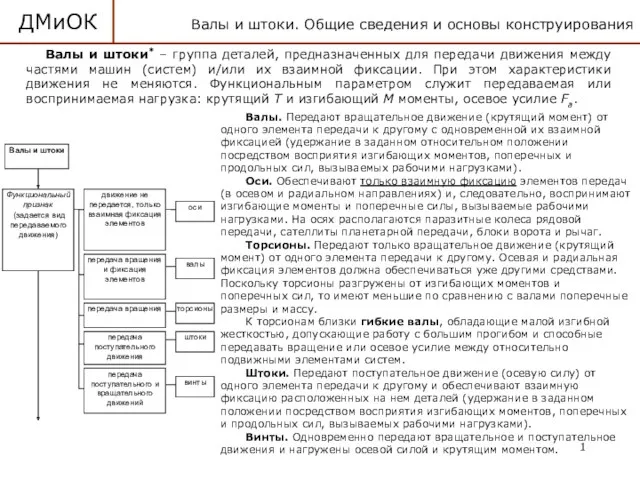 Детали машин и основы конструирования. Валы и штоки. (Лекция 11)
Детали машин и основы конструирования. Валы и штоки. (Лекция 11) Презентация к уроку физики в 8 классе по теме Электризация
Презентация к уроку физики в 8 классе по теме Электризация Размещение автосцепки на вагоне. Особенности автосцепки СА-3М
Размещение автосцепки на вагоне. Особенности автосцепки СА-3М Повторение за 8 класс
Повторение за 8 класс Презентация к уроку физики 9 класса Радиоактивность
Презентация к уроку физики 9 класса Радиоактивность Подшипники качения
Подшипники качения Сила Лоренца. Второй закон Ньютона. Напряженность электрического поля. Полная энергия релятивистской частицы
Сила Лоренца. Второй закон Ньютона. Напряженность электрического поля. Полная энергия релятивистской частицы