Содержание
- 2. Вопрос 8. Квантовые системы тождественных частиц. Системы тождественных частиц. Бозоны и фермионы. Принцип Паули .
- 3. Системы тождественных частиц См. файл частицы.pdf Системы тождественных частиц
- 4. Бозоны и фермионы См. файл частицы.pdf
- 5. Бозоны и фермионы: спин и статистика В релятивистской квантовой теории сохраняется полная энергия, масса и полное
- 6. Бозоны и фермионы: спин и статистика См. файл спин и статистика.pdf
- 7. Бозоны и фермионы: спин и статистика См. файл спин и статистика.pdf
- 8. Принцип Паули См. файл частицы.pdf
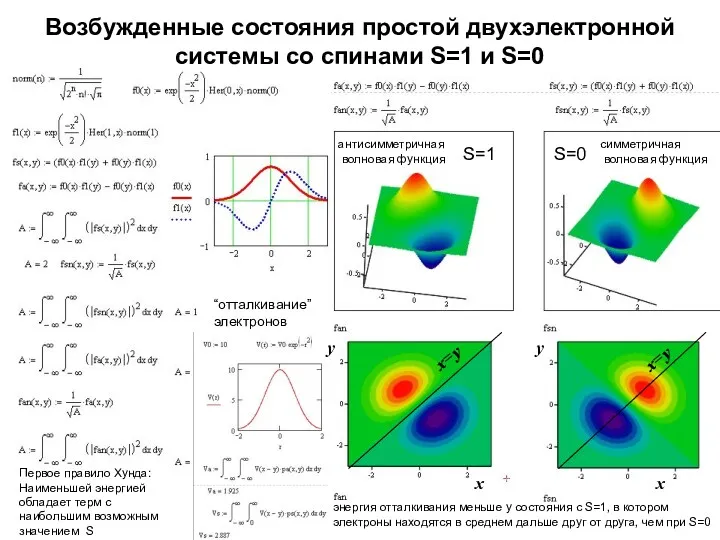
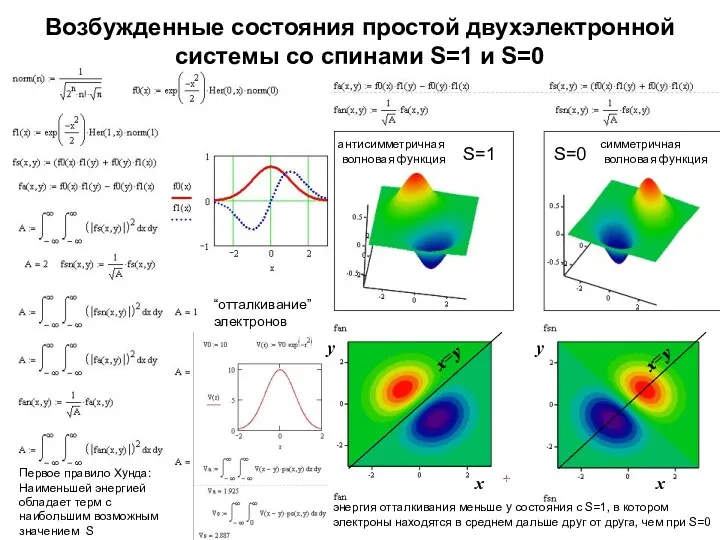
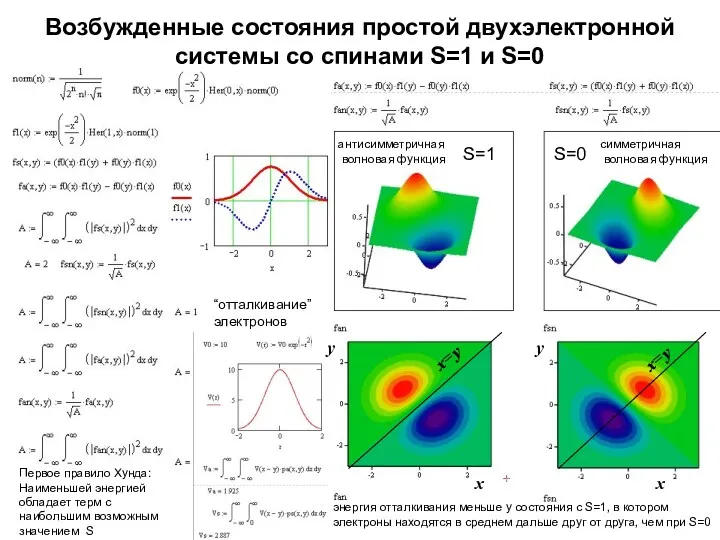
- 9. Возбужденные состояния простой двухэлектронной системы со спинами S=1 и S=0 S=1 S=0 x x y антисимметричная
- 10. Возбужденные состояния простой двухэлектронной системы со спинами S=1 и S=0 S=1 S=0 x x y антисимметричная
- 11. Вопрос 9. Многоэлектронные атомы. Многоэлектронный атом. Приближение самосогласованного поля. Электронная конфигурация. Терм. Тонкая структура терма. Приближение
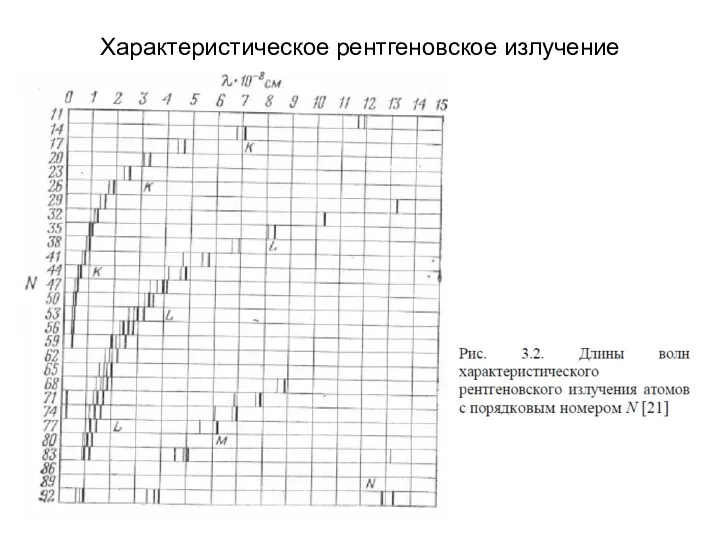
- 12. Характеристическое рентгеновское излучение
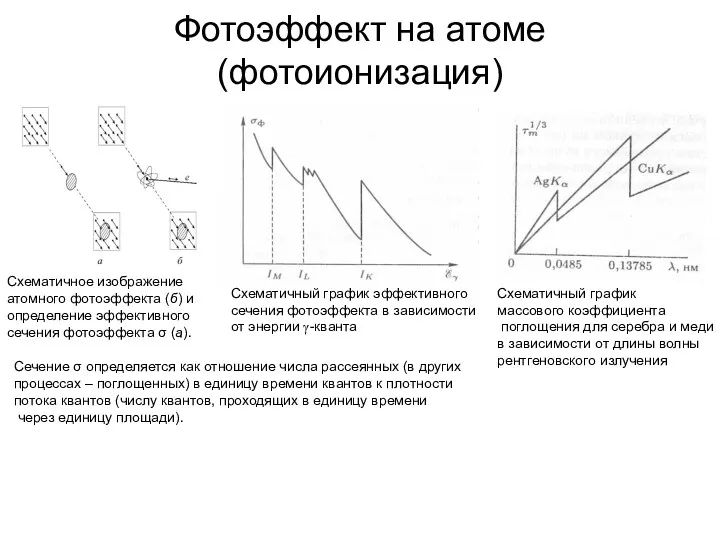
- 13. Фотоэффект на атоме (фотоионизация) Схематичное изображение атомного фотоэффекта (б) и определение эффективного сечения фотоэффекта σ (а).
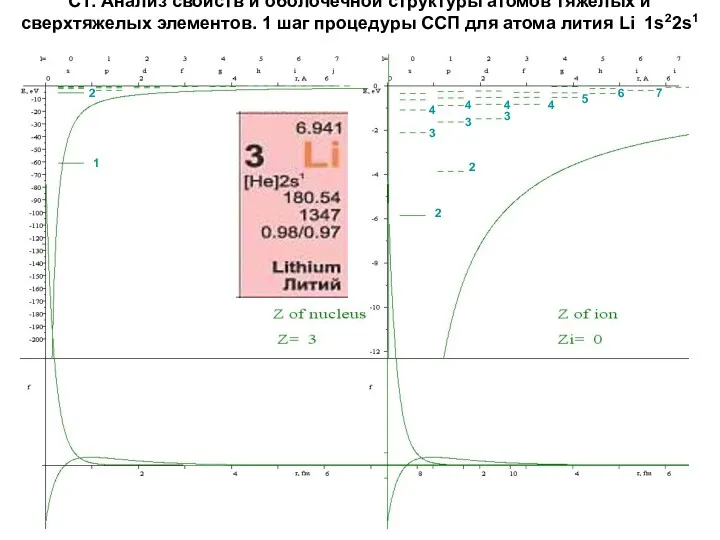
- 14. С1. Анализ свойств и оболочечной структуры атомов тяжелых и сверхтяжелых элементов. 1 шаг процедуры ССП для
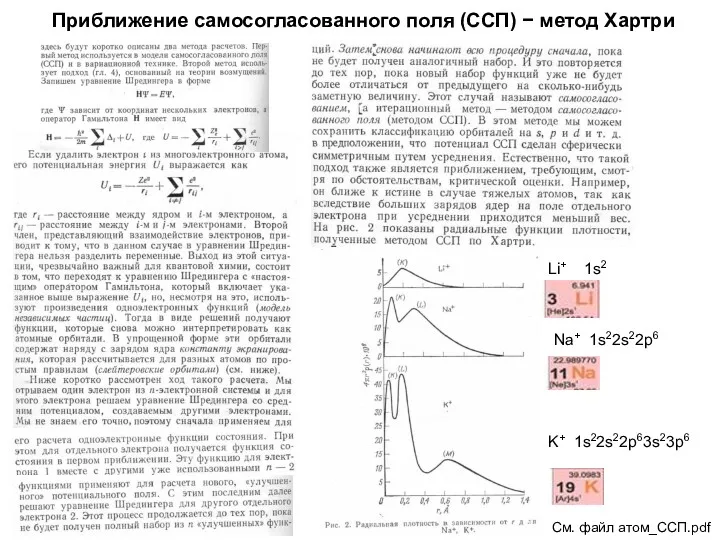
- 15. Приближение самосогласованного поля (ССП) − метод Хартри См. файл атом_ССП.pdf Li+ 1s2 Na+ 1s22s22p6 K+ 1s22s22p63s23p6
- 16. Приближение самосогласованного поля (ССП) − метод Хартри См. файл атом_ССП.pdf
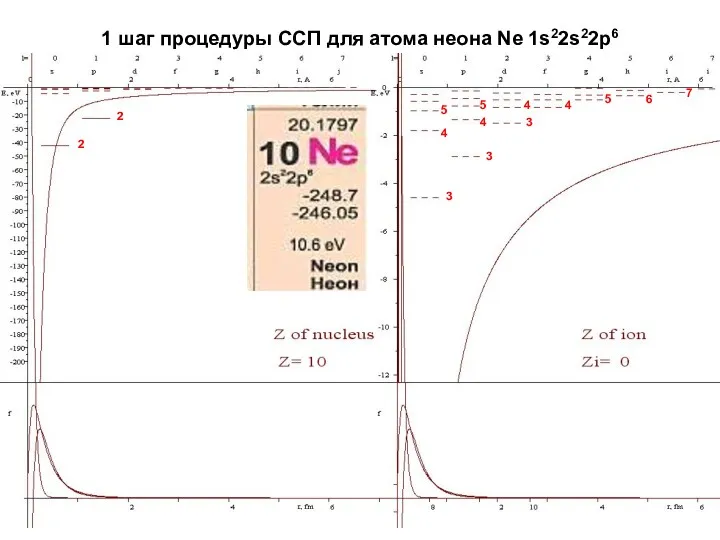
- 17. 1 шаг процедуры ССП для атома неона Ne 1s22s22p6 2 2 3 3 3 4 4
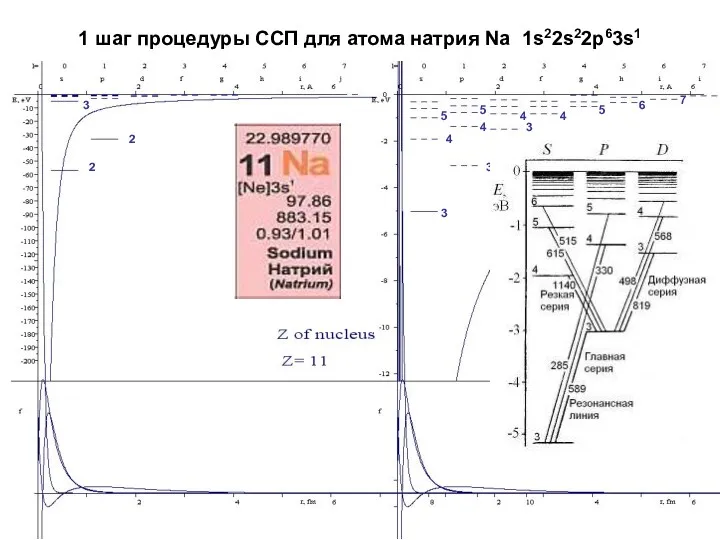
- 18. 1 шаг процедуры ССП для атома натрия Na 1s22s22p63s1 2 2 3 3 3 3 4
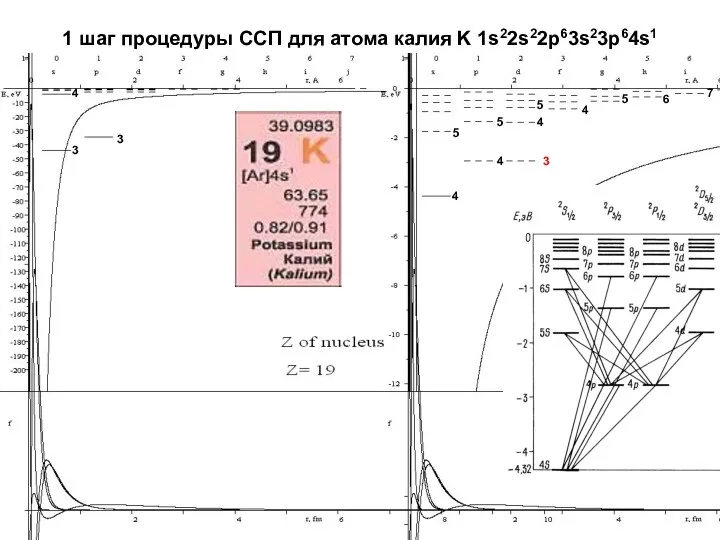
- 19. 1 шаг процедуры ССП для атома калия K 1s22s22p63s23p64s1 4 4 4 4 3 3 3
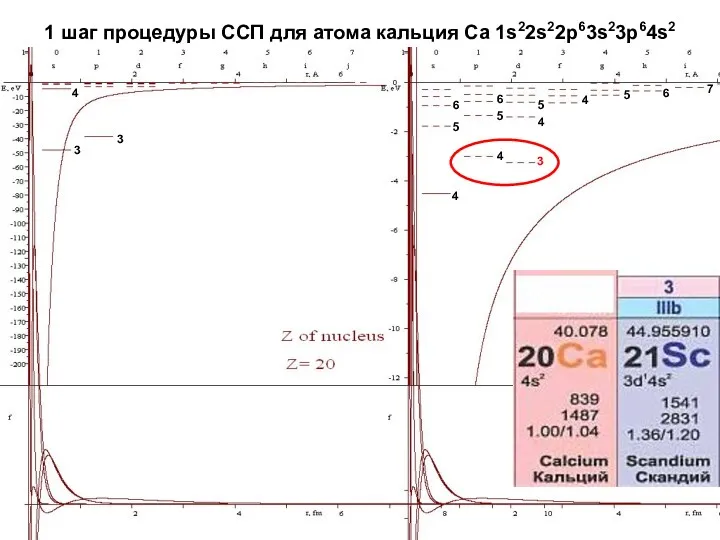
- 20. 1 шаг процедуры ССП для атома кальция Ca 1s22s22p63s23p64s2 4 4 4 4 3 3 3
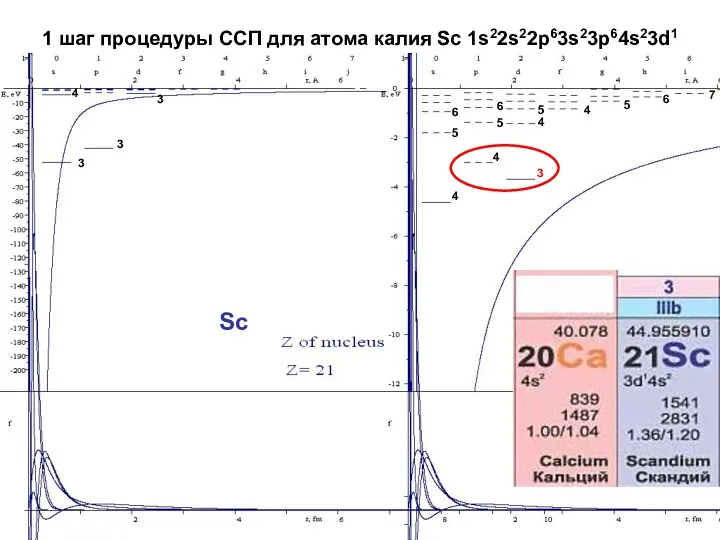
- 21. 1 шаг процедуры ССП для атома калия Sc 1s22s22p63s23p64s23d1 Sc 4 4 4 4 3 3
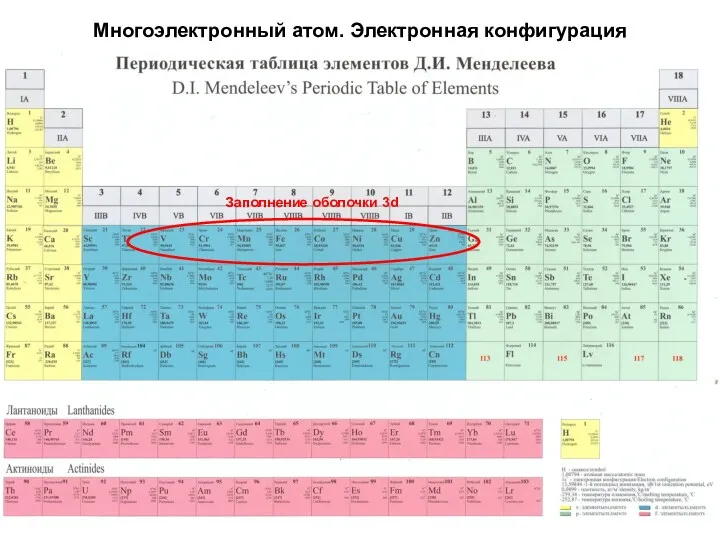
- 22. Многоэлектронный атом. Электронная конфигурация Заполнение оболочки 3d
- 23. Многоэлектронный атом. Электронная конфигурация Заполнение оболочки 3d
- 24. Обменное взаимодействие Обменное взаимодей- ствие учитывается в процедуре ССП метода Хартри-Фока и по теории возмущений. Простейший
- 25. Возбужденные состояния простой двухэлектронной системы со спинами S=1 и S=0 S=1 S=0 x x y антисимметричная
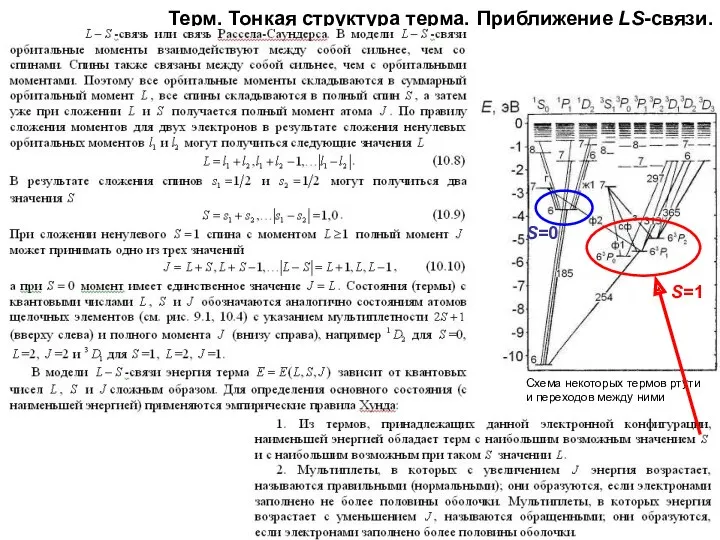
- 26. Терм. Тонкая структура терма. Приближение LS-связи. Схема некоторых термов ртути и переходов между ними S=1 S=0
- 27. Приближение LS-связи. Пример атома ртути. Схема некоторых термов ртути и переходов между ними, в разрывах стрелок
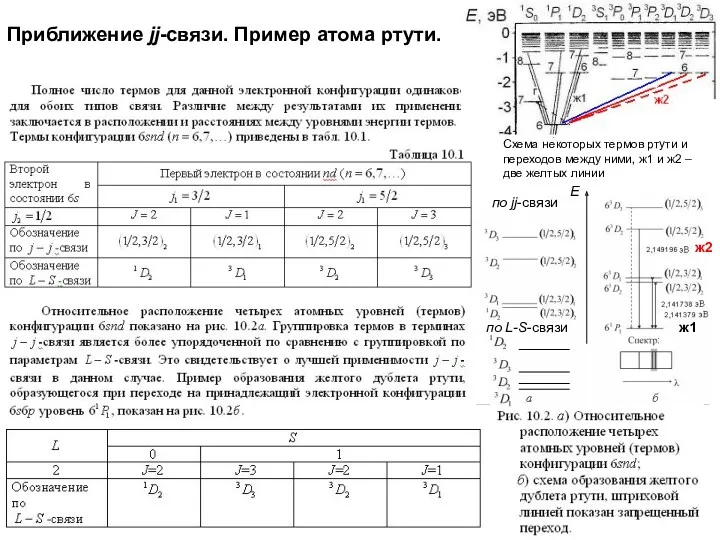
- 28. Приближение jj-связи.
- 29. Приближение jj-связи. Пример атома ртути. Схема некоторых термов ртути и переходов между ними, ж1 и ж2
- 30. Вопрос 10. Молекулы. Основы физики молекул. Молекулярные спектры излучения и поглощения. Адиабатическое приближение. Термы двухатомной молекулы.
- 31. Основы физики молекул. Вращение ядер (атомных остовов).
- 32. Основы физики молекул. Колебания ядер (атомных остовов).
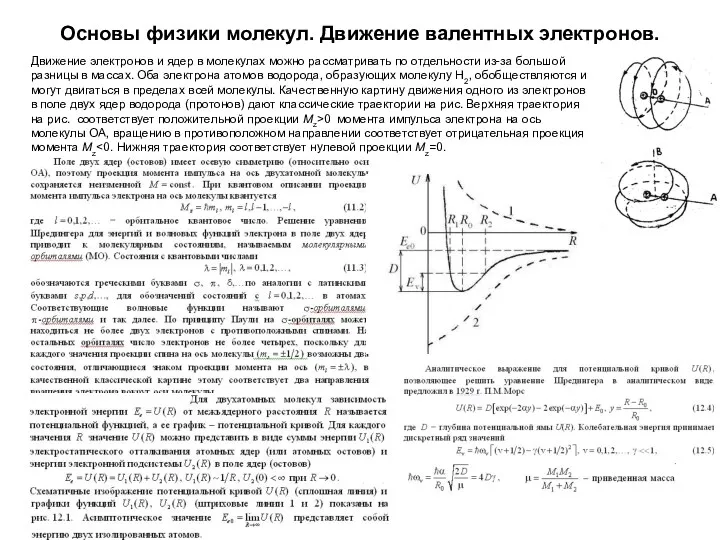
- 33. Основы физики молекул. Движение валентных электронов. Движение электронов и ядер в молекулах можно рассматривать по отдельности
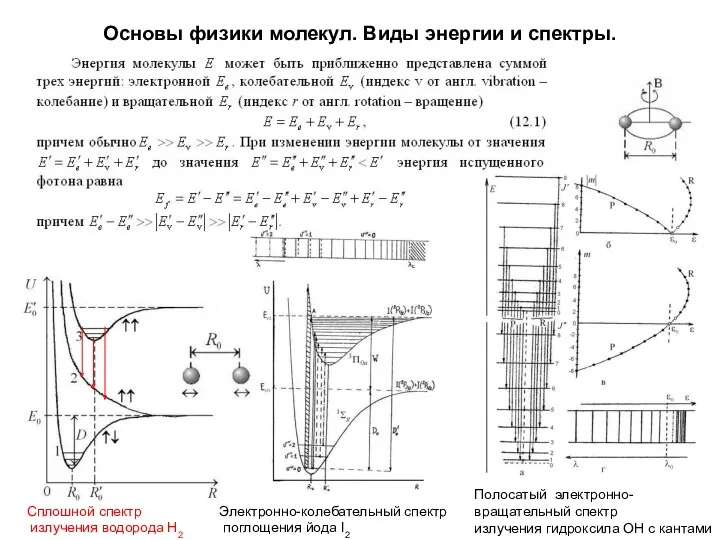
- 34. Основы физики молекул. Виды энергии и спектры. Сплошной спектр излучения водорода Н2 Электронно-колебательный спектр поглощения йода
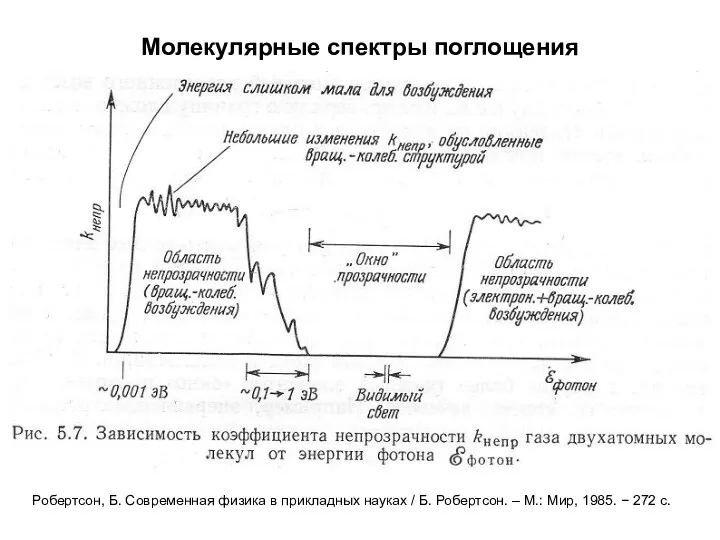
- 35. Молекулярные спектры поглощения Робертсон, Б. Современная физика в прикладных науках / Б. Робертсон. – М.: Мир,
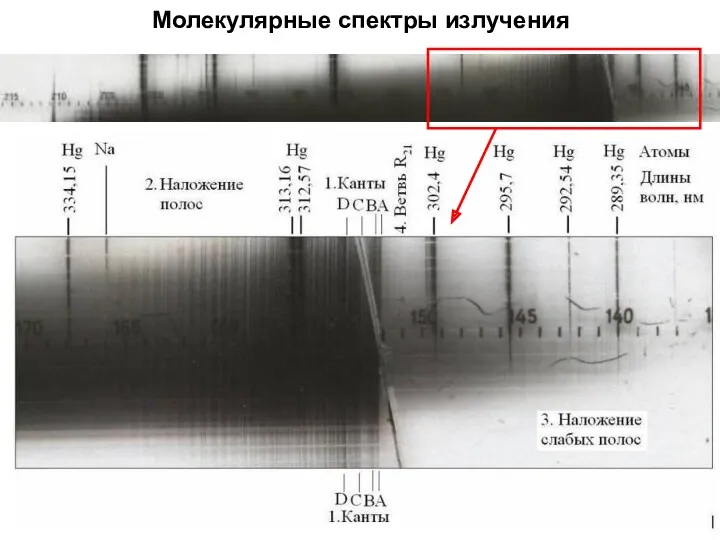
- 36. Молекулярные спектры излучения Многолинейчатый спектр Н2 Сплошной спектр Н2 Серия Бальмера атомарного водорода Н
- 37. Молекулярные спектры излучения
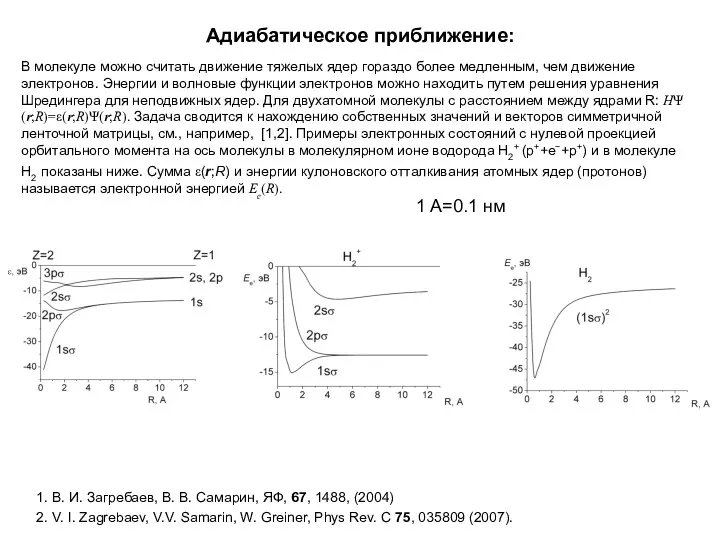
- 38. Адиабатическое приближение: В молекуле можно считать движение тяжелых ядер гораздо более медленным, чем движение электронов. Энергии
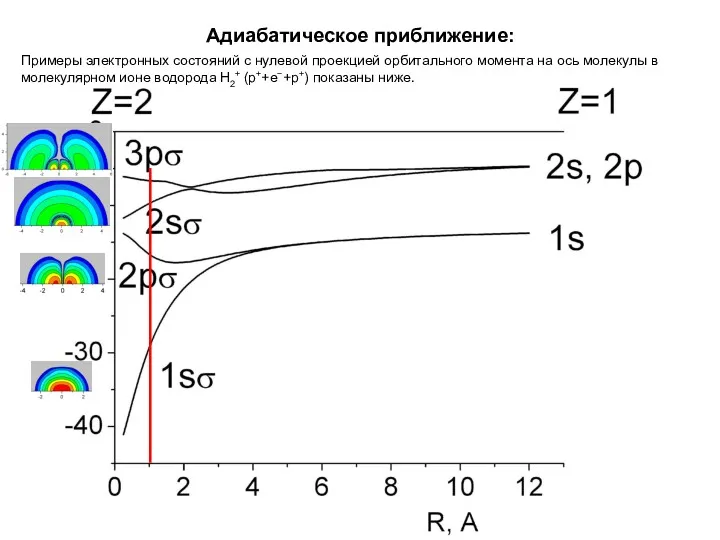
- 39. Адиабатическое приближение: Примеры электронных состояний с нулевой проекцией орбитального момента на ось молекулы в молекулярном ионе
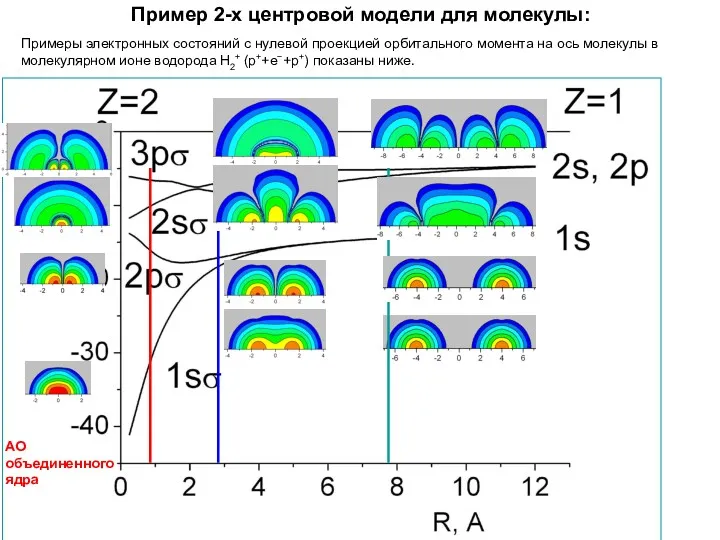
- 40. Пример 2-х центровой модели для молекулы: Примеры электронных состояний с нулевой проекцией орбитального момента на ось
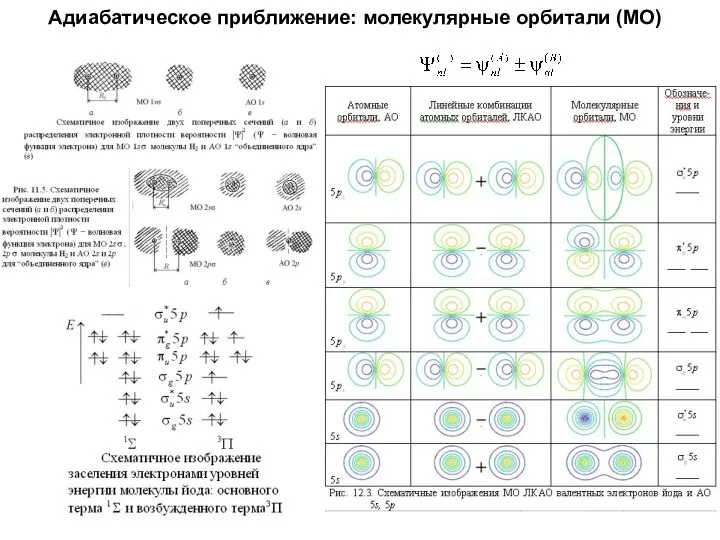
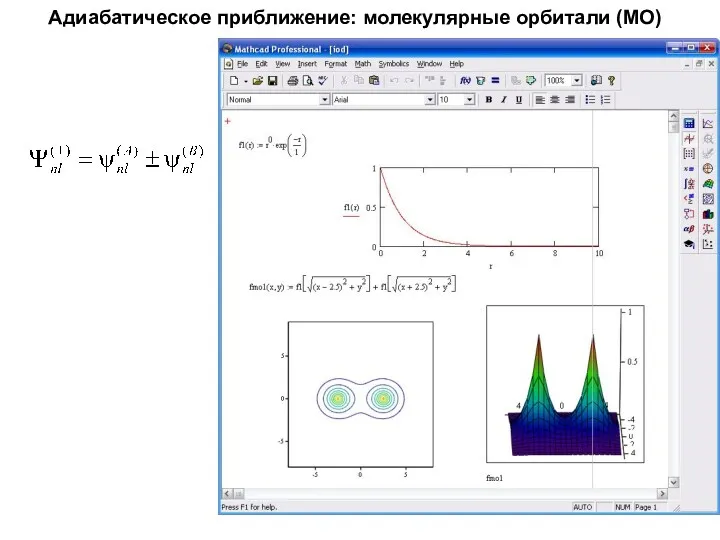
- 41. Адиабатическое приближение: молекулярные орбитали (МО)
- 42. Адиабатическое приближение: молекулярные орбитали (МО)
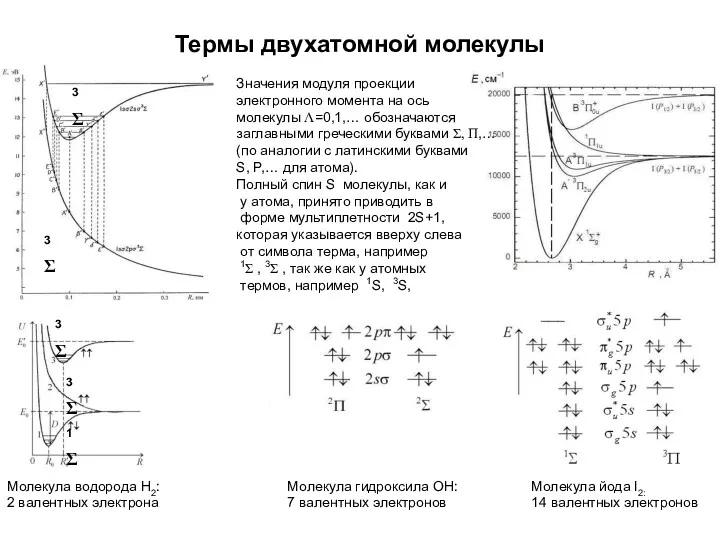
- 43. Термы двухатомной молекулы Молекула водорода Н2: 2 валентных электрона Молекула йода I2: 14 валентных электронов Молекула
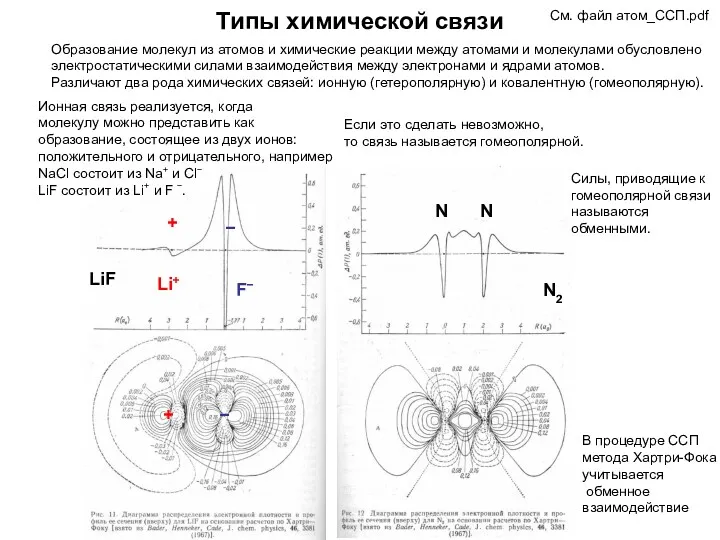
- 44. Типы химической связи См. файл атом_ССП.pdf Образование молекул из атомов и химические реакции между атомами и
- 46. Скачать презентацию

















 Принцип работы тепловых машин
Принцип работы тепловых машин Уравнения строительной механики. Вариационные принципы строительной механики
Уравнения строительной механики. Вариационные принципы строительной механики тест по физике 7 класс
тест по физике 7 класс Квалиметриялық шкалалар
Квалиметриялық шкалалар Дисперсия, интерференция, дифракция и поляризация света
Дисперсия, интерференция, дифракция и поляризация света Ауада ұшу тақырыбына презентаия
Ауада ұшу тақырыбына презентаия Lecture 12 Current & Resistance
Lecture 12 Current & Resistance Уравнение движения системы с переменной массой
Уравнение движения системы с переменной массой Радиолокация и радиолокатор
Радиолокация и радиолокатор Гироскопические приборы и устройства
Гироскопические приборы и устройства Перенапряжения при однофазных дуговых замыканиях на землю в сетях 6–35 кВ
Перенапряжения при однофазных дуговых замыканиях на землю в сетях 6–35 кВ Давление в жидкостях и газах. Закон Паскаля (7 класс)
Давление в жидкостях и газах. Закон Паскаля (7 класс) Кинематика. Относительность механического движения
Кинематика. Относительность механического движения Крутые машины
Крутые машины Сила и сила трения
Сила и сила трения Аэродинамика и летно-технические данные вертолёта. Тема №1. Основные понятия о несущей поверхности. Лекция №2
Аэродинамика и летно-технические данные вертолёта. Тема №1. Основные понятия о несущей поверхности. Лекция №2 Электрическое поле системы неподвижных зарядов в вакууме. Теорема Гаусса для электростатического поля
Электрическое поле системы неподвижных зарядов в вакууме. Теорема Гаусса для электростатического поля Урок Преломление света – 8 класс
Урок Преломление света – 8 класс Общая теория относительности Эйнштейна
Общая теория относительности Эйнштейна Спектры и спектральные аппараты. Виды спектров. Спектральный анализ
Спектры и спектральные аппараты. Виды спектров. Спектральный анализ ПРА и системы управления освещением
ПРА и системы управления освещением Электромагнитная совместимость. Электромагнитные помехи. (Занятие 2)
Электромагнитная совместимость. Электромагнитные помехи. (Занятие 2) Упругая деформация
Упругая деформация Разнообразие форм домашней работы учащихся по физике.
Разнообразие форм домашней работы учащихся по физике. Презентация к уроку по теме : Механическая работа. Единицы работы.
Презентация к уроку по теме : Механическая работа. Единицы работы. Действие магнитного поля на движущийся заряд. 9 класс
Действие магнитного поля на движущийся заряд. 9 класс Как и почему летают самолеты и планера
Как и почему летают самолеты и планера Защита от шума
Защита от шума