Содержание
- 2. Модель атома Резерфорда-Бора Опыты Резерфорда. Планетарная модель атома. Линейчатый спектр излучения атома водорода. Спектральные серии. Постулаты
- 3. 1. Опыты Резерфорда. Планетарная модель атома. Модель Томсона. Атом представляет собой непрерывно заряженный положительным зарядом шар
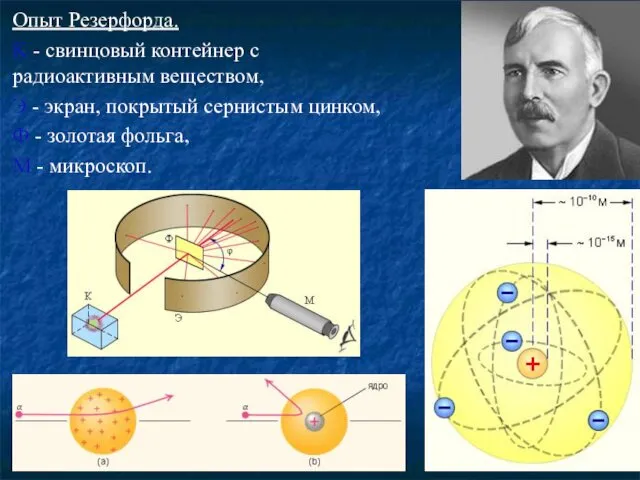
- 4. Опыт Резерфорда. K - свинцовый контейнер с радиоактивным веществом, Э - экран, покрытый сернистым цинком, Ф
- 5. Модель атома Резерфорда (ядерная, планетарная). Вокруг положительного ядра, имеющего заряд Z·e, размер 10-15-10-14м и массу, практически
- 6. Недостатки модели атома Резерфорда: 1. Модель не согласуется с наблюдаемой стабильностью атомов; противоречит законам классической физики.
- 7. Недостатки модели атома Резерфорда: 2. Модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры
- 8. 2. Линейчатый спектр излучения атома водорода. Спектральные серии. Спектры излучения состоят из отдельных спектральных линий или
- 9. Экспериментальный спектр атома водорода
- 10. В каждой данной серии m имеет постоянное значение, m=1,2,3,4,5,6 (определяет серию), n принимает целочисленные значения начиная
- 11. 3. Постулаты Бора. Спектр энергии электрона. Испускание и поглощение энергии атомом. Первый постулат Бора (постулат стационарных
- 12. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не
- 13. Второй постулат Бора (правило частот): При переходе атома из одного стационарного состояния в другое излучается (поглощается)
- 14. Спектр энергии электрона Уравнение движения электрона, движущегося по круговой орбите атома водорода: n=1, 2, 3,… Электрон,
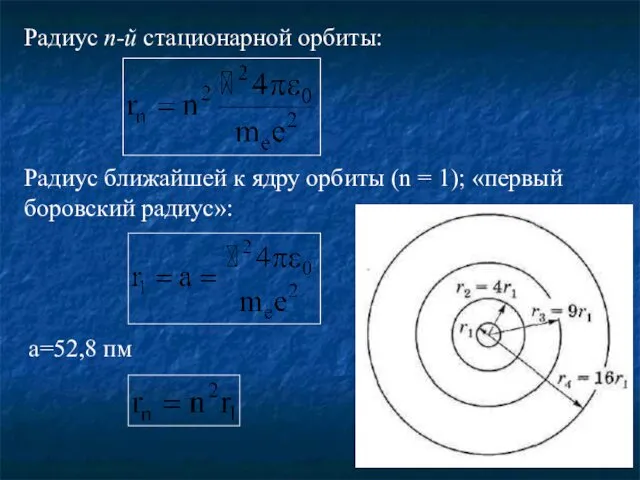
- 15. Радиус n-й стационарной орбиты: Радиус ближайшей к ядру орбиты (n = 1); «первый боровский радиус»: a=52,8
- 16. Значения для радиусов и скоростей электрона в атоме водорода:
- 17. Кинетическая энергия электрона: Потенциальная энергия электрона в электростатическом поле ядра: Полная энергия электрона атоме водорода:
- 18. Квантование энергии. Энергия электрона в атоме водорода может принимать только дискретные значения, т.е. квантуется: энергетические состояния
- 19. Спектр атома водорода по Бору Энергия испущенного фотона при переходе атома водорода из состояния п в
- 21. Энергия ионизации Энергия, необходимая для удаления электрона из атома, находящегося в основном состоянии. Энергия связи данного
- 22. Достоинства и недостатки теории Бора. Достоинства: объяснила линейчатый спектр атомов; предсказала правильные значения частот спектральных линий
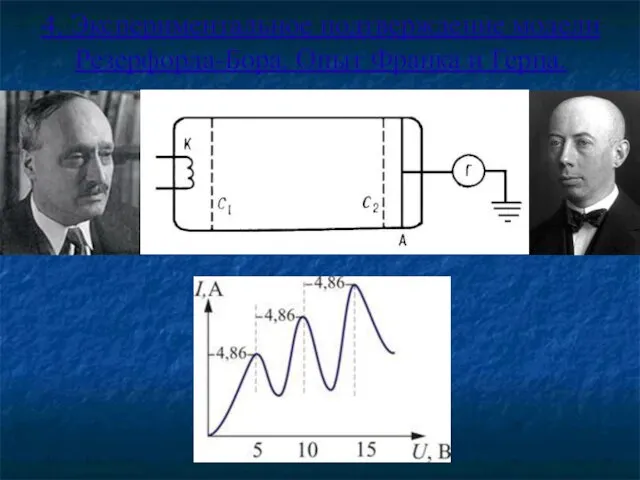
- 23. 4. Экспериментальное подтверждение модели Резерфорда-Бора. Опыт Франка и Герца.
- 25. Скачать презентацию



















 Линейные антенные решетки
Линейные антенные решетки Энергия электрического поля. Тема 6
Энергия электрического поля. Тема 6 Элементы гемодинамики
Элементы гемодинамики Метрология. Допуски и посадки шпоночных и шлицевых соединений
Метрология. Допуски и посадки шпоночных и шлицевых соединений Динамика механической системы
Динамика механической системы тепловые явления в юрте
тепловые явления в юрте Силовий трансформатор ЧС-4
Силовий трансформатор ЧС-4 Особливості будови систем та механізмів автомобіля ГАЗ-66
Особливості будови систем та механізмів автомобіля ГАЗ-66 Введение. Общие сведения о машинах и механизмах
Введение. Общие сведения о машинах и механизмах Зубчатые передачи
Зубчатые передачи Теоретическая механика. Статика абсолютно твердого тела
Теоретическая механика. Статика абсолютно твердого тела Diesel and petrol power
Diesel and petrol power Буксирное устройство судна и его техническая эксплуатация
Буксирное устройство судна и его техническая эксплуатация Пневмотранспорт, виды и применение. Достоинства и недостатки. Тема 14
Пневмотранспорт, виды и применение. Достоинства и недостатки. Тема 14 Методическая разработка для урока по теме Поперечность световых волн.
Методическая разработка для урока по теме Поперечность световых волн. Разборка и сборка тормозных колодок автобуса ЛИАЗ-5256
Разборка и сборка тормозных колодок автобуса ЛИАЗ-5256 Блок - разновидность простого механизма
Блок - разновидность простого механизма Системы ПТУ 2
Системы ПТУ 2 Гидродинамика. Поток жидкости и его основные понятия
Гидродинамика. Поток жидкости и его основные понятия Электрические цепи при гармоническом воздействии в установившемся режиме
Электрические цепи при гармоническом воздействии в установившемся режиме Уравнение Менделеева - Клапейрона
Уравнение Менделеева - Клапейрона Урок по физике в 7классе на тему Плотность вещества. Решение задач
Урок по физике в 7классе на тему Плотность вещества. Решение задач Tiristor GTO
Tiristor GTO Электротехника. Резонанс в электрических цепях. (Лекция 9)
Электротехника. Резонанс в электрических цепях. (Лекция 9) Измерение параметров инфракрасного и терагерцового излучения ч.2 Схемы измерения параметров
Измерение параметров инфракрасного и терагерцового излучения ч.2 Схемы измерения параметров Спектры. Виды спектров
Спектры. Виды спектров Инструментальные методы анализа
Инструментальные методы анализа Реализация проблемного метода обучения на уроках физики с помощью интерактивных компьютерных моделей
Реализация проблемного метода обучения на уроках физики с помощью интерактивных компьютерных моделей