Содержание
- 2. 1. Закономерности в атомных спектрах. Изолированные атомы в виде разреженного газа или паров металлов испускают спектр,
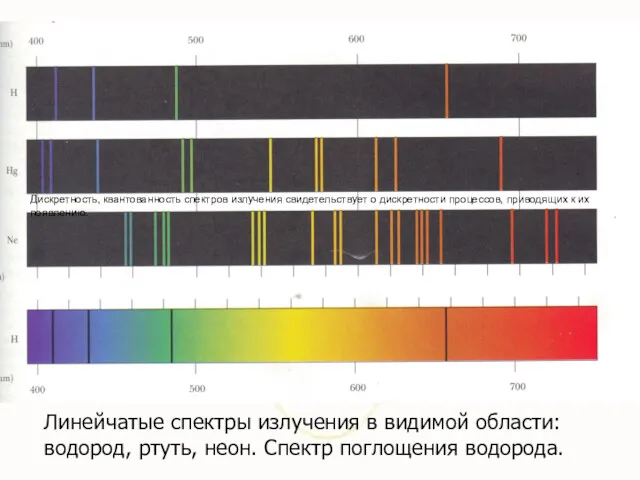
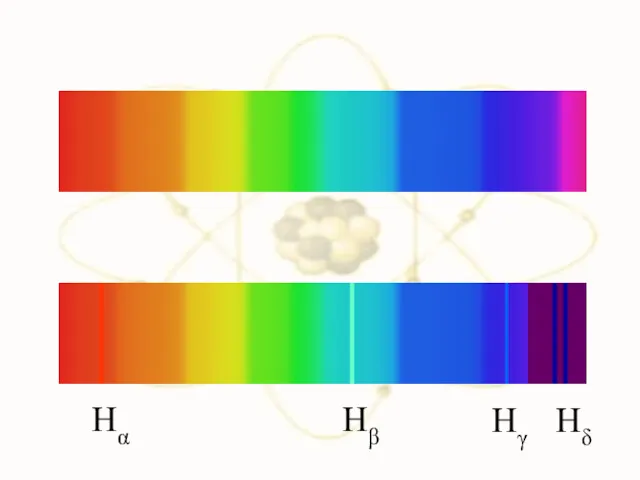
- 4. Линейчатые спектры излучения в видимой области: водород, ртуть, неон. Спектр поглощения водорода. Дискретность, квантованность спектров излучения
- 5. Швейцарский физик Й. Бальмер в 1885 году установил, что длины волн серии в видимой части спектра
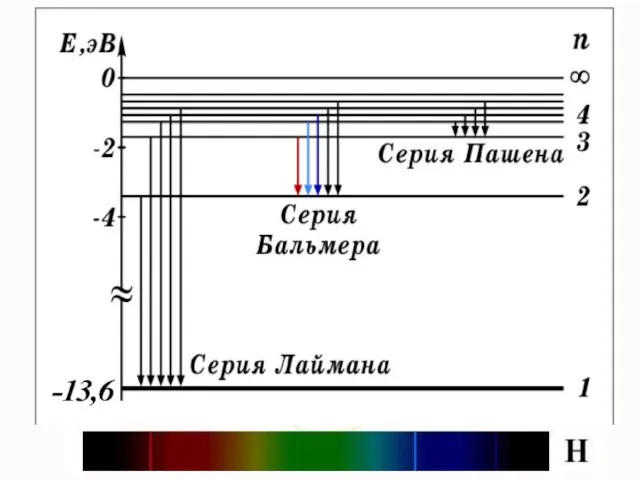
- 6. Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий:
- 7. Обобщенная формула Й. Бальмера где k = 1, 2, 3,…, n = k + 1, k
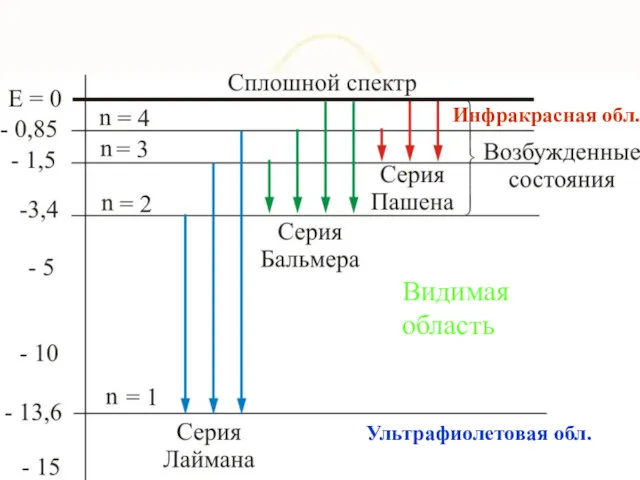
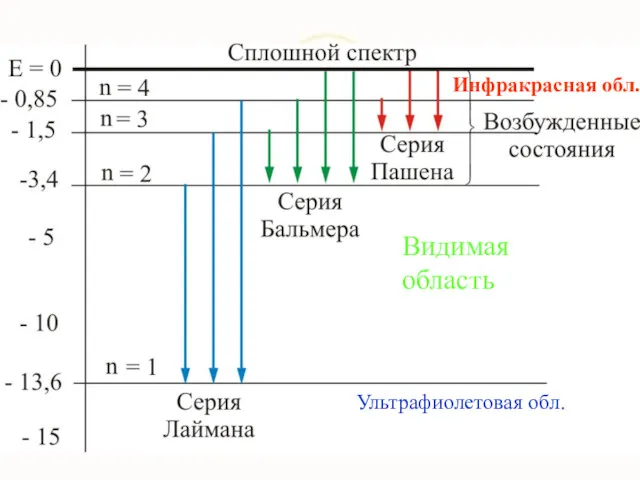
- 8. Видимая область Инфракрасная обл. Ультрафиолетовая обл.
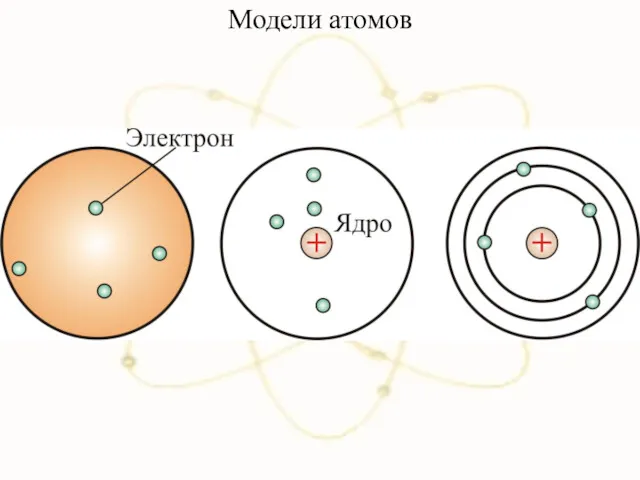
- 9. Модели атомов
- 10. 1895г. - открытие Х-лучей Рентгеном 1896г. - открытие радиоактивности Беккерелем 1897г. - открытие электрона (Дж.Томсон определил
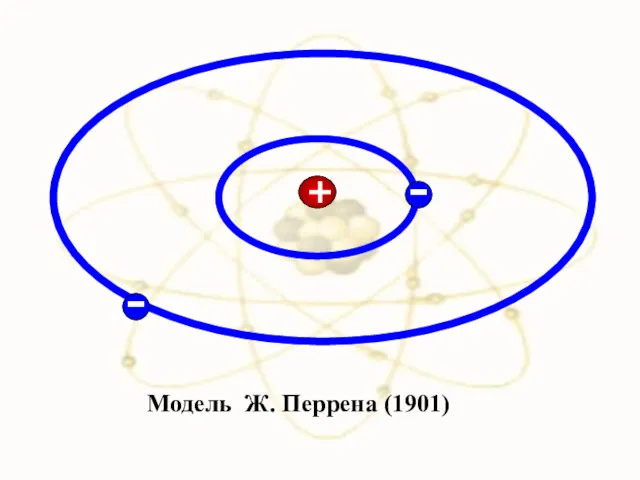
- 11. Модель Ж. Перрена (1901)
- 12. Модель Х. Нагаока (1904)
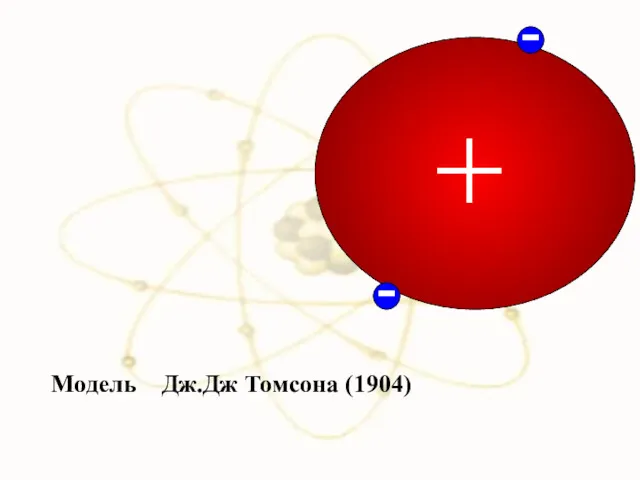
- 13. Модель Дж.Дж Томсона (1904)
- 14. В 1903 году Дж. Дж. Томсон, предложил модель атома: сфера, равномерно заполненная положительным электричеством, внутри которой
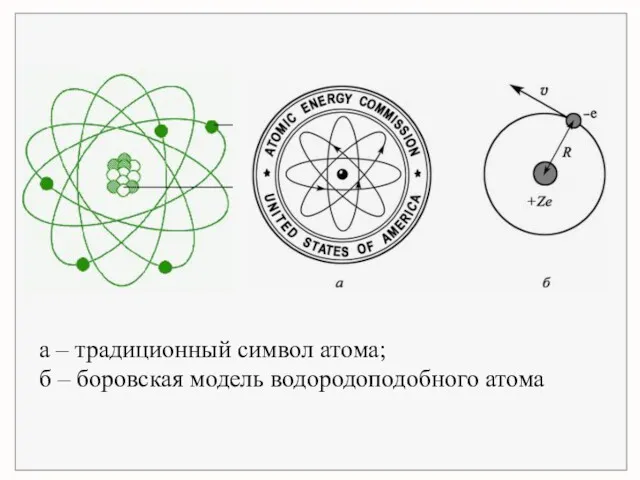
- 15. а – традиционный символ атома; б – боровская модель водородоподобного атома
- 16. В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф. Содди в 1903 г. разработал
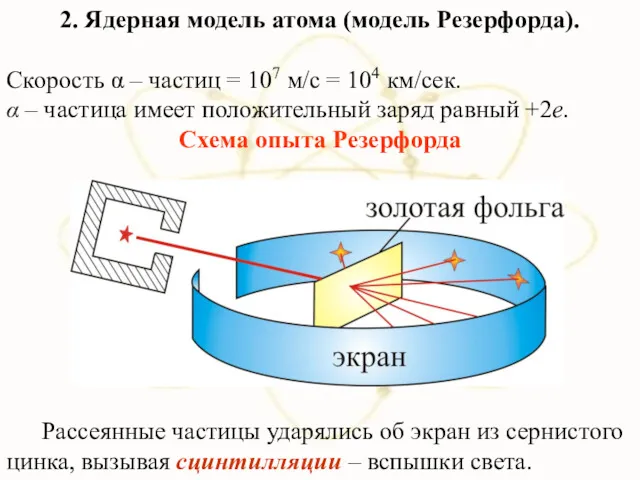
- 17. 2. Ядерная модель атома (модель Резерфорда). Скорость α – частиц = 107 м/с = 104 км/сек.
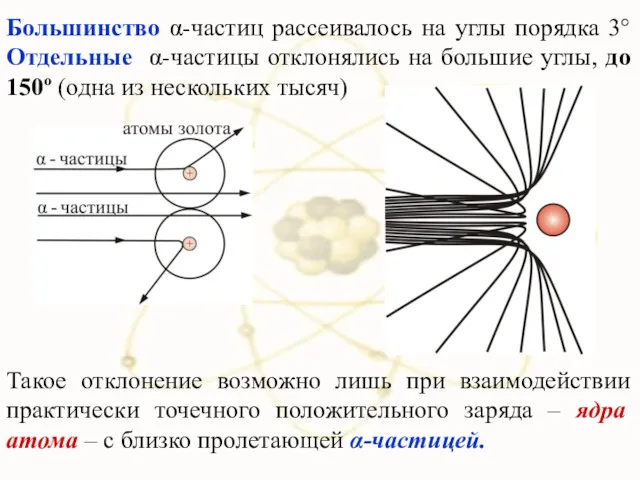
- 18. Большинство α-частиц рассеивалось на углы порядка 3° Отдельные α-частицы отклонялись на большие углы, до 150º (одна
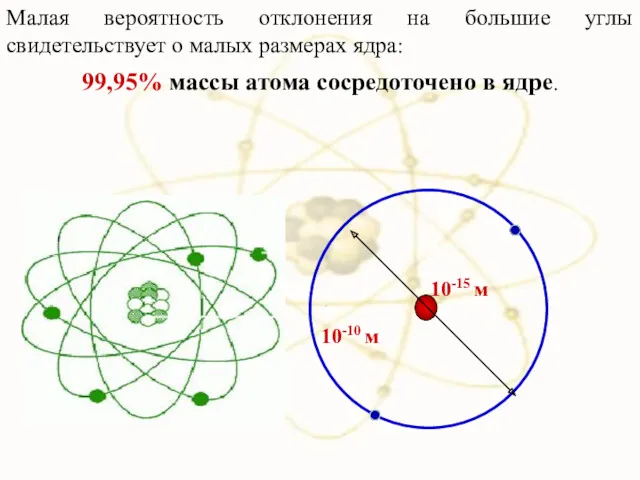
- 19. Малая вероятность отклонения на большие углы свидетельствует о малых размерах ядра: 99,95% массы атома сосредоточено в
- 20. Движение α-частицы происходит по гиперболе: Угол рассеяния равен углу между асимптотами гиперболы m – масса α-частицы,
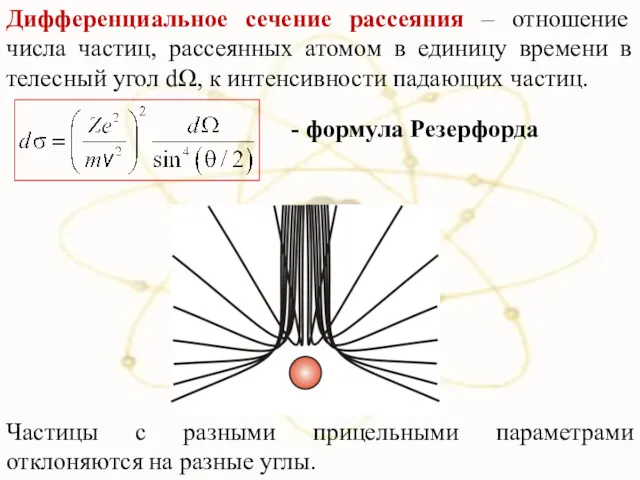
- 21. Дифференциальное сечение рассеяния – отношение числа частиц, рассеянных атомом в единицу времени в телесный угол dΩ,
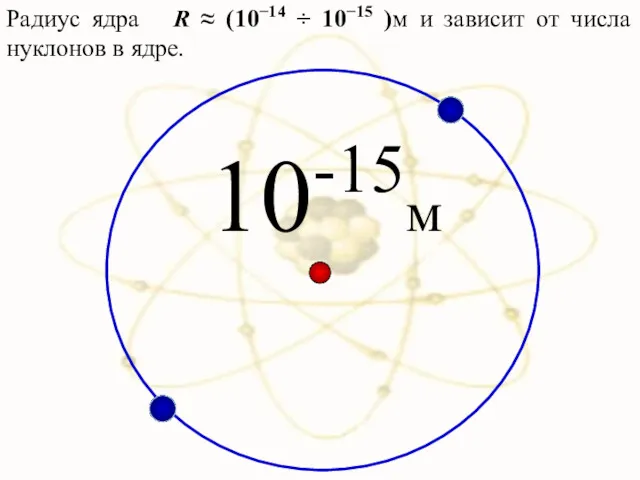
- 22. 10-15м Радиус ядра R ≈ (10−14 ÷ 10−15 )м и зависит от числа нуклонов в ядре.
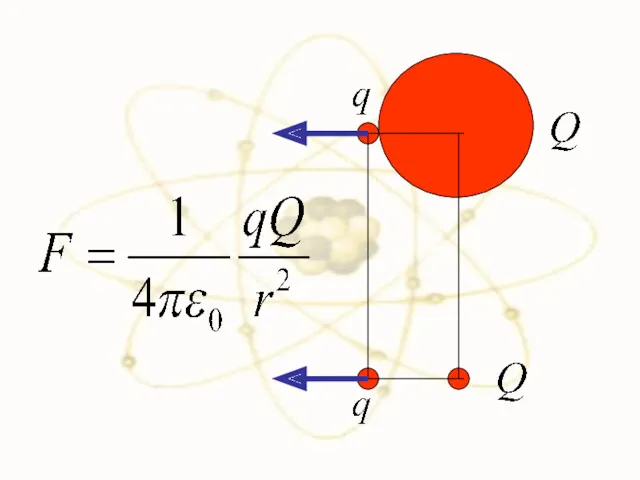
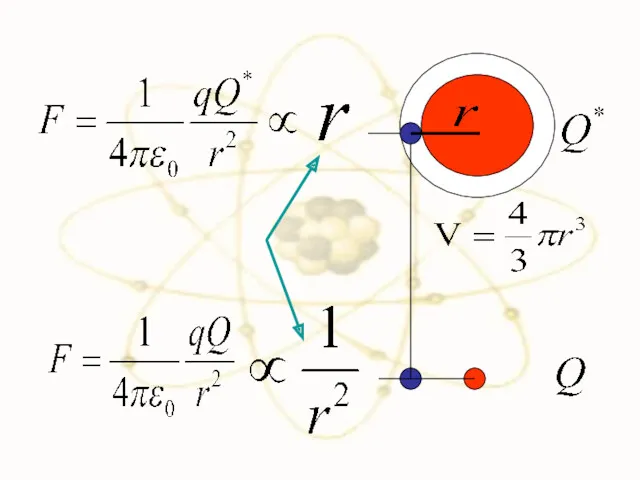
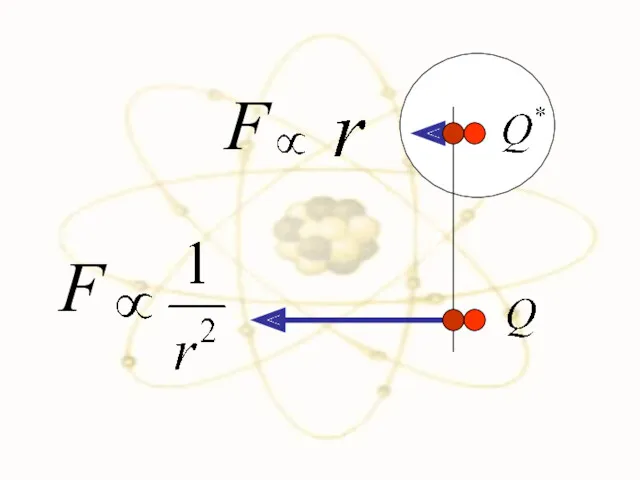
- 25. F F
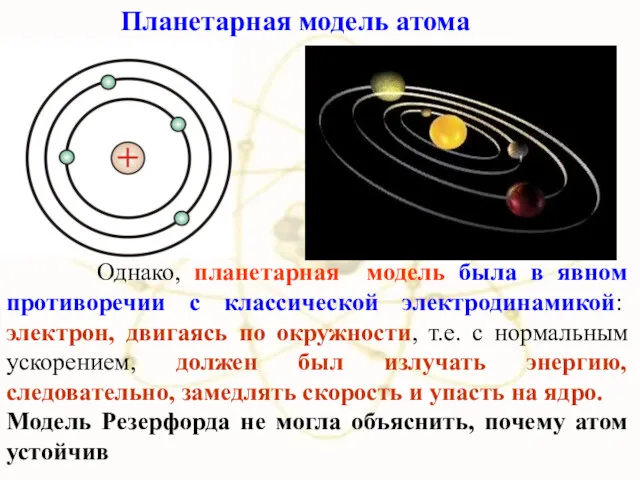
- 26. Однако, планетарная модель была в явном противоречии с классической электродинамикой: электрон, двигаясь по окружности, т.е. с
- 27. БОР Нильс Хендрик Давид (1885–1962) датский физик-теоретик, один из создателей современной физики. Сформулировал идею о дискретности
- 28. Атом следует описывать как «пирамиду» стационарных энергетических состояний. Пребывая в одном из стационарных состояний, атом не
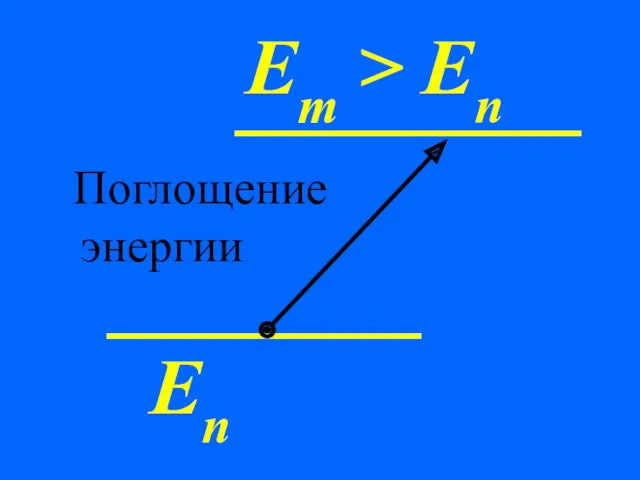
- 29. Еn Em > En Поглощение энергии
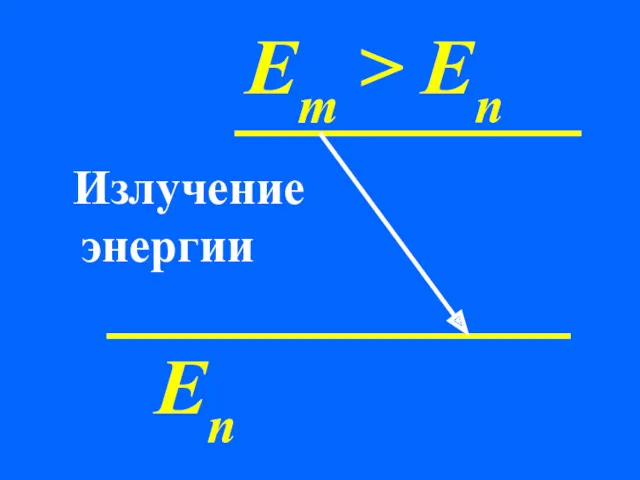
- 30. Еn Em > En Излучение энергии
- 31. Постулаты Бора Электроны движутся только по определенным (стационарным) орбитам. При этом не происходит излучения энергии. Условие
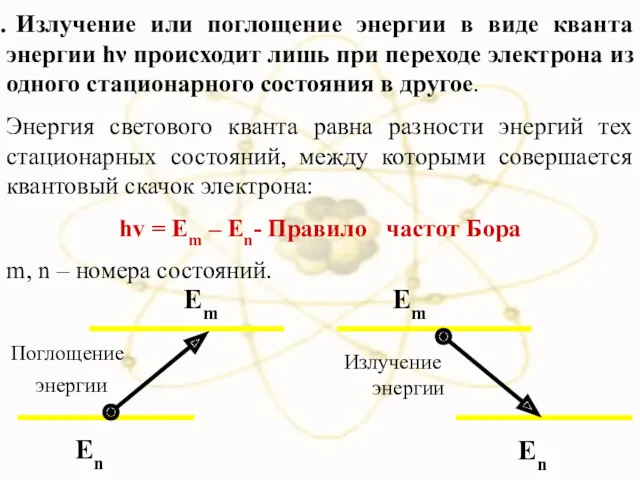
- 32. Излучение или поглощение энергии в виде кванта энергии hν происходит лишь при переходе электрона из одного
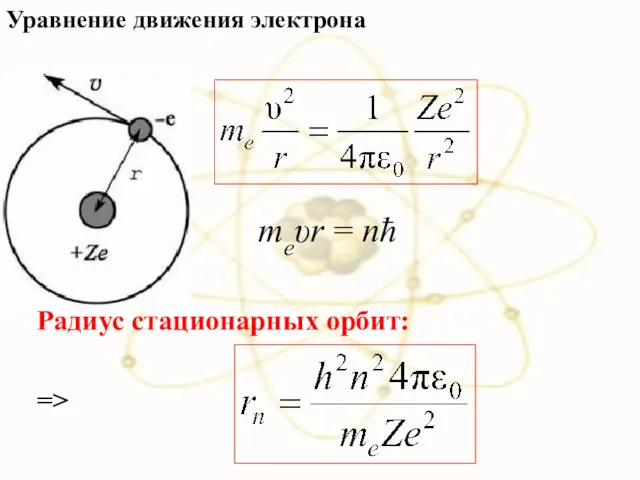
- 33. Уравнение движения электрона => Радиус стационарных орбит: meυr = nħ
- 34. Радиус первой орбиты водородного атома называют Боровским радиусом: При n =1, Z = 1 для водорода
- 35. Внутренняя энергия атома слагается из кинетической энергии электрона и потенциальной энергией взаимодействия электрона с ядром: Энергия
- 36. Видимая область Инфракрасная обл. Ультрафиолетовая обл.
- 37. При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией
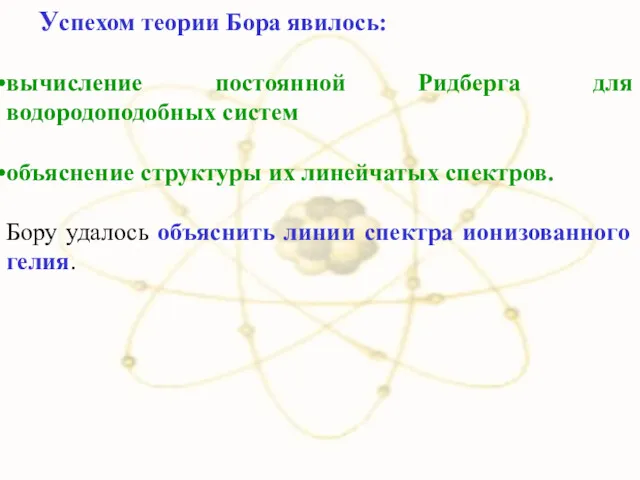
- 38. Успехом теории Бора явилось: вычисление постоянной Ридберга для водородоподобных систем объяснение структуры их линейчатых спектров. Бору
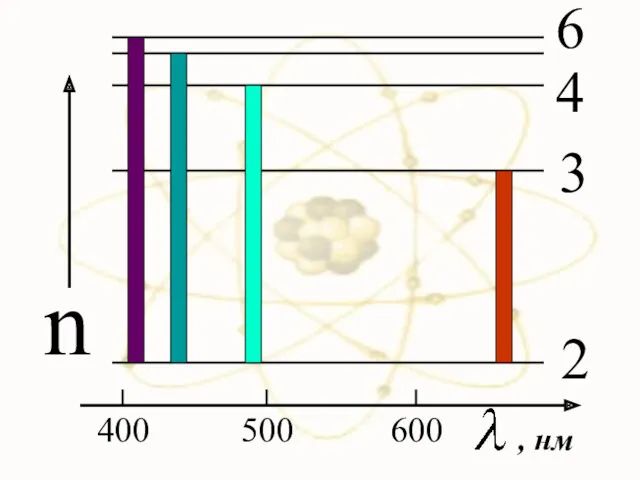
- 39. 400 500 600 n 2 3 4 6 , нм
- 41. Бор теоретически вычислил отношение массы протона к массе электрона mp/me = 1847, это находится в соответствии
- 42. Однако наряду с успехами в теории Бора с самого начала обнаружились существенные недостатки. Внутренняя противоречивость теории:
- 43. Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной
- 44. 4. Опыт Франка и Герца Существование дискретных энергетических уровней атома и доказательство правильности теории Бора подтверждается
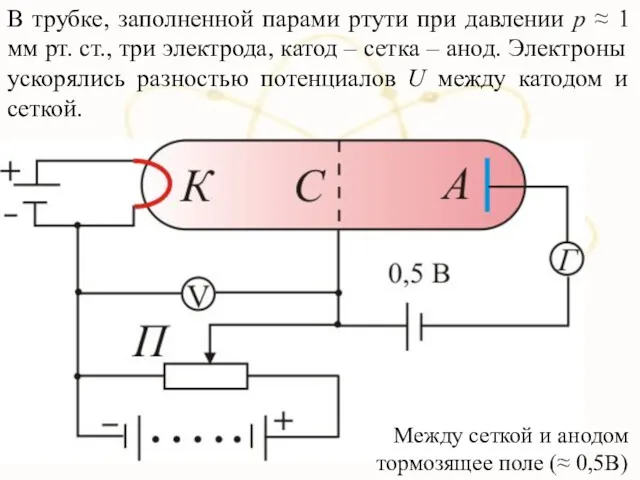
- 45. В трубке, заполненной парами ртути при давлении р ≈ 1 мм рт. ст., три электрода, катод
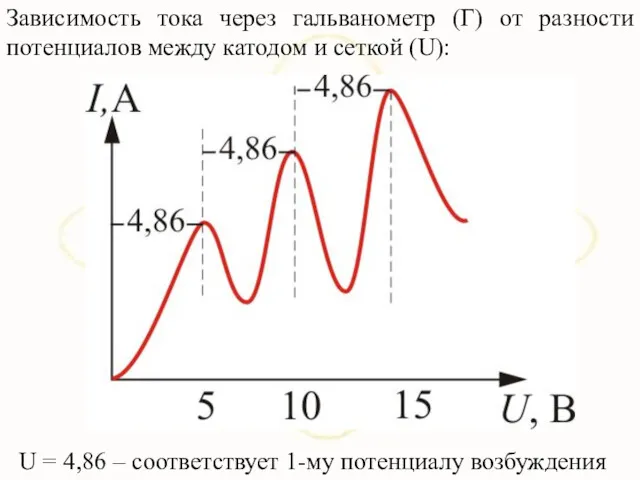
- 46. Зависимость тока через гальванометр (Г) от разности потенциалов между катодом и сеткой (U): U = 4,86
- 47. Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию бомбардирующих
- 48. При U При U=4,86В энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает
- 49. Атомы ртути, получившие при соударении с электронами энергию ΔЕ1 и перешедшие в возбужденное состояние, спустя время
- 51. Скачать презентацию






















 Закат как физическое явление
Закат как физическое явление Экспериментальные методы исследования частиц
Экспериментальные методы исследования частиц Техническое обслуживание и ремонт автотранспорта МДК 01.01 Устройство автомобилей
Техническое обслуживание и ремонт автотранспорта МДК 01.01 Устройство автомобилей Постоянные магниты (8 класс)
Постоянные магниты (8 класс) Устройство механической коробки передач
Устройство механической коробки передач Формирование ключевых компетенций при решении творческих задач на уроках физики
Формирование ключевых компетенций при решении творческих задач на уроках физики Электростатическое поле в вакууме
Электростатическое поле в вакууме Электричество и его использование
Электричество и его использование Введение в тепловое моделирование
Введение в тепловое моделирование Растяжение и сжатие
Растяжение и сжатие презентация Проще простого тепловые явления или Физика за чашкой чая
презентация Проще простого тепловые явления или Физика за чашкой чая презентация Интеграция как один из способов повышения качества обучения на уроках физики
презентация Интеграция как один из способов повышения качества обучения на уроках физики Явление электромагнитной индукции
Явление электромагнитной индукции открытый урок тепловые машины
открытый урок тепловые машины Основные законы электротехники
Основные законы электротехники Гравітаційне поле. Сила тяжіння. Перша космічна швидкість. Урок 21. Фізика. 10 клас
Гравітаційне поле. Сила тяжіння. Перша космічна швидкість. Урок 21. Фізика. 10 клас Атом ядросының модельдерінің түрлерІ
Атом ядросының модельдерінің түрлерІ Попов Александр Степанович
Попов Александр Степанович Терминалы
Терминалы Архимедова сила. Архимед (287-212 до н.э.)
Архимедова сила. Архимед (287-212 до н.э.) Молекулярная физика. Лекция 9
Молекулярная физика. Лекция 9 Анализ, диагностика, техническое обслуживание и ремонт комплексной системы управления двигателем (КСАУ-Д) Lada Priora
Анализ, диагностика, техническое обслуживание и ремонт комплексной системы управления двигателем (КСАУ-Д) Lada Priora презентация решение задач по теме Простые механизмы
презентация решение задач по теме Простые механизмы Ознакомление с автомобилем 580 и его системами
Ознакомление с автомобилем 580 и его системами Колесные пары тепловозов
Колесные пары тепловозов What’s the Connection? Forces and Motion
What’s the Connection? Forces and Motion Introduction to Quantum Mechanic
Introduction to Quantum Mechanic Electromagnetic Waves Scale. Uses of Electromagnetic Waves
Electromagnetic Waves Scale. Uses of Electromagnetic Waves