Содержание
- 2. Молекулярная физика Молекулярно-кинетическая теория. Масса атомов и молекул определяется в атомных единицах массы (а.е.м.) (1/12 массы
- 3. Молекулярная физика , Где - кинетическая энергия поступательного движения молекулы массой m0, Дж/К - постоянная Больцмана,
- 4. Молекулярная физика Давление. При столкновении со стенками сосуда молекулы газа оказывают на них давление, передавая им
- 5. Молекулярная физика Рассмотрим движение молекулы идеального газа вдоль оси у в объеме V (Рис) При каждом
- 6. Молекулярная физика Полная сила, действующая на стенку со стороны всех N молекул, находящихся в сосуде, равна
- 7. Молекулярная физика температуры, получим основное уравнение МКТ в форме Больцмана .Если преобразовать уравнение то получим уравнение
- 8. Молекулярная физика состояний . Вычитая из первого выражения второе, получим: Задача 55. Баллон, вместимостью 20 л,
- 9. Молекулярная физика Решение. Из уравнения Клапейрона – Менделеева давление равно . Средняя квадратичная скорость определяется выражением
- 10. Молекулярная физика откуда Задача 58. Баллон, вместимостью 20 л содержит смесь водорода и азота при температуре
- 11. Молекулярная физика находим . Задача 60. Найдите среднюю кинетическую энергию поступательного движения молекулы идеального газа, если
- 13. Скачать презентацию










 Задачи на машины постоянного тока. Лекция 1
Задачи на машины постоянного тока. Лекция 1 Игра по физике Тайна черных ящиков для учащихся 10-11 классов
Игра по физике Тайна черных ящиков для учащихся 10-11 классов История развития физики. Физика и техника
История развития физики. Физика и техника Познавательная викторина
Познавательная викторина Будова атома. Склад атомних ядер. Протонне та нуклонне число
Будова атома. Склад атомних ядер. Протонне та нуклонне число Урок Оптические приборы, физика11 класс
Урок Оптические приборы, физика11 класс БЛОКИ. «ЗОЛОТОЕ ПРАВИЛО МЕХАНИКИ»
БЛОКИ. «ЗОЛОТОЕ ПРАВИЛО МЕХАНИКИ» Общественному смотр знаний в 9классе по разделу Механика.
Общественному смотр знаний в 9классе по разделу Механика. Разработка внеклассного мероприятия Физический КВН (8 класс)
Разработка внеклассного мероприятия Физический КВН (8 класс) Адсорбция изотермалары
Адсорбция изотермалары ФОРМИРОВАНИЕ ИНФОРМАЦИОННОЙ КОМПЕТЕНЦИИ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ТЕМЫ ЭЛЕМЕНТЫ КВАНТОВОЙ ФИЗИКИ9 КЛАСС
ФОРМИРОВАНИЕ ИНФОРМАЦИОННОЙ КОМПЕТЕНЦИИ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ТЕМЫ ЭЛЕМЕНТЫ КВАНТОВОЙ ФИЗИКИ9 КЛАСС Радиоактивность, модели атомов
Радиоактивность, модели атомов Синусоидалы емес периодты сигналдарды Фурье қатарына жіктеу. Синусоидалы емес периодты сигналдардың әрекеттік орташа мәндері
Синусоидалы емес периодты сигналдарды Фурье қатарына жіктеу. Синусоидалы емес периодты сигналдардың әрекеттік орташа мәндері Система живлення двигуна УТД-20С1 повітрям
Система живлення двигуна УТД-20С1 повітрям Как и почему летают самолеты и планера
Как и почему летают самолеты и планера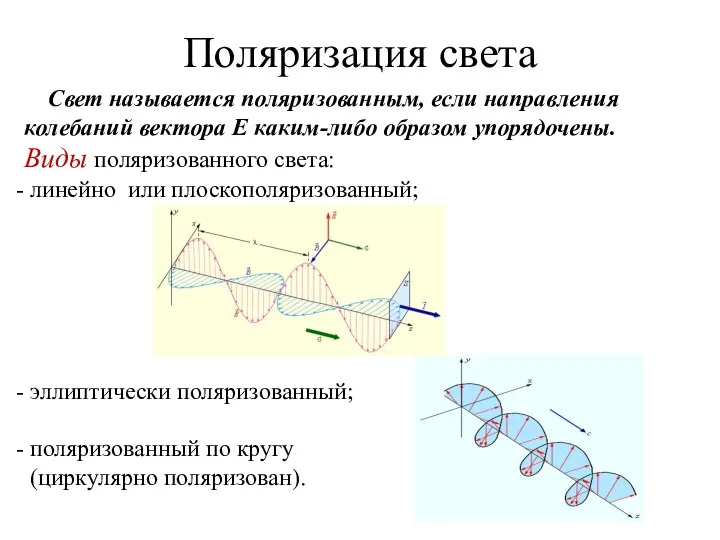 Поляризация света
Поляризация света Ядерная физика. (Урок-обобщение). 9 класс
Ядерная физика. (Урок-обобщение). 9 класс Электрические цепи
Электрические цепи Принцип действия тепловых двигателей
Принцип действия тепловых двигателей Физика и техника
Физика и техника Качественные задачи по физике
Качественные задачи по физике Повышение качества образования по предмету физика через систему использования интегрированных уроков в условиях модернизации образовательной системы РФ
Повышение качества образования по предмету физика через систему использования интегрированных уроков в условиях модернизации образовательной системы РФ Рентгеновские аппараты. Цифровые рентгенодиагностические комплексы. (Лекция 10)
Рентгеновские аппараты. Цифровые рентгенодиагностические комплексы. (Лекция 10) Первый закон термодинамики
Первый закон термодинамики Сила упругости
Сила упругости Основы триботехники. Лекция 1
Основы триботехники. Лекция 1 Лекция 8.2. Диэлектрические материалы. Классификация
Лекция 8.2. Диэлектрические материалы. Классификация Анализ технико-экономической эффективности КПГУ на базе паротурбинной установки ПТ-135/165-130/15
Анализ технико-экономической эффективности КПГУ на базе паротурбинной установки ПТ-135/165-130/15