Содержание
- 2. Цілі: Навчальна: ознайомити учнів з будовою атомних ядер, дати поняття «протон», «нейтрон», «протоне та нуклоне число»,
- 3. Інтелектуальна розминка 1. Що називається періодом? Що мають спільного й чим відрізняються великі періоди від малих?
- 4. Ідея дискретної будови речовини належить давньогрецькому філософу Демокріту, який жив близько 470 року до н.е. Демокріт
- 5. А відомий філософ Арістотель дотримувався іншої точки зору. У ІV ст. до н.е. він підтримав ідею,
- 6. У науці термін «атом» вперше після грецьких філософів використав англійський хімік Джон Дальтон. У 1807 році
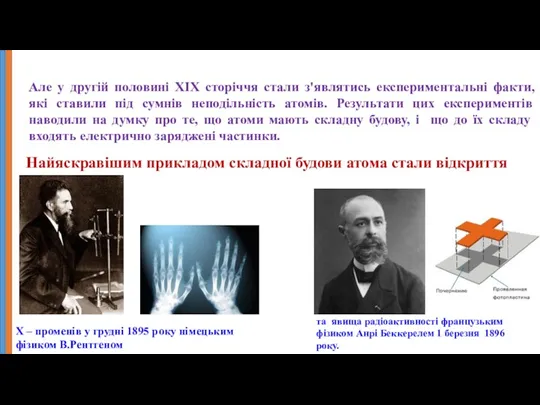
- 7. Але у другій половині ХІХ сторіччя стали з'являтись експериментальні факти, які ставили під сумнів неподільність атомів.
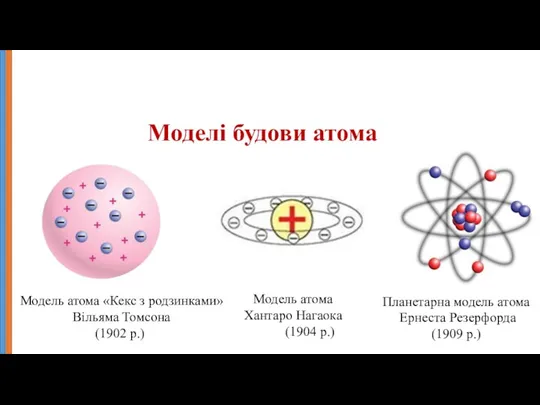
- 8. Планетарна модель атома Ернеста Резерфорда (1909 р.) Модель атома «Кекс з родзинками» Вільяма Томсона (1902 р.)
- 9. Атом- найменша хімічно неподільна частинка, яка складається з ядра і електронів, розташованих навколо нього. До складу
- 10. Заряд ядра (кількість протонів) атома дорівнює порядковому номеру елемента в періодичній системі. А через те, що
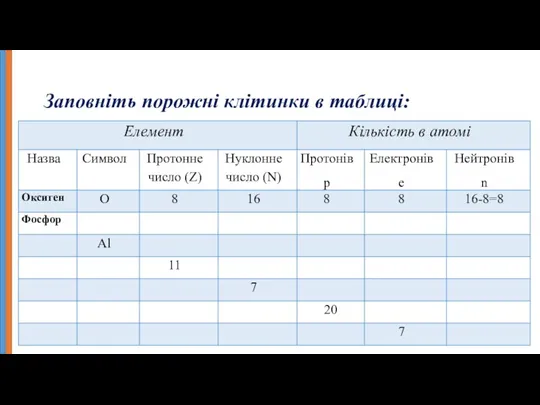
- 12. Заповніть порожні клітинки в таблиці:
- 14. Скачать презентацию







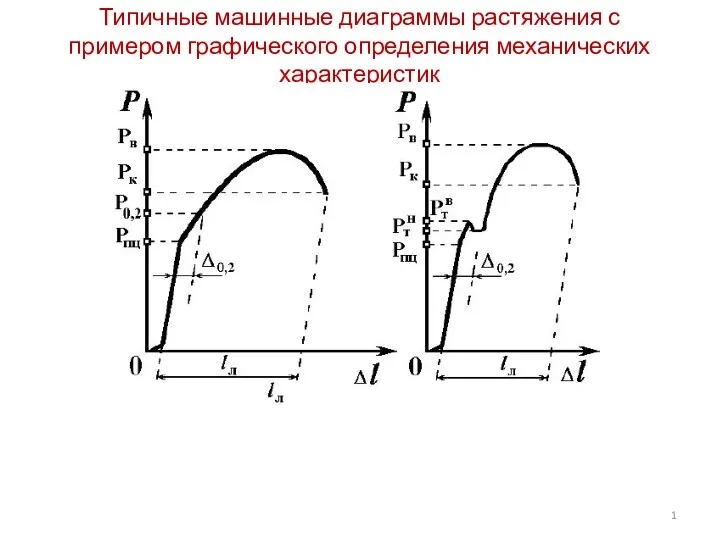 Типичные машинные диаграммы растяжения с примером графического определения механических характеристик
Типичные машинные диаграммы растяжения с примером графического определения механических характеристик Электричество. Работа электрического тока
Электричество. Работа электрического тока Кинематика. 10 класс
Кинематика. 10 класс Лекция № 5,6 РБ. Цепная реакция деления тяжелых ядер
Лекция № 5,6 РБ. Цепная реакция деления тяжелых ядер Молекулярно-кинетическая теория идеальных газов
Молекулярно-кинетическая теория идеальных газов Учебный курс Термодинамика и теплопередача. Практическое занятие 2
Учебный курс Термодинамика и теплопередача. Практическое занятие 2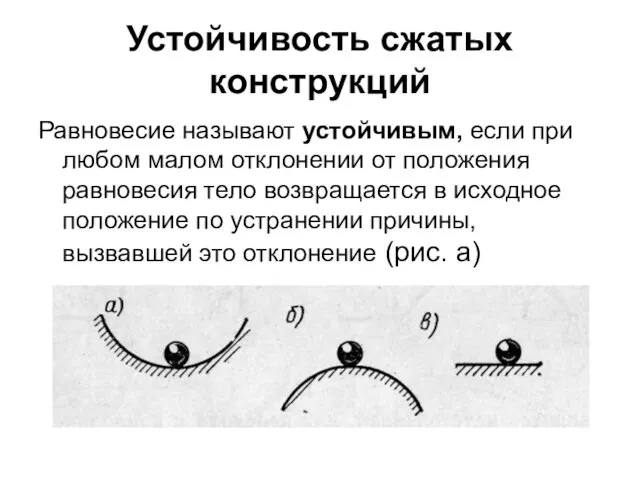 Устойчивость сжатых конструкций
Устойчивость сжатых конструкций Экспериментальные методы исследования частиц
Экспериментальные методы исследования частиц Анализ вариантов составляющих конструкции из КМ силового элемента втулки РВ вертолета
Анализ вариантов составляющих конструкции из КМ силового элемента втулки РВ вертолета Методы эффективного управления инверторами напряжения в приводах переменного тока
Методы эффективного управления инверторами напряжения в приводах переменного тока Forces and Motion If I were…
Forces and Motion If I were… Фізика в житті сучасної людини
Фізика в житті сучасної людини Центр тяжести. Равновесие тел
Центр тяжести. Равновесие тел Определение стоимости и расхода электроэнергии
Определение стоимости и расхода электроэнергии Методы регистрации заряженных частиц
Методы регистрации заряженных частиц Солнечная батарея
Солнечная батарея Источники электрического тока. Физика. 8 класс
Источники электрического тока. Физика. 8 класс Неоднородное одномерное уравнение теплопроводности
Неоднородное одномерное уравнение теплопроводности Заттың құрылысы
Заттың құрылысы Лампа накаливания
Лампа накаливания Жидкое и твердое состояния вещества
Жидкое и твердое состояния вещества Законы постоянного тока
Законы постоянного тока Технологии выращивания кристаллов. Технология полупроводниковых материалов
Технологии выращивания кристаллов. Технология полупроводниковых материалов Организация работ по ТО и ТР автомобилей Lada Granta с детальной разработкой участка покраски
Организация работ по ТО и ТР автомобилей Lada Granta с детальной разработкой участка покраски Деление атомных ядер. (Тема 2.7)
Деление атомных ядер. (Тема 2.7) Архимед и его мудрое открытие (287 - 212 до н.э.)
Архимед и его мудрое открытие (287 - 212 до н.э.) Влияние билингвизма на способности по физике
Влияние билингвизма на способности по физике Каталитические нейтрализаторы отработавших газов бензиновых двигателей внутреннего сгорания
Каталитические нейтрализаторы отработавших газов бензиновых двигателей внутреннего сгорания