Содержание
- 2. Термодинамічними називаються системи, що містять значну кількість складових елементів (теоретично N ≅ 1010...1020 елементів) і підкоряються
- 3. Температура характеризує ступінь нагрітості системи і визначається через поняття теплової рівноваги системи чи систем. В міжнародній
- 4. Внутрішньою енергією (Е) називається енергія тіл, що складають систему. Внутрішня енергія системи - це енергія механічного
- 5. Кількість теплоти (Q) є міра зміни внутрішньої енергії в теплових процесах, що не супроводжуються виконання механічної
- 6. Якщо параметри термодинамічної системи фіксовані, то йдеться про стан системи. Стан називається рівноважним, якщо кожен з
- 7. Ідеальний газ - це газ, що складається з матеріальних точок, які рухаються абсолютно хаотично і сили
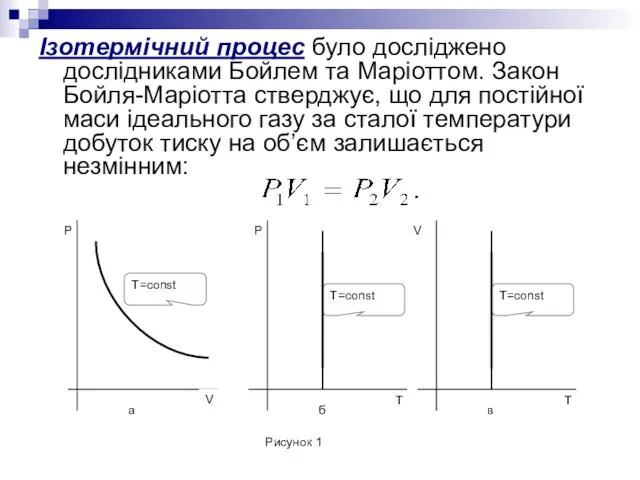
- 8. Ізотермічний процес було досліджено дослідниками Бойлем та Маріоттом. Закон Бойля-Маріотта стверджує, що для постійної маси ідеального
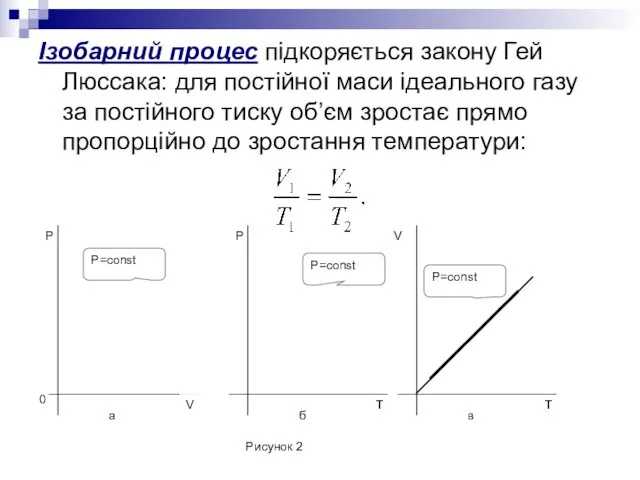
- 9. Ізобарний процес підкоряється закону Гей Люссака: для постійної маси ідеального газу за постійного тиску об’єм зростає
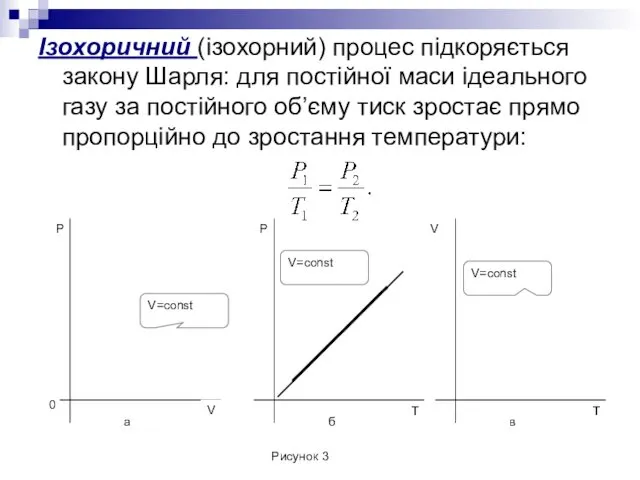
- 10. Ізохоричний (ізохорний) процес підкоряється закону Шарля: для постійної маси ідеального газу за постійного об’єму тиск зростає
- 11. Об’єднаний газовий закон, стверджує: для постійної маси ідеального газу добуток тиску на об’єм віднесений до абсолютної
- 12. Рівняння стану довільної маси ідеального газу зв’язує параметри його стану: де Р - тиск; V -
- 13. Молекулярно-кінетична теорія В основі її лежать слідуючи положення: 1) всі речовини складаються з атомів та молекул;
- 14. Основним рівнянням молекулярно-кінетичної теорії називається рівняння, що зв’язує між собою характеристики руху молекул з макропараметри стану
- 15. Динамічні характеристики окремих молекул позбавлені фізичного змісту – з ними не можливо проводити розрахунки, фізичний зміст
- 16. Термодинаміка – розділ фізики, який вивчає загальні властивості макроскопічних систем, що перебувають у стані термодинамічної рівноваги.
- 17. Внутрішня енергія макроскопічного тіла дорівнює сумі кінетичних енергій безладного руху всіх молекул і потенціальних енергій взаємодії
- 18. Внутрішня енергія ідеального газу обумовлюється лише кінетичною енергією руху молекул, потенціальною енергією їх взаємодії можна знехтувати.
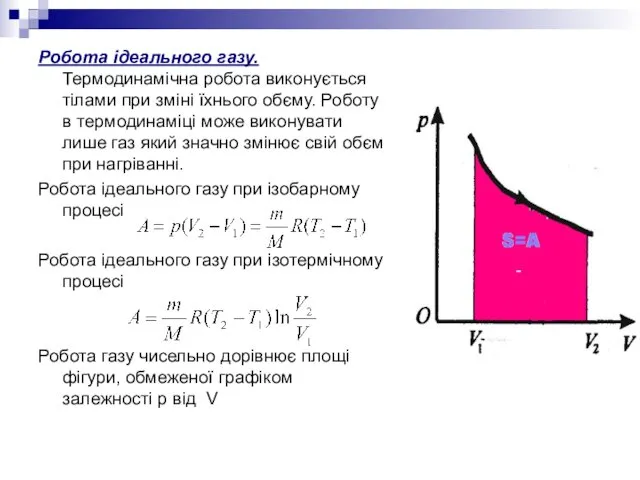
- 19. Робота ідеального газу. Термодинамічна робота виконується тілами при зміні їхнього обєму. Роботу в термодинаміці може виконувати
- 20. Теплопередачею називається процес передавання енергії від одного тіла до іншого без виконання роботи. Існує три способи
- 21. Питома теплоємність речовини (с) – це величина, яка чисельно дорівнює кількості теплоти, що отримує або віддає
- 22. Перший закон термодинаміки: Кількість теплоти Q передана системі, витрачається на зміну її внутрішньої енергії ∆U і
- 23. Застосування першого закону термодинаміки до різних ізопроцесів у газах
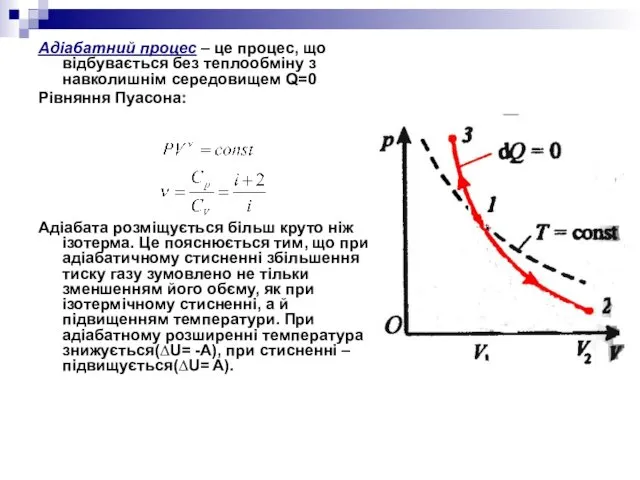
- 24. Адіабатний процес – це процес, що відбувається без теплообміну з навколишнім середовищем Q=0 Рівняння Пуасона: Адіабата
- 25. Другий закон термодинаміки - Неможливо здійснити такий періодичний процес, єдиним наслідком якого було б повне перетворення
- 26. Тепловий двигун – машина, що перетворює внутрішню енергію палива на механічну енергію Три основних частини двигуна:
- 27. Прямий цикл Карно складається з двох ізотерм: 1→2 за температури Т1 і 3→4 за температури Т2
- 29. Скачать презентацию





















 Электрический ток в различных средах
Электрический ток в различных средах Топливные насосы двигателя
Топливные насосы двигателя Физико-химические методы анализа
Физико-химические методы анализа Барометр – анероид. Атмосферное давление на различных высотах. Манометры
Барометр – анероид. Атмосферное давление на различных высотах. Манометры Элементы физической кинетики
Элементы физической кинетики Звуковые волны
Звуковые волны Техническое обслуживание диагностирование и ремонт газораспределительного механизма автомобиля
Техническое обслуживание диагностирование и ремонт газораспределительного механизма автомобиля Презентация к уроку Получение и передача переменного электрического тока. Трансформатор
Презентация к уроку Получение и передача переменного электрического тока. Трансформатор Воздухоплавание
Воздухоплавание Радиоприёмные устройства. Часть 1. Основные параметры и классификация
Радиоприёмные устройства. Часть 1. Основные параметры и классификация Скоростемер 3СЛ-2м. Функции скоростемера 3СЛ-2м
Скоростемер 3СЛ-2м. Функции скоростемера 3СЛ-2м Рулевое управление тракторов
Рулевое управление тракторов Фазированные антенные решетки и их назначение. Типы диаграммоформирования
Фазированные антенные решетки и их назначение. Типы диаграммоформирования Лекция 8. Аналитическая механика. Теорема Эмми Нётер
Лекция 8. Аналитическая механика. Теорема Эмми Нётер Динамика механической системы
Динамика механической системы Кинематика материальной точки и твердого тела
Кинематика материальной точки и твердого тела Припої. Загальні властивості
Припої. Загальні властивості Авиационные генераторы. Стартер-генератор ГСР-СТ-12/40 А. (Тема 3.3)
Авиационные генераторы. Стартер-генератор ГСР-СТ-12/40 А. (Тема 3.3) Електричне поле
Електричне поле Явления переноса в газах
Явления переноса в газах Механическая работа и мощность. Подготовка к ЕГЭ
Механическая работа и мощность. Подготовка к ЕГЭ Сила трения
Сила трения Молекулярная физика. Термодинамические системы (лекция 1)
Молекулярная физика. Термодинамические системы (лекция 1) Викторина по физике для 8 класса по теме Оптика
Викторина по физике для 8 класса по теме Оптика Презентация к уроку физики в 10 классе Закон всемирного тяготения
Презентация к уроку физики в 10 классе Закон всемирного тяготения Конструкция тележек грузовых вагонов
Конструкция тележек грузовых вагонов Электростатическое поле. Закон Кулона. Напряженность электростатического поля
Электростатическое поле. Закон Кулона. Напряженность электростатического поля Электронная презентация Атмосферное давление
Электронная презентация Атмосферное давление