Содержание
- 2. Молекулярно-кинетическая теория МКТ объясняет свойства макроскопических тел и тепловых процессов, на основе представлений о том, что
- 3. Основные положения мкт Все вещества состоят из мельчайших частиц (молекул и атомов), которые разделены промежутками. Все
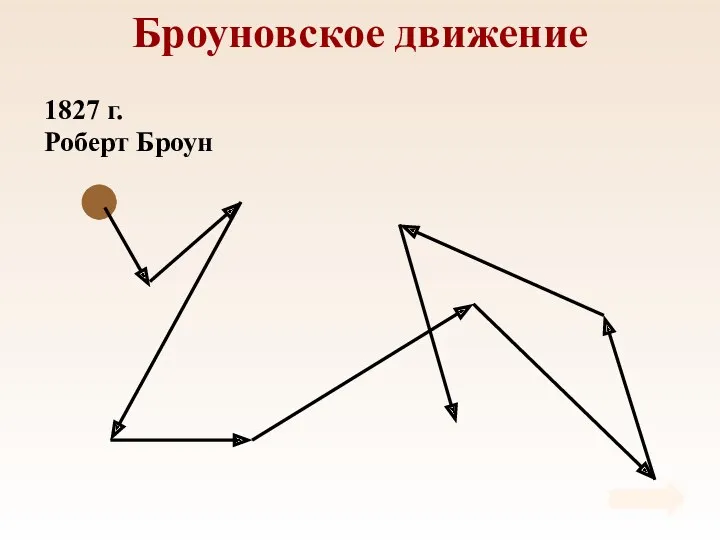
- 4. Броуновское движение 1827 г. Роберт Броун
- 5. Броуновское движение Причина броуновского движения состоит в том, что удары молекул жидкости о частицу не компенсируют
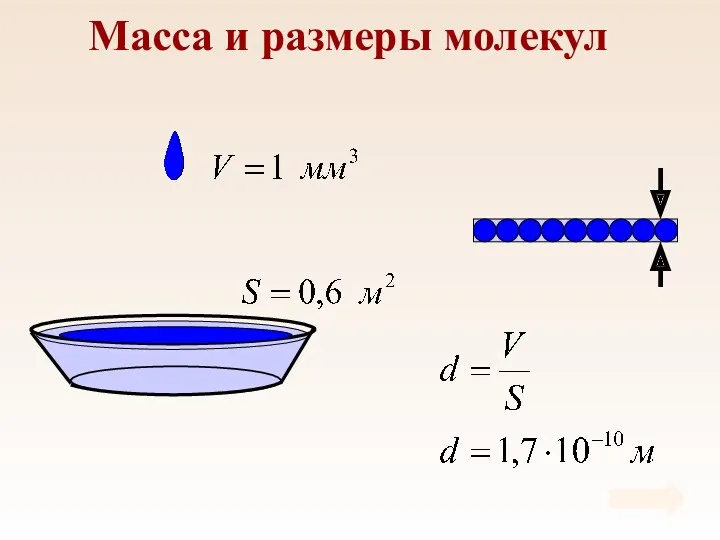
- 6. Масса и размеры молекул
- 7. Масса и размеры молекул Массы молекул в макроскопических масштабах чрезвычайно малы.
- 8. кофе этанол Масса и размеры молекул
- 9. Масса и размеры молекул Относительной молекулярной (или атомной) массой вещества (Мr) называют отношение массы молекулы (или
- 10. Количество вещества Количество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но
- 11. Количество вещества В 1 моле любого вещества содержится одно и то же число атомов или молекул.
- 12. Количество вещества Молярной массой вещества называют массу вещества, взятого в количестве 1 моль. m0 - масса
- 13. Количество вещества m – масса вещества
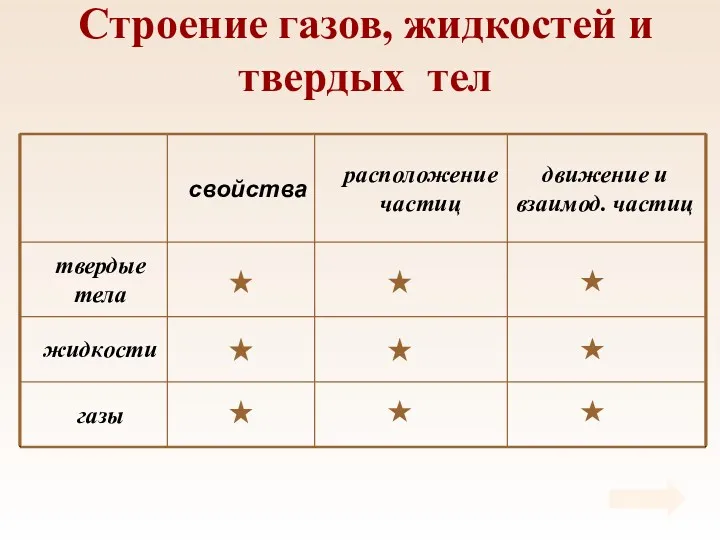
- 14. Таблица Свойства газов, жидкостей и твердых тел
- 15. Строение газов, жидкостей и твердых тел
- 16. Свойства Твердые тела сохраняют объем и форму.
- 17. Свойства Жидкости сохраняют объем и принимают форму сосуда. Обладают текучестью.
- 18. Свойства Газы не имеют формы, занимают весь предоставленный объем.
- 19. Расположение частиц Частицы расположены в строгом порядке вплотную друг к другу. Кристаллическая решетка.
- 20. Расположение частиц Частицы расположены вплотную друг к другу, образуют только ближний порядок.
- 21. Расположение частиц Частицы расположены на значительных расстояниях (расстояния между частицами во много раз больше размеров самих
- 22. Движение и взаимодействие частиц Частицы совершают колебательные движения около положения равновесия Силы притяжения и отталкивания значительны
- 23. Движение и взаимодействие частиц Частицы совершают колебательные движения около положения равновесия, изредка совершая скачки на новое
- 24. Движение и взаимодействие частиц Частицы свободно перемещаются по всему объему, двигаясь поступательно Силы притяжения почти отсутствуют,
- 25. Идеальный газ Идеальный газ – это газ, в котором Частицы – материальные точки Частицы взаимодействуют только
- 26. Среднее значение квадрата скорости молекул Скорость – величина векторная, поэтому средняя скорость движения частиц в газе
- 27. Среднее значение квадрата скорости молекул
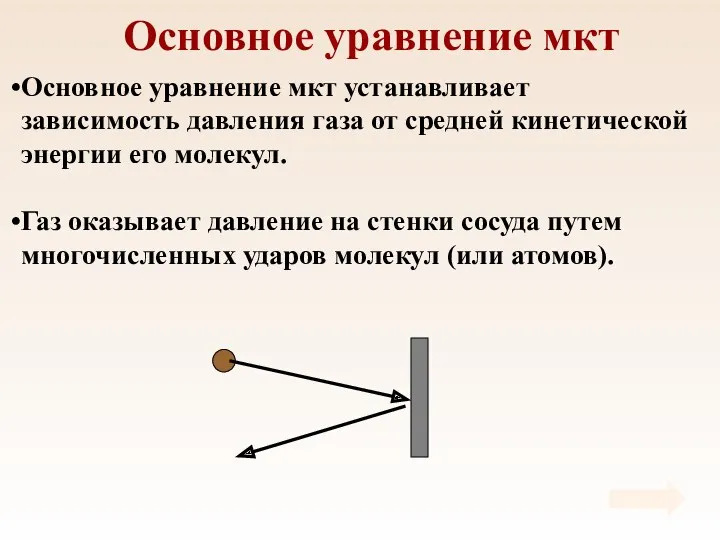
- 28. Основное уравнение мкт Основное уравнение мкт устанавливает зависимость давления газа от средней кинетической энергии его молекул.
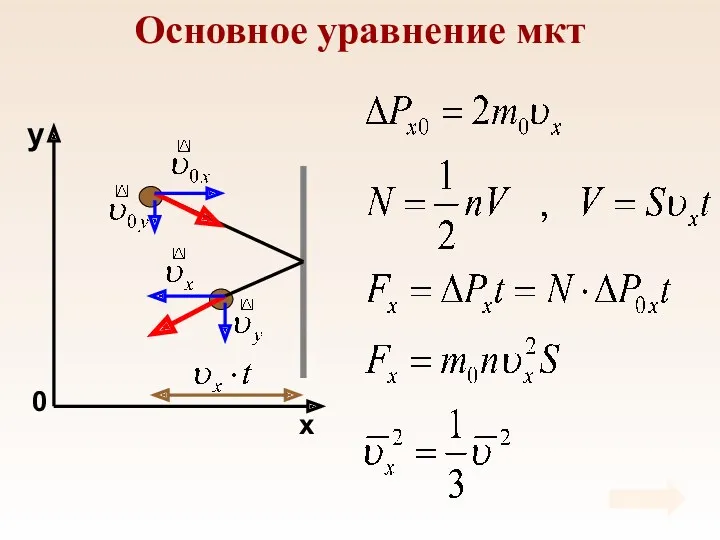
- 29. Основное уравнение мкт
- 30. Основное уравнение мкт
- 31. Температура и тепловое равновесие Макроскопические параметры (макропараметры) – величины, характеризующие состояние макроскопических тел без учета молекулярного
- 32. Температура и тепловое равновесие Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно
- 33. Температура и тепловое равновесие Термометр – прибор для измерения температуры тела. Термометр входит в состояние теплового
- 34. Температура и тепловое равновесие Основная деталь термометра – термометрическое тело, то есть тело, макропараметры которого изменяются
- 35. Температура и тепловое равновесие Изобретателем термометра является Галилео Галилей (ок. 1600 г.) Термометрическим телом в его
- 36. Температурные шкалы шкала Цельсия шкала Фаренгейта шкала Реомюра шкала Кельвина
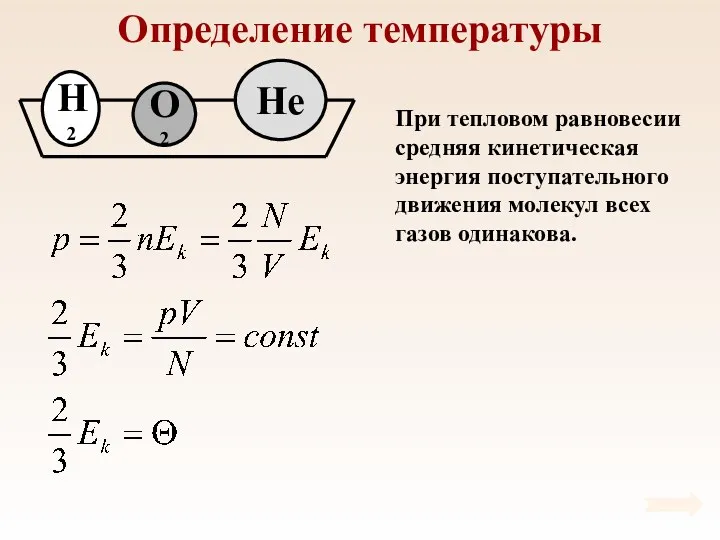
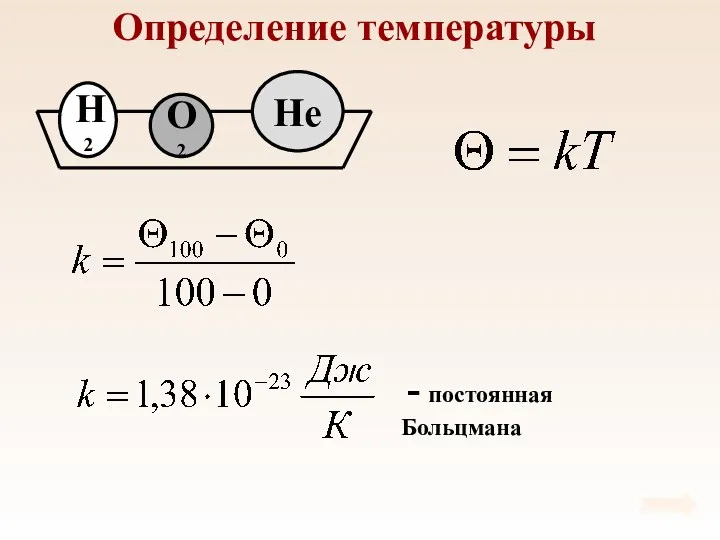
- 37. Определение температуры При тепловом равновесии средняя кинетическая энергия поступательного движения молекул всех газов одинакова.
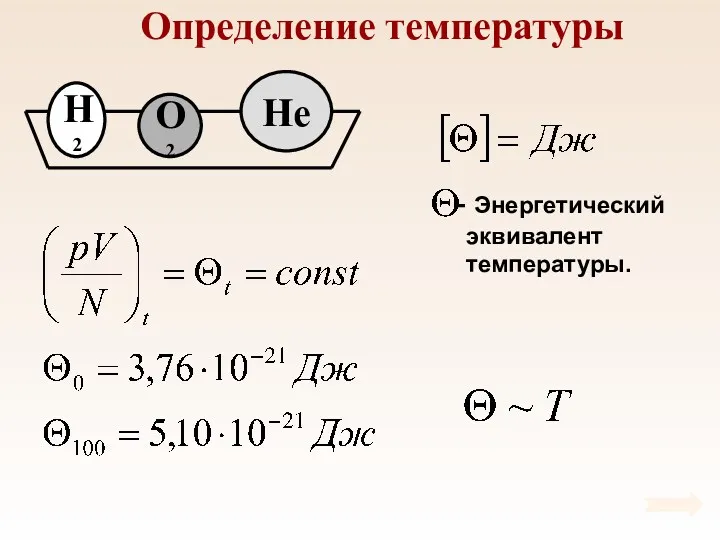
- 38. Определение температуры
- 39. Определение температуры
- 40. Температура – мера средней кинетической энергии молекул
- 41. Опыт показывает, что давление газа зависит от температуры и для любых веществ справедливо соотношение где k
- 42. Средняя кинетическая энергия прямо пропорциональна абсолютной температуре. ТЕМПЕРАТУРА - мера средней кинетической энергии молекул. Связь давления
- 43. Шкала Фаренгейта. 00С=320F, 1000С=2120F → t0C=5/9(t0F-32). Температурные шкалы: Шкала Цельсия. 00С – таяние льда, 1000С –
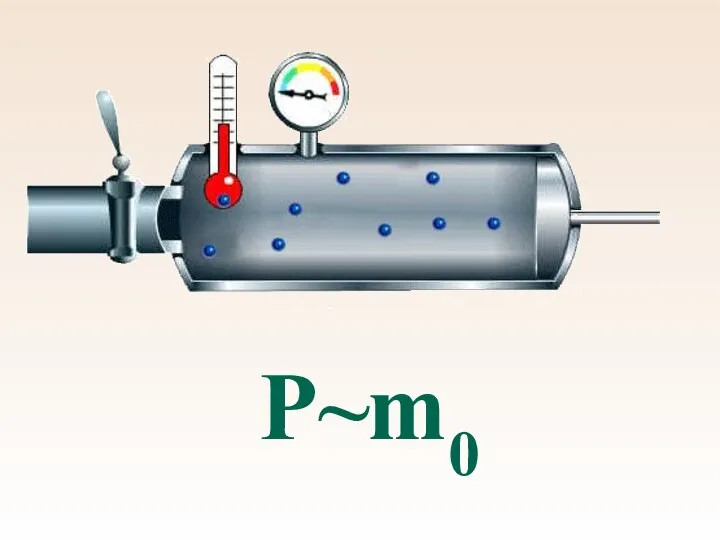
- 44. Р~m0
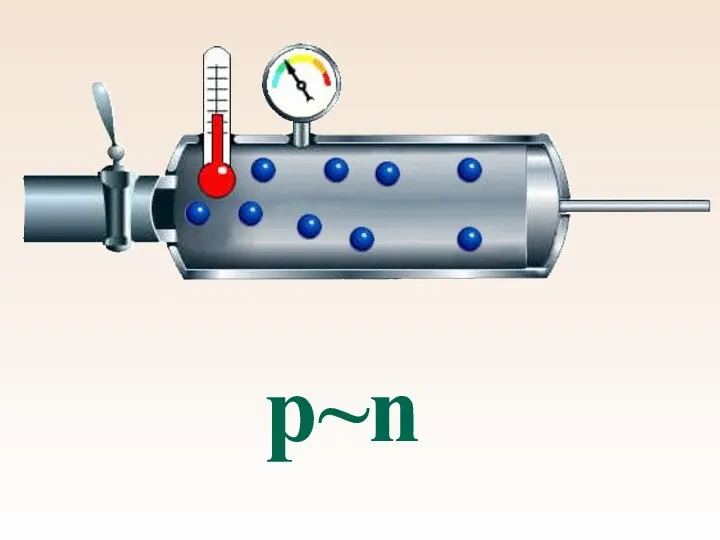
- 45. р~n
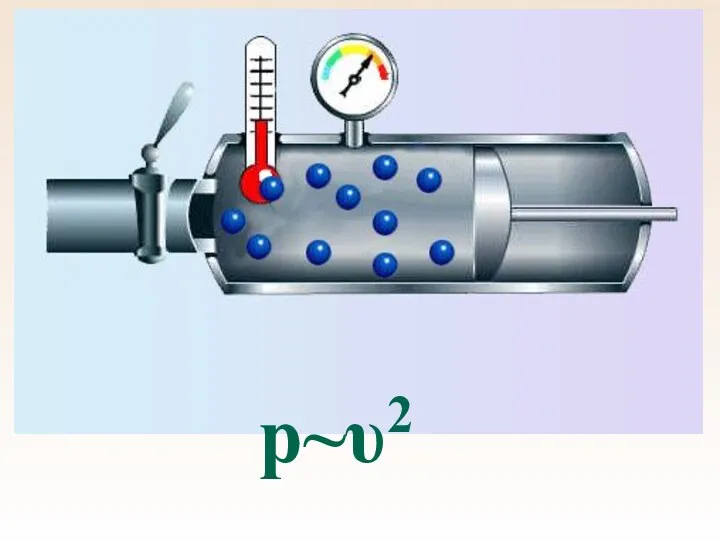
- 46. р~υ2
- 47. Скорости молекул
- 49. Скачать презентацию


































 Устройство ходовой части автомобиля ВАЗ 2109
Устройство ходовой части автомобиля ВАЗ 2109 Синтез ких фильтров методом окон
Синтез ких фильтров методом окон Линзы. Построение изображений в линзах
Линзы. Построение изображений в линзах Physics of Semiconductor Devices
Physics of Semiconductor Devices Элементы специальной теории относительности. Релятивистская кинематика
Элементы специальной теории относительности. Релятивистская кинематика Подшипники скольжения
Подшипники скольжения Середня швидкість. Нерівномірний рух
Середня швидкість. Нерівномірний рух Сравнение теплоёмкости воды и масла, воды и камня
Сравнение теплоёмкости воды и масла, воды и камня Результаты ЕГЭ по физике в Самарской области 2022 г
Результаты ЕГЭ по физике в Самарской области 2022 г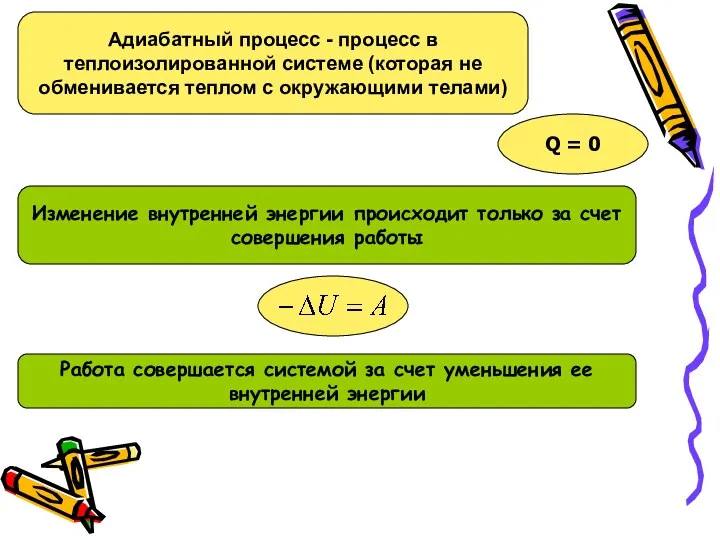 Адиабатный процесс
Адиабатный процесс Строение атомов. Объяснение электрических явлений. 8 класс
Строение атомов. Объяснение электрических явлений. 8 класс Ультрафиолетовые лучи
Ультрафиолетовые лучи Инерциальные системы отсчета. Первый и второй закон Ньютона
Инерциальные системы отсчета. Первый и второй закон Ньютона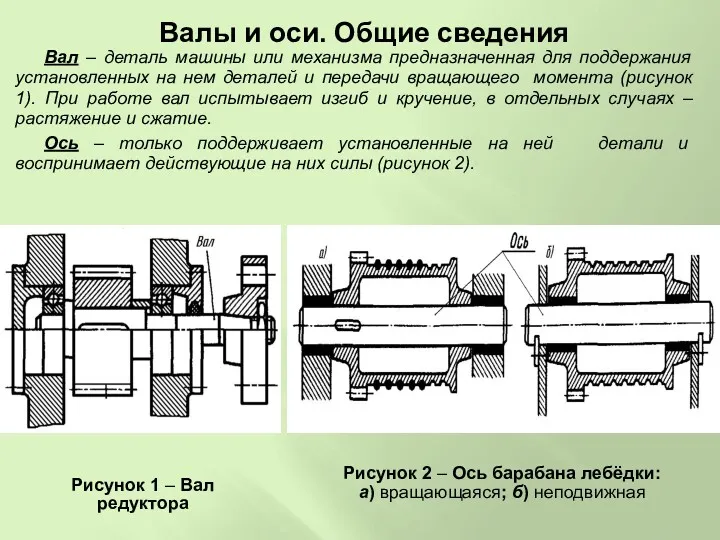 Валы и оси машины или механизма
Валы и оси машины или механизма Смазочные масла. Тема 1.5
Смазочные масла. Тема 1.5 Проезентация по теме Дисперсия света
Проезентация по теме Дисперсия света Электрические цепи синусоидального тока с магнитно (индуктивно) связанными элементами. Лекция 7
Электрические цепи синусоидального тока с магнитно (индуктивно) связанными элементами. Лекция 7 Презентация к уроку в 10 классе по теме Сила упругости и сила трения
Презентация к уроку в 10 классе по теме Сила упругости и сила трения Количество теплоты. Единицы количества теплоты. Удельная теплоемкость. 8 класс
Количество теплоты. Единицы количества теплоты. Удельная теплоемкость. 8 класс Устройство двигателей
Устройство двигателей Айнымалы ток
Айнымалы ток Тепловое излучение. Природа и свойства теплового излучения
Тепловое излучение. Природа и свойства теплового излучения Качество САУ. Точность работы САУ в установившихся режимах
Качество САУ. Точность работы САУ в установившихся режимах Презентация Ядерный реактор
Презентация Ядерный реактор Урок Механическая работа 7 класс
Урок Механическая работа 7 класс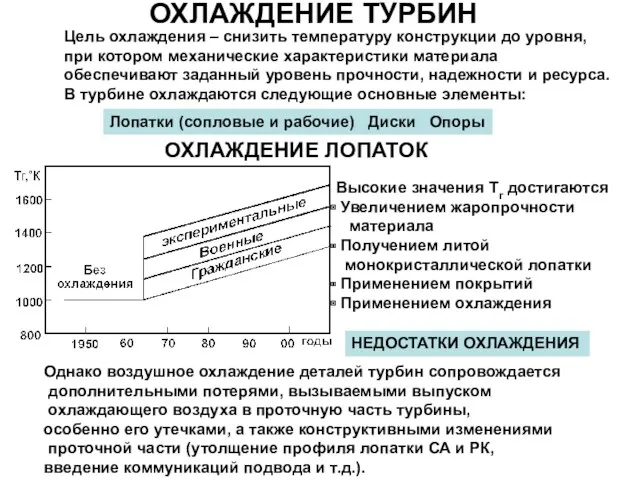 Охлаждение турбин
Охлаждение турбин Электроемкость. Конденсаторы
Электроемкость. Конденсаторы Техническая термодинамика
Техническая термодинамика