Содержание
- 2. Тема 5 Молекулярная физика
- 3. П 17. Основные положения молекулярно-кинетической (МКТ) теории. Масса и размеры молекул.
- 4. Молекулярно-кинетическая теория МКТ объясняет свойства макроскопических тел и тепловых процессов, на основе представлений о том, что
- 5. Основные положения мкт Вещество состоит из частиц Частицы непрерывно и хаотически движутся Частицы взаимодействуют друг с
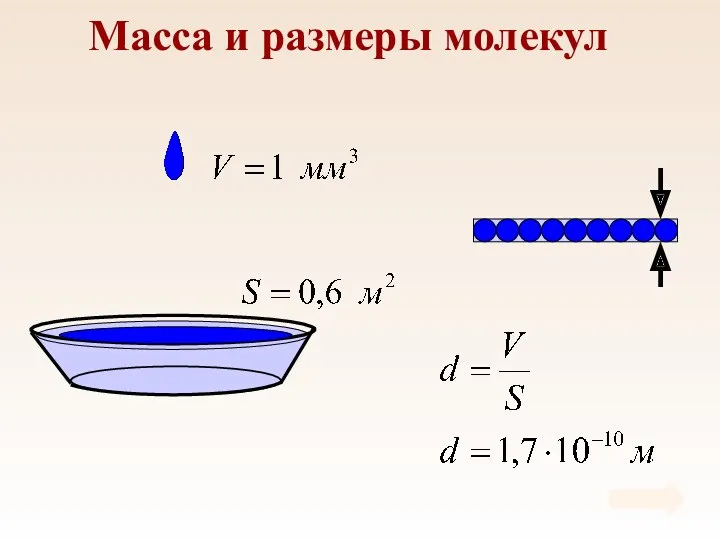
- 6. Масса и размеры молекул
- 7. Масса и размеры молекул Массы молекул в макроскопических масштабах чрезвычайно малы.
- 8. кофе этанол Масса и размеры молекул
- 9. Масса и размеры молекул Относительной молекулярной (или атомной) массой вещества (Мr) называют отношение массы молекулы (или
- 10. Количество вещества Количество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но
- 11. Количество вещества В 1 моле любого вещества содержится одно и то же число атомов или молекул.
- 12. Количество вещества Молярной массой вещества называют массу вещества, взятого в количестве 1 моль. m0 - масса
- 13. Количество вещества m – масса вещества
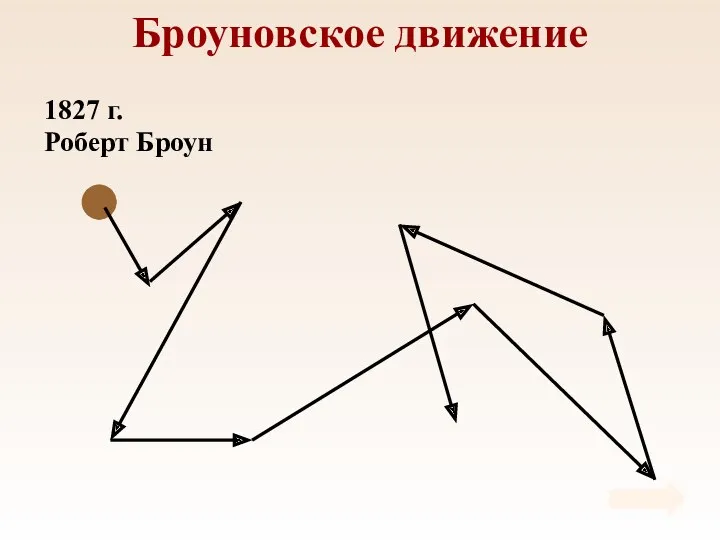
- 14. Броуновское движение 1827 г. Роберт Броун
- 15. Броуновское движение Причина броуновского движения состоит в том, что удары молекул жидкости о частицу не компенсируют
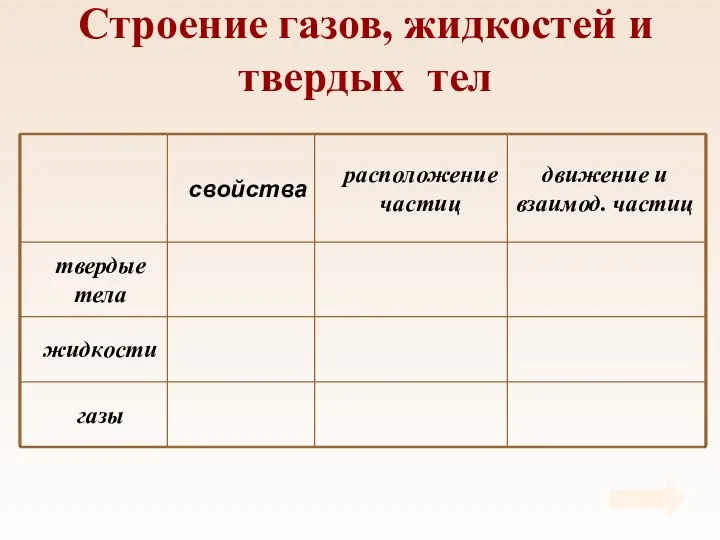
- 16. Таблица Свойства газов, жидкостей и твердых тел
- 17. Строение газов, жидкостей и твердых тел
- 18. Свойства Твердые тела сохраняют объем и форму.
- 19. Свойства Жидкости сохраняют объем и принимают форму сосуда. Обладают текучестью.
- 20. Свойства Газы не имеют формы, занимают весь предоставленный объем.
- 21. Расположение частиц Частицы расположены в строгом порядке вплотную друг к другу. Кристаллическая решетка.
- 22. Расположение частиц Частицы расположены вплотную друг к другу, образуют только ближний порядок.
- 23. Расположение частиц Частицы расположены на значительных расстояниях (расстояния между частицами во много раз больше размеров самих
- 24. Движение и взаимодействие частиц Частицы совершают колебательные движения около положения равновесия Силы притяжения и отталкивания значительны
- 25. Движение и взаимодействие частиц Частицы совершают колебательные движения около положения равновесия, изредка совершая скачки на новое
- 26. Движение и взаимодействие частиц Частицы свободно перемещаются по всему объему, двигаясь поступательно Силы притяжения почти отсутствуют,
- 27. П. 18. Модель идеального газа. Основное уравнение МКТ идеального газа.
- 28. Идеальный газ Идеальный газ – это газ, в котором Частицы – материальные точки Частицы взаимодействуют только
- 29. Среднее значение квадрата скорости молекул Скорость – величина векторная, поэтому средняя скорость движения частиц в газе
- 30. Среднее значение квадрата скорости молекул
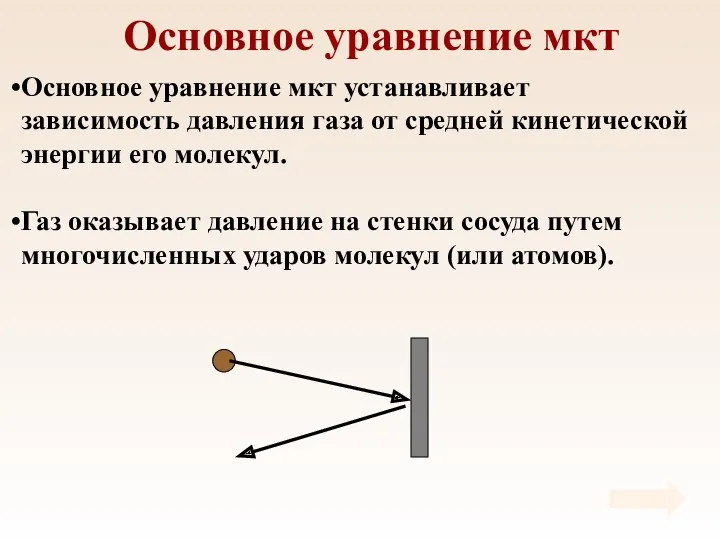
- 31. Основное уравнение мкт Основное уравнение мкт устанавливает зависимость давления газа от средней кинетической энергии его молекул.
- 32. Основное уравнение мкт
- 33. Основное уравнение мкт
- 34. П. 19. Тепловое движение. Уравнение состояния идеального газа.
- 35. Температура и тепловое равновесие Макроскопические параметры (макропараметры) – величины, характеризующие состояние макроскопических тел без учета молекулярного
- 36. Температура и тепловое равновесие Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно
- 37. Температура и тепловое равновесие Термометр – прибор для измерения температуры тела. Термометр входит в состояние теплового
- 38. Температура и тепловое равновесие Основная деталь термометра – термометрическое тело, то есть тело, макропараметры которого изменяются
- 39. Температура и тепловое равновесие Изобретателем термометра является Галилео Галилей (ок. 1600 г.) Термометрическим телом в его
- 40. Температурные шкалы шкала Цельсия шкала Фаренгейта шкала Реомюра шкала Кельвина
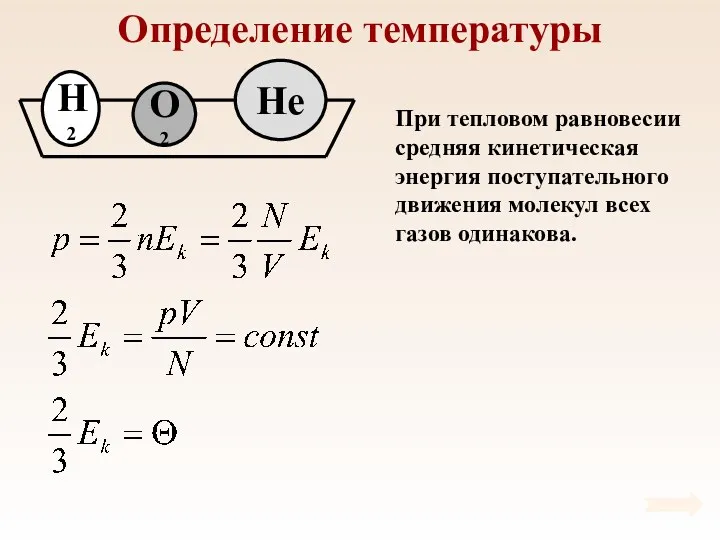
- 41. Определение температуры При тепловом равновесии средняя кинетическая энергия поступательного движения молекул всех газов одинакова.
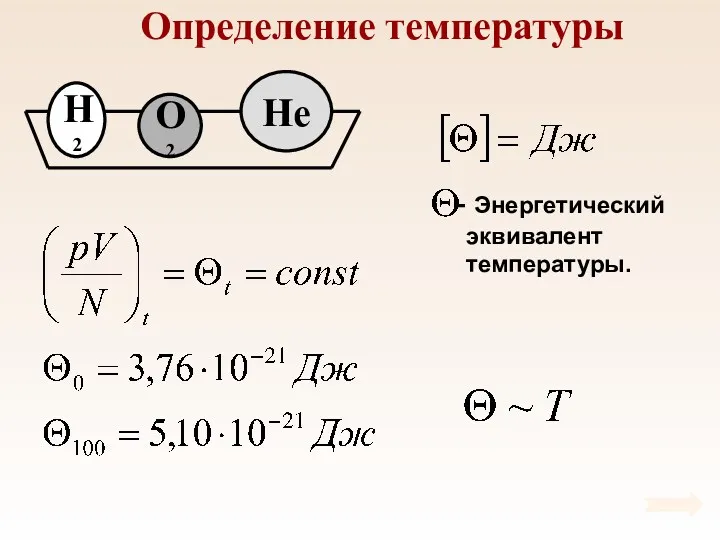
- 42. Определение температуры
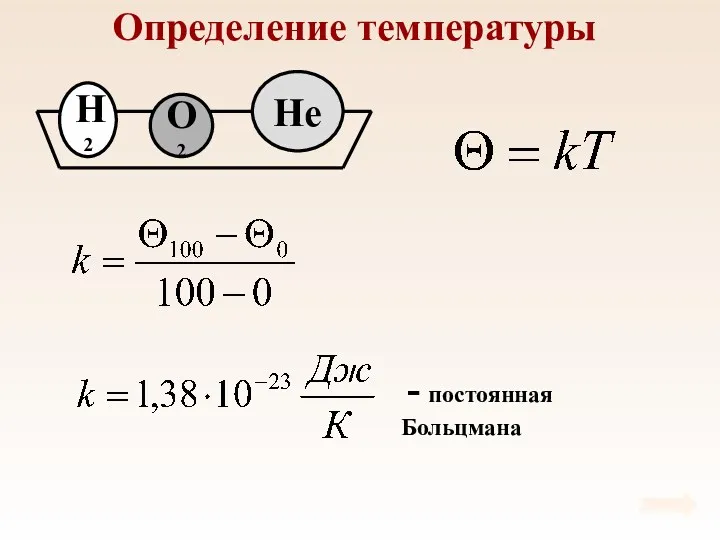
- 43. Определение температуры
- 44. Температура – мера средней кинетической энергии молекул
- 45. Зависимость давления газа от температуры и концентрации молекул газа
- 46. Скорости молекул
- 47. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона) - универсальная газовая постоянная
- 48. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона) Если в ходе процесса масса газа остается неизменной,
- 49. П. 20. Изопроцессы и их графики.
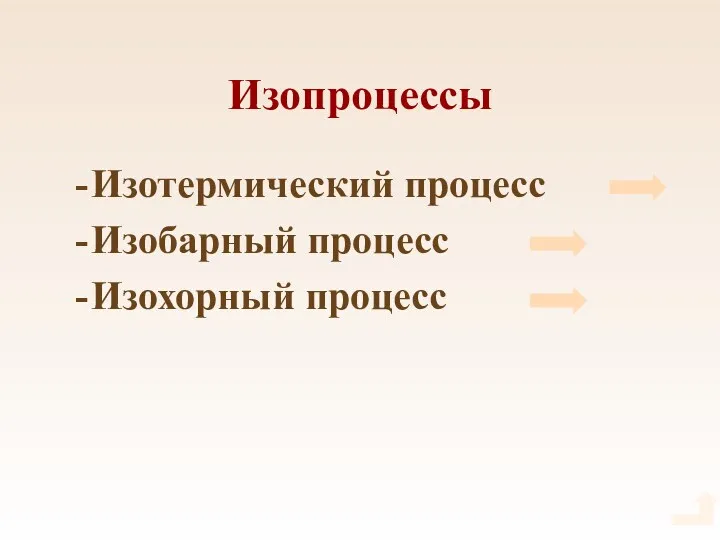
- 50. Изопроцессы Изотермический процесс Изобарный процесс Изохорный процесс
- 51. Изотермический процесс Процесс, происходящий с газом неизменной массы при постоянной температуре называется изотермическим. Изотермический процесс описывается
- 52. Изобарный процесс Процесс, происходящий с газом неизменной массы при постоянном давлении называется изобарным. Изобарный процесс описывается
- 53. Изохорный процесс Процесс, происходящий с газом неизменной массы при постоянном объеме называется изохорным. Изохорный процесс описывается
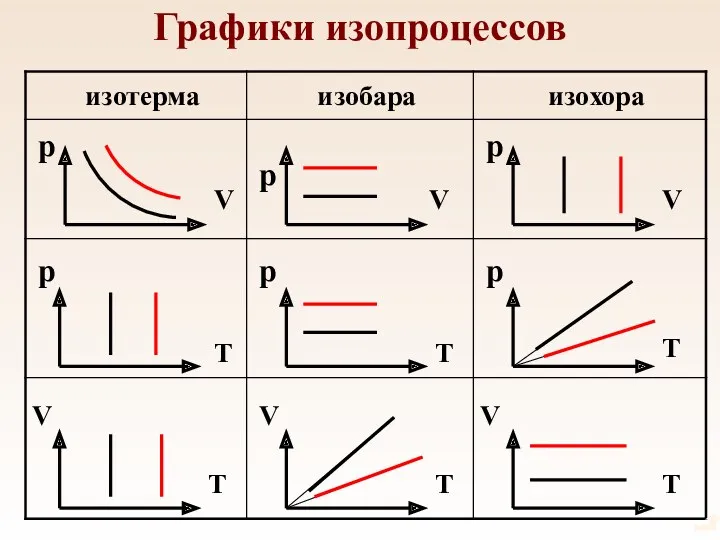
- 54. Графики изопроцессов p p p p p p V V V V V V T T
- 55. Тема 6. Термодинамика. П. 21 Агрегатные состояния вещества и их фазовые переходы. Аморфные тела.
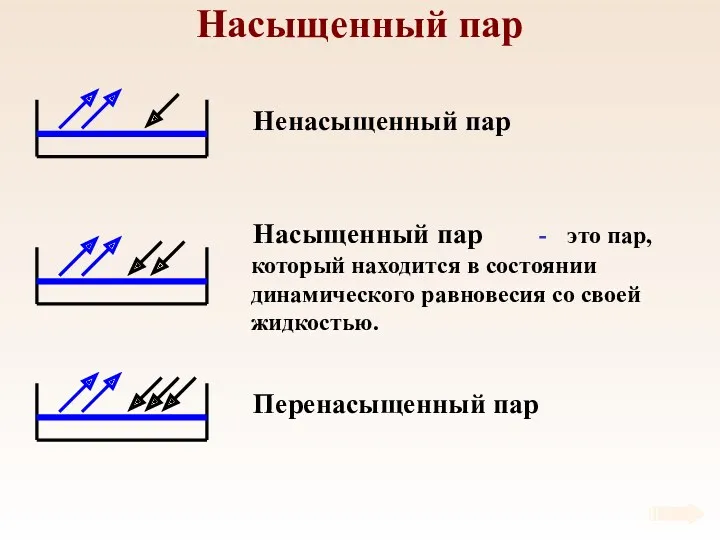
- 56. Насыщенный пар Ненасыщенный пар Насыщенный пар Перенасыщенный пар - это пар, который находится в состоянии динамического
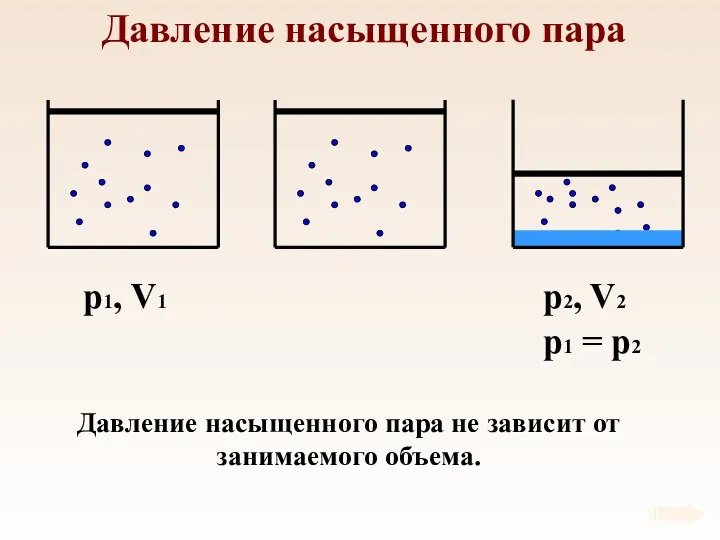
- 57. Давление насыщенного пара p1, V1 Давление насыщенного пара не зависит от занимаемого объема.
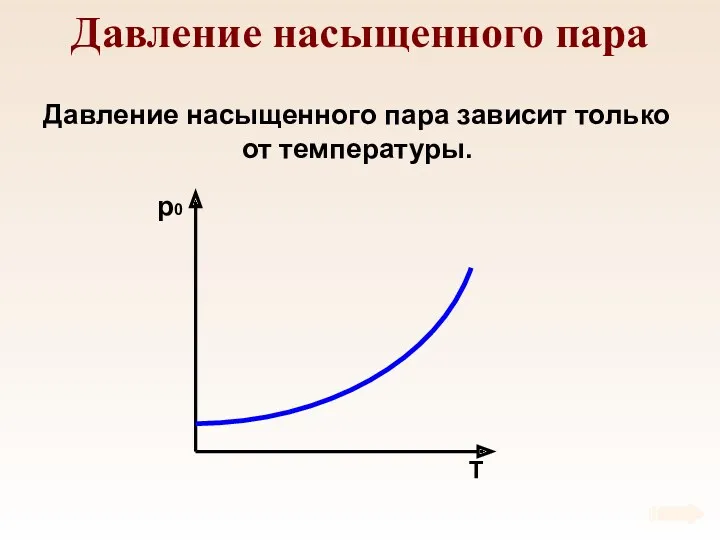
- 58. Давление насыщенного пара Давление насыщенного пара зависит только от температуры.
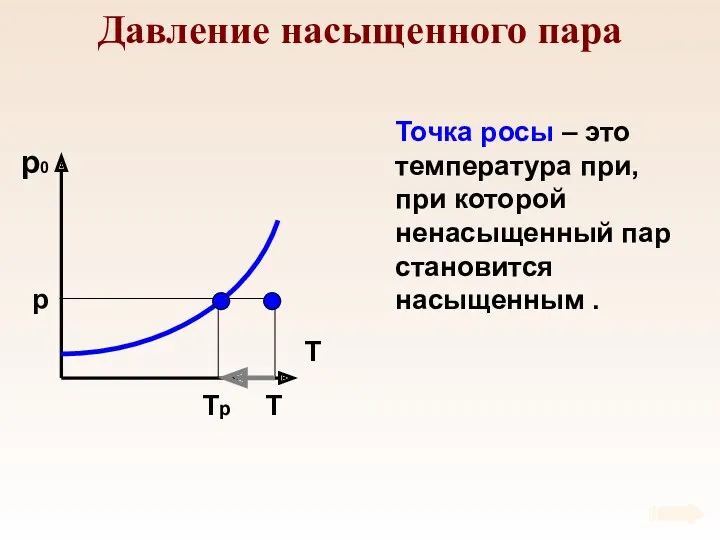
- 59. Давление насыщенного пара p T Tр Точка росы – это температура при, при которой ненасыщенный пар
- 60. Испарение и кипение Процесс парообразования с поверхности жидкости. Процесс парообразования по всему объему жидкости. Происходит при
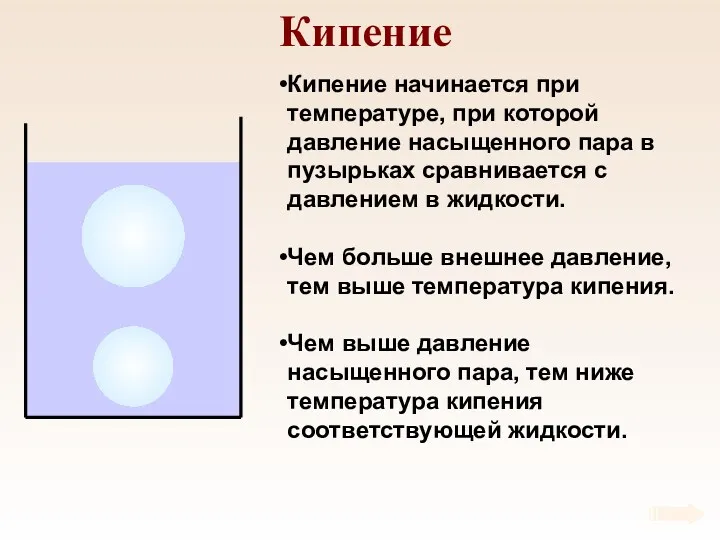
- 61. Кипение Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в
- 62. Влажность абсолютная относительная Плотность водяных паров в воздухе. Отношение парциального давления водяного пара, содержащегося в воздухе,
- 63. Измерение влажности Приборы для измерения влажности: Психрометр Гигрометр
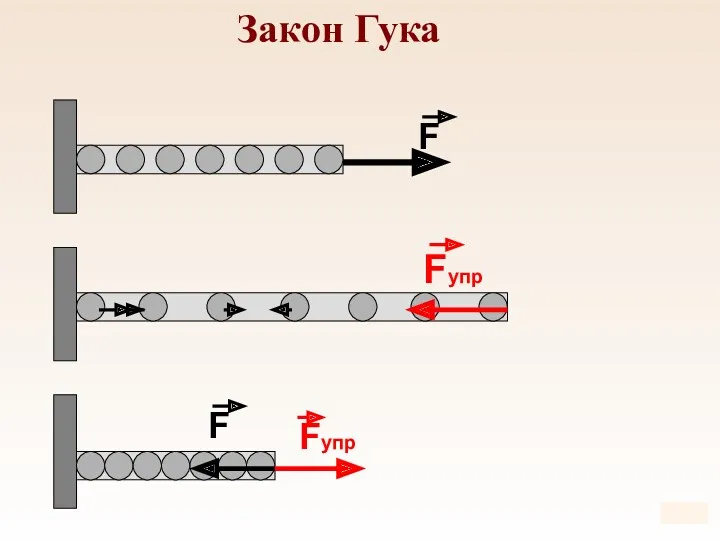
- 64. Закон Гука
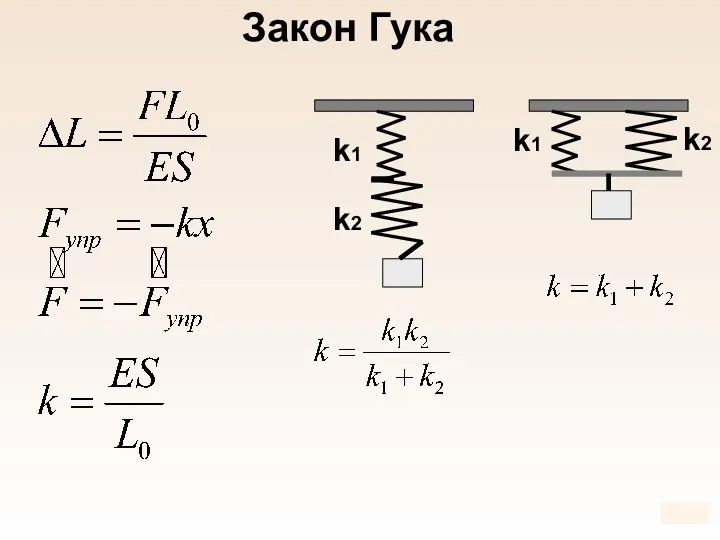
- 65. k – жесткость Закон Гука
- 66. Е – модуль Юнга 1660 г. Закон Гука
- 67. Закон Гука
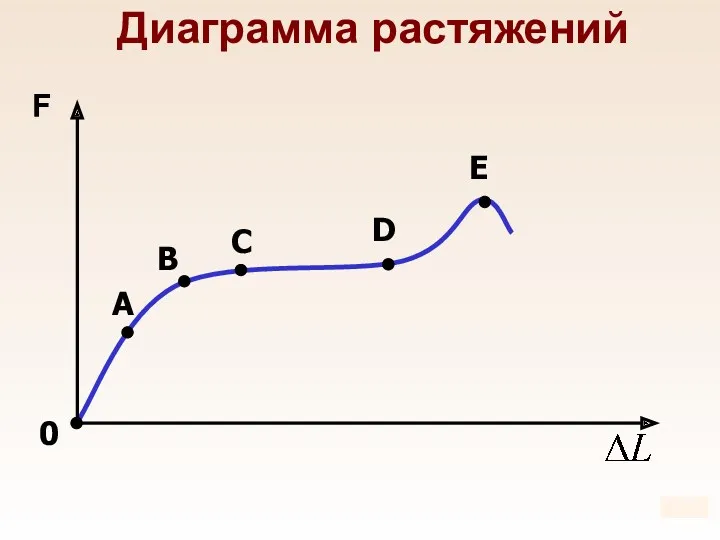
- 68. Диаграмма растяжений
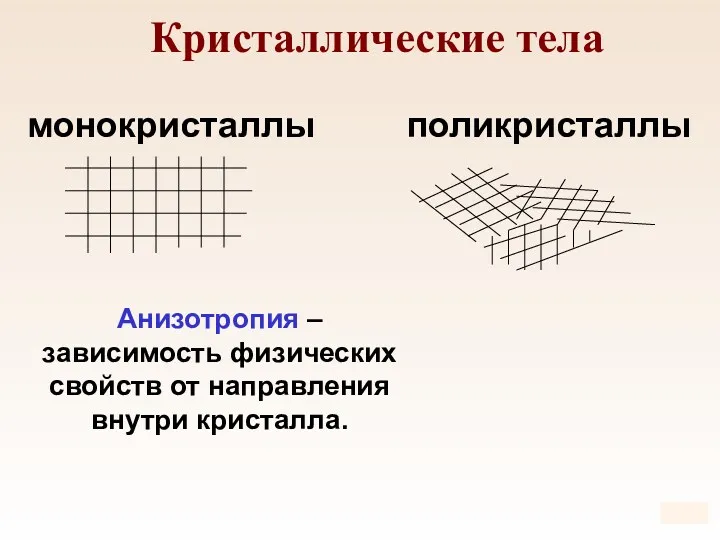
- 69. Кристаллические тела монокристаллы поликристаллы Анизотропия – зависимость физических свойств от направления внутри кристалла.
- 70. Аморфные тела Нет строгого порядка в расположении атомов. Все аморфные тела изотропны, т.е их физические свойства
- 71. П.22. Внутренняя энергия и работа газа. Уравнение теплового баланса.
- 72. Внутренняя энергия Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов)
- 73. Внутренняя энергия В идеальном газе частицы не взаимодействуют между собой, следовательно их потенциальные энергии равны нулю.
- 74. Внутренняя энергия Одноатомный газ (неон, аргон, гелий) – i = 3. Двухатомный газ (водород, азот) –
- 75. Внутренняя энергия Способы изменения внутренней энергии: Передача теплоты Совершение работы
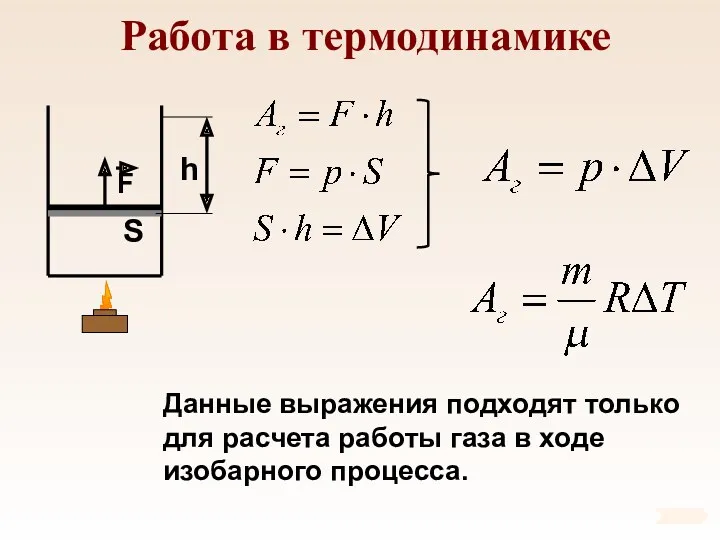
- 76. Работа в термодинамике Данные выражения подходят только для расчета работы газа в ходе изобарного процесса.
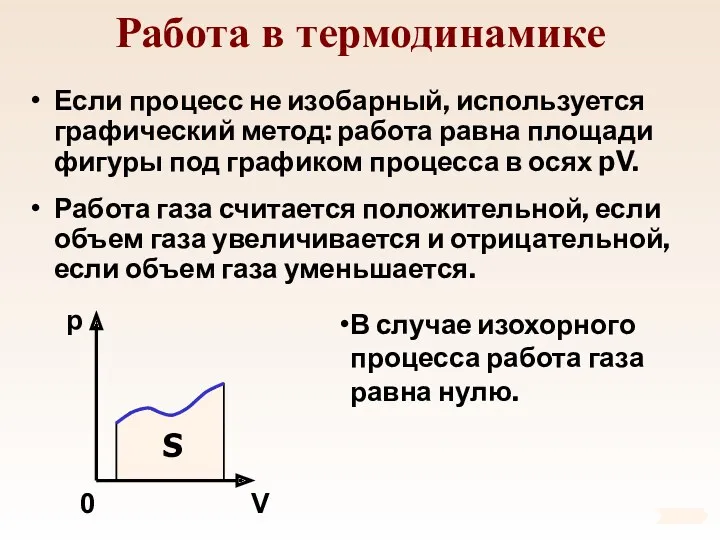
- 77. Работа в термодинамике Если процесс не изобарный, используется графический метод: работа равна площади фигуры под графиком
- 78. Количество теплоты Количество теплоты – это энергия полученная или отданная телом в процессе теплопередачи. Виды теплопередачи:
- 79. Количество теплоты потребляется выделяется нагревание охлаждение с – удельная теплоемкость вещества – величина равная энергии, необходимой
- 80. Количество теплоты потребляется выделяется плавление кристаллизация
- 81. Количество теплоты потребляется выделяется парообразование конденсация L - удельная теплота парообразования вещества – величина равная энергии,
- 82. Количество теплоты потребляется выделяется Сгорание топлива q – удельная теплота сгорания топлива – величина равная энергии,
- 83. П. 23 Первый закон термодинамики и применение его к изопроцессам .
- 84. Первый закон термодинамики Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно
- 85. Применение первого закона термодинамики к различным процессам Изотермический процесс Изобарный процесс Изохорный процесс Адиабатный процесс
- 86. Изотермический процесс В ходе изотермического процесса все полученное системой количество теплоты идет на совершение работы.
- 87. Изобарный процесс Данный способ расчета внутренней энергии и количества теплоты подходит только для одноатомного газа.
- 88. Изобарный процесс Если газ не одноатомный, то Можно воспользоваться следующими выражениями: i – число степеней свободы
- 89. Изохорный процесс В ходе изохорного процесса все полученное системой количество теплоты идет на изменение внутренней энергии
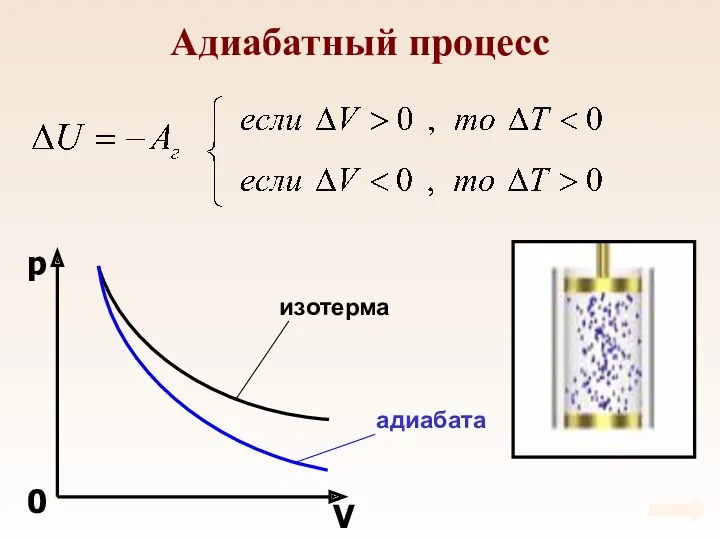
- 90. Адиабатный процесс Процесс, который происходит без теплообмена с внешней средой называется адиабатным. В ходе адиабатного процесса
- 91. Адиабатный процесс
- 92. П.24. Тепловые двигатели. Второй закон термодинамики
- 93. Тепловые двигатели Тепловые двигатели – механизмы, преобразующие внутреннюю энергию топлива в механическую энергию. Основные детали: нагреватель,
- 94. Тепловые двигатели
- 96. Скачать презентацию








































































 Повітряний транспорт
Повітряний транспорт Подготовка к ЕГЭ и ГИА по физике (вариант 1, задания 13-32)
Подготовка к ЕГЭ и ГИА по физике (вариант 1, задания 13-32) Третій закон Ньютона. Межі застосування законів Ньютона
Третій закон Ньютона. Межі застосування законів Ньютона Трансформатор. Қазіргі трансформаторлар
Трансформатор. Қазіргі трансформаторлар Презентация к уроку Закон всемирного тяготения
Презентация к уроку Закон всемирного тяготения Урок на тему Последовательное соединение проводников
Урок на тему Последовательное соединение проводников Топливные форсунки автомобиля
Топливные форсунки автомобиля Функциональная диэлектрическая электроника. Динамические неоднородности. УФЭ (7)
Функциональная диэлектрическая электроника. Динамические неоднородности. УФЭ (7) Игра Хочу всё знать!
Игра Хочу всё знать! Жұдырықша механизмдегі негізгі өлшемдері және параметрлері
Жұдырықша механизмдегі негізгі өлшемдері және параметрлері 2.1 МЕХАНИКА ЖИДКОСТЕЙ И ГАЗОВ
2.1 МЕХАНИКА ЖИДКОСТЕЙ И ГАЗОВ Основные параметры метода контроля
Основные параметры метода контроля Законы регулирования
Законы регулирования Электрический ток в разных средах
Электрический ток в разных средах Общие теоремы динамики материальной точки
Общие теоремы динамики материальной точки Презентация к уроку физики в 8 классе: Обобщение по теме Агрегатные состояния вещества.
Презентация к уроку физики в 8 классе: Обобщение по теме Агрегатные состояния вещества. Расчеты на прочность при изгибе
Расчеты на прочность при изгибе Вечные двигатели
Вечные двигатели Устойчивость к скачкам потока. Лекция 8
Устойчивость к скачкам потока. Лекция 8 Проводники в электростатическом поле
Проводники в электростатическом поле Масса алмасу үдерістері
Масса алмасу үдерістері Транспортное средство для курьерской доставки “kursus”
Транспортное средство для курьерской доставки “kursus” Антенны осевого излучения УКВ диапазона. Лекция № 13. АФУ
Антенны осевого излучения УКВ диапазона. Лекция № 13. АФУ Расчет электрических нагрузок на предприятии. (Лекция 3)
Расчет электрических нагрузок на предприятии. (Лекция 3) Енераторларға техникалық қызмет көрсету және жөндеу
Енераторларға техникалық қызмет көрсету және жөндеу Отчет о прохождении производственной практики (по профилю специальности)
Отчет о прохождении производственной практики (по профилю специальности) Силовое поле
Силовое поле Кипение
Кипение