Содержание
- 2. МКТ - учение о свойствах и строение вещества. - объясняет свойства материального мира, через движение и
- 3. Основоположники теории: М.В. Ломоносов; Больцман, Максвелл, Авогадро. Издавна человека интересовали такие вопросы как: каково внутреннее строение
- 5. 1.Диффузия - самопроизвольное проникновение соприкасающихся веществ одного в другое. Особенности явления: - с повышением температуры диффузия
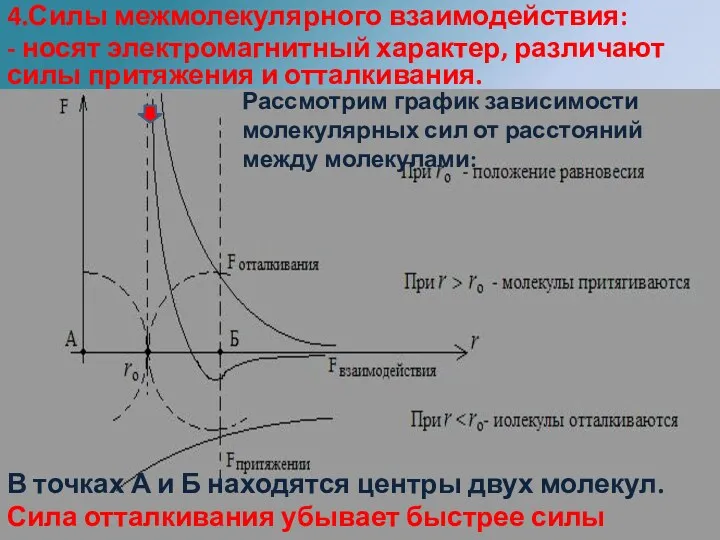
- 6. 4.Силы межмолекулярного взаимодействия: - носят электромагнитный характер, различают силы притяжения и отталкивания. Это обусловлено наличием в
- 7. Силы короткодействующие заметны лишь на расстоянии порядка размеров молекул. Fприт = - ; Fотталк = .
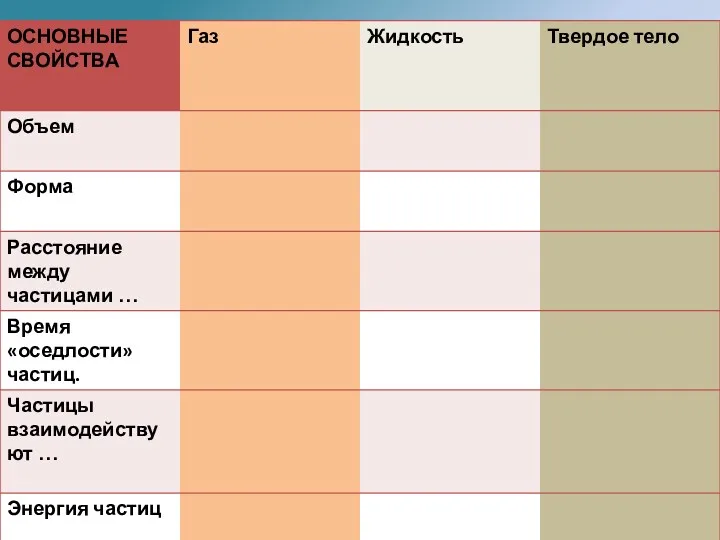
- 8. В физике используются понятия газ, жидкость, твердое тело и плазма. Учебник «Физика» В.Ф. Дмитриева: читать стр
- 10. ИДЕАЛЬНЫЙ ГАЗ. Любая физическая теория использует модели, изучаемого объекта. Пример: модель атома. Модель - материальная точка;
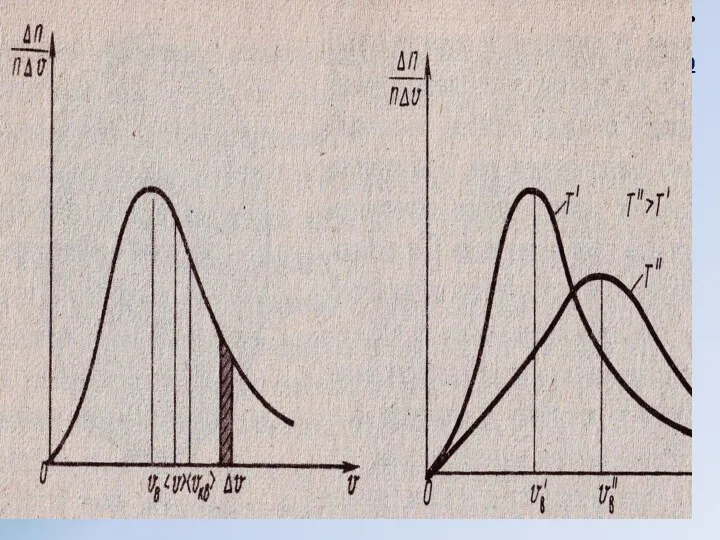
- 11. Микроскопические параметры - индивидуальные физические величины, относящиеся к 1 частице (то, uо, V о и т.
- 12. Вакуум - разряженное состояние газа, при котором средняя длина свободного пробега молекул газа определяется только размерами
- 13. ОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ МКТ 1) Атомная единица массы 1а.е.м = 1,66 10 -27 кг Дальтон предлагал
- 14. 3)Молярная масса- масса 1 моля вещества - [μ]= кг/моль 4) Масса молекулы т = то N
- 15. Отто Штерн (немецкий физик) в 1920 году с целью получения экспериментальных данных, подтверждающих правильность МКТ, определил
- 16. Полоска серебра, получившаяся при вращении цилиндров, оказалась размытой. Это свидетельствует о том, что атомы серебра, испарившиеся
- 17. ДАВЛЕНИЕ ГАЗА. Давление - физическая величина, равная отношению силы F, действующей на площадь поверхности к площади
- 18. Давление газа на стенки сосуда обусловлено совокупностью ударов молекул о стенки сосуда (передачей импульса частиц). Вывод
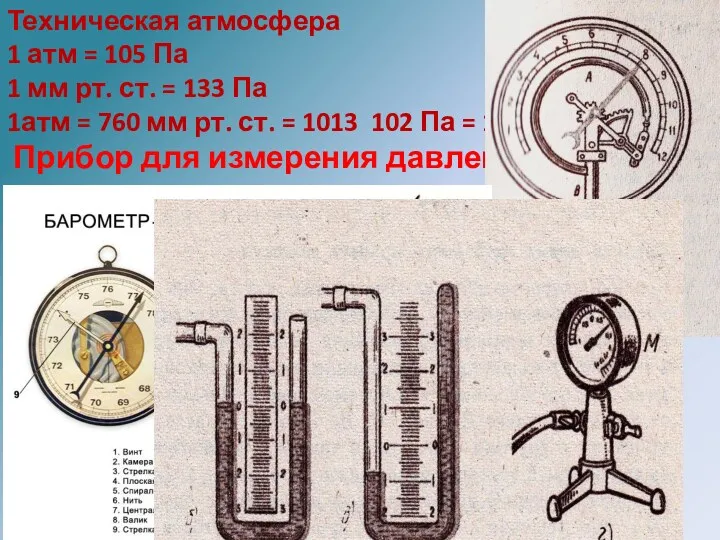
- 19. Техническая атмосфера 1 атм = 105 Па 1 мм рт. ст. = 133 Па 1атм =
- 20. Температура - величина, характеризующая степень нагретости тел. Измеряют термометром, его приводят в соприкосновение с изучаемым телом.
- 21. Так получим температурную шкалу – теоретическую В левой части все величины "+" => температура может быть
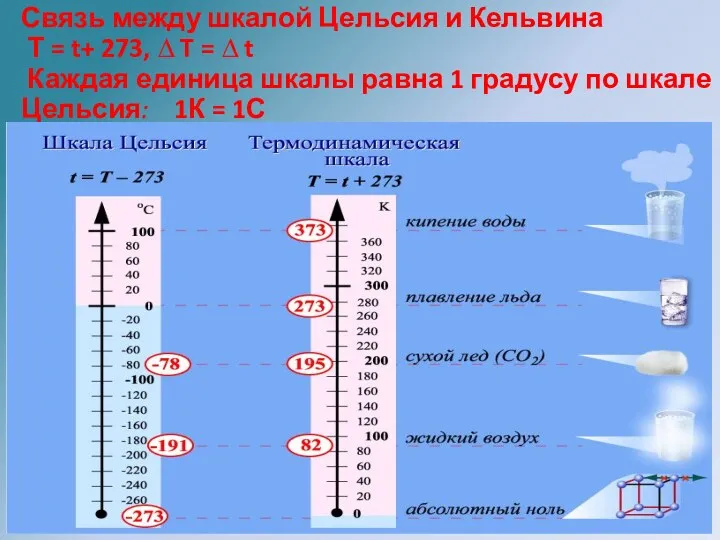
- 22. Связь между шкалой Цельсия и Кельвина Т = t+ 273, ∆ T = ∆ t Каждая
- 23. Существует предельная температура - абсолютный нуль. Абсолютный нуль температуры - предельная температура, при которой давление в
- 24. уравнение состояния идеального газа УРАВНЕНИЕ КЛАПЕЙРОНА - МЕНДЕЛЕЕВА Установим связь между основными макропараметрами газа: m, V,
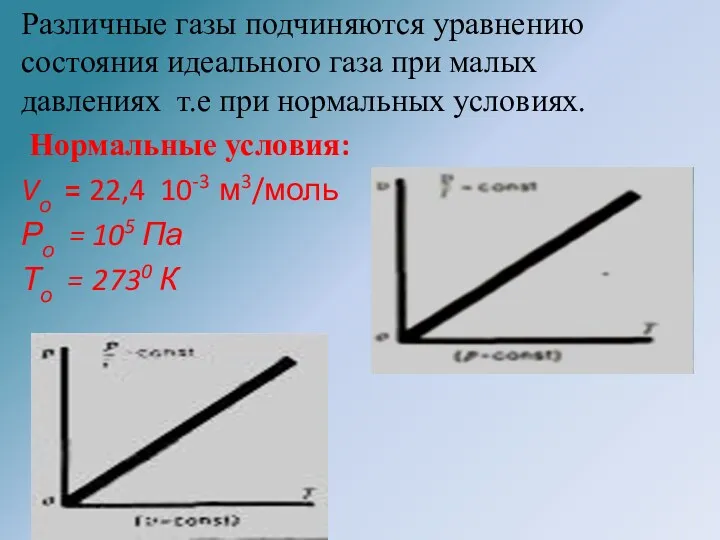
- 25. Различные газы подчиняются уравнению состояния идеального газа при малых давлениях т.е при нормальных условиях. Нормальные условия:
- 26. ГАЗОВЫЕ ЗАКОНЫ Смотреть отдельную презентацию!!!
- 28. Скачать презентацию










![3)Молярная масса- масса 1 моля вещества - [μ]= кг/моль 4)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/608753/slide-13.jpg)








 Тепловые машины и их КПД (презентация 8 класс)
Тепловые машины и их КПД (презентация 8 класс) Открытие электрической лампочки
Открытие электрической лампочки Электроемкость конденсатора и энергия электрического поля. (лекция 1б)
Электроемкость конденсатора и энергия электрического поля. (лекция 1б) Помехоустойчивость технических средств
Помехоустойчивость технических средств Личностно-ориентированный подход в обучении физике
Личностно-ориентированный подход в обучении физике Векторлар өрісінің циркуляциясы, роторы
Векторлар өрісінің циркуляциясы, роторы Упругие поля (поля напряжений) вокруг дислокаций. Энергия дислокаций. Термодинамика дислокаций
Упругие поля (поля напряжений) вокруг дислокаций. Энергия дислокаций. Термодинамика дислокаций Термографія в медицині
Термографія в медицині Производство, передача и потребление электрической энергии
Производство, передача и потребление электрической энергии Визуальные оптические системы. Геодезическое инструментоведение
Визуальные оптические системы. Геодезическое инструментоведение Дисперсия света
Дисперсия света урок физики в 8 классе Мир сквозь очки
урок физики в 8 классе Мир сквозь очки Решение задач по физике. Подготовка к проверочной работе. 7 класс
Решение задач по физике. Подготовка к проверочной работе. 7 класс Полевые транзисторы. Классификация полевых транзисторов. Лекция 9
Полевые транзисторы. Классификация полевых транзисторов. Лекция 9 Презентация . Электромагнитное поле
Презентация . Электромагнитное поле Искусственные спутники Земли
Искусственные спутники Земли Особенности ядерных реакций
Особенности ядерных реакций Уравнения электромеханической и механической характеристик асинхронного двигателя и их анализ
Уравнения электромеханической и механической характеристик асинхронного двигателя и их анализ Поляризация поперечных волн. Поляризация света. Дисперсия света. Виды спектров
Поляризация поперечных волн. Поляризация света. Дисперсия света. Виды спектров Методы помехоустойчивого приема дискретных сообщений
Методы помехоустойчивого приема дискретных сообщений Вещества и явления в окружающем мире
Вещества и явления в окружающем мире Термоядерная реакция
Термоядерная реакция Полное освидетельствование колёсных пар
Полное освидетельствование колёсных пар Типы оптических спектров. Спектральный анализ
Типы оптических спектров. Спектральный анализ Биосенсоры. Иммобилизация фермента на поверхности электрода
Биосенсоры. Иммобилизация фермента на поверхности электрода Принцип работы центробежного нагнетателя. Силы, действующие на ротор нагнетателя при различных режимах работы
Принцип работы центробежного нагнетателя. Силы, действующие на ротор нагнетателя при различных режимах работы Тест по физике 7 класс
Тест по физике 7 класс Реактивний двигун
Реактивний двигун