Содержание
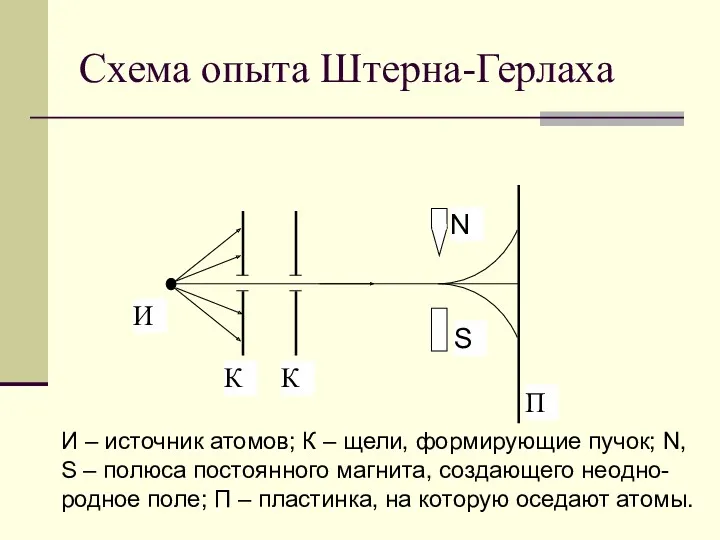
- 2. Схема опыта Штерна-Герлаха И – источник атомов; К – щели, формирующие пучок; N, S – полюса
- 3. Результаты опыта Штерна-Герлаха
- 4. Спиновое квантовое число (спин) Спин - собственный механический момент импульса электрона s = ½ — спиновое
- 5. Принцип Паули. Распределение электронов в атоме. Спин электрона
- 6. Состояние электрона в атоме определяется набором квантовых чисел
- 7. Правила отбора Переходы между электронными состояниями возможны только в том случае, если: 1) изменение ∆l орбитального
- 8. Принцип Паули В одном и том же атоме не может быть более одного электрона с одинаковым
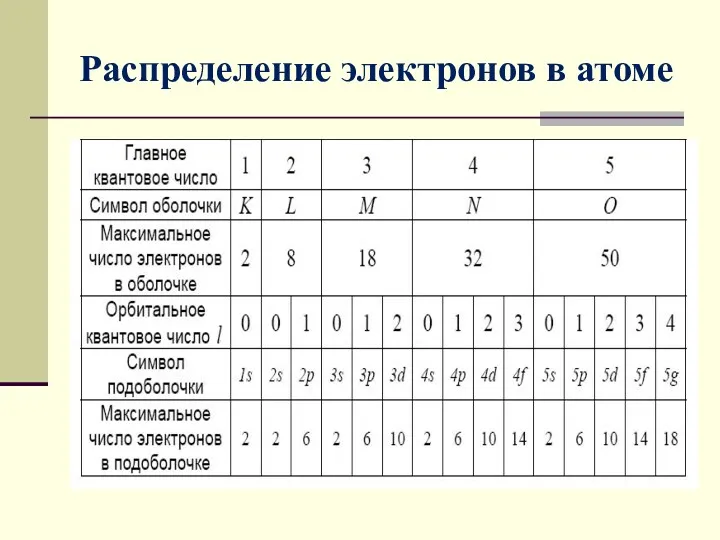
- 9. Распределение электронов в атоме по состояниям Совокупность электронов в многоэлектронном атоме, имеющих одно и то же
- 10. Распределение электронов в атоме
- 11. Линейчатый спектр атома водорода Швейцарский ученый И. Бальмер (1825—1898) подобрал эмпирическую формулу, описывающую все известные в
- 12. В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В
- 13. В инфракрасной области спектра были обнаружены: серия Пашена серия Брэкета серия Пфунда серия Хэмфри
- 15. Скачать презентацию










 Давление газа и твердых тел
Давление газа и твердых тел Простые механизмы
Простые механизмы Сопротивлению материалов. Курс лекций
Сопротивлению материалов. Курс лекций ЭДС. Решение задач. Тест
ЭДС. Решение задач. Тест Спектрально-люминесцентные методы исследования
Спектрально-люминесцентные методы исследования Кулачковые механизмы
Кулачковые механизмы Навигация и лоция
Навигация и лоция Интерактивный урок Эксплуатация и ремонт. Возможные неисправности топливораздаточных колонок и способы их устранения
Интерактивный урок Эксплуатация и ремонт. Возможные неисправности топливораздаточных колонок и способы их устранения Классическая теория электропроводности металлов. (Лекция 13)
Классическая теория электропроводности металлов. (Лекция 13) Michael Faraday
Michael Faraday Буксовый узел с коническими подшипниками БРЕНКО кассетного типа
Буксовый узел с коническими подшипниками БРЕНКО кассетного типа презентация урока
презентация урока Основные понятия и законы динамики
Основные понятия и законы динамики Електричний струм. Електрична провідність матеріалів. Дії електричного струму
Електричний струм. Електрична провідність матеріалів. Дії електричного струму межпредметные связи в проектной деятельности
межпредметные связи в проектной деятельности Техническое обслуживание рулевого управления автомобиля Toyota Mark II
Техническое обслуживание рулевого управления автомобиля Toyota Mark II Генератор переменного тока ( устаревшее альтернатор)
Генератор переменного тока ( устаревшее альтернатор) Динамические характеристики системы точечных масс
Динамические характеристики системы точечных масс Линзы. Формула тонкой линзы
Линзы. Формула тонкой линзы Лекция 20 (3). Тепловое излучение. Внешний фотоэффект. Давление света. Эффект Комптона
Лекция 20 (3). Тепловое излучение. Внешний фотоэффект. Давление света. Эффект Комптона Волновая оптика
Волновая оптика Действие произвольной возмущающей нагрузки
Действие произвольной возмущающей нагрузки Момент силы. Применение закона равновесия рычага к блоку
Момент силы. Применение закона равновесия рычага к блоку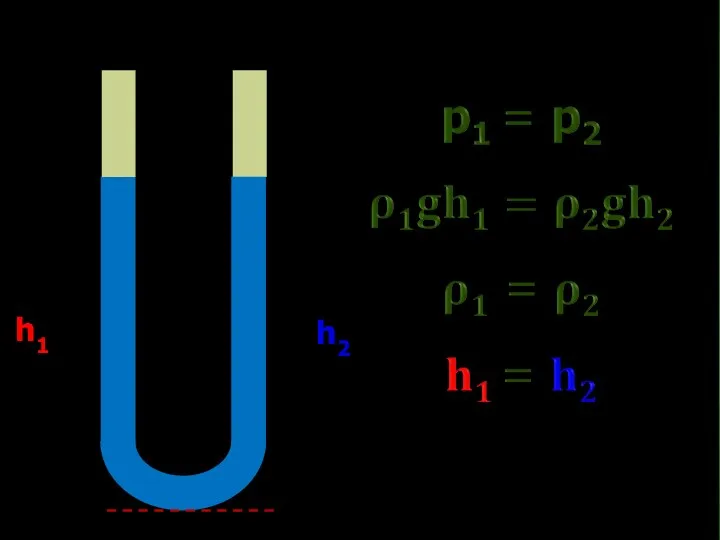 Сообщающиеся сосуды
Сообщающиеся сосуды Физика. Сила
Физика. Сила Физический диктант Плотность вещества
Физический диктант Плотность вещества Физические основы работы полупроводниковых приборов. Энергетические уровни и зоны
Физические основы работы полупроводниковых приборов. Энергетические уровни и зоны Матеріали дипломної роботи. Електропостачання житлового мікрорайону міста Дрогобич
Матеріали дипломної роботи. Електропостачання житлового мікрорайону міста Дрогобич